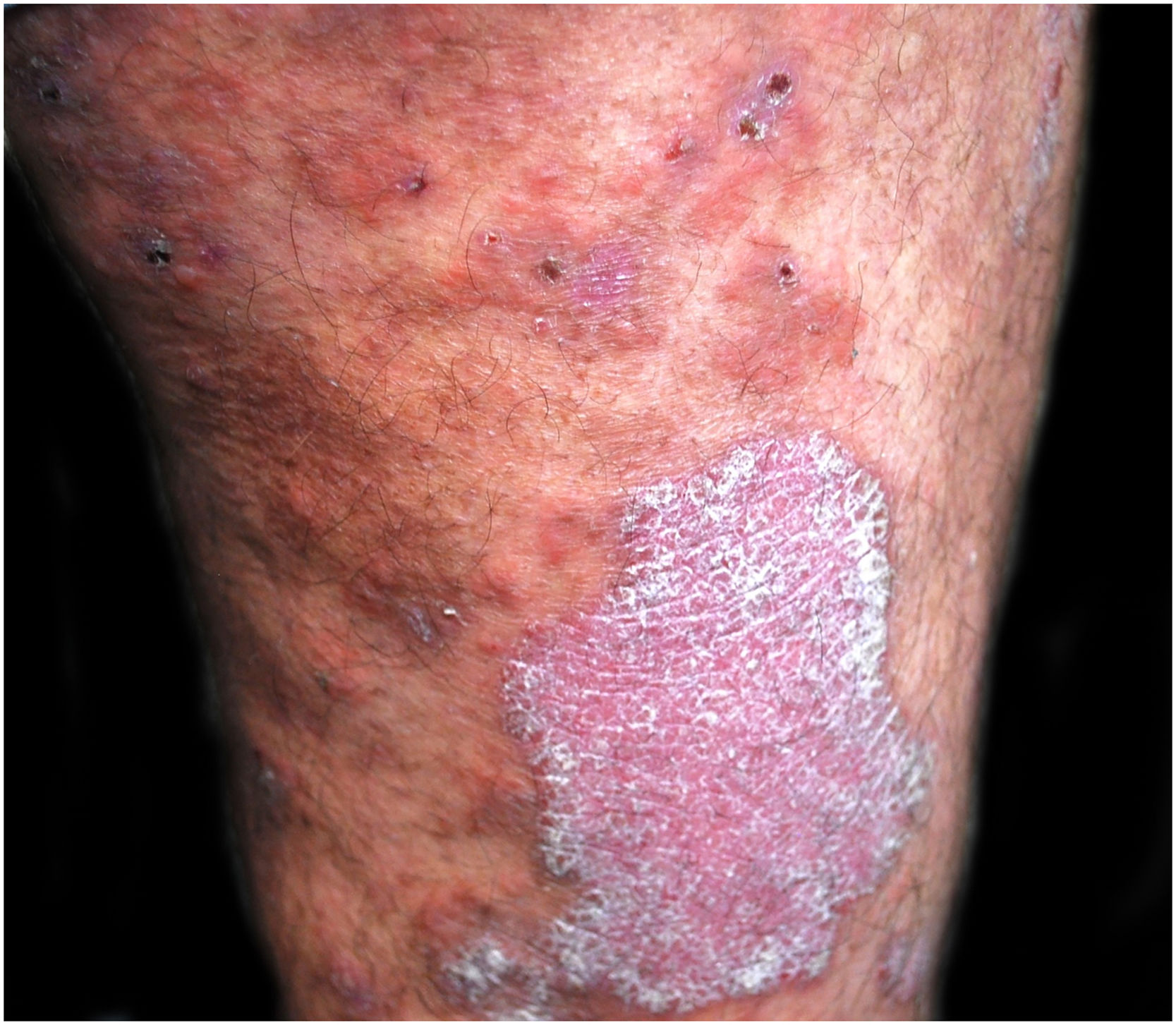
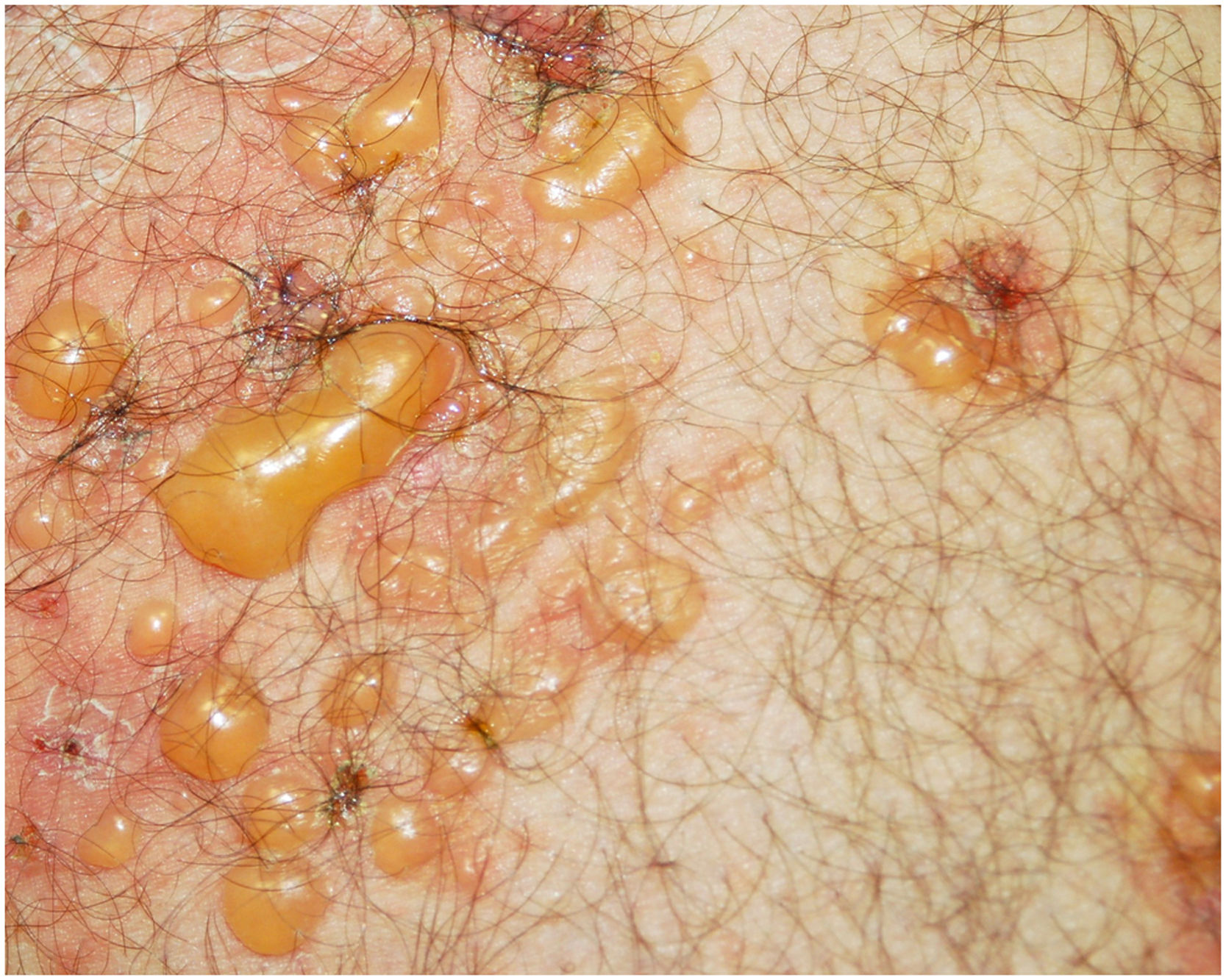
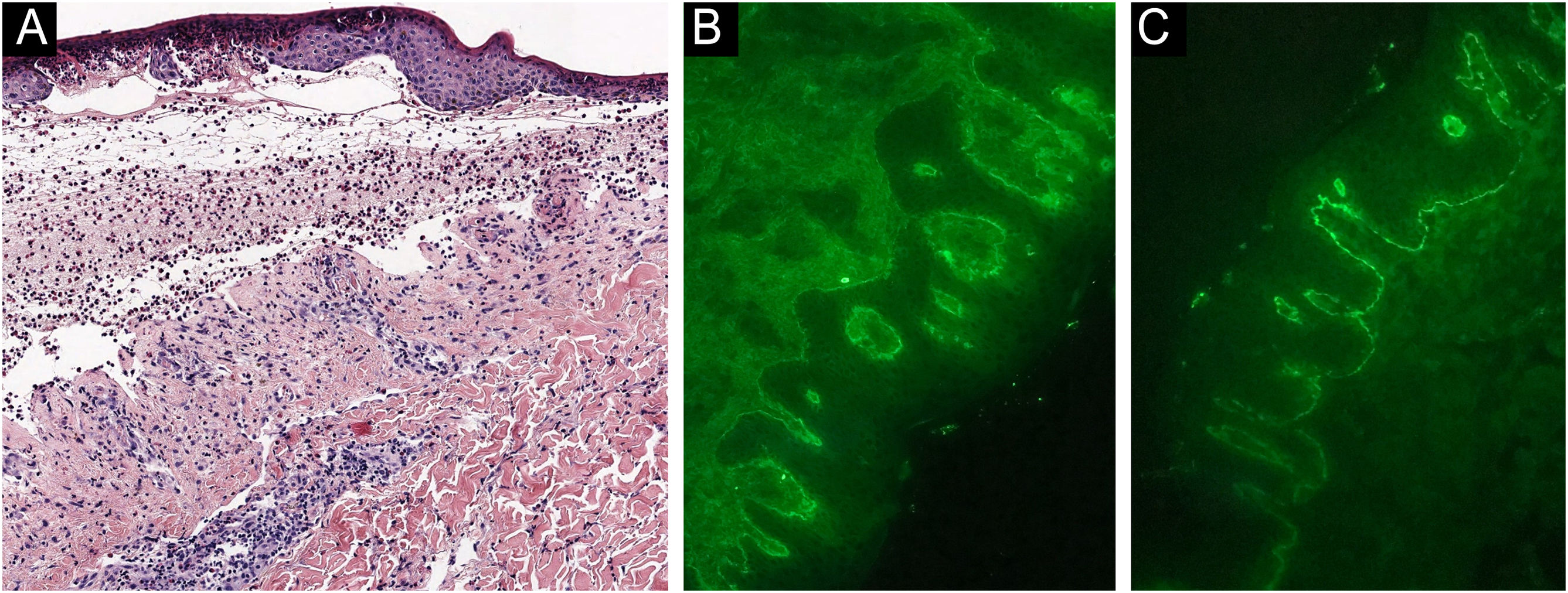
Paciente do sexo masculino, de 48 anos, acompanhado por 12 anos com psoríase moderada placas, tratado com corticosteroides tópicos, como furoato de mometasona e dipropionato de betametasona (nunca havia recebido tratamento sistêmico ou fototerapia), apresentou surto de prurido e lesões bolhosas com piora acentuada da psoríase (figs. 1 e 2). A histopatologia mostrou bolha subepidérmica contendo eosinófílos (fig. 3A), e a imunofluorescência direta demonstrou deposição linear de C3 (Agilent Dako, referência F0201) e IgG (Agilent Dako, referência F0202) na membrana basal (fig. 3B e 3C). Esses achados, associados com a positividade do teste ELISA para anticorpos IgG antiBP180 28 RU/mL, e IgG antiBP230 33 RU/mL (ARUP Laboratories, código de teste 0092566) confirmaram o diagnóstico de penfigoide bolhoso (PB).
Assim, iniciou‐se azatioprina 100mg/dia, com pouca resposta após 11 meses de tratamento. A mudança para ciclosporina 300mg/dia foi inicialmente eficaz, mas não se conseguiu obter controle adequado após 13 meses. O início do uso de metotrexato 7,5mg semanalmente alcançou remissão quase completa de ambas as doenças em dois meses. Entretanto, o tratamento teve que ser descontinuado no terceiro mês em decorrência de diarreia persistente e trombocitopenia.
Posteriormente, foi iniciado etanercepte 50mg semanalmente em virtude do aparecimento de artrite psoriásica. A resposta foi boa por seis anos, mas foi identificada neoplasia condroide que, embora parecesse um encondroma, foi recomendada suspensão do medicamento e seguimento rigoroso. Isso levou à exacerbação do PB e ao agravamento da psoríase.
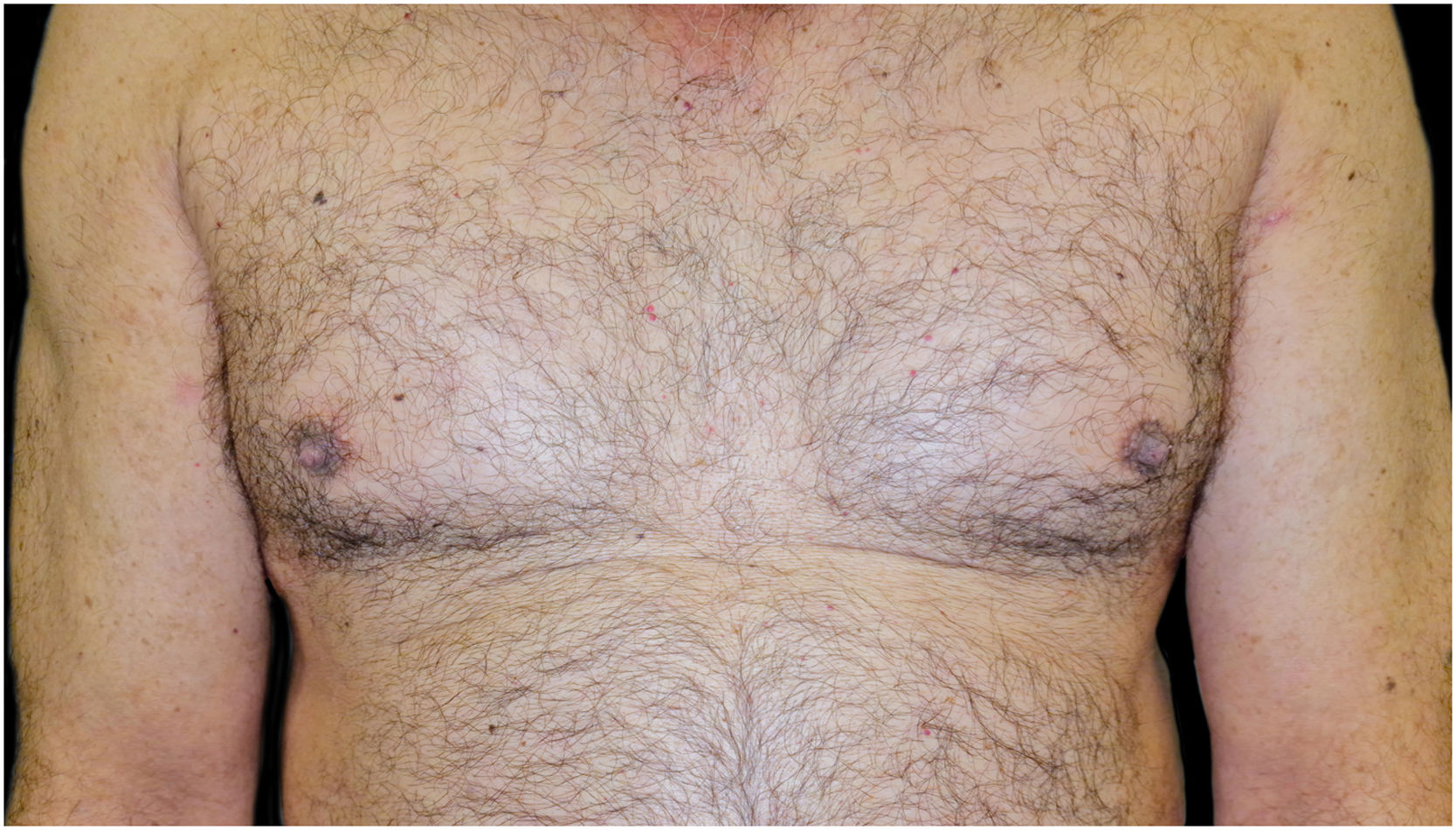
A combinação de omalizumabe 300mg mensalmente e doxiciclina 100mg/dia foi então prescrita, mas o PB não foi controlado e a psoríase piorou para Psoriasis Area and Severity Score (PASI) 10 e Dermatology Life Quality Index (DLQI) 15. Então, após sete meses, decidiu‐se iniciar monoterapia com guselcumabe: 100mg subcutânea nas semanas 0 e 4, seguido de uma dose de manutenção a cada oito semanas. Um mês após a primeira dose, o paciente apresentou PASI0; um mês depois, as lesões de PB desapareceram (fig. 4). Até o momento, dois anos após o início, mantém‐se guselcumabe 100mg a cada oito semanas e permanece com PASI0, sem sinais ou sintomas radiológicos de artrite (Psoriatic Arthritis Uncluttered Screening Evaluation – PURE4 0), e sem novos surtos de PB.
A associação entre psoríase e PB é descrita na literatura em nível epidemiológico, pois pacientes com PB têm aproximadamente 2,5 vezes mais probabilidade de desenvolver psoríase do que a população em geral.1–3 Foi proposto que a psoríase pode causar danos teciduais que expõem certos antígenos desencadeantes de uma resposta autoimune.3 Também foi sugerido que poderia haver alteração arquitetônica da membrana basal na psoríase, tanto na própria placa quanto na pele aparentemente saudável. Os achados mais relevantes são a desintegração e a distribuição irregular da laminina e da fibronectina‐3, que levam ao dano da membrana basal, o que pode facilitar ao surgimento com PB.4
Além disso, parece que níveis elevados de interleucina (IL)‐23 não são encontrados apenas na psoríase, mas também no PB (associado ou não à psoríase). A IL‐23 pode atuar produzindo superexpressão da metalopeptidase de matriz 9 (MMP)‐9, que modifica a membrana basal.5
Atualmente, não há casos publicados de tratamento do PB com anti‐IL23, embora haja um caso tratado com anti‐IL12/23 (ustequinumabe).6 Em contrapartida, foram relatados alguns casos de desenvolvimento de PB associados ao início do uso de anti‐IL23 ou anti‐IL12/23, nos quais, curiosamente, a maioria não apresentou autoanticorpos para PB.7–9 O mecanismo pelo qual o guselcumabe foi eficaz no presente caso permanece desconhecido. Pode ser que a regulação do eixo IL‐23 controle diretamente o PB. Outra possibilidade é que o guselcumabe melhore principalmente a psoríase, a estabilização da membrana basal que evita a ocorrência do PB.
A relação entre anti‐IL23 e PB não está definida. Entretanto, existem dados que apoiam a plausibilidade biológica de que possam ser eficazes nessa doença – portanto, poderão ser considerados futuramente como alternativa terapêutica em casos multirrefratários, desde que mais estudos sejam realizados.
Suporte financeiroNenhum.
Contribuição dos autoresFrancisco José Rodríguez‐Cuadrado: Concepção e desenho do estudo; obtenção dos dados ou análise e interpretação dos dados; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; revisão crítica da literatura; aprovação da versão final do manuscrito.
Gaston Roustan‐Gullón: Redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Dolores Suárez‐Massa: Redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Mercedes Hospital‐Gil: Redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Rodríguez‐Cuadrado FJ, Roustan‐Gullón G, Suárez‐Massa D, Hospital‐Gil M. Multirefractory bullous pemphigoid, psoriasis and psoriatic arthritis successfully treated with guselkumab. An Bras Dermatol. 2024;99:783–5.
Trabalho realizado no Hospital Universitario Puerta de Hierro Majadahonda, Majadahonda, Espanha.