Uma das principais reações adversas da radioterapia adjuvante na mama é a radiodermatite.
ObjetivoAvaliar a incidência de radiodermatite em mulheres com câncer de mama, identificar os fatores associados à sua gravidade e determinar o tempo em que esse evento ocorre.
MétodosEstudo de coorte prospectivo com 113 mulheres com câncer de mama avaliadas antes da radioterapia e a cada quinta aplicação até o final do tratamento. Para a avaliação dos fatores de risco, utilizou‐se a regressão logística e o modelo de regressão proporcional de Cox. Valores de p<0,05 foram considerados significantes.
ResultadosA taxa de incidência de radiodermatite foi de 98,2%, e foi demonstrado que para cada ponto adicional do índice de massa corporal (IMC) a chance de ocorrência de radiodermatite nos graus II a IV aumenta em 14% (OR=1,14 [95% IC 1,04–1,26]; p=0,004), e o uso de estatina aumenta o risco de lesões cutâneas mais graves em quatro vezes (OR=4,27 [95% IC 1,11–16,42]; p=0,035). O uso exclusivo de hidrogel para hidratação da pele foi um fator independente para retardar o aparecimento da radiodermatite (HR=0,55 [95% IC 0,36–0,82]; p=0,004).
Limitações do estudoA principal limitação deste estudo foi sua validade externa. Os fatores identificados devem ser considerados para serviços e populações semelhantes aos deste estudo.
ConclusõesHouve alta incidência de radiodermatite, e sua gravidade relacionou‐se com maior IMC e uso de estatinas; verificou‐se um efeito protetor do uso de hidrogel.
O câncer de mama é o tumor maligno mais comum entre as mulheres, excluindo os cânceres de pele não melanoma. A radioterapia tem papel importante no controle locorregional e à distância dessa neoplasia, aumentando as taxas de sobrevida livre de doença e a taxa de sobrevida global em até 20% em 20 anos.1,2 Portanto, a radioterapia é indicada para todas as pacientes submetidas à cirurgia conservadora e para aquelas submetidas à mastectomia.
Uma das principais reações adversas da radioterapia adjuvante na mama é a radiodermatite. Aproximadamente 85%–90% das pacientes desenvolvem algum grau dessa reação, que pode se manifestar com gravidade variável. A irradiação promove inúmeras alterações na pele, incluindo aumento do pH, diminuição da hidratação, aumento do fluxo sanguíneo cutâneo e hiperpigmentação.3‐5 As toxicidades cutâneas manifestam‐se como eritema, hiperpigmentação, descamação, exulceração, ulceração e necrose.6,7
As consequências da radiodermatite são inúmeras e incluem diminuição da qualidade de vida em virtude da dor e do desconforto, infecção, diminuição da autoimagem e interrupção da radioterapia, prejudicando o controle da neoplasia.8
Diversos fatores já foram associados à toxicidade cutânea da radioterapia, como a forma tridimensional da mama e a técnica de tratamento.9,10 Comorbidades, quimioterapia concomitante, exposição solar, alta dose de irradiação, localização e estadiamento do tumor foram identificados em estudos anteriores como relacionados à radiodermatite.11‐14
Iwakawa et al. demonstraram que o risco de reações cutâneas na mama era altamente dependente da instituição onde a paciente foi atendida em virtude das diferentes técnicas de tratamento, procedimentos cirúrgicos, magnitudes de energia de fótons e elétrons, uso de colimadores multilâminas, dispositivos de imobilização e filtros de cunha.9
Portanto, há necessidade de conhecer melhor os fatores associados ao desenvolvimento de radiodermatite nessas pacientes, considerando as diferentes realidades dos serviços de radioterapia e as diferentes populações atendidas. Nesse contexto, este estudo teve como objetivo avaliar a incidência de radiodermatite em mulheres com câncer de mama, identificar os fatores associados à sua gravidade e determinar o tempo em que essa reação adversa ocorre durante a radioterapia.
MétodosTipo do estudo, local e participantesEstudo de coorte prospectivo e analítico realizado no setor de radioterapia de hospital universitário. Os critérios de inclusão foram mulheres maiores de 18 anos, diagnosticadas com câncer de mama com indicação pelo radioterapeuta de radioterapia com emissão de fótons. Essa indicação era para tratamento radioterápico adjuvante, além de intervalo de 21 dias após a quimioterapia, cicatrização completa da ferida cirúrgica e amplitude de movimento do membro superior ipsilateral. Foram excluídas pacientes com alterações cutâneas da mama, preexistentes à radioterapia por interferência na avaliação e pacientes com mobilidade limitada em virtude da dificuldade de realização dos procedimentos do estudo.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital Universitário (CAAE: 62865916.2.0000.5411) e conduzido de acordo com as recomendações da Resolução 466/12 (Declaração de Helsinque). O termo de consentimento informado foi entendido e assinado pelas pacientes ou responsáveis antes da inclusão no estudo.
Procedimentos do estudoAs participantes foram avaliadas no momento da inclusão, antes do início da radioterapia, e em torno de cada cinco sessões (com intervalos variando de três a sete sessões) até o final do tratamento.
Na primeira avaliação foram coletados dados demográficos e clínicos, estadiamento do câncer de mama (segundo o American Joint Committee on Cancer – AJCC 8ª edição),15 esquema da radioterapia e fotografias das mamas antes do tratamento. As avaliações subsequentes incluíram dados sobre cuidados com a pele, observação direta do local irradiado e fotografias para avaliação de possível desenvolvimento de radiodermatite. No início e durante a radioterapia, as pacientes foram orientadas quanto aos objetivos do tratamento, cuidados com a área irradiada e eventos adversos. Por ser um estudo observacional, não houve interferência na rotina e prescrições do serviço.
DesfechosDesfecho primário: incidência de radiodermatite durante o tratamento padrão e reforço (boost), bem como o grau de gravidade das lesões.
Desfechos secundários: i) fatores associados ao desenvolvimento de radiodermatite entre diferentes classificações; ii) tempo em que a radiodermatite ocorreu durante a radioterapia.
O diagnóstico e a classificação da radiodermatite em pacientes com câncer de mama foram realizados de acordo com o Radiation Therapy Oncology Group (RTOG):16 a) grau I, eritema leve, epilação e descamação seca; b) grau II, eritema doloroso, descamação úmida localizada e edema moderado; c) grau III, descamação úmida confluente e edema importante; ou d) grau IV, ulceração, hemorragia e necrose.
RadioterapiaA radioterapia foi realizada utilizando‐se o sistema de planejamento de tratamento computadorizado da Eclipse™ (versões 11.0 e 13.0) da Varian Medical Systems. Foi utilizada a técnica de radioterapia bidimensional com acelerador linear, modelo Clinac® 2100C, da Varian. O tratamento foi realizado com feixes de raios X (fótons) de 6 MV com dois ou quatro campos de radiação tangentes. Foram utilizados quatro campos de radiação, dois com filtro em cunha e dois sem filtro. Todos os pacientes foram tratados com a técnica SSD (source surface distance), na qual a distância da fonte de radiação à pele do paciente é igual à distância do isocentro do acelerador linear (distância da fonte=100,0cm).
VariáveisAs informações das variáveis foram coletadas por um único pesquisador obtidas nos prontuários das pacientes e por meio de entrevista norteada por ficha de coleta de dados elaborada pelos pesquisadores. Foram coletadas as variáveis sociodemográficas, clínicas (idade, raça, tabagismo, peso, altura, IMC, comorbidades, medicamentos em uso), relacionadas ao tratamento radioterápico e ao câncer de mama e as variáveis relacionadas ao cuidado com a pele.
Análise estatísticaAs variáveis categóricas foram apresentadas como porcentagens, e as variáveis contínuas como médias e desvios‐padrão quando paramétricas e como medianas e primeiro e terceiro quartis quando não paramétricas. Em virtude do menor número de pacientes com radiodermatite graus II a IV, os pacientes foram divididos em dois grupos para comparação: a) grupo 1, pacientes com radiodermatite grau I; e b) grupo 2, pacientes com radiodermatite graus II a IV. Para a comparação das características clínicas e demográficas, utilizou‐se o teste Qui‐quadrado ou exato de Fisher para variáveis categóricas, teste‐t para amostras independentes para as variáveis contínuas paramétricas e teste de Kruskal‐Wallis para as variáveis não paramétricas. Para avaliar os fatores de risco para o desenvolvimento de graus mais elevados de radiodermatite, foi realizada análise multivariada por regressão logística, e incluídas no modelo as variáveis com valor de p<0,1.
Para avaliar o risco para o desenvolvimento de radiodermatite em função do tempo de tratamento, aplicou‐se o modelo de regressão proporcional de Cox nas análises univariada e multivariada e, para esta última, foram utilizados aqueles com valor de p<0,1 na análise univariada. Para as variáveis significantes no modelo de Cox, foi utilizada a análise de Kaplan‐Meier para traçar a curva de sobrevida.
Todas as análises estatísticas foram realizadas usando SPSS versão 23.0 (IBM) e Epi Info™ (Centros de Controle e Prevenção de Doenças dos EUA). Valores de p<0,05 foram considerados significantes.
ResultadosUm total de 122 mulheres com câncer de mama foram admitidas no serviço de radioterapia no período de fevereiro a setembro de 2017. Nove pacientes foram excluídas: quatro por tratamento com emissão de elétrons, três por alterações cutâneas secundárias ao tumor e duas por limitação de mobilidade. Portanto, 113 pacientes permaneceram no estudo.
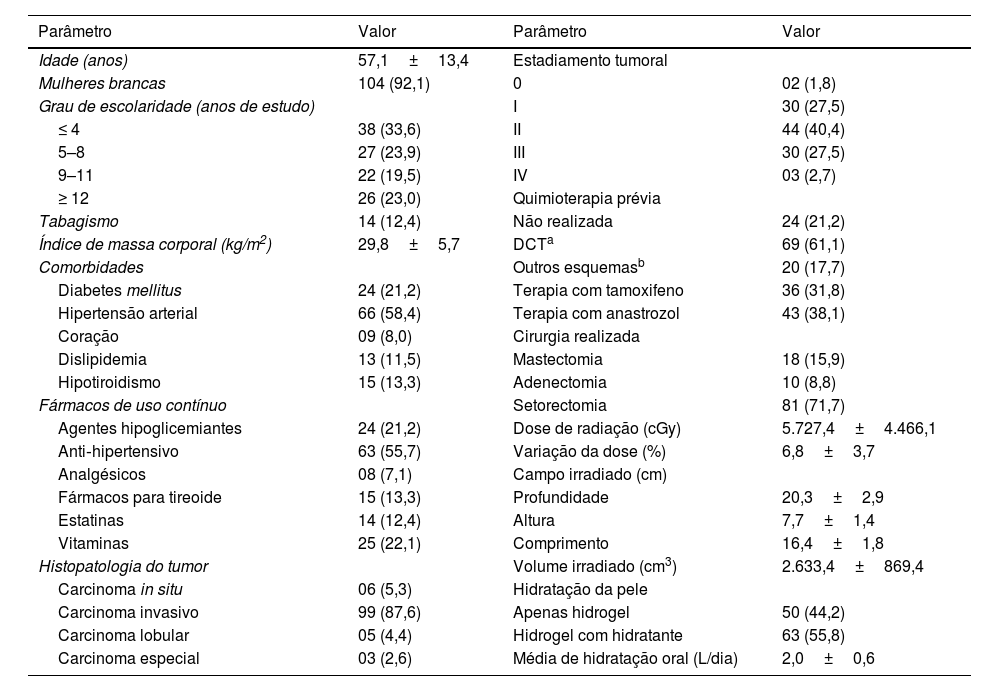
As características demográficas, clínicas e radioterápicas das 113 participantes são apresentadas na tabela 1. As pacientes receberam a radioterapia padrão, totalizando 9 a 30 sessões, com média de 26 sessões (DP±2,8) e dose média de 5.727,4 (DP±4.466,1) centigrays (cGy).
Características demográficas, clínicas e terapêuticas de 113 mulheres com câncer de mama submetidas à radioterapia por irradiação de fótons
| Parâmetro | Valor | Parâmetro | Valor |
|---|---|---|---|
| Idade (anos) | 57,1±13,4 | Estadiamento tumoral | |
| Mulheres brancas | 104 (92,1) | 0 | 02 (1,8) |
| Grau de escolaridade (anos de estudo) | I | 30 (27,5) | |
| ≤ 4 | 38 (33,6) | II | 44 (40,4) |
| 5–8 | 27 (23,9) | III | 30 (27,5) |
| 9–11 | 22 (19,5) | IV | 03 (2,7) |
| ≥ 12 | 26 (23,0) | Quimioterapia prévia | |
| Tabagismo | 14 (12,4) | Não realizada | 24 (21,2) |
| Índice de massa corporal (kg/m2) | 29,8±5,7 | DCTa | 69 (61,1) |
| Comorbidades | Outros esquemasb | 20 (17,7) | |
| Diabetes mellitus | 24 (21,2) | Terapia com tamoxifeno | 36 (31,8) |
| Hipertensão arterial | 66 (58,4) | Terapia com anastrozol | 43 (38,1) |
| Coração | 09 (8,0) | Cirurgia realizada | |
| Dislipidemia | 13 (11,5) | Mastectomia | 18 (15,9) |
| Hipotiroidismo | 15 (13,3) | Adenectomia | 10 (8,8) |
| Fármacos de uso contínuo | Setorectomia | 81 (71,7) | |
| Agentes hipoglicemiantes | 24 (21,2) | Dose de radiação (cGy) | 5.727,4±4.466,1 |
| Anti‐hipertensivo | 63 (55,7) | Variação da dose (%) | 6,8±3,7 |
| Analgésicos | 08 (7,1) | Campo irradiado (cm) | |
| Fármacos para tireoide | 15 (13,3) | Profundidade | 20,3±2,9 |
| Estatinas | 14 (12,4) | Altura | 7,7±1,4 |
| Vitaminas | 25 (22,1) | Comprimento | 16,4±1,8 |
| Histopatologia do tumor | Volume irradiado (cm3) | 2.633,4±869,4 | |
| Carcinoma in situ | 06 (5,3) | Hidratação da pele | |
| Carcinoma invasivo | 99 (87,6) | Apenas hidrogel | 50 (44,2) |
| Carcinoma lobular | 05 (4,4) | Hidrogel com hidratante | 63 (55,8) |
| Carcinoma especial | 03 (2,6) | Média de hidratação oral (L/dia) | 2,0±0,6 |
As variáveis categóricas foram apresentadas em números absolutos e percentuais (entre parênteses) e as contínuas como média e desvio‐padrão.
Das 113 pacientes, 68 (60,2%) também receberam reforço do tratamento após o término da radioterapia padrão (boost), com dose média de radiação de 1.202 (DP±323,2) cGy. A dose máxima na pele variou de 3%–11% da dose prescrita.
Além da radioterapia realizada em topografia mamária, 40 pacientes também receberam tratamento com radiação de fótons na fossa supraclavicular ipsilateral, em decorrência da presença de metástases linfonodais. Ressalta‐se que por ser radioterapia bidimensional, não houve irradiação na cadeia linfonodal da mamária interna e axila.
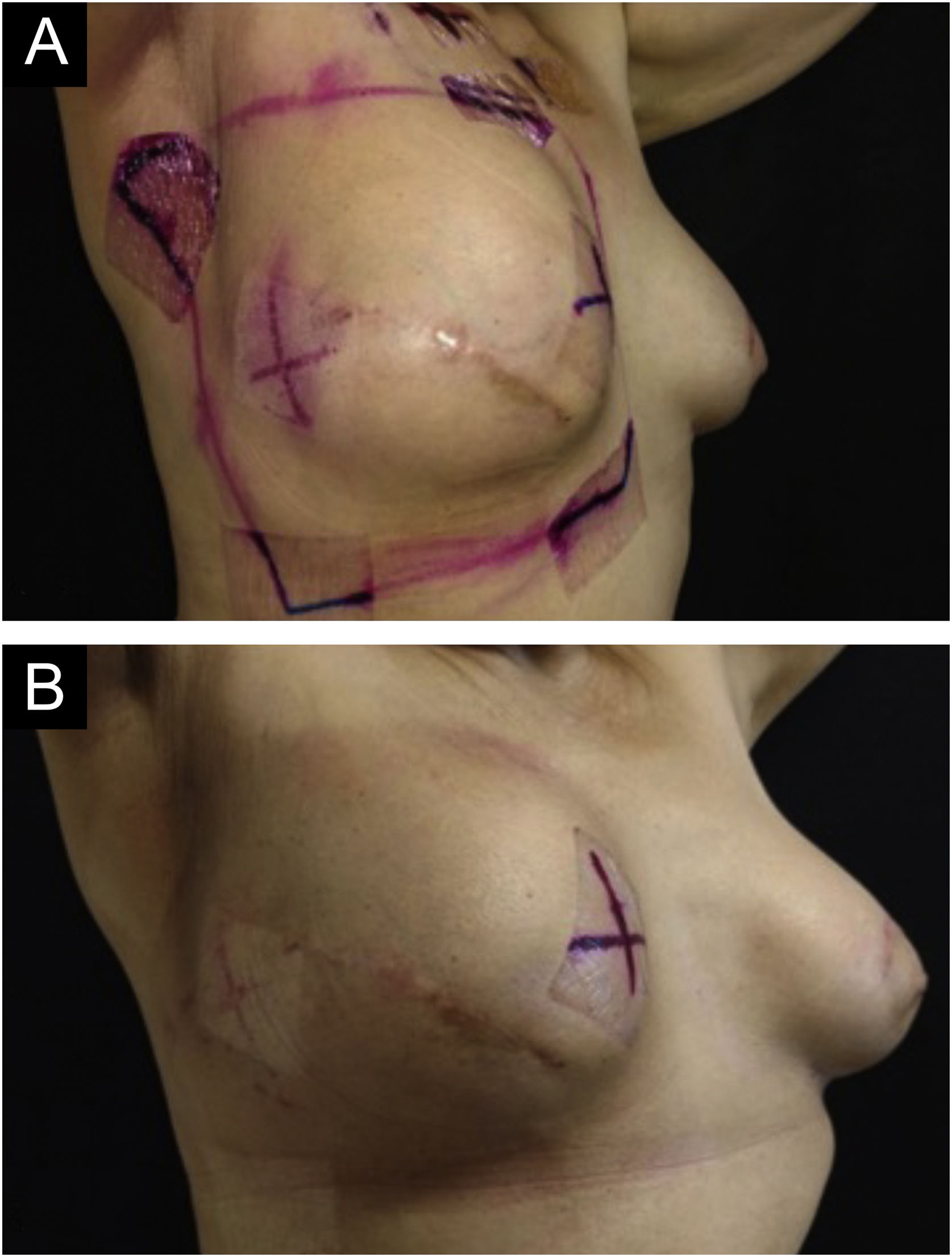
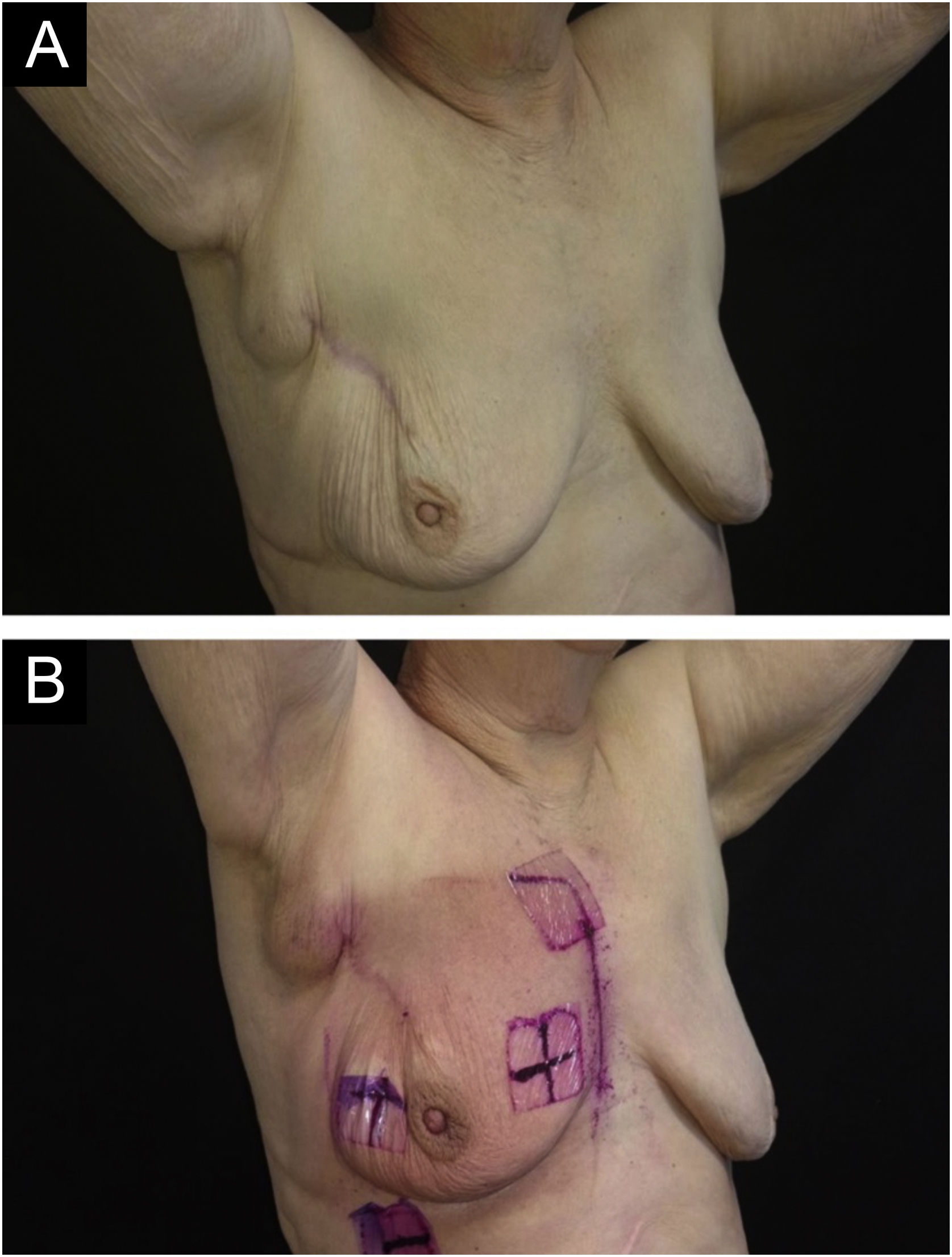
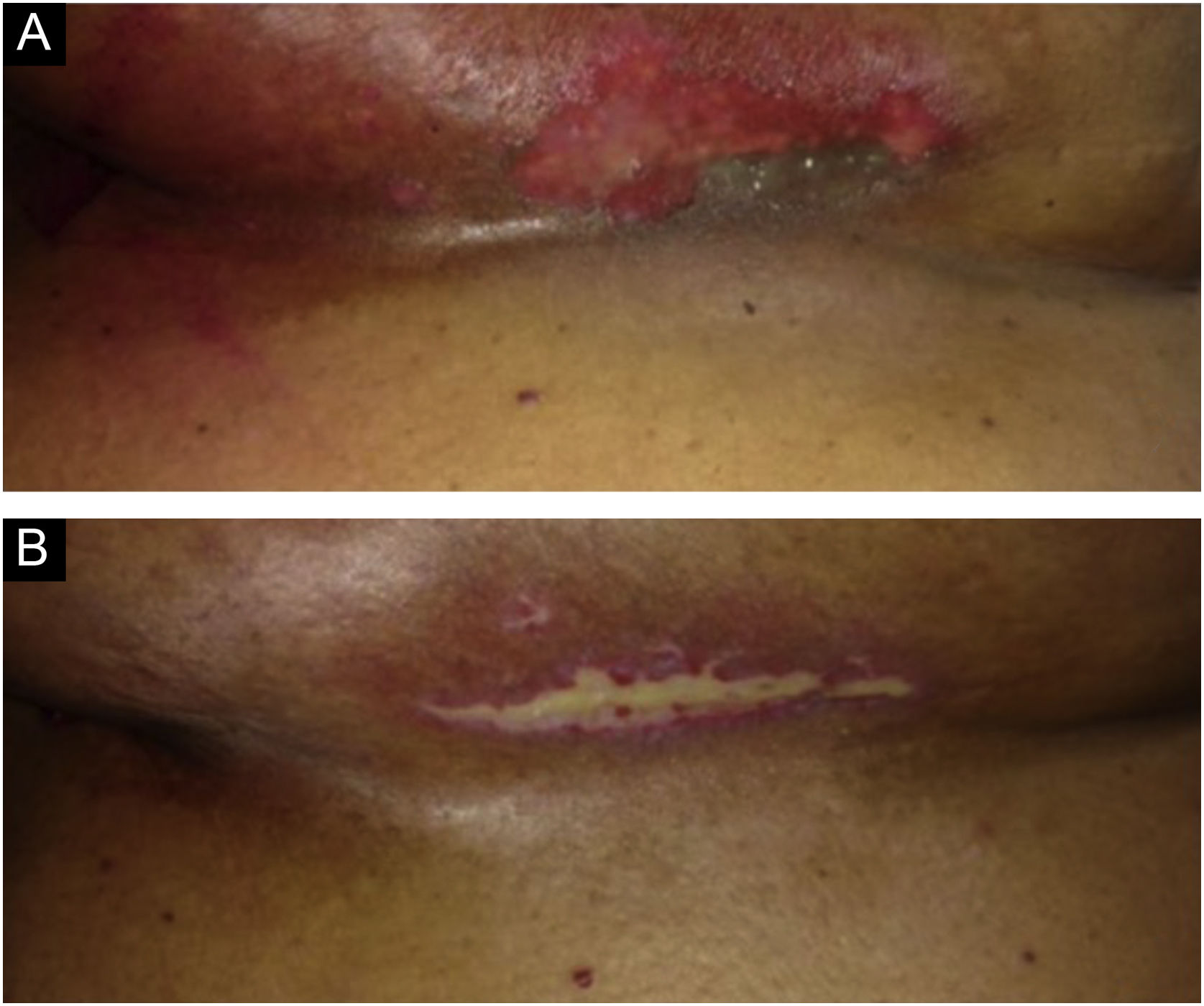
Desfecho primárioAlgum grau de radiodermatite ocorreu em 111/113 pacientes (98,2%). Quanto à gravidade, 95/113 pacientes (85,6%) desenvolveram radiodermatite grau I, 14/113 (12,6%) grau II, 1/113 (0,9%) grau III e 1/113 (0,9%) grau IV. Vale ressaltar que das pacientes que receberam radioterapia de reforço, 54/68 (79,4%) desenvolveram a radiodermatite durante a radioterapia padrão e mantiveram o grau I, 12/68 (17,6%) desenvolveram grau II, das quais seis apenas iniciaram a reação após o reforço, 1/68 (1,5%) desenvolveu grau III e 1/68 (1,5%) grau IV, ambas com início após o reforço. As figuras 1–3 representam pacientes que desenvolveram diferentes graus de radiodermatite na mama.
Imagens de da prega inframamária após 28 sessões de radioterapia com dose total de 5.654 cGy. (A) Radiodermatite de grau II, caracterizada por exulceração (descamação úmida) localizada. (B) Quatorze dias após o término da radioterapia mostra radiodermatite grau IV, caracterizada por ulceração.
Também é importante destacar as características das duas pacientes que não desenvolveram nenhum grau de radiodermatite. Uma com 77 anos, IMC=25,9; recebeu nove sessões, com dose média de 2.400 cGy e não continuou o tratamento por falecimento. A outra paciente, de 46 anos, IMC 28,5, recebeu apenas 10 sessões conforme prescrição do radioterapeuta para tratamento paliativo, também com dose média de 2.400 cGy.
Desfechos secundáriosFatores associados à radiodermatite de graus de gravidade mais elevadosTodas as variáveis apresentadas na tabela 1 foram analisadas quanto à associação com radiodermatite de graus de gravidade mais elevados (II, III e IV). Na regressão logística foram incluídas as variáveis cujo valor de p na análise univariada foi <0,1; portanto, foram incluídos os seguintes parâmetros: IMC, diabetes mellitus, dislipidemia, uso de hipoglicemiantes orais, analgésicos e estatinas, variação da dose de radiação, profundidade de radiação, volume irradiado e esquemas quimioterápicos prévios. Essa análise revelou que para cada unidade de aumento do IMC, a chance de ocorrência de radiodermatite graus II a IV aumentou em 14% (OR=1,14; 95% IC 1,04–1,26; p=0,004) e que o uso de estatina concomitante à radioterapia aumentou o risco em quatro vezes (OR=4,27; 95% IC 1,11–16,42; p=0,035).
Também foram avaliadas a dose, o fracionamento e a energia recebida no boost em cicatriz cirúrgica. Na análise estatística, essas variáveis não se mostraram fatores independentes da gravidade da radiodermatite (p>0,1).
Tempo de início da radiodermatiteO tempo médio para o aparecimento da radiodermatite foi de 17±5 (variação de 5 a 27) dias. Em todos os casos, a radiodermatite se manifestou antes do término da radioterapia padrão e início da radioterapia de reforço. Destaca‐se que 12/113 (10,6%) pacientes receberam prótese de silicone e todas desenvolveram radiodermatite grau I, com tempo médio para o aparecimento de 18,4±5,7 (variação do tempo de início da reação de 8 a 26) dias.
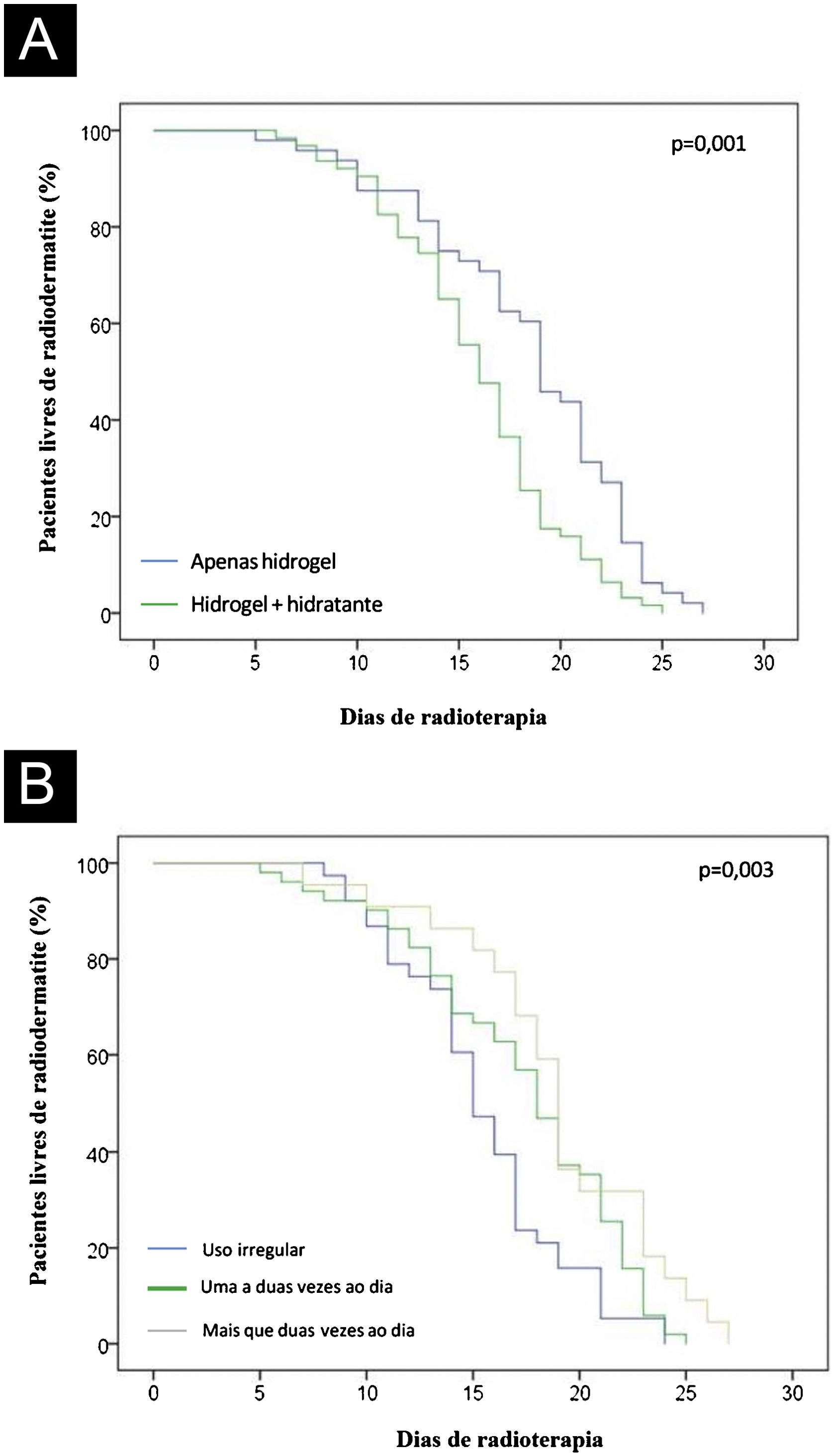
Todas as variáveis apresentadas na tabela 1 foram analisadas quanto a sua associação com o tempo de início da radiodermatite. A análise multivariada, realizada pelo modelo de regressão de Cox, mostrou que o uso exclusivo de hidrogel para hidratação da pele foi um fator independente para retardar o aparecimento de radiodermatite quando comparado aos pacientes em uso de hidrogel associado a cremes hidratantes (p=0,004), conforme demonstrado na tabela 2. A mediana do tempo de aparecimento das lesões cutâneas em pacientes em uso isolado de hidrogel foi de 19,0 (variação 14,5–23,0) dias, enquanto para pacientes em uso de hidrogel e cremes hidratantes foi de 16,0 (variação de 13,0–19,0) dias (p=0,003). A figura 4A mostra a curva dos pacientes livres de radiodermatite de acordo com o esquema de hidratação da pele utilizado.
Análise multivariada dos fatores preditores para o tempo de início da radiodermatite em mulheres com câncer de mama tratadas por irradiação de fótons
| Razão de risco (95% IC) | Valor de p | |
|---|---|---|
| Suplementação vitamínica | 0,68 (0,40–1,14) | 0,14 |
| Quimioterapia prévia | ||
| Esquema DCT (referência)a | – | – |
| Outros regimesb | 1,50 (0,89–2,52) | 0,12 |
| Não realizado | 1,03 (0,60–1,76) | 0,93 |
| Uso de hidrogel vs. hidrogel com hidratante | 0,55 (0,36–0, 82) | 0,004 |
95% IC, intervalo de confiança de 95%.
Outros esquemas – ciclofosfamida mais taxano, doxorrubicina mais ciclofosfamida, doxorrubicina, ciclofosfamida e carboplatina, doxorrubicina, ciclofosfamida e floururacil, taxano mais carboplatina.
Os parâmetros apresentados nesta tabela, utilizados para o modelo de riscos proporcionais de Cox, foram aqueles que apresentaram p‐valor menor que 0,1 na análise univariada.
Considerando que a utilização exclusiva de hidrogel retardou em alguns dias o aparecimento de radiodermatite, foi realizada análise mais detalhada desse grupo de pacientes, os quais foram divididos de acordo com a frequência do uso exclusivo do hidrogel: irregular (menos de uma vez/dia), uma ou duas vezes/dia e mais de duas vezes/dia. A mediana do tempo de aparecimento da radiodermatite nos dois últimos grupos que utilizaram o hidrogel com maior frequência foi maior do que naqueles com uso irregular (> duas vezes/dia: 19,0 [17,0–23,0] dias; uma a duas vezes/dia: 18,0 [14,0–22,0] dias; uso irregular: 15,0 [13,0–17,0] dias, p=0,009). A figura 4B mostra a curva de pacientes livres de radiodermatite de acordo com a frequência de hidrogel utilizada para hidratação da pele durante o período de radioterapia.
DiscussãoNo presente estudo, as pacientes com câncer de mama foram submetidas à técnica de radioterapia bidimensional com acelerador linear, e quase todas (98,2%) apresentaram radiodermatite na mama, com início da reação geralmente após algumas sessões. Destaca‐se que as duas pacientes que não apresentaram radiodermatite foram as que receberam em torno de 10 sessões, portanto com menor dose acumulada.
Esses achados são muito semelhantes aos encontrados por outros estudos com alta taxa de incidência dessa toxicidade.3,17 Yee et al. conduziram revisão sistemática com a inclusão de 96 ensaios clínicos randomizados com pacientes com câncer de mama que realizaram radioterapia com feixe externo e encontraram incidência variável entre os estudos de 26,3%–92,2%. Conclui‐se que modos de administração de radioterapia, como a radioterapia com intensidade modulada (intensity‐modulated radiotherapy – IMRT) e hipofracionamento demonstraram diminuir a toxicidade cutânea comparados aos tratamentos convencionais.3
Lee et al. observaram incidência muito semelhante ao nosso estudo (97,3% de radiodermatite em 111 mulheres com câncer de mama na Coreia do Sul); entretanto, não relataram a técnica de radioterapia utilizada.18 Alta taxa de toxicidade cutânea também foi observada em estudo brasileiro realizado em hospital de São Paulo com 86 mulheres, no qual 100% das pacientes desenvolveram essa reação após radioterapia com acelerador linear, com dose total de 5.040 cGy (180 cGy dose/dia).19 Essa alta incidência corrobora a importância do estudo da radiodermatite, principalmente em relação às medidas de prevenção ou retardo de seu início.
Um achado marcante neste estudo foi o impacto do IMC na incidência de maiores graus de radiodermatite. Para cada unidade adicional de IMC, houve aumento de 14% no risco de reações cutâneas de graus II a IV. Outros estudos também identificaram associação do IMC com o aumento do risco de radiodermatite. Foi observada associação do IMC com o desenvolvimento de reações cutâneas graves na mama.13 Em outro estudo, Twardella et al. também demonstraram associação entre IMC e aumento do risco de toxicidade cutânea aguda.12 Esses autores também identificaram correlação entre mamas grandes e IMC mais elevado. Esse achado poderia justificar o IMC como fator de risco independente para radiodermatite mais grave. Em revisão sistemática, Mukesh et al. encontraram que maior volume mamário estava relacionado ao risco de radiodermatite.14 Também se pode dizer que mulheres com IMCs maiores provavelmente apresentam mamas maiores e, consequentemente, maior risco de toxicidade cutânea decorrente da radiação. A justificativa para esses achados está relacionada a mamas maiores, pela presença de tecido extra, o qual interfere na absorção de radiação por distribuição não homogênea da dose e maior campo de separação. Há também maior queda da mama no sulco mamário, causando maiores toxicidades nessa região, isso porque o tecido redundante na região inframamária serve como região de acúmulo de dose de feixe de fótons, que é então incidente sobre o tecido oposto a ele.12
Outro achado neste estudo foi a associação entre o uso continuado de estatinas e o desenvolvimento de radiodermatite mais grave. Essa classe de medicamentos aumentou o risco de pacientes apresentarem toxicidade cutânea nos graus II a IV em quatro vezes. Há poucos dados na literatura confirmando essa associação, que tem sido descrita como dermatite recordatória por radiação (DRR). Nesse fenômeno, a lesão cutânea se manifesta após o término da radioterapia. É mais bem descrito para quimioterapia após radioterapia. No entanto, dois casos de DRR com uso de estatinas são relatados na literatura. Abadir e Liebmann descreveram um caso de um paciente com câncer de bexiga que recebeu radioterapia local e não desenvolveu lesões cutâneas durante a radioterapia.20 No entanto, um ano após o término da radioterapia e o início do uso da sinvastatina para hipercolesterolemia, o paciente desenvolveu lesão no local da irradiação prévia. Relato semelhante foi feito por Taunk et al., que descrevem o caso de paciente com câncer de mama submetida à radioterapia que desenvolveu radiodermatite durante o tratamento.21 Após cinco anos, a paciente iniciou o uso de rosuvastatina e amlodipina para tratar hipercolesterolemia e hipertensão arterial sistêmica. Após duas semanas, desenvolveu lesão cutânea no local onde já havia recebido a irradiação e desenvolvido radiodermatite. A questão que se coloca é se as estatinas têm algum efeito deletério sobre a pele, especialmente quando associadas à radioterapia. Esta classe de medicamentos inibe a enzima 3‐hidroxi‐3‐metilglutaril coenzima A (HMG CoA) redutase, causando redução significante nos níveis séricos de colesterol, especialmente aqueles que formam o colesterol de lipoproteína de baixa densidade. Com esse efeito sobre a HMG CoA redutase, as estatinas inibem a via do mevalonato e, consequentemente, reduzem a produção de compostos isoprenoides não esteroidais que resultam em efeitos celulares pleiotrópicos, entre os quais proliferação, diferenciação e mielinização.22 Relatos de lesões cutâneas induzidas pelo uso de estatinas têm sido descritos.23‐26 Considerando que a radiação danifica quimicamente a pele, talvez o uso de estatinas possa potencializar os danos no processo de regeneração cutânea. Outro fator que deve ser lembrado, embora não avaliado neste estudo, são as interações medicamentosas com estatinas que podem aumentar o risco de efeitos colaterais desses fármacos.
Outro achado importante deste estudo foi o uso do hidrogel como fator protetor para a radiodermatite. Embora o uso do hidrogel não tenha evitado a ocorrência de radiodermatite, pois apenas duas participantes não apresentaram toxicidade cutânea, ele retardou seu aparecimento quando comparado aos pacientes que utilizaram o hidrogel combinado com cremes hidratantes. Em nosso serviço, todos os pacientes submetidos à radioterapia são orientados a hidratar a pele três vezes ao dia, seja com hidratante ou hidrogel. A recomendação de qual produto deve ser utilizado para hidratação depende de sua acessibilidade para cada paciente. Como os cremes hidratantes foram utilizados como alternativa ao hidrogel, principalmente pelo maior custo do hidrogel, os pacientes que utilizaram os dois produtos pertenciam majoritariamente ao grupo que utilizou o hidrogel de maneira irregular. Não houve grupo de pacientes que utilizou apenas creme hidratante de modo regular, impossibilitando realizar conclusões mais confiáveis sobre a melhor maneira de retardar a radiodermatite. O desenho do presente estudo, por ser observacional, não é o melhor para avaliar eficácia de intervenções. Para diminuir fatores confundidores, o desenho de estudo apropriado é o de ensaio clínico, de preferência randomizado, com formação de grupos de tratamentos padronizados e mais homogêneos.
Entretanto, o uso de hidrogel como fator protetor da radiodermatite já foi demonstrado. Censabella et al. realizaram estudo comparando pacientes divididos em grupo que usou hidrogel do início ao fim da radioterapia (grupo hidrogel preventivo) e dois grupos de controles históricos pareados: um que aplicou creme de dexpantenol durante toda a terapia (grupo dexpantenol) e outro que aplicou creme de dexpantenol para 11–14 sessões de radioterapia seguido de gel hidroativo (grupo hidrogel curativo). Os pacientes do grupo hidrogel preventivo desenvolveram menos radiodermatite e mais tardiamente do que os pacientes do grupo dexpantenol e não diferiram do grupo hidrogel curativo.27
Sabe‐se da importância da hidratação da pele como maneira de prevenir a toxicidade cutânea pela radioterapia.28,29 A capacidade de reter água na pele está relacionada ao estrato córneo externo da epiderme.30 Pode ser retido pela hidratação dos corneócitos, as células que compõem o estrato córneo. Os lipídios intracelulares dessa camada formam uma barreira transepidérmica que impede a perda de água. As glândulas sebáceas também desempenham papel importante na retenção de água, principalmente pela produção de glicerol. Quando a pele é irradiada, ocorrem danos significantes, afetando a produção de glicerol e lipídios intracelulares, permitindo perda de água e consequente ressecamento da pele, o que contribui para os efeitos da radiação sobre a pele e o desenvolvimento da radiodermatite.6
Além dos eventos adversos inerentes à radioterapia, um estudo brasileiro mostrou que mulheres que realizaram radioterapia para câncer de mama apresentaram com maior frequência queixas dermatológicas, o que foi estatisticamente significante (RP=1,13; 95% IC 1,03–1,23; p=0,011). Essas queixas foram principalmente relacionadas a radiodermatite, tais como eritema, hiperpigmentação, xerose e prurido mamário, demostrando o impacto dessas alterações dermatológicas nas pacientes em tratamento para câncer de mama.31
A principal limitação deste estudo foi sua validade externa. Os fatores aqui identificados devem ser considerados para serviços e populações semelhantes aos deste estudo. A radioterapia nesta amostra foi realizada com planejamento com base em imagens planas (bidimensional). Alguns serviços utilizam técnica diferente de radioterapia, com planejamento volumétrico com base em imagem tridimensional. Iwakawa et al. já demonstraram que o risco de reações cutâneas na mama era altamente dependente da instituição onde a paciente foi tratada, em decorrência das diferentes técnicas de tratamento, da falta de homogeneidade da dose e da forma tridimensional da mama.9 Por esse motivo, este estudo foi realizado para identificar as características da radiodermatite com esse tipo de radioterapia. Outra limitação foi a não realização da volumetria mamária, uma vez que mamas maiores foram identificadas em outro estudo com fator de risco independente para maior gravidade da radiodermatite.32 Entretanto, no presente estudo, foi analisado o volume irradiado, o qual é uma variável relacionada ao volume da mama, mas na análise multivariada não apresentou ser fator de risco independente para gravidade e tempo de início da radiodermatite. Também não classificamos os pacientes segundo os fototipos de Fitzpatrick, e sim de acordo com a raça referida – houve predominância da raça branca (92,1%), e não foi fator relacionado à gravidade e ao tempo de início da radiodermatite. O estudo de Twardella et al., que classificou os pacientes de acordo com o fototipo, não encontrou essa variável como fator de risco.12
Por fim, os achados de nosso estudo são válidos para radioterapia com planejamento com base em imagem plana, técnica de radioterapia bidimensional com acelerador linear e com feixes de raios X (fótons) cuja dose média foi de 5.727 cGy.
ConclusãoNosso estudo contribui para melhor conhecimento da radiodermatite em mulheres com câncer de mama, pois mostra sua alta incidência, a relação de sua gravidade com o IMC e o uso de estatinas, e o efeito protetor do uso de hidrogel. Estudos futuros são necessários para aumentar o conhecimento sobre os fatores associados à radiodermatite, considerando diferentes populações e a diversidade de tratamentos.
Suporte financeiroNenhum.
Contribuição dos autoresLoren Giagio Cavalcante: Concepção e planejamento do estudo; elaboração do texto, coleta, análise e interpretação dos dados; revisão de literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Rejane Aparecida Rodrigues Domingues: Coleta dos dados; revisão de literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Batista de Oliveira Junior: Análise e interpretação dos dados; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Marco Antônio Rodrigues Fernandes: Análise e interpretação dos dados; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Eduardo Carvalho Pessoa: Análise e interpretação dos dados; revisão crítica do manuscrito; aprovação da versão final do manuscrito
Luciana Patrícia Fernandes Abbade: Participação efetiva na orientação da pesquisa, análise e interpretação dos dados; análise estatística; elaboração do texto; revisão de literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Cavalcante LG, Domingues RAR, Oliveira Junior B, Fernandes MAR, Pessoa EC, Abbade LPF. Incidence of radiodermatitis and factors associated with its severity in women with breast cancer: a cohort study. An Bras Dermatol. 2024;99:57–65.
Trabalho realizado no Departamento de Infectologia, Dermatologia, Diagnóstico por Imagem e Radioterapia, Faculdade de Medicina, Universidade Estadual Paulista, Botucatu, SP, Brasil.