Alopecia areata é doença autoimune que causa perda de cabelo sem cicatrizes na lesão. As variantes genéticas do gene do antígeno 4 associado ao linfócito T citotóxico (CTLA4), um regulador negativo da resposta das células T, foram associadas a predisposição a doenças autoimunes em diferentes populações; no entanto, o envolvimento dessas variantes genéticas no desenvolvimento da alopecia areata é controverso.
ObjetivoAvaliar a associação potencial de duas variantes do gene CTLA4 e alopecia areata em uma população mexicana.
MétodosForam genotipadas por PCR‐RFLP as variantes+49AG (rs231775) e CT60 (rs3087243) de 50 pacientes com alopecia areata e 100 controles saudáveis.
ResultadosNão foi observada diferença estatística para alguma das variantes genéticas quanto às frequências alélicas ou genotípicas entre os pacientes com alopecia areata e controles quando considerados os parâmetros de história familiar/pessoal de doenças autoimunes ou sexo (p>0,05).
Limitações do estudoAmostra pequena de pacientes e coleta de dados em apenas uma população do nordeste do México.
ConclusãoAs variantes genéticas rs231775 e rs3087243 do gene CTLA4 não são um fator de risco para o desenvolvimento de alopecia areata na população mexicana analisada.
A alopecia areata (AA) é doença autoimune que causa perda de cabelo sem cicatrizes na lesão e ocorre em qualquer idade.1 Ela normalmente se apresenta como áreas arredondadas de alopecia, únicas ou múltiplas, embora possa ocorrer calvície completa (AA total). AA universal é definida como a perda de pelos em todo o corpo. A AA também pode se apresentar na circunferência da cabeça, chamada AA ofiásica.2 A AA é considerada doença poligênica influenciada por herança geneticamente complexa, especialmente de genes relacionados a doenças autoimunes e inflamatórias, além de fatores ambientais.3,4 A literatura relata que vários genes do sistema imunológico contribuem para o desenvolvimento dessa doença, como o gene regulador autoimune (AIRE), antígeno leucocitário humano (HLA), genes de interleucina (IL), antígeno 4 associado ao linfócito T citotóxico (CTLA4), proteína tirosina fosfatase não receptora 22 (PTPN22), fator de necrose tumoral da superfamília 6 ou CD95 (FAS) e ligante FAS (FASL), entre outros.5,6
O CTLA4 (2q34) é membro da superfamília imunoglobulinas que codificam uma proteína que é potente reguladora negativa da resposta das células T. Por seu papel na manutenção da tolerância imunológica, ele tem sido apontado como um gene de suscetibilidade em doenças autoimunes humanas,e apresenta vários polimorfismos associados ao seu desenvolvimento.7 Entre os polimorfismos, duas variantes genéticas podem contribuir para a suscetibilidade ao AA:+49AG (rs231775), uma variação missense que leva a uma substituição do aminoácido treonina por alanina no códon 17 no peptídeo líder (T17A) e CT60 (rs3087243), localizada em 236bp downstream no gene CTLA4 (3’‐UTR).8 No entanto, estudos recentes feitos em diferentes populações indicam que a relação dessas variantes genéticas no desenvolvimento de AA é controversa.3,9
O presente estudo teve como objetivo determinar se as variantes dos genes CTLA4+49AG (rs231775) e CT60 (rs3087243) constituem um fator de predisposição para AA em uma coorte de pacientes mexicanos.
Material e métodosSeleção de pacientes e controlesO estudo incluiu 50 indivíduos mexicanos com diagnóstico de AA não relacionados entre si (32 mulheres e 18 homens; idade média: 30±15 anos) e 100 participantes saudáveis (59 mulheres e 41 homens; idade média: 25±8 anos); os controles apresentavam história familiar médica negativa para doenças autoimunes/inflamatórias. Os pacientes foram recrutados no Departamento de Dermatologia após a aceitação e assinatura do termo de consentimento livre e esclarecido. Este estudo foi aprovado pelo Comitê de Ética em Pesquisa e registrado sob o código DE09‐001. Detalhes adicionais sobre as características clínicas e demográficas, tipo de AA e distribuição de cada paciente foram obtidos durante a avaliação clínica.
Isolamento e genotipagem de DNAO DNA genômico foi isolado do sangue venoso periférico com o método salting out e suspenso em Tris‐EDTA (pH 7,8) a uma concentração final de 0,1 a 1,0μg/μL antes do uso. As frequências genotípicas e alélicas das variantes do gene CTLA4+49AG (rs231775) e CT60 (rs3087243) foram caracterizadas por PCR‐RFLP com um termociclador MJ Mini PTC1148 (Bio‐Rad, Hercules; CA, Estados Unidos), primers oligonucleotídicos específicos (IDT, Coralville, IA, Estados Unidos) e enzimas de restrição (New England Biolabs, Ipswich, MA, Estados Unidos) de acordo com um protocolo publicado anteriormente.10 Os fragmentos obtidos foram analisados por eletroforese em gel de agarose a 2,5% com brometo de etídio, observados no transiluminador UVP modelo 2UV de alto desempenho (Upland, CA, E) e documentados.
Análise estatísticaPara análise genética, o tamanho da amostra foi calculado com base na incidência mundial de AA de 2%,11 assumiu‐se um poder de 99,0% (um valor‐Z de 2,33), foi obtido o número mínimo de 43 indivíduos.
O software SPSS v21.0 para Windows (SPSS, Inc. Chicago, IL, Estados Unidos) e o programa estatístico Epi‐INFOTM 7 (Stone. Mountain, GA, USD Inc) foram usados para análise dos dados. O equilíbrio de Hardy‐Weinberg para os alelos foi obtido por meio de um teste de qualidade de ajuste e a dependência genotípica entre pacientes e controles foi determinada com um teste de χ2. A razão de probabilidades (OR) foi calculada a partir de tabelas de contingência 2×2 (p<0,05).
ResultadosCaracterísticas clínicas dos participantesO presente estudo analisou a distribuição do genótipo e a frequência alélica das variantes do gene CTLA4+49AG e CT60. O universo do estudo (n) consistiu em 50 pacientes com AA e 100 controles. A apresentação clínica da AA nos pacientes foi: 41 pacientes com AA em placas (unifocal n=14, oito mulheres e seis homens; multifocal n=27, 19 mulheres e 8 homens), quatro pacientes com AA ofiásica (três mulheres e um homem), uma mulher com AA total e quatro pacientes com AA universal (três homens e um mulher). Dez pacientes (20%) tinham histórico pessoal de doenças autoimunes (vitiligo, diabetes melito tipo 2, entre outros) e 36 indivíduos (72%) tinham histórico familiar de doença imunológica.
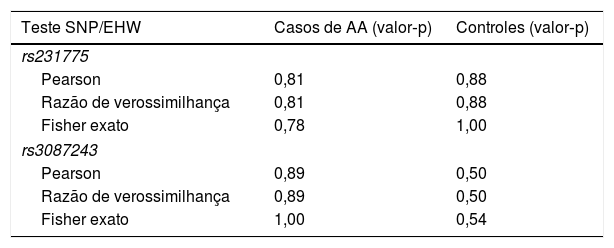
Análise de alelos e genótiposVários testes foram feitos para ambas as variantes genéticas, a fim de avaliar o equilíbrio de Hardy‐Weinberg (EHW; tabela 1), todos com p>0,05, indicaram que as variantes dos genes rs231775 e rs3087243 estavam em EHW nos pacientes com AA e controles.
Testes para desvio do equilíbrio de Hardy‐Weinberg em pacientes com AA e controles saudáveis
| Teste SNP/EHW | Casos de AA (valor‐p) | Controles (valor‐p) |
|---|---|---|
| rs231775 | ||
| Pearson | 0,81 | 0,88 |
| Razão de verossimilhança | 0,81 | 0,88 |
| Fisher exato | 0,78 | 1,00 |
| rs3087243 | ||
| Pearson | 0,89 | 0,50 |
| Razão de verossimilhança | 0,89 | 0,50 |
| Fisher exato | 1,00 | 0,54 |
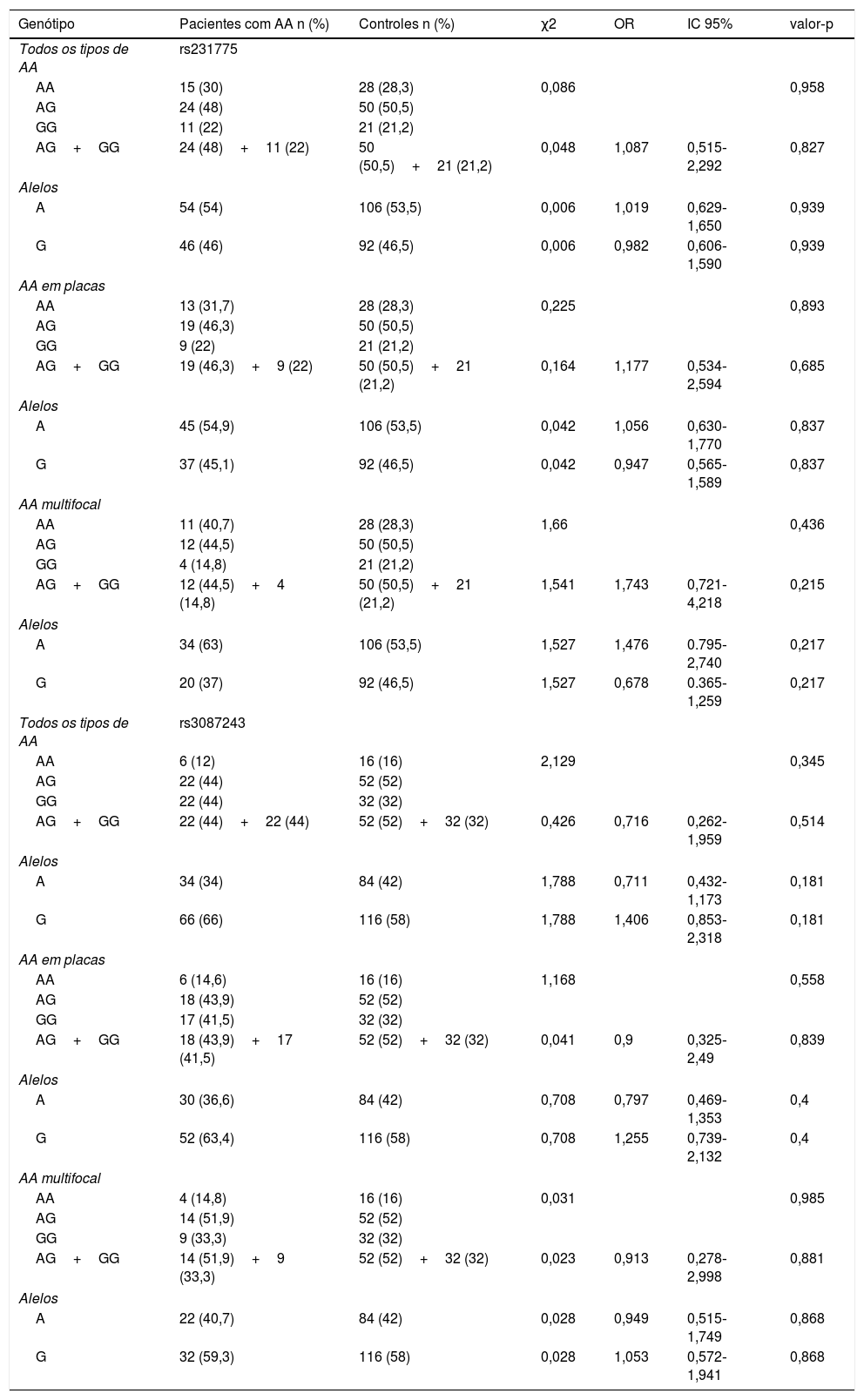
Os alelos e genótipos do CTLA4 rs231775 e do rs3087243 do grupo controle foram comparados com os dos indivíduos com AA (todos os tipos de AA) e com os diferentes tipos de AA; a tabela 1 apresenta os resultados dessa comparação. Para CTLA4 rs231775, 30% dos pacientes com AA apresentaram genótipo AA do tipo selvagem homozigótico, 48% apresentaram o genótipo AG heterozigótico e os 22% restantes, genótipo GG variante homozigótica. Para CTLA4 rs3087243, 44% dos pacientes com AA apresentaram o genótipo GG do tipo selvagem homozigótico, 44% apresentaram o genótipo AG heterozigótico e os 12% restantes, AA variante homozigótica.
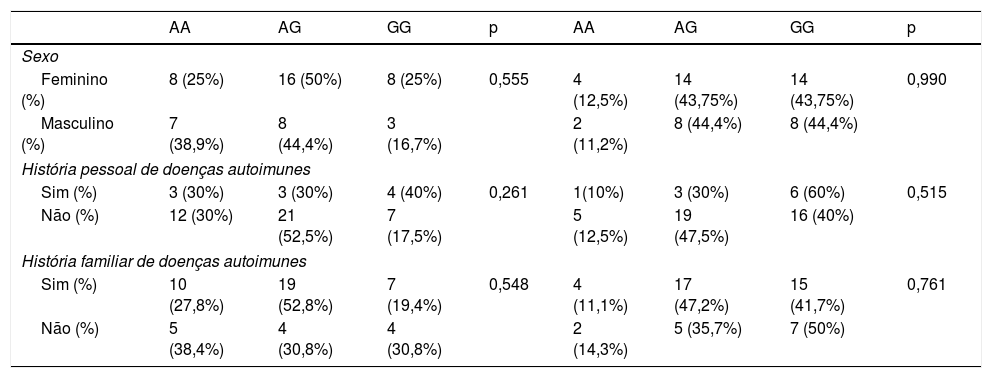
Associação dos genótipos em pacientes com alopecia areataQuando os genótipos e frequências de alelos CTLA4 rs231775 e rs3087243 foram comparados entre toda a coorte (todos os tipos de AA) e controles, observou‐se que o genótipo AG heterozigótico para CTLA4 rs231775 e rs3087243 era mais frequente nos controles do que em todos os grupos de pacientes com AA. Além disso, não se observou associação entre variantes alélicas e AA nos pacientes analisados (p>0,05; tabela 2). Além disso, não foi encontrada relação entre o genótipo e o tipo de AA com a história pessoal/familiar de doenças autoimunes ou o sexo dos pacientes analisados (p>0,05; tabela 3).
Frequência de alelos e genótipo das variantes genéticas CTLA4+49AG (rs231775) e CT60 (rs3087243) em pacientes com AA e controles saudáveis
| Genótipo | Pacientes com AA n (%) | Controles n (%) | χ2 | OR | IC 95% | valor‐p |
|---|---|---|---|---|---|---|
| Todos os tipos de AA | rs231775 | |||||
| AA | 15 (30) | 28 (28,3) | 0,086 | 0,958 | ||
| AG | 24 (48) | 50 (50,5) | ||||
| GG | 11 (22) | 21 (21,2) | ||||
| AG+GG | 24 (48)+11 (22) | 50 (50,5)+21 (21,2) | 0,048 | 1,087 | 0,515‐2,292 | 0,827 |
| Alelos | ||||||
| A | 54 (54) | 106 (53,5) | 0,006 | 1,019 | 0,629‐1,650 | 0,939 |
| G | 46 (46) | 92 (46,5) | 0,006 | 0,982 | 0,606‐1,590 | 0,939 |
| AA em placas | ||||||
| AA | 13 (31,7) | 28 (28,3) | 0,225 | 0,893 | ||
| AG | 19 (46,3) | 50 (50,5) | ||||
| GG | 9 (22) | 21 (21,2) | ||||
| AG+GG | 19 (46,3)+9 (22) | 50 (50,5)+21 (21,2) | 0,164 | 1,177 | 0,534‐2,594 | 0,685 |
| Alelos | ||||||
| A | 45 (54,9) | 106 (53,5) | 0,042 | 1,056 | 0,630‐1,770 | 0,837 |
| G | 37 (45,1) | 92 (46,5) | 0,042 | 0,947 | 0,565‐1,589 | 0,837 |
| AA multifocal | ||||||
| AA | 11 (40,7) | 28 (28,3) | 1,66 | 0,436 | ||
| AG | 12 (44,5) | 50 (50,5) | ||||
| GG | 4 (14,8) | 21 (21,2) | ||||
| AG+GG | 12 (44,5)+4 (14,8) | 50 (50,5)+21 (21,2) | 1,541 | 1,743 | 0,721‐4,218 | 0,215 |
| Alelos | ||||||
| A | 34 (63) | 106 (53,5) | 1,527 | 1,476 | 0.795‐2,740 | 0,217 |
| G | 20 (37) | 92 (46,5) | 1,527 | 0,678 | 0.365‐1,259 | 0,217 |
| Todos os tipos de AA | rs3087243 | |||||
| AA | 6 (12) | 16 (16) | 2,129 | 0,345 | ||
| AG | 22 (44) | 52 (52) | ||||
| GG | 22 (44) | 32 (32) | ||||
| AG+GG | 22 (44)+22 (44) | 52 (52)+32 (32) | 0,426 | 0,716 | 0,262‐1,959 | 0,514 |
| Alelos | ||||||
| A | 34 (34) | 84 (42) | 1,788 | 0,711 | 0,432‐1,173 | 0,181 |
| G | 66 (66) | 116 (58) | 1,788 | 1,406 | 0,853‐2,318 | 0,181 |
| AA em placas | ||||||
| AA | 6 (14,6) | 16 (16) | 1,168 | 0,558 | ||
| AG | 18 (43,9) | 52 (52) | ||||
| GG | 17 (41,5) | 32 (32) | ||||
| AG+GG | 18 (43,9)+17 (41,5) | 52 (52)+32 (32) | 0,041 | 0,9 | 0,325‐2,49 | 0,839 |
| Alelos | ||||||
| A | 30 (36,6) | 84 (42) | 0,708 | 0,797 | 0,469‐1,353 | 0,4 |
| G | 52 (63,4) | 116 (58) | 0,708 | 1,255 | 0,739‐2,132 | 0,4 |
| AA multifocal | ||||||
| AA | 4 (14,8) | 16 (16) | 0,031 | 0,985 | ||
| AG | 14 (51,9) | 52 (52) | ||||
| GG | 9 (33,3) | 32 (32) | ||||
| AG+GG | 14 (51,9)+9 (33,3) | 52 (52)+32 (32) | 0,023 | 0,913 | 0,278‐2,998 | 0,881 |
| Alelos | ||||||
| A | 22 (40,7) | 84 (42) | 0,028 | 0,949 | 0,515‐1,749 | 0,868 |
| G | 32 (59,3) | 116 (58) | 0,028 | 1,053 | 0,572‐1,941 | 0,868 |
Análise das variantes genéticas CTLA4+49AG (rs231775) e CT60 (rs3087243) por sexo e história pessoal/familiar de doenças autoimunes
| AA | AG | GG | p | AA | AG | GG | p | |
|---|---|---|---|---|---|---|---|---|
| Sexo | ||||||||
| Feminino (%) | 8 (25%) | 16 (50%) | 8 (25%) | 0,555 | 4 (12,5%) | 14 (43,75%) | 14 (43,75%) | 0,990 |
| Masculino (%) | 7 (38,9%) | 8 (44,4%) | 3 (16,7%) | 2 (11,2%) | 8 (44,4%) | 8 (44,4%) | ||
| História pessoal de doenças autoimunes | ||||||||
| Sim (%) | 3 (30%) | 3 (30%) | 4 (40%) | 0,261 | 1(10%) | 3 (30%) | 6 (60%) | 0,515 |
| Não (%) | 12 (30%) | 21 (52,5%) | 7 (17,5%) | 5 (12,5%) | 19 (47,5%) | 16 (40%) | ||
| História familiar de doenças autoimunes | ||||||||
| Sim (%) | 10 (27,8%) | 19 (52,8%) | 7 (19,4%) | 0,548 | 4 (11,1%) | 17 (47,2%) | 15 (41,7%) | 0,761 |
| Não (%) | 5 (38,4%) | 4 (30,8%) | 4 (30,8%) | 2 (14,3%) | 5 (35,7%) | 7 (50%) | ||
AA é doença autoimune com perda de cabelos que tem sido associada a múltiplas variantes genéticas, várias das quais participam de vias de resposta imune relacionadas ao HLA.12 O produto do gene CTLA4 é um receptor expresso pelas células T CD4+e CD8+. Experimentos em camundongos knockout demonstraram o importante papel que o CTLA4 desempenha na proteção contra a autoimunidade. O CTLA‐4 é um regulador negativo crítico das respostas das células T e sua ação nas células Treg pode controlar a atividade de outras células e a autoimunidade fatal.13
Foi sugerida a associação entre a presença das variantes do gene CTLA4 e o desenvolvimento de diferentes doenças autoimunes.14,15 No entanto, nas doenças imunológicas dermatológicas, os resultados são controversos; no vitiligo, a literatura relata tanto sua participação como não influência.16 Uma situação semelhante foi observada no desenvolvimento da psoríase.17,18
Nesse sentido, considerando a possível contribuição da função autoimune na alopecia, estudos de variantes genéticas do gene CTLA4 foram conduzidos em diversas populações. Uma análise anterior dessa associação sugeriu o possível envolvimento das variantes do gene CTLA4 como fator de risco no desenvolvimento de AA em uma população europeia,8 com efeito mais forte em pacientes com formas acentuadas da doença.
Outro estudo feito em uma população italiana, no qual foram analisadas as variantes dos genes rs231775 e rs3087243, apontou esse último como fator de risco no desenvolvimento de AA em placas.9 Por outro lado, estudo feito no Irã não conseguiu provar a associação da variante do gene rs3087243 no desenvolvimento de AA.3
Em estudo anterior, os autores observaram a participação de variantes genéticas de TNFα e PTPN2219 como fator de risco para AA em pacientes mexicanos; a função de ambos os genes está relacionada à regulação dos mecanismos imunológicos. No entanto, a participação das variantes genéticas do CTLA4 na AA não foi analisada nessa população.
Alguns SNPs dentro do gene CTLA‐4 já foram analisados quanto à suscetibilidade à artrite reumatoide (AR) na população mexicana; entre eles, rs5742909, rs231775 e rs3087243; sugere‐se que o haplótipo ‐319C/+49G/CT60G do gene CTLA‐4 é fator de risco para AR, enquanto que o SNP rs3087243 pode ser fator protetor contra esse tipo de doença autoimune.20
No entanto, não foram observadas diferenças significativas para rs231775 e rs3087243 no presente estudo (tabela 2), sugeriu‐se que essas variantes não são fator de risco no desenvolvimento de AA ou de AA em placas na população mexicana.
ConclusãoAs variantes genéticas rs231775 e rs3087243 do gene CTLA4 não constituem fator de risco no desenvolvimento de AA na população mexicana de Monterrey, México. Além disso, essas variantes genéticas não apresentam associação com antecedentes familiares/pessoais de doenças autoimunes ou com o gênero dos sujeitos do estudo.
Suporte financeiroNenhum.
Contribuição dos autoresMauricio Andrés Salinas Santander: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Cristina Susana Cantu‐Salinas: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Jorge Ocampo‐Candiani: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Victor de Jesus Suarez‐Valencia: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Jennifer Guadalupe Ramirez‐Guerrero: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Celia Nohemi Sanchez‐Dominguez: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
A Daniel Díaz, Ph.D. por sua assistência na revisão deste manuscrito.
Como citar este artigo: Salinas‐Santander MA, Cantu‐Salinas CS, Ocampo‐Candiani J, Suarez‐Valencia VJ, Ramirez‐Guerrero JG, Sanchez‐Dominguez CN. CTLA4+49AG (rs231775) and CT60 (rs3087243) gene variants are not associated with alopecia areata in a Mexican population from Monterrey Mexico. An Bras Dermatol. 2020;95:283–8.
Trabalho realizado no Departamento de Investigação, Faculdade de Medicina da Universidade de Saltillo, Universidade Autônoma de Coahuila, Saltillo, Coahuila, México e Serviço de Dermatologia, Hospital Universitário Dr. José Eleuterio González, Faculdade de Medicina, Universidade Autônoma de Nuevo León, Nuevo León, México.