O pênfigo vulgar (PV) é dermatose bolhosa autoimune grave. Foram relatados fatores desencadeantes de PV de natureza genética, relacionados a neoplasias malignas e uso de medicamentos. Relatamos dois pacientes que apresentaram agravamento ou exacerbação do PV após a vacinação contra COVID‐19.
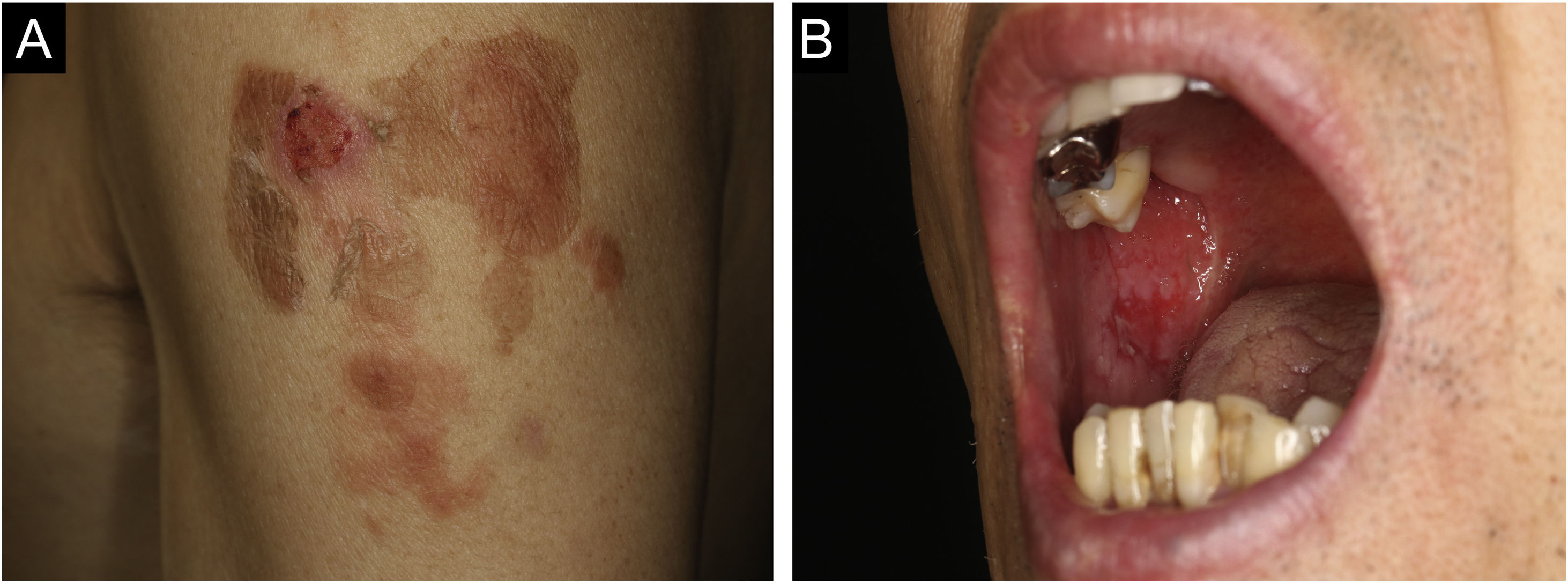
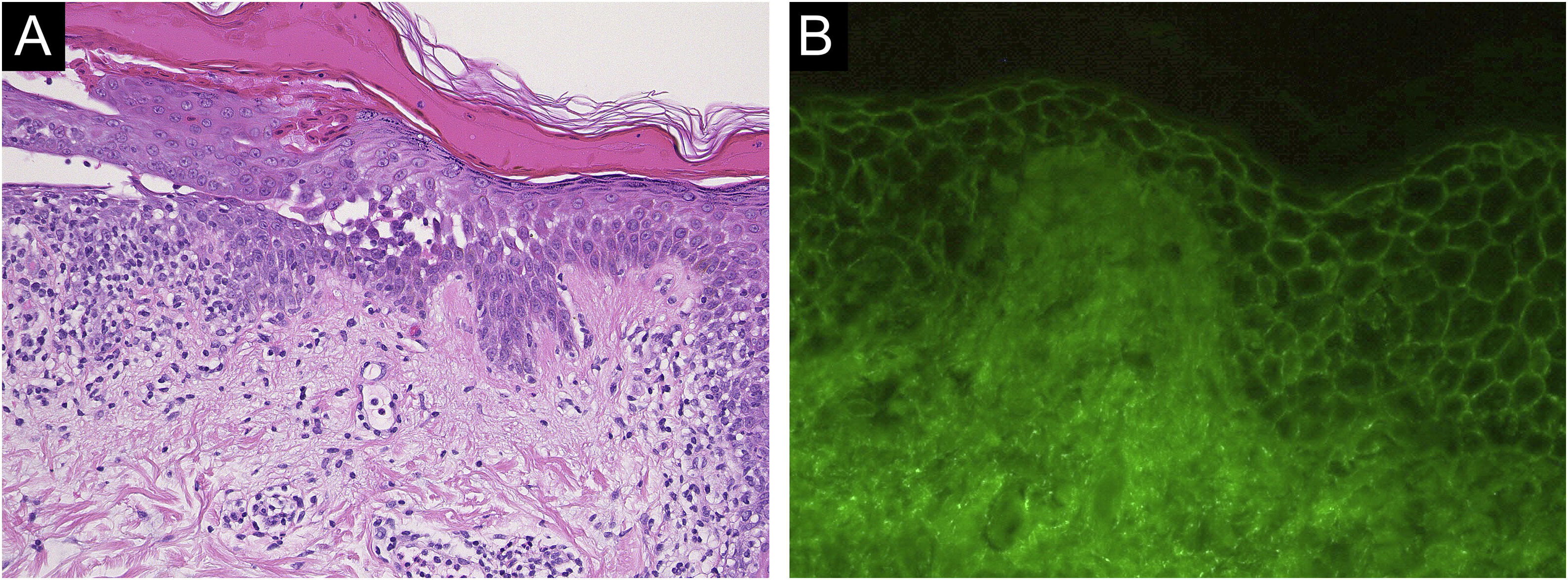
Caso 1: Paciente do sexo masculino, de 60 anos, com erosão dolorosa na mucosa oral há dois meses, atendido por otorrinolaringologista e internista. O paciente recebeu a segunda dose da vacina contra COVID‐19 (Comirnaty®) e, uma semana depois, apresentou eritema e erosões no local da vacinação no braço esquerdo. Posteriormente, desenvolveu eritema e erosões no tronco; foi encaminhado ao serviço de dermatologia um mês após a vacinação. O exame clínico mostrou erosões secundárias ao rompimento de lesões bolhosas, principalmente no tronco, couro cabeludo e braço esquerdo (fig. 1A). O paciente também apresentava múltiplas erosões na mucosa oral (fig. 1B). A histopatologia de fragmento de pele mostrou acantólise na camada epidérmicas inferiores e presença de densos infiltrados dérmicos com linfocíticos e eosinófílos (fig. 2A). A imunofluorescência direta (IFD) revelou deposição intercelular de IgG e C3 na epiderme (fig. 2B). Os níveis séricos de anticorpos anti‐desmogleína (Dsg)‐1 (120 U/mL, normal <3 U/mL) e anticorpos anti‐Dsg‐3 (262 U/mL, normal <3 U/mL) estavam elevados. Foi iniciada prednisolona oral (50mg/dia; 1mg/kg/dia); entretanto, a resposta foi fraca e, portanto, pulso de metilprednisolona (1.000mg/dia por três dias consecutivos), plasmaférese e metotrexato (6mg/semana) foram adicionados. Após obter remissão, o paciente recebeu a terceira e quarta doses da vacinação contra COVID‐19, sem recidiva.
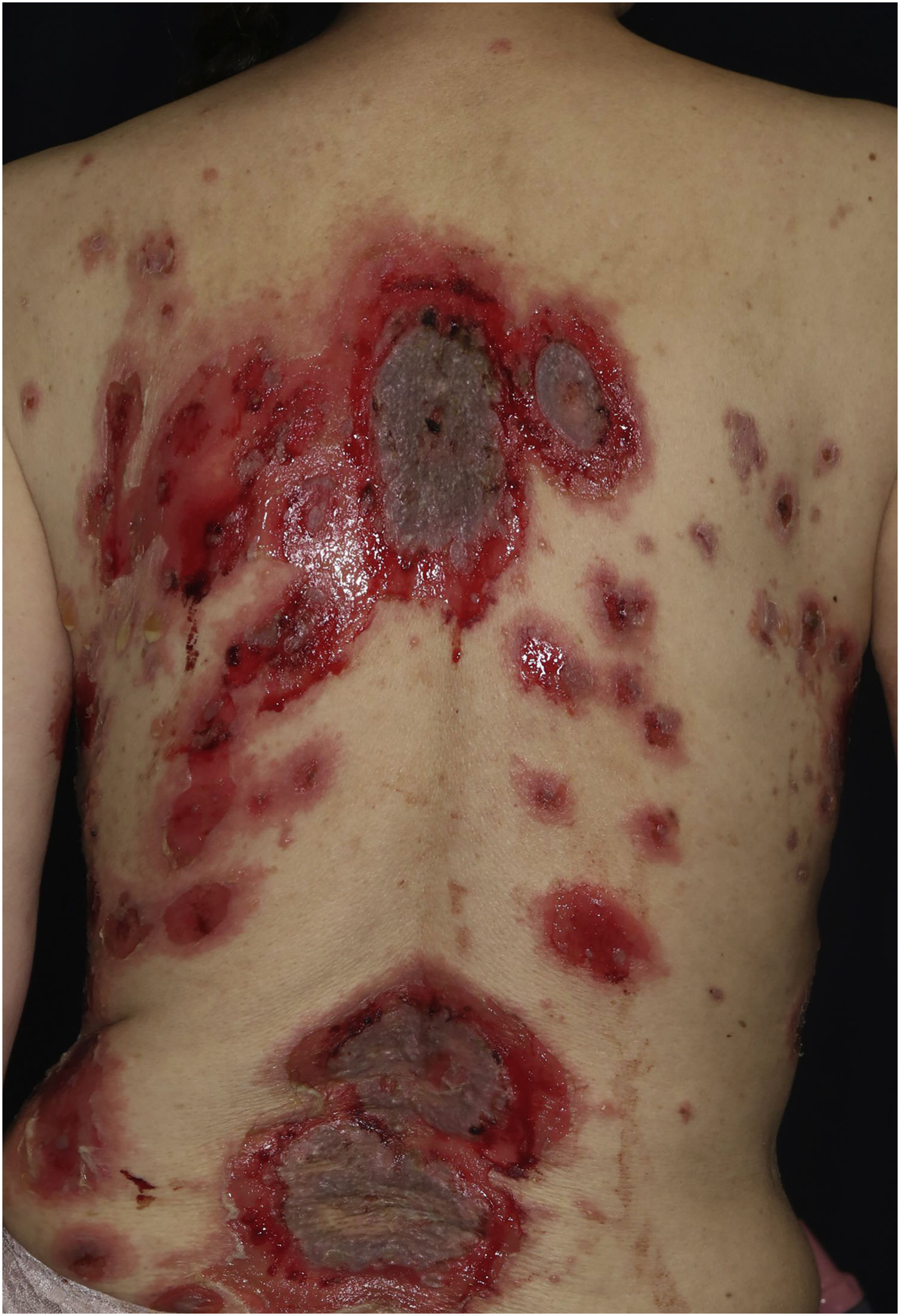
Caso 2: Paciente do sexo feminino, de 69 anos, recebeu a terceira dose da vacina contra COVID‐19 (Spikevax®) e, quase ao mesmo tempo, sofreu uma queimadura no braço direito. Posteriormente, a paciente desenvolveu erosões nas extremidades e no tronco, que aumentaram gradativamente em número; ela foi encaminhada ao serviço de dermatologia três meses após a vacinação. O exame clínico revelou extenso eritema, bolhas flácidas e erosões secundárias ao rompimento de lesões bolhosas no tronco (fig. 3). A paciente também apresentava múltiplas erosões na mucosa oral.
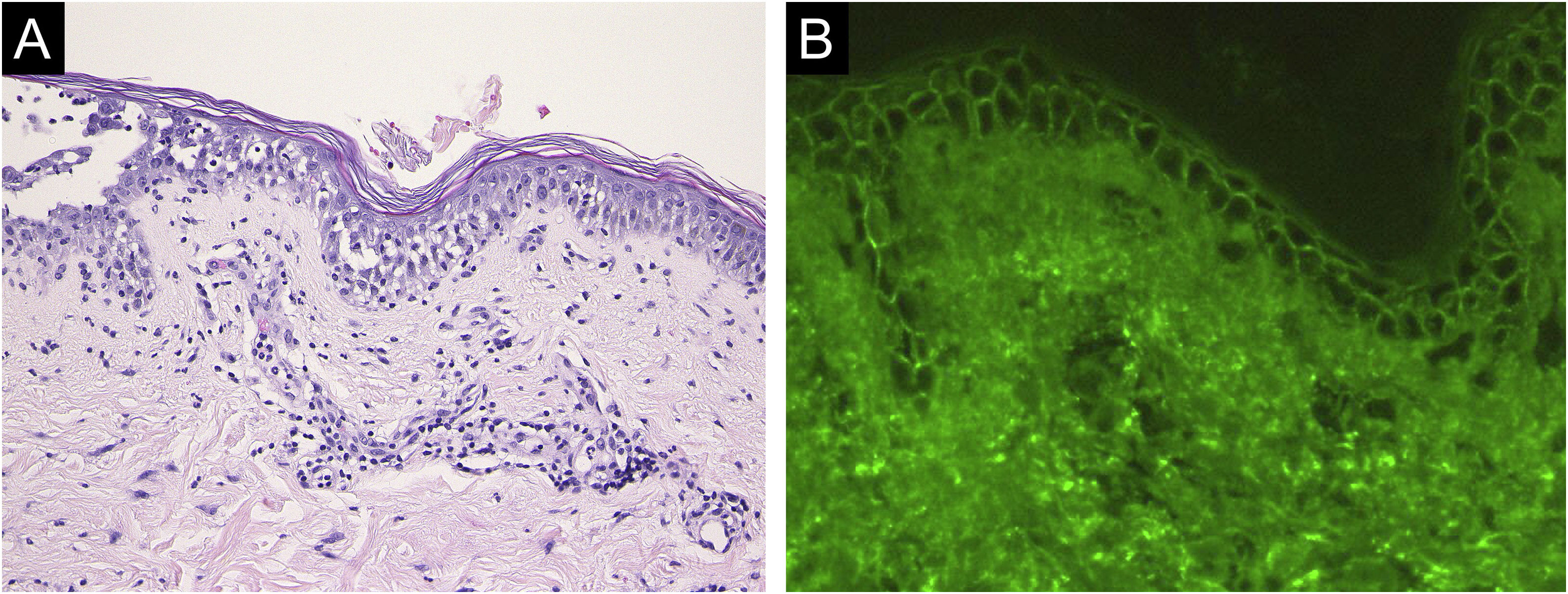
A histopatologia de fragmento de pele do abdome revelou acantólise nas camadas epidérmicas inferiores e presença de densos infiltrados dérmicos com linfócitos e eosinófilos (fig. 4A). A IFD revelou deposição intercelular de IgG (fig. 4B) e C3 na porção inferior da epiderme. Os níveis séricos de anticorpos anti‐Dsg‐3 estavam elevados (8360 U/mL, normal <3 U/mL), enquanto os níveis de anticorpos anti‐Dsg‐1 estavam normais. O tratamento com prednisolona oral (45mg/dia [1mg/kg/dia]), pulsoterapia com metilprednisolona (1.000mg/dia por três dias consecutivos) e azatioprina (100mg/dia) resultou na epitelização completa das erosões após cinco semanas de tratamento.
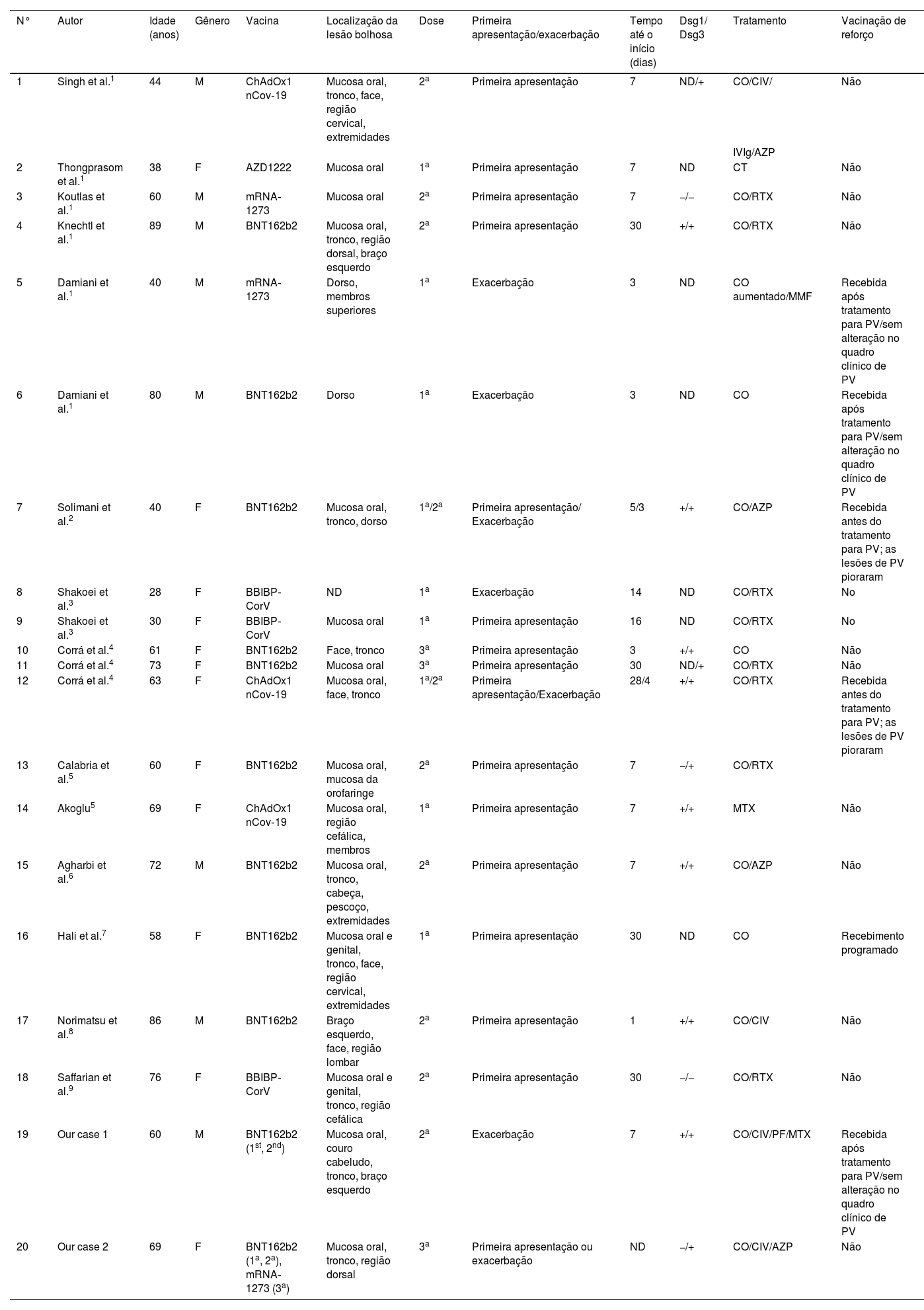
Foram relatados aparecimento ou exacerbações de PV desencadeados por vacinações ou infecções virais.1‐9 Também foram relatados casos de indução ou exacerbação de PV após vacinação contra influenza, raiva, hepatite B, tétano e difteria.1 Além disso, recentemente foram relatados casos de indução ou exacerbação de doenças bolhosas autoimunes, psoríase, líquen plano, dermatomiosite e lúpus eritematoso sistêmico após a vacinação contra COVID‐19.10 Acredita‐se que a ativação da imunidade inata em virtude da vacina seja a causa da exacerbação ou desenvolvimento de sintomas cutâneos. A injeção de BNT162b2 induz a ativação de células T e células B e, após a injeção, as células T CD4+ e CD8+ aumentam com a produção de IFN‐γ e IL‐2.2 Foi sugerido que a vacinação contra a COVID‐19 contribui para a produção de citocinas como IL‐4, IL‐17 e IL‐21, que desempenham papéis importantes em doenças bolhosas autoimunes, como o PV.3 As vacinas também ativam as células B, levando ao aumento da produção de anticorpos.4 Os casos relatados1‐9 de PV que apresentaram desenvolvimento de novo ou pioraram após a vacinação contra COVID‐19 estão resumidos na tabela 1. O PV surgiu após uma mediana de sete (intervalo de 1‐30) dias cada após a primeira, segunda e terceira doses das vacinas. Em contraste, o tempo médio para casos de exacerbações foi de três dias (intervalo de 3‐14 dias), período significantemente mais curto do que nos casos de primeira apresentação. Entretanto, há dois casos que puderam receber vacinas adicionais após terem sido submetidos a tratamento intenso para PV sem agravamento da doença. Em um dos presentes casos também foi possível aplicar doses adicionais da vacina contra a COVID‐19 sem agravamento da doença. A vacina contra a COVID‐19 certamente pode exacerbar o PV em casos muito raros; ainda assim, a vacina pode ser administrada com segurança em pacientes com PV cuja doença esteja bem controlada. Como a vacinação é um procedimento necessário para prevenir o agravamento da COVID‐19 em pacientes imunossuprimidos, os raros casos de progressão do PV não devem desencorajar a vacinação de pacientes com PV.
Casos relatados de pênfigo vulgar desencadeados ou exacerbados após vacinação contra COVID‐19
| N° | Autor | Idade (anos) | Gênero | Vacina | Localização da lesão bolhosa | Dose | Primeira apresentação/exacerbação | Tempo até o início (dias) | Dsg1/ Dsg3 | Tratamento | Vacinação de reforço |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Singh et al.1 | 44 | M | ChAdOx1 nCov‐19 | Mucosa oral, tronco, face, região cervical, extremidades | 2a | Primeira apresentação | 7 | ND/+ | CO/CIV/ | Não |
| IVIg/AZP | |||||||||||
| 2 | Thongprasom et al.1 | 38 | F | AZD1222 | Mucosa oral | 1a | Primeira apresentação | 7 | ND | CT | Não |
| 3 | Koutlas et al.1 | 60 | M | mRNA‐1273 | Mucosa oral | 2a | Primeira apresentação | 7 | −/− | CO/RTX | Não |
| 4 | Knechtl et al.1 | 89 | M | BNT162b2 | Mucosa oral, tronco, região dorsal, braço esquerdo | 2a | Primeira apresentação | 30 | +/+ | CO/RTX | Não |
| 5 | Damiani et al.1 | 40 | M | mRNA‐1273 | Dorso, membros superiores | 1a | Exacerbação | 3 | ND | CO aumentado/MMF | Recebida após tratamento para PV/sem alteração no quadro clínico de PV |
| 6 | Damiani et al.1 | 80 | M | BNT162b2 | Dorso | 1a | Exacerbação | 3 | ND | CO | Recebida após tratamento para PV/sem alteração no quadro clínico de PV |
| 7 | Solimani et al.2 | 40 | F | BNT162b2 | Mucosa oral, tronco, dorso | 1a/2a | Primeira apresentação/ Exacerbação | 5/3 | +/+ | CO/AZP | Recebida antes do tratamento para PV; as lesões de PV pioraram |
| 8 | Shakoei et al.3 | 28 | F | BBIBP‐CorV | ND | 1a | Exacerbação | 14 | ND | CO/RTX | No |
| 9 | Shakoei et al.3 | 30 | F | BBIBP‐CorV | Mucosa oral | 1a | Primeira apresentação | 16 | ND | CO/RTX | No |
| 10 | Corrá et al.4 | 61 | F | BNT162b2 | Face, tronco | 3a | Primeira apresentação | 3 | +/+ | CO | Não |
| 11 | Corrá et al.4 | 73 | F | BNT162b2 | Mucosa oral | 3a | Primeira apresentação | 30 | ND/+ | CO/RTX | Não |
| 12 | Corrá et al.4 | 63 | F | ChAdOx1 nCov‐19 | Mucosa oral, face, tronco | 1a/2a | Primeira apresentação/Exacerbação | 28/4 | +/+ | CO/RTX | Recebida antes do tratamento para PV; as lesões de PV pioraram |
| 13 | Calabria et al.5 | 60 | F | BNT162b2 | Mucosa oral, mucosa da orofaringe | 2a | Primeira apresentação | 7 | −/+ | CO/RTX | |
| 14 | Akoglu5 | 69 | F | ChAdOx1 nCov‐19 | Mucosa oral, região cefálica, membros | 1a | Primeira apresentação | 7 | +/+ | MTX | Não |
| 15 | Agharbi et al.6 | 72 | M | BNT162b2 | Mucosa oral, tronco, cabeça, pescoço, extremidades | 2a | Primeira apresentação | 7 | +/+ | CO/AZP | Não |
| 16 | Hali et al.7 | 58 | F | BNT162b2 | Mucosa oral e genital, tronco, face, região cervical, extremidades | 1a | Primeira apresentação | 30 | ND | CO | Recebimento programado |
| 17 | Norimatsu et al.8 | 86 | M | BNT162b2 | Braço esquerdo, face, região lombar | 2a | Primeira apresentação | 1 | +/+ | CO/CIV | Não |
| 18 | Saffarian et al.9 | 76 | F | BBIBP‐CorV | Mucosa oral e genital, tronco, região cefálica | 2a | Primeira apresentação | 30 | −/− | CO/RTX | Não |
| 19 | Our case 1 | 60 | M | BNT162b2 (1st, 2nd) | Mucosa oral, couro cabeludo, tronco, braço esquerdo | 2a | Exacerbação | 7 | +/+ | CO/CIV/PF/MTX | Recebida após tratamento para PV/sem alteração no quadro clínico de PV |
| 20 | Our case 2 | 69 | F | BNT162b2 (1a, 2a), mRNA‐1273 (3a) | Mucosa oral, tronco, região dorsal | 3a | Primeira apresentação ou exacerbação | ND | −/+ | CO/CIV/AZP | Não |
ND, não disponível; DSG1, anticorpo anti‐desmogleína‐1; DSG3, anticorpo anti‐desmogleína‐3; CT, corticosteroides tópicos; CO, corticosteroides orais; CIV, corticosteroides intravenosos; RTX, rituximabe; MTX, metotrexato; AZP, azatioprina; MMF, micofenolato mofetil; IVIg, terapia intravenosa com imunoglobulina em altas doses; PF, plasmaférese; PV, pênfigo vulgar.
Nenhum.
Contribuição dos autoresKinuko Irie: Revisão crítica da literatura; Obtenção, análise e interpretação dos dados; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo; aprovação da versão final do manuscrito
Toshiyuki Yamamoto: Concepção e planejamento do estudo; revisão crítica do manuscrito; aprovação da versão final do manuscrito
Conflito de interessesNenhum.
Como citar este artigo: Irie K, Yamamoto T. Severe aggravation and possible triggering of pemphigus vulgaris following COVID‐19 vaccination: report of two cases. An Bras Dermatol. 2024;99:758–62.
Trabalho realizado na Fukushima Medical University, Fukushima, Japão.