A leishmaniose tegumentar (LT) no Brasil é leishmaniose do novo mundo (LTNM), com espécies de protozoário, vetores, reservatórios e apresentação distintos, comparada à do velho mundo (LTVM), que ocorre em países europeus, africanos e do Oriente Médio. Relatamos o quarto caso de LT no Brasil por espécie do velho mundo, não nativa da América Latina, e discutimos sobre a introdução dessa espécie no país.
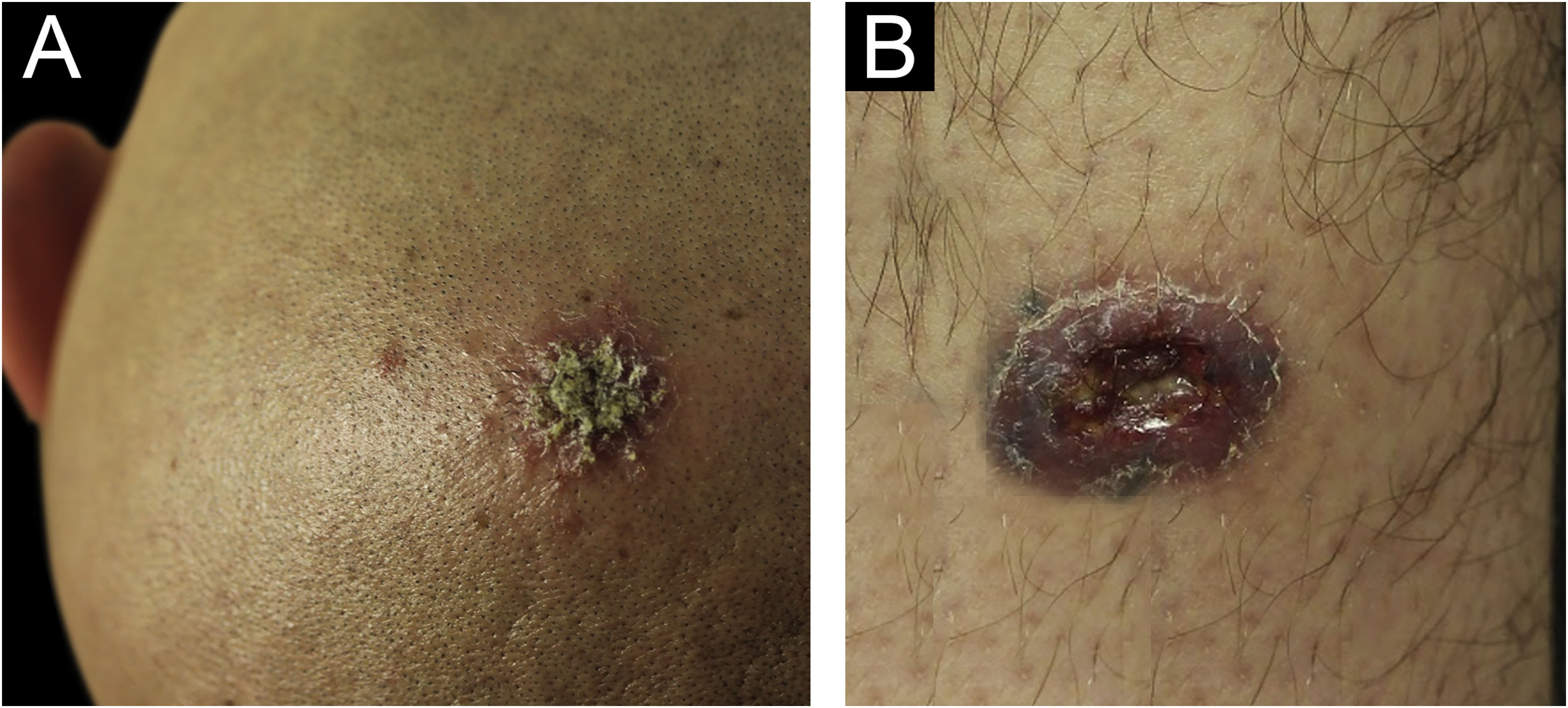
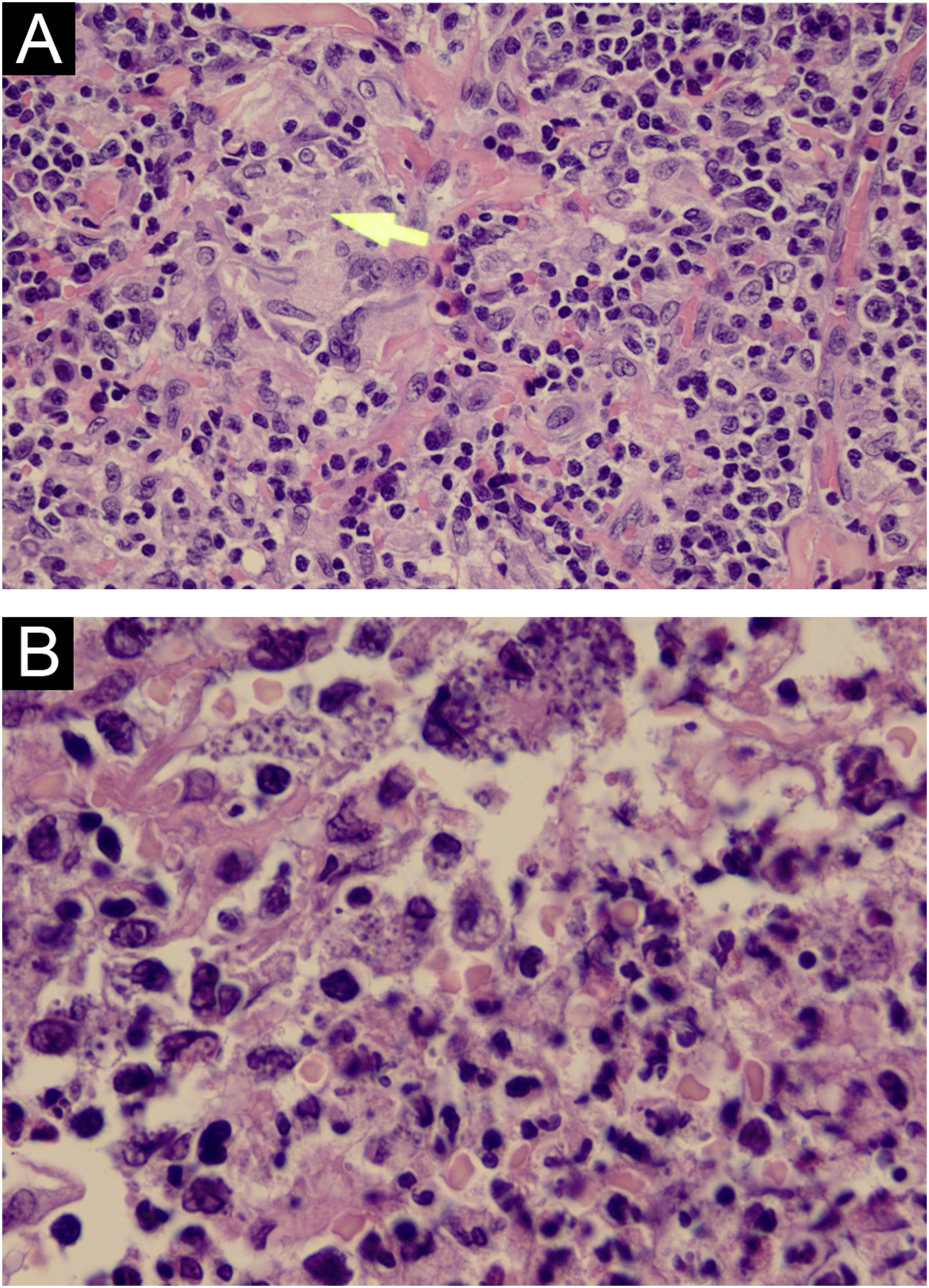
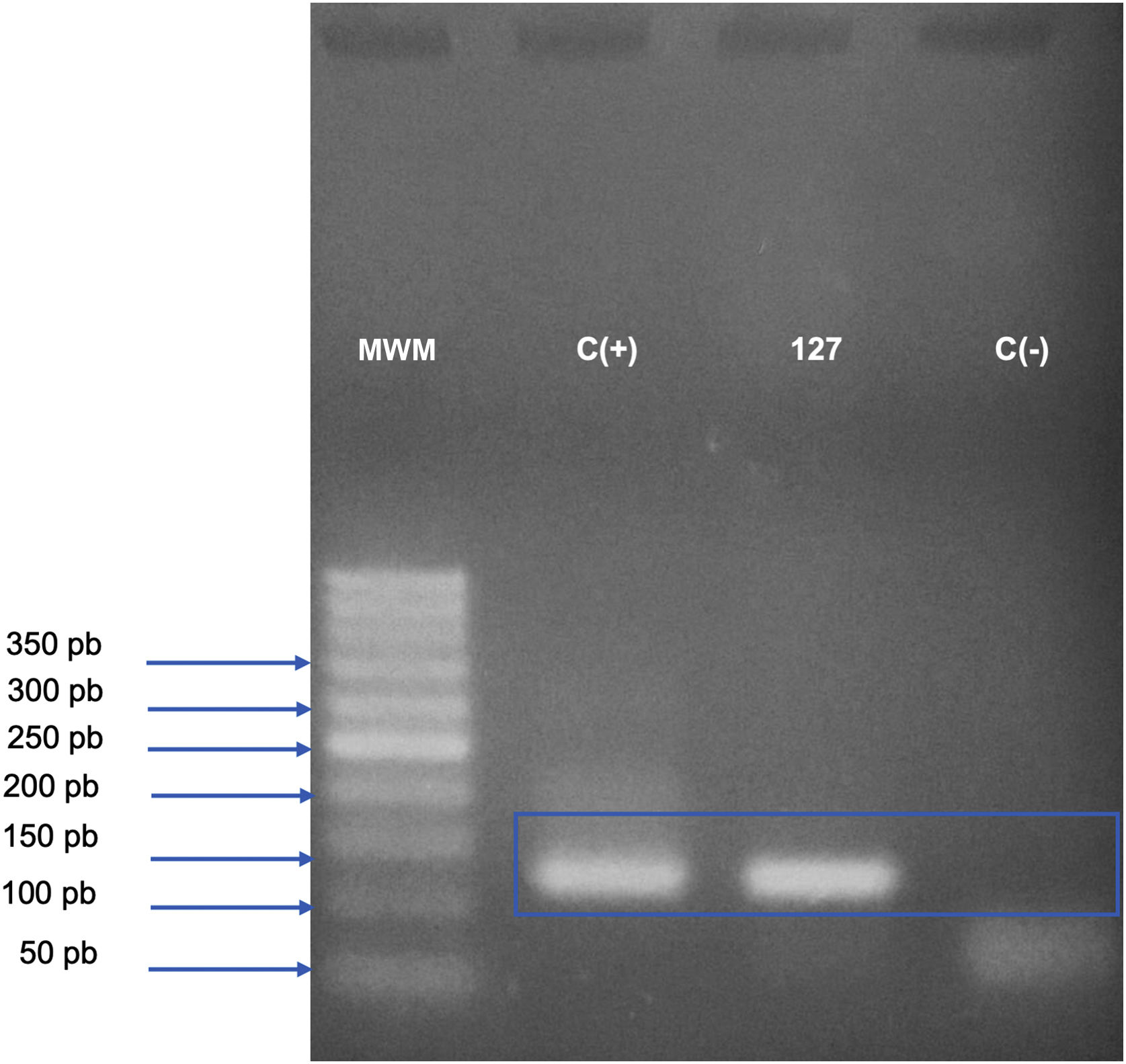
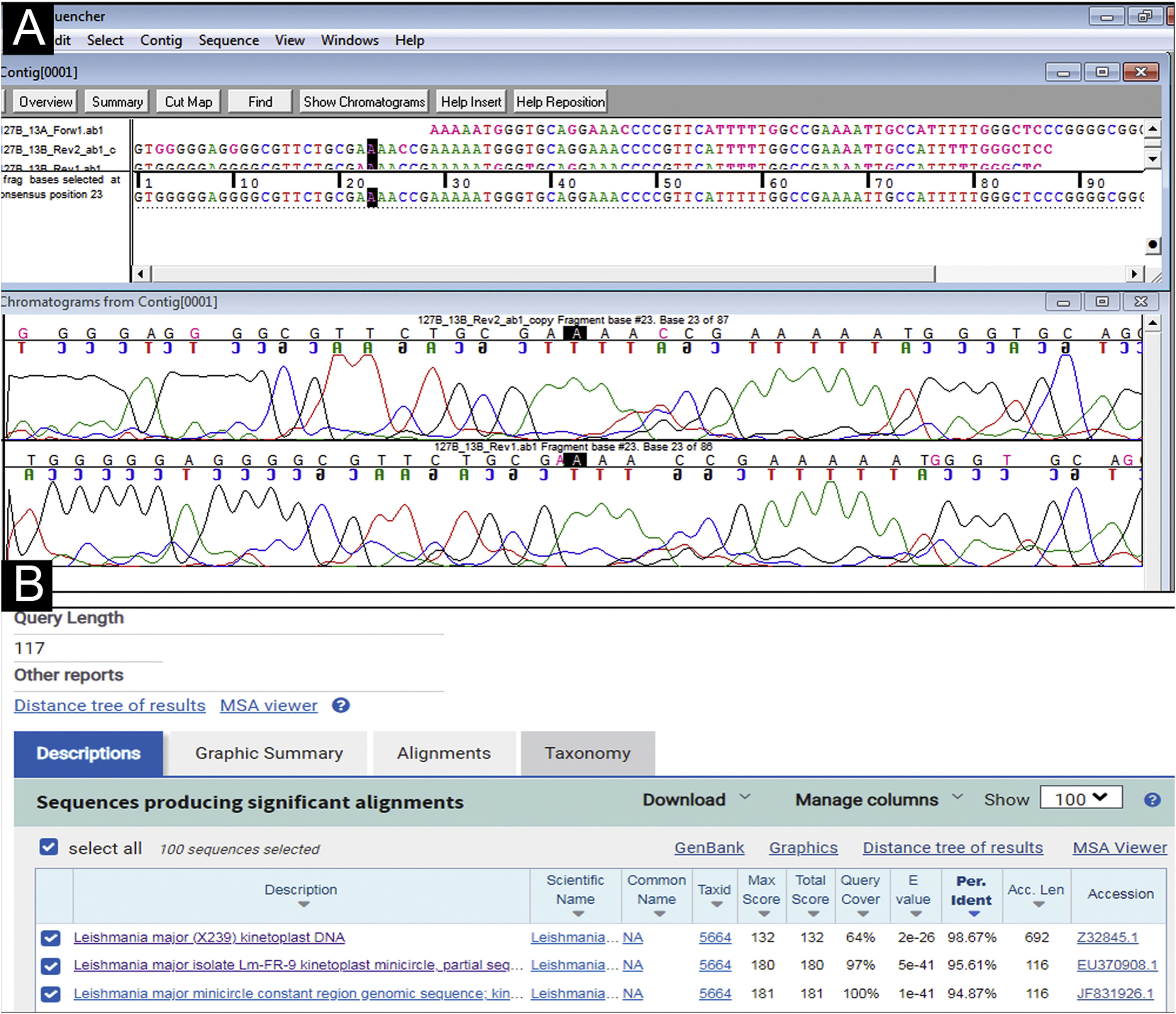
Relato do casoHomem sírio de 31 anos apresentou‐se com onze placas eritemato‐crostosas nos membros, tronco e couro cabeludo, além de úlcera emoldurada de 1,5 cm, fundo limpo, na região distal da perna direita (fig. 1). O quadro teve início há três meses, sem sintomas sistêmicos, após 45 dias de viagem a Homs, Síria. Três familiares apresentavam lesões semelhantes. Com a hipótese de LT, foram realizadas biópsias, as quais demonstraram infiltrado misto dérmico e presença de muitos parasitas amastigotas dentro de macrófagos (fig. 2). Entretanto, não foi possível identificar diferenças entre Leishmania amazonensis e L. major por meio da anatomopatologia, apesar de a literatura referir diferenças no tamanho dos vacúolos parasitóforos dessas espécies (maiores e com mais parasitas para L. amazonensis e menores com poucos parasitas para L. major).1 Foi realizada a extração de DNA com o QIAampTM DNA FFPE tissue kit (QIAGEN) da biópsia de pele fixada em formalina e emblocada em parafina, e realizadas reação em cadeia da polimerase (PCR) simples e o sequenciamento de Sanger para análise do DNA minicircular do cinetoplasto (kDNA ou DNA mitocondrial) de Leishmania spp. Esse alvo genético foi escolhido pela presença em múltiplas cópias por célula e pelo tamanho do fragmento de DNA amplificado a partir dos primers empregados (kDNA‐F, forward: 5’‐GTGGGGGAGGGGCGTTCT‐3’ e kDNA‐R, reverse: 5’‐ATTTTACACCAACCCCCAGTT‐3’),2–4 permitindo maior sensibilidade para detecção do parasita no tipo de amostra analisada. Na PCR, houve amplificação específica de fragmento com tamanho aproximado de 116‐120 pares de bases (fig. 3), e o sequenciamento de DNA permitiu a identificação molecular do complexo de espécies L. major (fig. 4), confirmando o agente não nativo no país. Infelizmente, o paciente se mudou e não retornou presencialmente, apenas por telemedicina, referindo resolução espontânea.
Análise do fragmento de DNA minicircular do cinetoplasto (DNA mitocondrial ou kDNA) de Leishmania spp., amplificado pela reação em cadeia da polimerase (PCR) convencional e visualizado por eletroforese em gel de agarose a 2,5%. As bandas observadas no gel representam o produto de PCR (amplicon) de 116‐120 pares de bases, gerado a partir da amplificação com primers kDNA‐F e kDNA‐R; gel corado com Safe Dye (Cellco Biotech do Brasil). MPM, marcador de peso molecular de 50 pb (Cellco Biotech do Brasil); C(+), controle positivo (DNA extraído de cultura – Leishmania amazonensis – 40 ng/L); 127, DNA extraído de amostra de biópsia de pele de região do maléolo medial direito fixado em formalina e emblocado em parafina; C(–), controle negativo (água estéril).
Análise do sequenciamento de DNA a partir do produto de PCR com os primers específicos para uma região do DNA minicircular do cinetoplasto (DNA mitocondrial ou kDNA) de Leishmania spp. (A) Montagem e edição das sequências, uma fita senso (forward) e duas fitas antissenso (reverse), com o emprego do software SequencherTM e visualização dos cromatogramas ou eletroferogramas. (B) Análise comparativa realizada pelo alinhamento da sequência consenso com sequências nucleotídicas depositadas no GenBank‐NCBI (BLASTn – blast.ncbi.nih.gov.qBlast.cgi). O sequenciamento permitiu a identificação molecular do complexo de espécies Leishmania major (BLASTn=similaridade ou identidade máxima: >95%, tamanho do fragmento: 117 pb).
No Oriente Médio, os agentes etiológicos mais relatados são L. tropica e L. major, transmitidos pelo mosquito do gênero Phlebotomus.5Leishmania major, porém, não apresenta reservatório, e é considerada uma antroponose. No Brasil, as espécies mais prevalentes são L. braziliensis, L. amazonensis e L. guyanensis, transmitidas pelos mosquitos do gênero Lutzomyia. Quanto à clínica, diferente da clássica úlcera com fundo granulomatoso, a LTVM caracteriza‐se por múltiplas pápulas eritematosas nos locais das picadas, que evoluem para nódulos <2 cm, ulceram e formam crosta (“úlceras secas”).5 O teste de Montenegro tem alta sensibilidade para a detecção de infecção prévia por L. major.6
Em 1991, na Síria, onde essa doença é endêmica, em decorrência do combate ao mosquito, os casos diminuíram. Contudo, no final dos anos 1990, observou‐se um aumento atribuído à intensa migração rural‐urbana e à deterioração de serviços, como o recolhimento do lixo e saneamento básico.7 A partir de 2011, não há mais dados epidemiológicos, em razão da guerra civil, que culminou na destruição de 57% dos hospitais públicos.7 Houve colapso da saúde e migração em massa para países vizinhos. Assim, reemergiram doenças como poliomielite, sarampo e tuberculose, além da LT, em resposta ao aumento dos vetores e ao caos assistencial.
Os refugiados estabeleceram‐se em cidades fronteiriças, principalmente na Turquia, desamparados de atendimento médico e em ambiente favorável à propagação de epidemias. Observaram‐se novos casos de LT nos campos de refugiados. No Líbano, houve aumento de seis casos entre 2000‐2012 para 1.033 casos só em 2013, dos quais 97% eram em refugiados sírios.8
No Brasil, a Síria é a nacionalidade com a maior representatividade entre os refugiados.9 Há situações de vulnerabilidade, obstáculos político‐sócio‐econômicos, de idioma e culturais, que são barreiras para o acesso à assistência de saúde digna. Desse modo, diagnóstico, tratamento, notificação e análise epidemiológica são prejudicados.
Com isso, é possível se questionar sobre a transmissão autóctone de espécies novas de Leishmania. Na Turquia, foram detectadas cepas não endêmicas, inclusive em paciente sem histórico de viagens, sugerindo a introdução dessa espécie.10 No Mediterrâneo, verificou‐se a competência do mosquito P. sergentii como vetor,11 levantando a hipótese da viabilidade da introdução dessa doença nos demais países europeus. No Brasil, onde a PCR não é rotineira, existem potenciais vetores para L. major12,13 e há casos isolados no Centro‐Oeste descritos de cepas L. major‐like, possivelmente L. major,14 nas décadas de 1970 e 1980, em pacientes sem histórico de viagens.15 Entretanto, faltam informações para avaliar a capacidade de transmissão autóctone.
ConclusãoSalientamos a importância desse diagnóstico nos pacientes provenientes de áreas endêmicas, considerando‐se o potencial para deformidades. Além disso, ressaltamos a relevância deste relato para a investigação epidemiológica da possibilidade de transmissão autóctone de espécies do velho mundo no país.
Suporte financeiroNenhum.
Contribuição dos autoresCindy Tiemi Matsumoto: Levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Milvia Maria Simões e Silva Enokihara: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Marília Marufuji Ogawa: Levantamento dos dados, ou análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Samira Yarak: Levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Agradecemos ao Centro de Diagnóstico e Pesquisa em Biologia Dr. Ivo Ricci (São Carlos, SP, Brasil) e Macrogen (Coreia do Sul) pela identificação molecular.
Como citar este artigo: Matsumoto CT, Enokihara MM, Ogawa MM, Yarak S. Fourth case of tegumentary leishmaniasis in Brazil by Leishmania major – is it possible for new species to be introduced in Brazil through immigration? An Bras Dermatol. 2023;98:564–7.
Trabalho realizado na Escola Paulista de Medicina, Universidade Federal de São Paulo, Departamento de Dermatologia, SP, Brasil.