Neoplasia de células dendríticas plasmocitoides blásticas (NCDPB) é linfoma/leucemia rara com incidência de 0,44 casos a cada 100.000 pessoas, com faixa etária média de 53 a 68 anos e relação de 3:1 entre homens e mulheres.1,2
A etiologia da NCDPB é desconhecida. A apresentação e o curso clínico da doença são amplamente heterogêneos.1,2 Não existem fatores genéticos ambientais ou hereditários documentados que predisponham ao seu desenvolvimento, mas aproximadamente 10%‐20% dos pacientes têm história prévia de neoplasias hematológicas.3
A NCDPB é caracterizada por comportamento agressivo com rápida disseminação. Quando presentes, as lesões cutâneas apresentam‐se como placas, pápulas ou nódulos, únicas ou múltiplas, de consistência firme, eritematosas e/ou violáceas, pruriginosas ou não. Destaca‐se que a NCDPB pode se apresentar inicialmente já com acometimento sistêmico ou evoluir, a partir da forma primária cutânea, com acometimento secundário de linfonodos e sintomas sistêmicos como perda ponderal. A sobrevida média é de poucos meses (12 a 14 meses).1,4 Dessa maneira, por ser doença extremamente rara e de manifestações clínicas variadas e ainda pouco descritas, o diagnóstico configura um desafio do ponto de vista clínico e histopatológico.
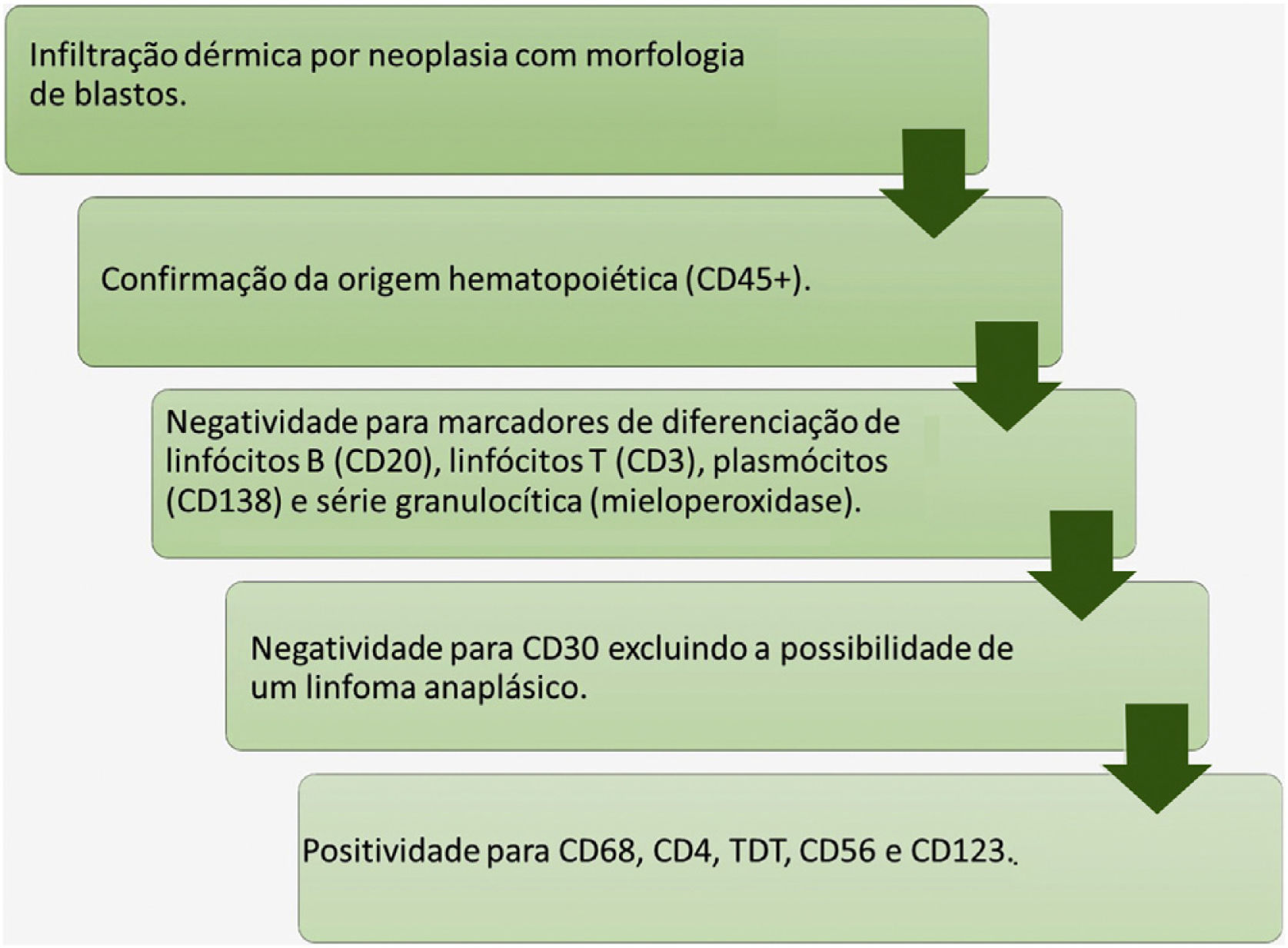
Diante do exposto, o objetivo do presente artigo é descrever um caso de NCDPB diagnosticado precocemente, com enfoque nos achados histopatológicos por meio da proposição de fluxograma para diagnóstico histopatológico.
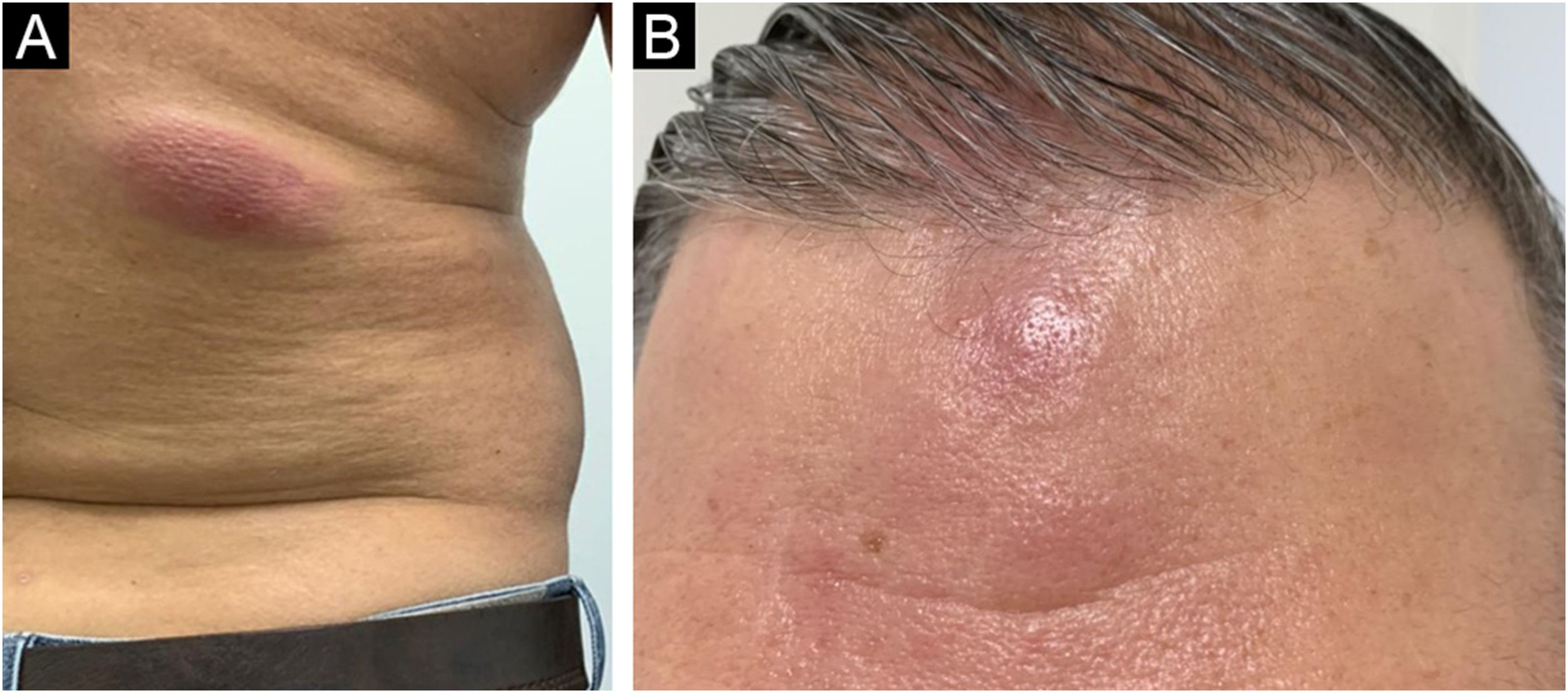
Relato do casoPaciente do sexo masculino, 38 anos, apresentando, ao exame clínico dermatológico, placas e nódulos eritemato‐violáceos associadas a prurido e distribuídas no tronco, membros superiores e região frontal (fig. 1). Negava perda ponderal, febre ou linfonodomegalias e não referia doenças prévias de importância. Foi realizada biópsia com as hipóteses clínicas de farmacodermia, sarcoidose, urticária vasculite e micose fungoide.
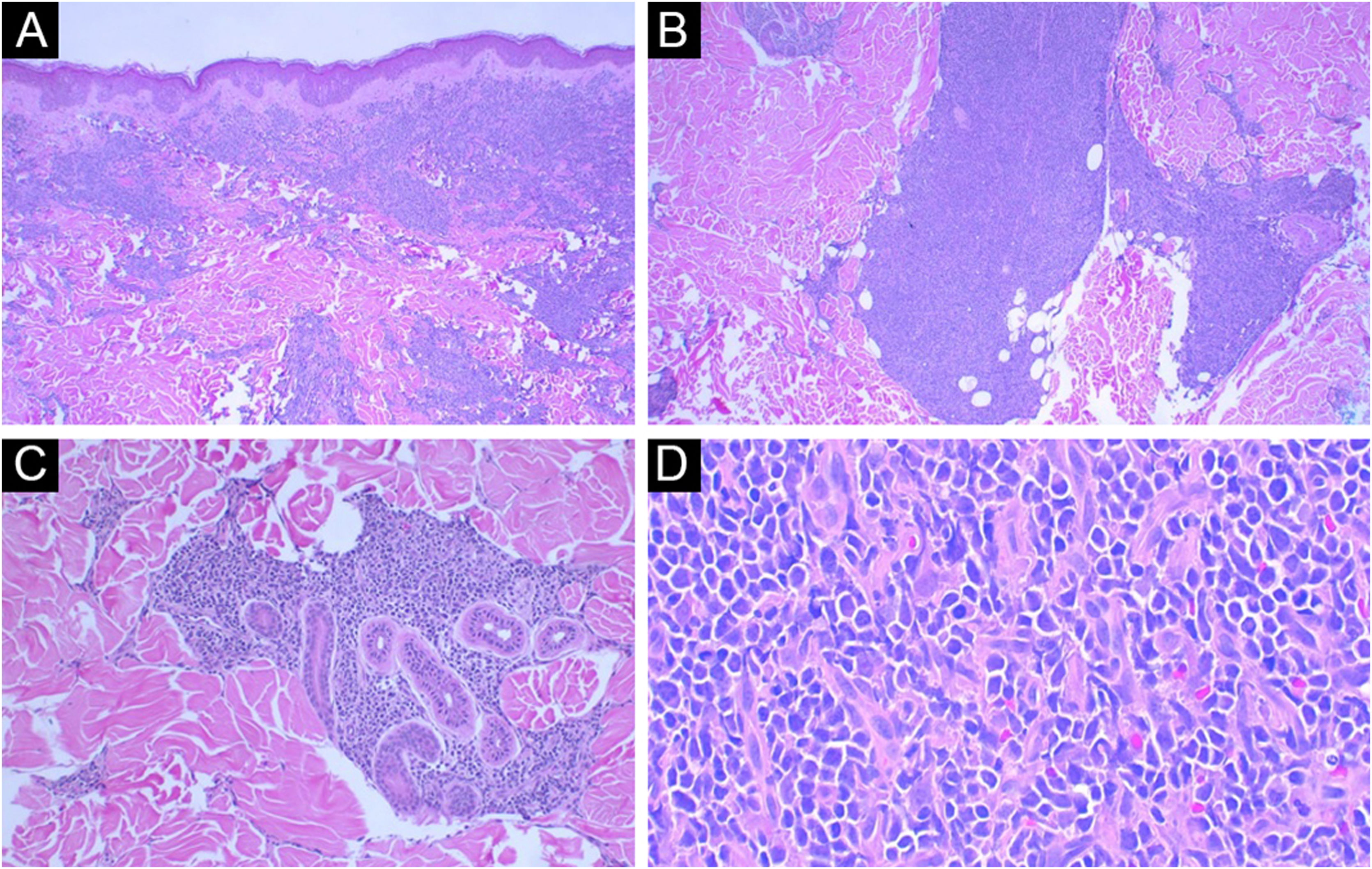
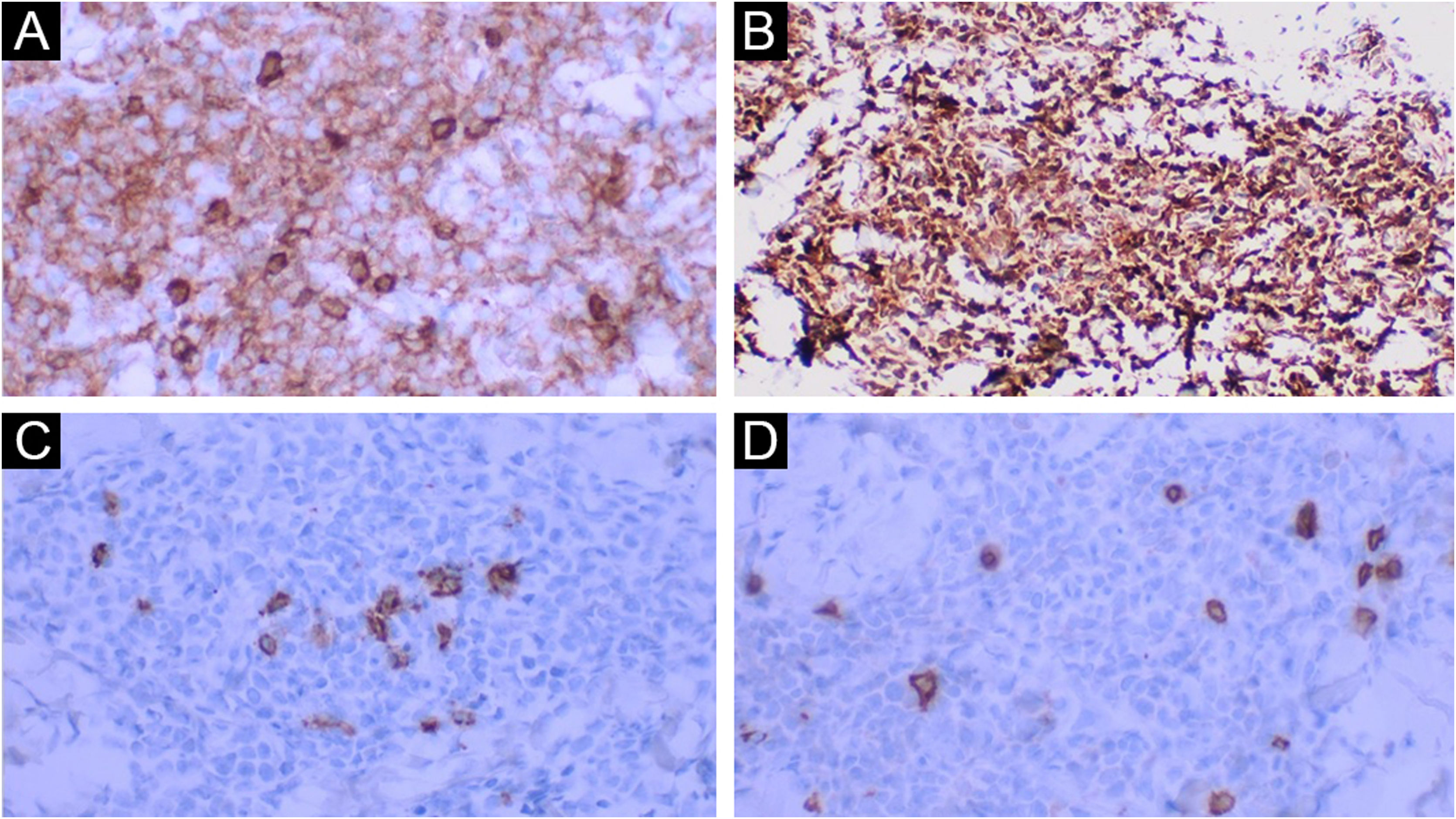
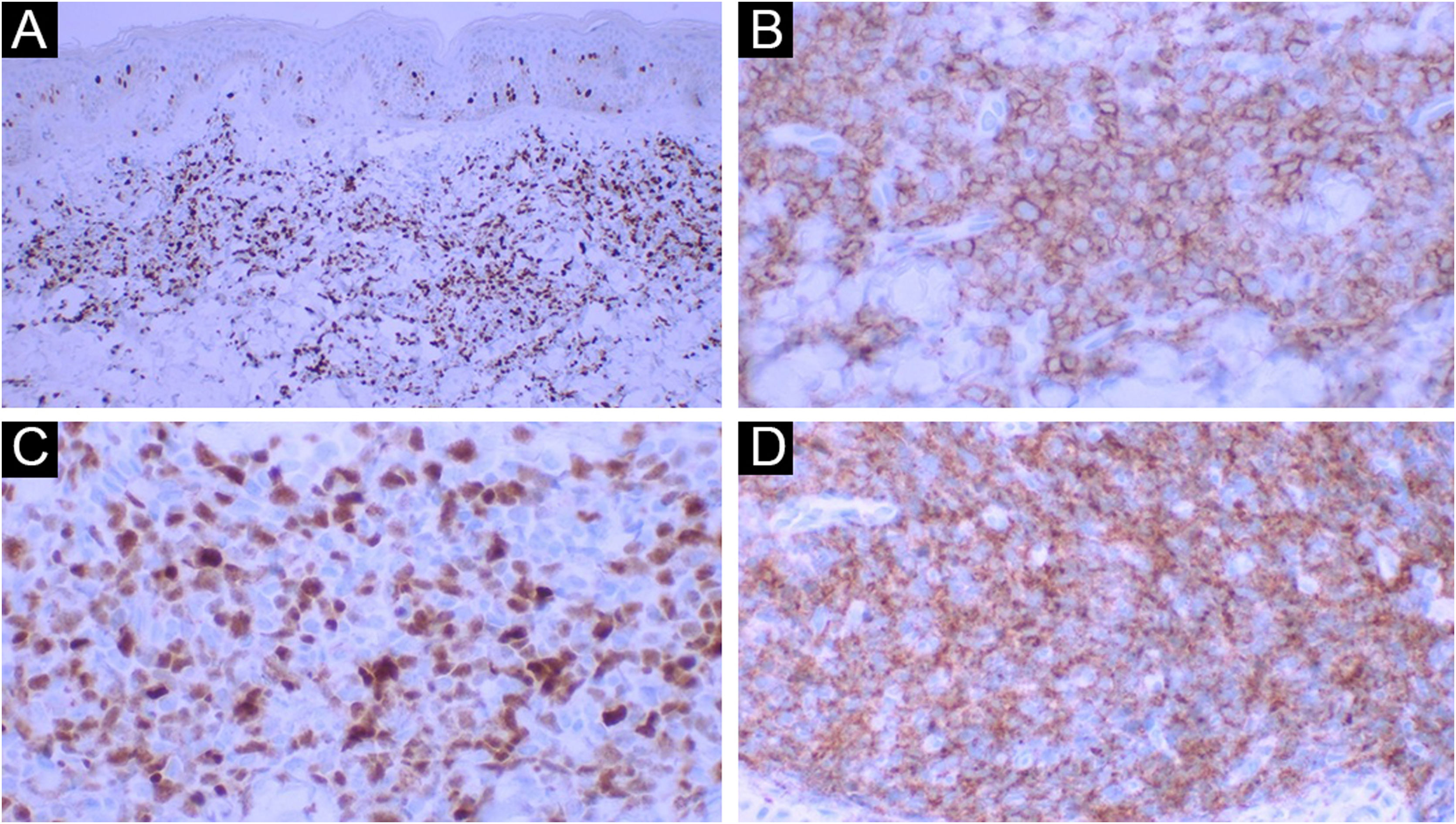
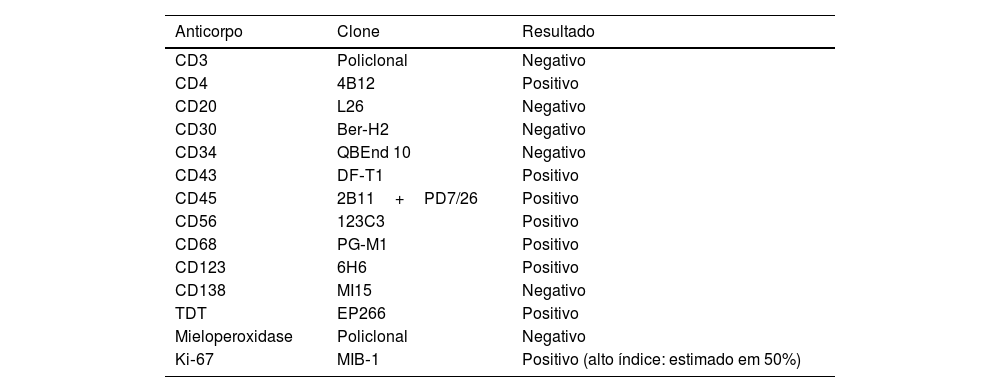
O exame histopatológico revelou um denso infiltrado dérmico superficial e profundo, com acometimento difuso e perianexial. O infiltrado estava caracterizado por células com morfologia de blastos exibindo núcleos irregulares, cromatina granulosa, um ou vários nucléolos, citoplasma agranular e escasso (fig. 2). Havia mitoses frequentes (mais de cinco mitoses por 1 mm2), incluindo formas atípicas. Não se observou necrose e angioinvasão. A epiderme encontrava‐se preservada e separada da neoplasia por uma zona grenz. Ao estudo imuno‐histoquímico, observou‐se positividade para CD45, CD4, CD43, CD56, TDT, CD123, elevado índice de proliferação celular (Ki‐67 estimado em 50%) e negatividade para os demais marcadores testados (CD3, CD20, CD30, CD34, CD138 e mieloperoxidase) – tabela 1, figuras 3 e 4. Os exames complementares realizados (tomografias de crânio, tórax e abdome; coleta de líquor; mielograma; cariótipo de medula óssea; imunofenotipagem de medula óssea e biópsia de medula óssea) não revelaram comprometimento extracutâneo pela neoplasia.
(A) Visão panorâmica: note a epiderme intacta e a presença da zona grenz (Hematoxilina & eosina, 40×). (B) Note o envolvimento da derme profunda (Hematoxilina & eosina, 100×). (C) No detalhe, área de acometimento perianexial permeando as glândulas sudoríparas (Hematoxilina & eosina, 200×). (D) No detalhe, as células com morfologia imatura, citoplasma escasso e cromatina granular (Hematoxilina & eosina, 400×).
Resultado de painel imuno‐histoquímico aplicado no presente caso
| Anticorpo | Clone | Resultado |
|---|---|---|
| CD3 | Policlonal | Negativo |
| CD4 | 4B12 | Positivo |
| CD20 | L26 | Negativo |
| CD30 | Ber‐H2 | Negativo |
| CD34 | QBEnd 10 | Negativo |
| CD43 | DF‐T1 | Positivo |
| CD45 | 2B11+PD7/26 | Positivo |
| CD56 | 123C3 | Positivo |
| CD68 | PG‐M1 | Positivo |
| CD123 | 6H6 | Positivo |
| CD138 | MI15 | Negativo |
| TDT | EP266 | Positivo |
| Mieloperoxidase | Policlonal | Negativo |
| Ki‐67 | MIB‐1 | Positivo (alto índice: estimado em 50%) |
O esquema HyperCVAD (ciclofosfamida hiperfracionada, vincristina, doxorrubicina e dexametasona alternado com altas doses de metotrexato e citarabina) foi o tratamento utilizado, obtendo‐se bons resultados, e o paciente segue em avaliação para possível transplante de medula óssea alogênico.
DiscussãoDescrita pela primeira vez em 1994 como linfoma de células NK pela expressão positiva de CD56, apenas em 2016 a NCDPB foi classificada como entidade própria pela Organização Mundial da Saúde.1
O prognóstico ruim exige suspeita e diagnóstico precoce para que o tratamento possa ser o mais eficaz possível. Para patologistas cirúrgicos, a NCDPB deve ser lembrada em caso de infiltração dérmica por neoplasia com morfologia de blastos. Para o diagnóstico final, o estudo imuno‐histoquímico é indispensável.
Diante de um caso com infiltração dérmica por uma neoplasia pouco diferenciada, a marcação para CD45 confirma a origem hematolinfoide. A negatividade para os marcadores CD3, CD20, CD138 e mieloperoxidase exclui diferenciação para linfócito T, linfócitos B, plasmócitos e diferenciação mieloide, respectivamente. A marcação para CD56 confirma o perfil citotóxico. Salienta‐se que NCDPB também apresenta expressão de marcadores de células T como CD4 e CD43, assim como marcadores de neoplasias de células imaturas como o TDT; no entanto, não há expressão de CD34, marcador frequentemente positivo nos blastos (fig. 5).
Apesar da possível boa reposta inicial à quimioterapia, invariavelmente os casos apresentam recorrência – quadro leucêmico fulminante é uma das principais causas de óbito.1 Os principais diagnósticos diferenciais do ponto de vista histopatológico são: infiltração cutânea por neoplasias mieloproliferativas ou síndrome mielodisplásicas.1,5
Considerando as demais neoplasias cutâneas CD56 positivas, o diagnóstico baseado no tripé da clínica, morfologia microscópica e resultado do estudo imuno‐histoquímico permite excluir os demais diagnósticos diferenciais.6 Clinicamente, é possível excluir a possibilidade de papulose linfomatoide. Além disso, a negatividade para CD30 auxilia na exclusão das neoplasias cutâneas CD30 positivas. Do ponto de vista morfológico, a ausência de necrose, angiocentrismo e destruição da parede vascular excluem a possibilidade de linfoma de células T/NK extranasal. A infiltração cutânea por leucemia mieloide aguda (LMA) CD56 positiva pode compartilhar marcadores imunofenotípicos com a NCDPB; no entanto, LMA raramente será positiva para CD123, e mais comumente expressa mieloperoxidase, marcador negativo na NCDPB.6
Quanto às modalidades de tratamento, ainda permanece discutível o impacto da utilização da terapia‐alvo anti‐CD123 (tagraxofusp) para NCDPB. No entanto, estudos demonstram boa resposta da utilização desse fármaco, seja em primeira linha de tratamento ou na recorrência da doença.7
Há que se considerar que a baixa incidência da NCDPB influencia o pequeno número de possibilidades terapêuticas disponíveis tão bem quanto dificulta o conhecimento mais profundo dessa neoplasia do ponto de vista molecular. Salienta‐se que, de maneira contrária à falsa ideia de que doenças dermatológicas apresentam bom prognóstico, a NCDPB deve ser reconhecida pelos dermatologistas e patologistas para agilizar o diagnóstico e possibilitar o tratamento precoce.
Suporte financeiroNenhum.
Contribuição dos autoresGabriel Taylor Castolde: Revisão bibliográfica e redação do artigo.
Alexandre Lizardo Lourenço Pontes: Dermatologista responsável pelo atendimento do paciente; realização da biópsia e revisão crítica do manuscrito final.
Gabriel Macedo Cortopassi: Hematologista responsável pelo tratamento, auxílio na redação do artigo e revisão crítica do manuscrito final.
José Cândido Caldeira Xavier‐Júnior: Concepção do artigo e do fluxograma; redação do artigo; supervisão do trabalho e revisão da versão final.
Conflito de interessesNenhum.
Como citar este artigo: Castolde GT, Pontes ALL, Cortopassi GM, Xavier‐Júnior JCC. Blastic plasmacytoid dendritic cell neoplasm: diagnostic difficulty and proposed flowchart for histopathological diagnosis. An Bras Dermatol. 2023;98:559–63.
Trabalho realizado na Faculdade de Medicina, Centro Universitário Católico Unisalesiano Auxilium, Araçatuba, SP, Brasil.