Estudos têm demonstrado que a taxa de incidência global de herpes‐zóster (HZ) na China é de 6,64 casos por 1.000 pessoas; apesar dos agravos causados pela neuralgia pós‐herpética (NPH), o mecanismo da doença ainda não está claro na China. Atualmente, biomarcadores eficazes para prever a NPH permanecem indisponíveis, o que dificulta a prevenção da NPH e o sucesso de seu tratamento.
ObjetivoO objetivo do estudo foi determinar o nível sérico de interleucina‐6 (IL‐6) na NPH.
MétodosOs níveis séricos de IL‐6 foram medidos por ELISA sanduíche de anticorpos múltiplos. A escala Likert foi utilizada para representar o grau de neuralgia nos pacientes. Aqueles com NPH foram divididos em grupo NPH leve e grupo NPH grave, de acordo com a escala de Likert. A curva ROC foi realizada para avaliar a eficiência diagnóstica da IL‐6 para NPH. A correlação entre o nível de IL‐6 e a escala Likert antes e após o tratamento com gabapentina e mecobalamina foi analisada.
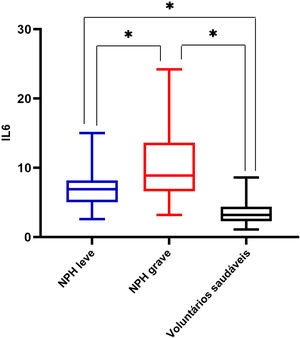
ResultadosOs níveis de IL‐6 em pacientes com NPH mostraram resultados mais elevados em relação aos voluntários. Os pacientes do grupo NPH grave apresentaram níveis séricos de IL‐6 mais elevados do que o grupo NPH leve. O escore na escala Likert estava relacionado com os níveis séricos de IL‐6 e a frequência de níveis de IL‐6 acima do valor de corte (4,95 pg/mL) nos grupos NPH antes e após o tratamento (p <0,05).
Limitações do estudoA dor é subjetiva. Alguns estados mentais, como ansiedade e depressão, influenciam muito a percepção individual da dor, e a tolerância à dor pode variar entre as pessoas. Portanto, os escores de dor podem ser afetados por diferentes fatores individuais.
ConclusõesOs níveis séricos de IL‐6 podem ser utilizados como indicadores bioquímicos da gravidade da NPH.
O vírus da varicela‐zóster (VZV) é um herpesvírus alfa humano. Quando uma pessoa é infectada pelo VZV pela primeira vez, o que geralmente acontece na infância, ocorre a varicela. O herpes‐zóster (HZ) é causado pela reativação do VZV latente no nervo craniano ou gânglios da raiz dorsal na idade adulta,1 possivelmente levando à neuralgia pós‐herpética (NPH). Mesmo após a cura das lesões cutâneas, a neuralgia cutânea local ainda persiste por meses ou anos, ou até mesmo evolui para neuralgia refratária, que ocorre frequentemente em pessoas de meia‐idade e idosos e causa dor de longa duração, principalmente em mulheres idosas. Além disso, a neuralgia refratária também leva à anorexia, insônia e depressão, que causam sério impacto na vida dos pacientes. Estudos recentes mostraram que a NPH é um tipo de dor neuropática,2 e os fatores de risco da NPH incluem idade, sexo, sintomas precursores da erupção cutânea, lesão cutânea grave, dor aguda grave e fatores psicossociais.3 A taxa de incidência de NPH é de cerca de 2 a 4,6 casos por 1.000 pessoas por ano, e essa taxa aumenta para 9,1 casos por 1.000 pessoas por ano na faixa etária de 50 a 75 anos.4 Estudos mostraram que a taxa geral de incidência de NPH na China é de 6,64 casos por 1.000 pessoas. Além disso, houve 99 episódios recorrentes em 4.313 episódios primários de 2015 a 2017. No entanto, o número médio de consultas de pacientes com doença inicial foi significantemente menor do que o de pacientes recorrentes (3,6 vs. 6,7 por paciente), e o tempo médio de internação de ataques recorrentes é maior do que o do primeiro ataque. Cerca de 9% a 34% dos pacientes desenvolverão NPH, e as taxas de incidência e prevalência aumentam gradualmente com a idade.5
Apesar dos danos causados pela NPH, o mecanismo da doença permanece obscuro na China. Atualmente, biomarcadores eficazes para prever a NPH permanecem indisponíveis, o que dificulta a prevenção da NPH e o sucesso de seu tratamento. A relação entre os níveis séricos de citocinas e os graus de dor em pacientes com NPH foi investigada através da observação das alterações dos níveis séricos de citocinas para descobrir os fatores imunológicos que afetam o aparecimento da NPH, estabelecendo assim as bases para a intervenção clínica precoce.
MétodosPacientes e critérios de elegibilidadeTodos os participantes forneceram consentimento informado oral e por escrito antes de participar do estudo. O desenho deste estudo está em conformidade com a Declaração de Helsinque, e o estudo foi aprovado pelo Comitê de Ética Biomédica do Hangzhou Third People's Hospital. Oitenta pacientes (35 homens e 45 mulheres) com NPH atendidos no hospital de abril de 2019 a outubro de 2021 foram considerados aptos para o estudo. A idade dos pacientes variou de 40 a 85 anos, com média de 68,3± 10,1 anos.
Critérios de inclusão para pacientes com NPH: 1) A NPH no presente estudo refere‐se a dor no local da erupção um mês após a cura do HZ, de acordo com os critérios diagnósticos de NPH; 2) os pacientes não devem apresentar histórico de doenças orgânicas, tais como doenças cardíacas, pulmonares ou renais; 3) os pacientes não devem apresentar nenhum déficit na função cognitiva e na fala, de acordo com os escores da escala Likert; além disso, devem ser capazes de entender e aceitar seus escores na escala Likert; 4) os pacientes não devem sofrer de outras doenças do sistema imunológico, câncer, infecções bacterianas ou apresentar outros sintomas relevantes.
Critérios de exclusão para pacientes com NPH: 1) pacientes com menos de 40 ou mais de 80; 2) pacientes com disfunção cognitiva e de linguagem ou incapazes de obter escores na escala Likert; 3) pacientes com câncer ou doenças autoimunes; 4) uso recente de imunossupressores; 5) mulheres grávidas e lactantes.
A escala Likert é frequentemente utilizada em estudos clínicos e relatos de casos de NPH. A faixa da pontuação dessa escala é de 0 (totalmente indolor) a 100 (a dor mais intensa que pode ocorrer). Clinicamente, o limiar mínimo significante de NPH é de 40 pontos. Dor clinicamente significante indica que o escore da escala Likert é superior a 40 pontos; dor intensa indica que o escore da escala Likert é maior que 70 pontos.6
Os pacientes com NPH foram divididos em dois grupos de acordo com a escala Likert. Pacientes com escore na escala Likert superior a 70 pontos foram definidos como NPH grave. Aqueles com escore na escala Likert acima de 40 pontos foram definidos como NPH leve (n=40). O grupo NPH foi definido pela escala Likert no dia da hospitalização.
Detecção de níveis séricos de IL‐6 e indicadores bioquímicosPara cada paciente, 3mL de sangue venoso foram coletados no segundo dia de hospitalização antes do tratamento. Outros 3mL de sangue venoso foram obtidos do paciente a partir do 14° dia após o tratamento, e todas as amostras de sangue foram colocadas em tubos com anticoagulante e enviadas ao banco de amostras do hospital para separação e criopreservação. Os níveis séricos de IL‐6 foram medidos por ELISA sanduíche de anticorpos múltiplos. O kit ELISA MCP‐1/IP‐10/rnaates/fractalkine humano usado neste estudo foi adquirido da Genzyme, EUA, e o kit incluía água destilada, um amostrador, um oscilador e um agitador magnético. Os indicadores bioquímicos foram detectados por analisador bioquímico automático no laboratório clínico do hospital, incluindo triglicérides (TG), colesterol total (CT), fator de necrose tumoral‐alfa (TNF‐α), colesterol lipoproteíco de baixa densidade (LDL‐C), e interleucina‐10 (IL‐10). As condições dos pacientes após o tratamento foram avaliadas pelo escore da escala Likert. A correlação entre os níveis séricos de IL‐6 na hospitalização e o escore da escala Likert após o tratamento também foi analisada.
Todos os pacientes receberam doses apropriadas de gabapentina oral e 1.000 ug de injeção intramuscular de mecobalamina diariamente. Pacientes com dor intensa receberam adicionalmente doses apropriadas de comprimidos orais de liberação prolongada de cloridrato de oxicodona.
Coleta de dados clínicosHistórico médico detalhado, histórico de medicação e o exame físico foram realizados em todos os pacientes e voluntários saudáveis. Os dados clínicos incluíram idade, sexo, histórico de tabagismo, histórico de consumo de álcool e pressão arterial.
Análise estatísticaAs análises estatísticas foram realizadas no software SPSS versão 21.0 (International Business Machines, Corp., Armonk, NY, EUA). As características dos pacientes foram descritas como frequências (porcentagens) ou médias±DP. Diferenças significantes entre os grupos foram avaliadas por análise de variância (ANOVA) unidirecional. O teste de qui‐quadrado foi utilizado para contagem dos dados. A eficiência diagnóstica foi calculada pela curva característica de operação do receptor (ROC); o valor de p <0,05 foi considerado estatisticamente significante. As figuras foram criadas com o software SPSS Statistics e GraphPad Prism 8.0.
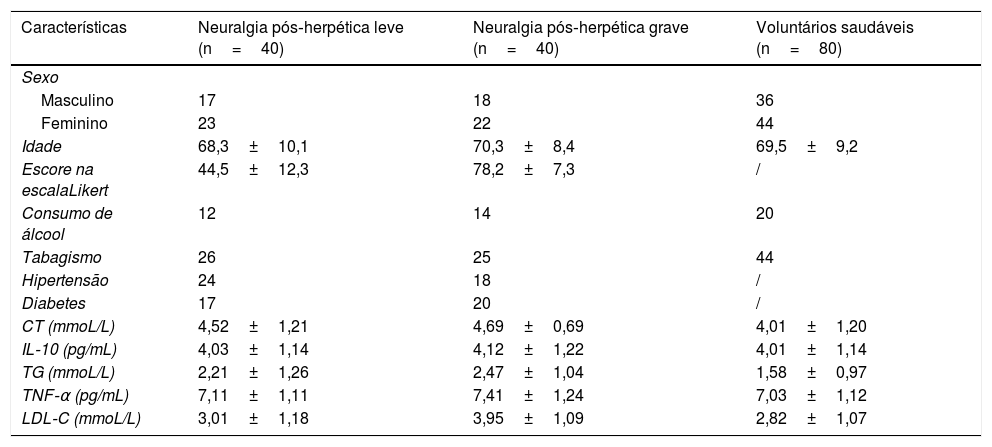
ResultadosUm total de 80 pacientes com NPH e 80 voluntários saudáveis foram incluídos no presente estudo. As características dos pacientes e voluntários são apresentadas na tabela 1.
Informações clínicas detalhadas de pacientes com neuralgia pós‐herpética e voluntários saudáveis. (Média±DP)
| Características | Neuralgia pós‐herpética leve (n=40) | Neuralgia pós‐herpética grave (n=40) | Voluntários saudáveis (n=80) |
|---|---|---|---|
| Sexo | |||
| Masculino | 17 | 18 | 36 |
| Feminino | 23 | 22 | 44 |
| Idade | 68,3±10,1 | 70,3±8,4 | 69,5±9,2 |
| Escore na escalaLikert | 44,5±12,3 | 78,2±7,3 | / |
| Consumo de álcool | 12 | 14 | 20 |
| Tabagismo | 26 | 25 | 44 |
| Hipertensão | 24 | 18 | / |
| Diabetes | 17 | 20 | / |
| CT (mmoL/L) | 4,52±1,21 | 4,69±0,69 | 4,01±1,20 |
| IL‐10 (pg/mL) | 4,03±1,14 | 4,12±1,22 | 4,01±1,14 |
| TG (mmoL/L) | 2,21±1,26 | 2,47±1,04 | 1,58±0,97 |
| TNF‐α (pg/mL) | 7,11±1,11 | 7,41±1,24 | 7,03±1,12 |
| LDL‐C (mmoL/L) | 3,01±1,18 | 3,95±1,09 | 2,82±1,07 |
TG, triglicérides; CT, colesterol total; LDL‐C, colesterol lipoproteico de baixa densidade; IL‐10, interleucina‐10; TNF‐α, fator de necrose tumoral‐α.
Não houve diferenças significantes entre pacientes com NPH e voluntários nas variáveis, incluindo idade, sexo, níveis de TNF‐α, CT, TG, IL‐10 e LDL‐C (p> 0,05, respectivamente).
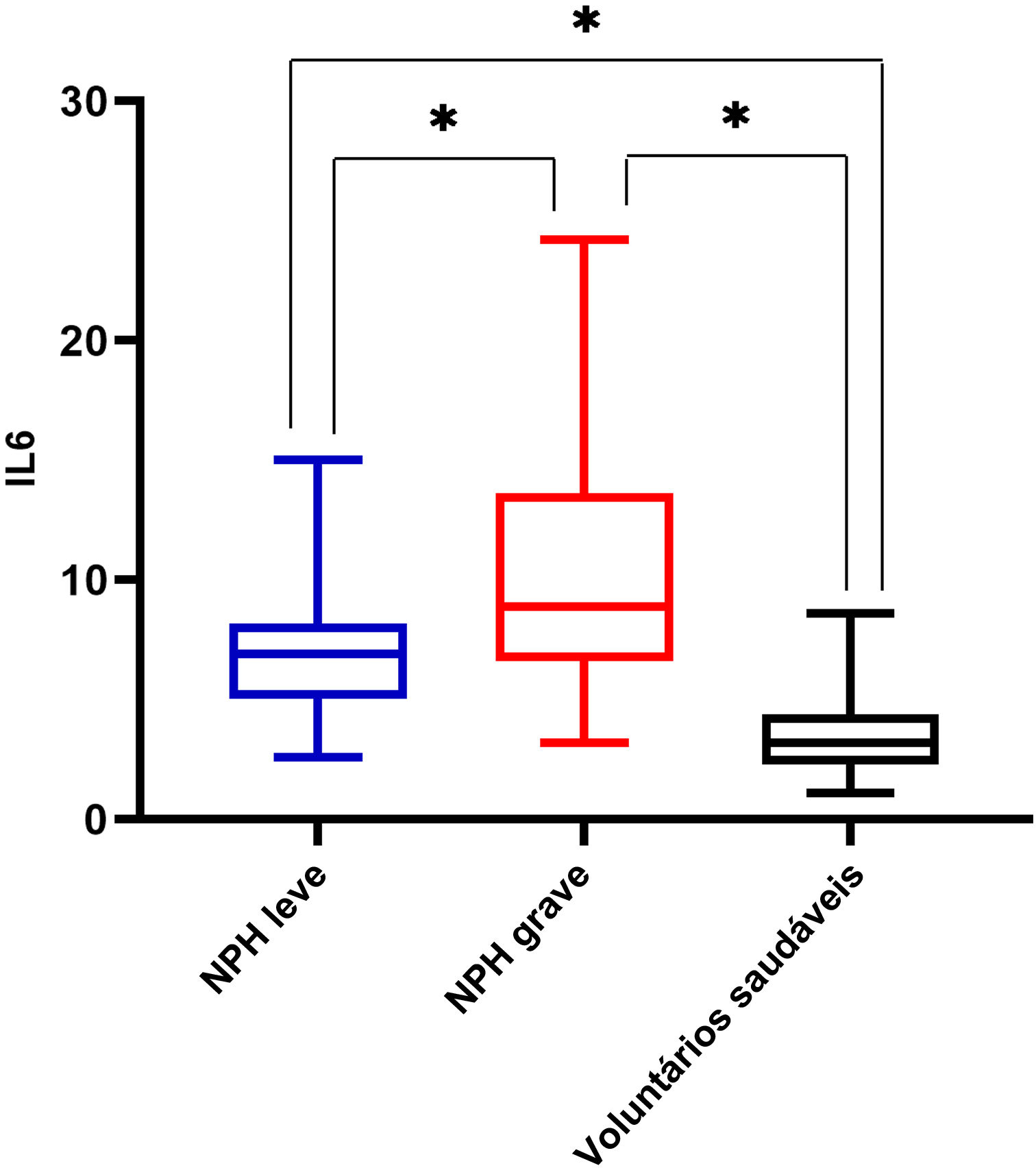
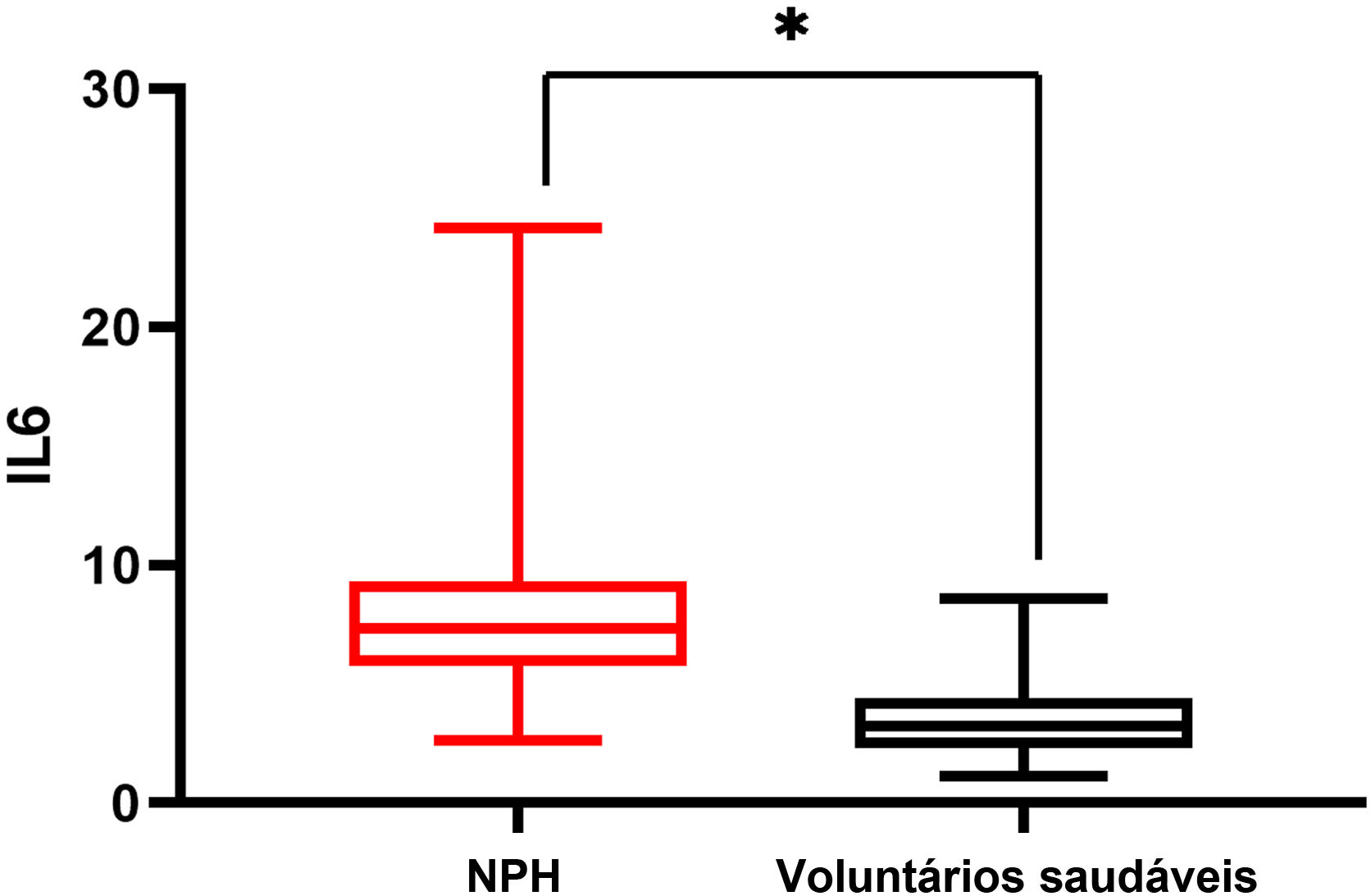
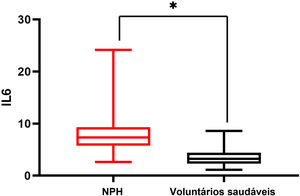
Houve diferença significante nos níveis séricos de IL‐6 entre os grupos NPH leve e NPH grave, e os pacientes do grupo NPH grave apresentaram níveis séricos de IL‐6 mais elevados do que os do grupo NPH leve (10,41±4,97 vs. 6,65±2,25; p <0,05). Pacientes com NPH grave ou leve apresentaram níveis séricos de IL‐6 mais elevados do que os voluntários saudáveis, com p <0,05 (fig. 1). Os níveis séricos de IL‐6 em pacientes com herpes‐zóster foram maiores do que aqueles em voluntários saudáveis (7,35±2,15 vs. 3,27±1,02; p=0,00; fig. 2).
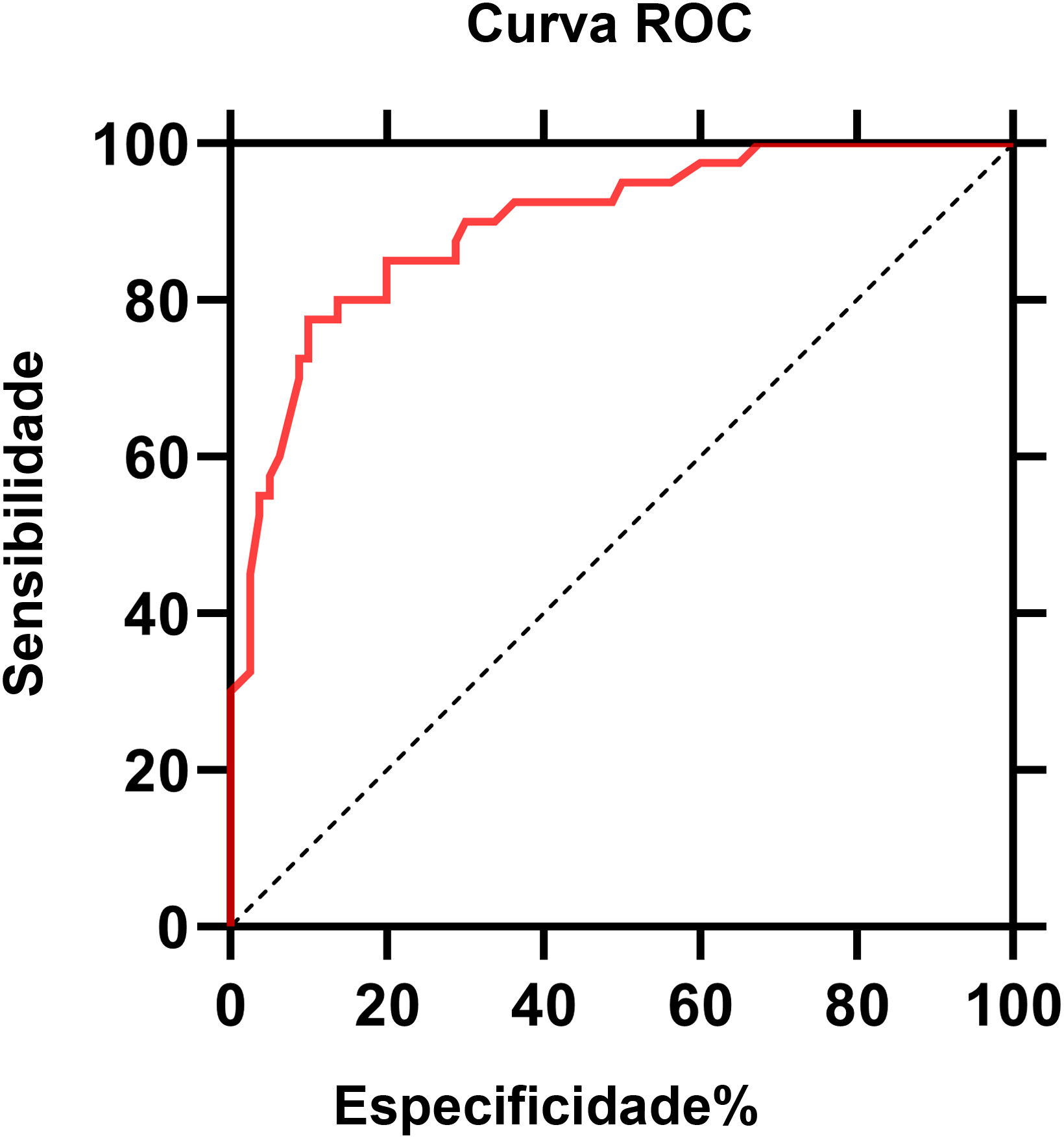
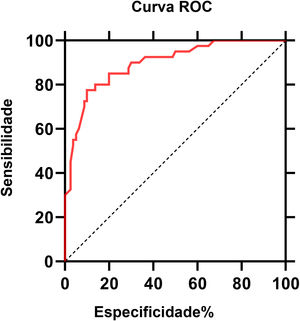
A curva ROC dos níveis de IL‐6 para NPH é mostrada na figura 3. O valor da área sob a curva (AUC, area under the curve) foi de 0,896 (intervalo de confiança de 95%: 0,85‐0,95; p <0,0001). De acordo com a curva ROC, o valor de corte dos níveis séricos de IL‐6 para NPH foi de 4,95 pg/mL, com sensibilidade de 80% e especificidade de 86,2%.
No grupo NPH, uma dose apropriada de gabapentina foi administrada por via oral com base nas condições do paciente, e mecobalamina foi administrada através de injeções intramusculares em uma dose diária. Após o 14° dia de tratamento, todos os pacientes com NPH foram avaliados pelo escore da escala Likert. Os resultados são apresentados na tabela 2. Os níveis séricos de IL‐6 na hospitalização foram associados ao escore da escala Likert após o 14° dia de tratamento (p <0,05).
Antes e após 14 dias de tratamento, os níveis séricos de IL‐6 em cada grupo foram correlacionados com o escore na Escala Likert
| Escore na Escala Likert (pontos) | 0‐40 | 40‐70 | ≥ 70 | p |
|---|---|---|---|---|
| Na hospitalização | ||||
| Paciente (caso) | 80 | 40 | 40 | |
| Nível de IL‐6 sérica (pg/mL) | 3,27±1,02 | 6,65±2,25 | 10,41±4,97 | <0,05 |
| IL‐6 sérica ≥ 4,95 pg/mL (caso) | 4 (5%) | 29 (72,5%) | 37(92,5%) | |
| 14 dias após o tratamento | ||||
| Paciente (caso) | 98 | 47 | 15 | |
| Nível de IL‐6 sérica (pg/mL) | 3,18±1,13 | 4,32±1,72 | 7,01±2,02 | <0,05 |
| IL‐6 sérica ≥ 4,95 pg/mL (caso) | 0 | 10 (21,3%) | 14 (93,3%) | |
Pacientes com escore na escala Likert superior a 70 pontos foram definidos como NPH grave.
Aqueles com escore na escala Likert acima de 40 pontos foram definidos como NPH leve.
O valor de corte dos níveis séricos de IL6 para NPH foi de 4,95 pg/mL.
A NPH é um tipo de dor neuropática refratária. Nos últimos anos, estudos mostraram que a NPH pode causar danos ao sistema nervoso.7 A doença pode apresentar uma variedade de sintomas sistêmicos, incluindo fadiga crônica, anorexia, perda ponderal, falta de atividade e insônia, acompanhados por alterações emocionais ou psicológicas, como ansiedade, depressão, desatenção etc.; alguns pacientes apresentam tendências suicidas.8 Na China, foi relatado que cerca de 45% dos pacientes com NPH sofreram interferência emocional moderada a grave, 40% dos pacientes com NPH sofreram interferência moderada a grave em suas atividades da vida diária, mais de 40% dos pacientes tiveram distúrbios do sono moderados a graves e 59,68% dos pacientes tinham ou frequentemente tiveram pensamentos suicidas.9 Também é relatado na literatura estrangeira que quanto mais intensa a dor, mais grave o impacto na energia, no sono e na qualidade de vida geral dos pacientes. Além disso, a NPH pode ter impacto moderado a grave na vida dos membros da família, causando fadiga, estresse, insônia e sofrimento emocional.10
Foi demonstrado que vários processos inflamatórios estão envolvidos na dor neuropática.11 Especificamente, as citocinas são capazes de regular diversas funções fisiológicas celulares. Elas são polipeptídios com pequenos pesos moleculares que são sintetizados e secretados por todos os tipos de células do corpo, desempenhando importante papel nos processos de estresse causados por trauma, dor e infecção.12 Atualmente, vários tipos de citocinas são conhecidas, incluindo a interleucina (IL), o interferon (IFN), o fator estimulante de colônias (CSF), o fator de necrose tumoral (TNF), o fator de crescimento neural (NGF) e o fator de crescimento transformador (TGF). Elas estão envolvidas na regulação da homeostase no sistema imunológico e, se houver estresse excessivo, reações patológicas ocorrerão. Estudos anteriores mostraram que as citocinas podem ser categorizadas como pró‐inflamatórias ou anti‐inflamatórias.13 As primeiras incluem IL‐6, IL‐1, IL‐8 e TNF, enquanto as últimas incluem IL‐4, IL‐10, antagonista do receptor de IL‐2 solúvel e TNF. Em condições fisiológicas normais, esses dois tipos de citocinas mantêm bom equilíbrio com a ajuda de regulações neuroendócrinas e humorais.14 Vale ressaltar que a IL‐6 é uma citocina multi‐efetora produzida por células Th2, macrófagos‐monócitos e células endoteliais. É uma molécula crucial na resposta imune, resposta de fase aguda e regulação hematopoiética. Além disso, como fator de diferenciação e crescimento de células B, células T e células endoteliais, a IL‐6 pode ativar genes‐alvo, participar da imunidade humoral, induzir a maturação de megacariócitos e atuar no crescimento, na diferenciação, regeneração e degradação de células nervosas nos sistemas nervosos periférico e central. Em condições fisiológicas normais, o conteúdo de IL‐6 secretado por macrófagos, mastócitos, linfócitos, neurônios e células gliais está em nível baixo, o que facilita o desenvolvimento normal e o reparo do sistema nervoso, enquanto alto nível de IL‐6 pode causar danos ao sistema nervoso. Os estudiosos também descobriram que o nível de IL‐6 em pacientes com NPH ou neuralgia posterior foi positivamente correlacionado com perda sensorial e perda de sensação de frio na área da dor.15–19
Com a lesão do nervo periférico, a expressão de IL‐6 e receptores da IL‐6 na medula espinhal é regulada positivamente. Em experimentos com animais, injeções de IL‐6 em ratos normais podem inibir suas respostas à estimulação térmica e mecânica. Mesmo quando as respostas à dor causadas pela estimulação mecânica foram preservadas, as injeções de IL‐6 ainda foram capazes de inibir as respostas à dor causadas pela estimulação térmica. Portanto, verificou‐se que a IL‐6 desempenha papel importante na dor persistente resultante da lesão de nervos periféricos e centrais.20,21 Além disso, Arruda et al.22 realizaram vários experimentos em animais, nos quais anticorpos IL‐6 ou IgG alogênica foram aplicados para tratar ratos com hiperalgesia persistente devido a lesão de nervo periférico.
No presente estudo, verificou‐se que o nível sérico de IL‐6 correlacionou‐se positivamente com o escore da escala Likert, sugerindo o papel da IL‐6 na progressão patológica da NPH. Algumas citocinas, como IFN‐γ, IL‐6 e IL‐8, estavam levemente aumentadas no grupo zóster em comparação com um grupo de indivíduos saudáveis normais de distribuição etária semelhante; essas diferenças apenas se aproximaram da significância.23 Foi parcialmente consistente com o presente estudo, mas esse estudo confirmou ainda que a IL‐6 estava intimamente relacionada à NPH por meio de agrupamento estratificado. No presente estudo, o nível sérico de IL‐6 em pacientes com NPH grave foi significantemente mais alto do que em pacientes com NPH leve ou no grupo controle saudável, e foi maior em pacientes com NPH grave do que em pacientes com NPH leve, sugerindo que pacientes com NPH e altos níveis de IL‐6 eram mais propensos a desenvolver NPH grave.
No presente estudo, o nível sérico de IL‐6 mostrou diferença estatisticamente significante entre os pacientes com NPH antes e após o tratamento. No estudo de Saxena AK et al., o tratamento da neuralgia do herpes‐zóster incluiu terapia cognitivo‐comportamental (TCC) juntamente com pregabalina. O efeito de alívio da dor foi notável, e uma regulação negativa significante da expressão de mRNA da IL‐6 foi observada.24 Resultados consistentes foram confirmados em populações do Leste e do Oeste Asiáticos. No entanto, não foi demonstrado que o nível de IL‐6 esteja intimamente relacionado ao prognóstico da NPH. O presente estudo constatou que os níveis séricos de IL‐6 em pacientes com NPH na hospitalização estão correlacionados com o escore na escala Likert no 14° dia após o diagnóstico. É sugerido que os níveis séricos de IL‐6 em pacientes com NPH na hospitalização possam ser fator preditivo para o prognóstico de curto prazo.
A IL‐6 sérica pode ser indicador diagnóstico de NPH com sensibilidade de 85% e especificidade de 87,5%. A possibilidade do herpes‐zóster evoluir para neuralgia do herpes‐zóster pode ser considerada precocemente pelo nível de IL‐6. Intervenção precoce e tratamento regular para pacientes com níveis elevados de IL‐6 podem ajudar a aliviar a dor e melhorar sua qualidade de vida.
ConclusõesO nível sérico de IL‐6 está relacionado com o grau de neuralgia herpética e pode ser um biomarcador para o diagnóstico de NPH.
Suporte financeiroZhejiang Provincial Health Science and Technology Project 2022KY977.
Contribuição dos autoresDing Lin: Obtenção, análise e interpretação de dados
Changyang Zhong: Aprovação da versão final do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Quanlong Jiang: Participação efetiva na orientação da pesquisa;
Aihua Huang: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados;
Yuan Liu: Elaboração e redação do manuscrito; análise estatística.
Yan Zhang: Concepção e planejamento do estudo.
Conflito de interessesNenhum.
Como citar este artigo: Lin D, Zhong C, Jiang Q, Huang A, Liu Y, Zhang Y. Serum interleukin‐6 levels are increased in post‐herpetic neuralgia: a single‐center retrospective study. An Bras Dermatol. 2023;98:203–8.
Trabalho realizado no Hangzhou Third People's Hospital e laboratório clínico, Hangzhou Third People's Hospital, Hangzhou, China.