Poliomavírus humanos, como MCPyV e HPyV6, são frequentemente encontrados como parte da microbiota da pele saudável e têm sido associados ao carcinoma de células de Merkel (CCM) e dermatoses pruriginosas e disceratóticas, respectivamente. Sua presença em outros tipos de afecções da pele varia muito dependendo do tipo de lesão e da população.
ObjetivoAnalisar comparativamente a presença de MCPyV e HPyV6 em câncer de pele não melanoma e pele saudável.
MétodosForam utilizadas técnicas de qPCR para quantificar esses patógenos em CPNM, doenças pré‐malignas e pele saudável de 87 pacientes.
ResultadosMCPyV foi detectado em mais de 40% das amostras, enquanto HPyV6 em 9,6%. A carga de MCPyV foi maior em carcinomas espinocelulares (CEC) em comparação com carcinomas basocelulares (CBC; p=0,016), e HPyV6 apresentou maior porcentagem de células infectadas em áreas de baixa exposição solar, bem como na pele normal (p=0,012). Concordância razoável (kappa=0,301) foi encontrada entre a detecção de MCPyV nas lesões e sua respectiva pele perilesional, indicando processo aleatório de disseminação local do vírus.
Limitações do estudoA falta de amostra maior de diferentes tipos de lesões e análises de expressão de proteínas limita os achados de correlação.
Conclusão: Este é o primeiro relato de detecção de HPyV6 na pele saudável de uma população brasileira, mas o papel de ambos os poliomavírus no CPNM ainda não foi demonstrado.
Vários vírus foram correlacionados em graus variados com doenças dermatológicas, desde exantemas e erupções cutâneas a câncer de pele. Entre esses vírus, dois poliomavírus merecem destaque, o poliomavírus de células de Merkel (MCPyV, Merkel cell polyomavirus) e o poliomavírus humano 6 (HPyV6, human polyomavirus 6). O primeiro, também conhecido como HPyV5, é o agente causal do carcinoma de células de Merkel (CCM), um câncer de pele não melanoma (CPNM) agressivo, letal e raro encontrado principalmente em indivíduos imunocomprometidos e idosos.1 O HPyV6, por outro lado, também parece infectar a pele cronicamente sem manifestação clínica, mas tem sido associado a dermatoses pruriginosas e disceratóticas.2 Embora essas associações sejam estabelecidas, ambos os vírus foram encontrados em diferentes lesões, notadamente em câncer de pele não melanoma (CPNM), bem como em pele saudável, e parecem constituir parte da flora da pele em adultos saudáveis.3
O MCPyV foi investigado em relação ao envolvimento no processo multifatorial de outros CPNM além do CCM, seja pela persistência do vírus na lesão ou como contribuinte inicial para a oncogênese. Em relação ao HPyV6, as mesmas questões podem ser apresentadas em decorrência de seu tropismo epitelial e expressão de proteínas potencialmente oncogênicas (antígenos T). Dado o tropismo observado de MCPyV e HPyV6 para células epiteliais, a natureza multifatorial da tumorigênese e a conhecida associação com doenças cutâneas correlacionadas, objetivou‐se investigar o DNA desses poliomavírus humanos com o intuito de elucidar seu possível envolvimento em processos neoplásicos.
Expandindo um relato anterior, no qual o grupo dos autores observou a presença de MCPyV no CBC por meio de abordagem qualitativa, com 25,7% de positividade viral,4 aqui objetivou‐se avaliar e quantificar sua presença em várias lesões cutâneas malignas e não malignas em um população brasileira.
MétodoForam coletadas 181 amostras congeladas de lesão, pele perilesional e pele normal provenientes de 87 pacientes atendidos no Hospital Universitário Antônio Pedro (HUAP‐UFF), entre setembro de 2017 e dezembro de 2018. Dados sobre idade, sexo, estado imunológico, etnia e localização do tumor foram coletados durante a entrevista com o médico examinador. A etnia, classificada como ‘branca’ ou ‘não branca’, foi definida pelo dermatologista de acordo com o fototipo do paciente, enquanto a localização do tumor foi usada para inferir a exposição solar (alta, moderada ou baixa).5 O diagnóstico histopatológico de todas as lesões foi realizado pelo Departamento de Patologia do HUAP‐UFF.
Em relação à amostragem, as biópsias das lesões consistiram em biópsias por shaving das lesões, biópsias da pele perilesional removida pela equipe cirúrgica para garantir a remoção completa do tumor, posteriormente confirmada como “livre de lesão” por histopatologia, e amostras de pele normal foram obtidas no procedimento para fechar a incisão cirúrgica. Todas as amostras foram fragmentadas e digeridas com proteinase K (Promega® – Madison, EUA), e o DNA foi extraído utilizando‐se kit comercial de acordo com as instruções do fabricante (RTP® DNA/RNA Kit – Molecular Stratec Biomedical – Berlim, Alemanha).
O DNA de MCPyV e HPyV6 foi quantificado por ensaios TaqMan® qPCR com base em protocolos descritos anteriormente.6,7 O gene beta‐globina também foi amplificado via qPCR para inferir a porcentagem de células infectadas (DNAviralgenebeta−globina/2). A análise estatística foi realizada com o software SPSS v. 20 (SPSS Inc. – Chicago, IL, Estados Unidos). O consentimento informado por escrito foi obtido de todos os indivíduos que concordaram em participar. Este estudo foi aprovado pelo Comitê de Ética da Universidade.
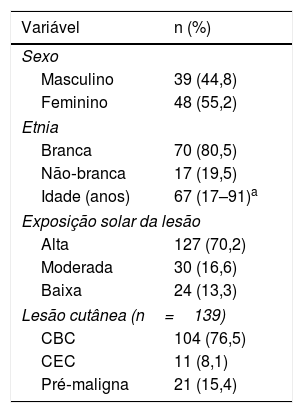
ResultadosAs características demográficas e clínicas dos 87 pacientes com CPNM estão resumidas na tabela 1. No geral, a maioria foi classificada como sendo de etnia branca (80,5%), do sexo feminino (55,2%), acima de 65 anos (58,1%) e teve o CPNM diagnosticado em áreas com alta exposição ao sol (70,2%); o carcinoma basocelular (CBC) foi o tipo histopatológico mais frequente (60,9%). As frequências virais de acordo com idade, sexo e etnia não foram significativas. Outras lesões encontradas, classificadas como pré‐malignas, incluíram elastose solar, ceratoacantoma, doença de Bowen e hidradenite.
Características dos pacientes (n=87)
| Variável | n (%) |
|---|---|
| Sexo | |
| Masculino | 39 (44,8) |
| Feminino | 48 (55,2) |
| Etnia | |
| Branca | 70 (80,5) |
| Não‐branca | 17 (19,5) |
| Idade (anos) | 67 (17–91)a |
| Exposição solar da lesão | |
| Alta | 127 (70,2) |
| Moderada | 30 (16,6) |
| Baixa | 24 (13,3) |
| Lesão cutânea (n=139) | |
| CBC | 104 (76,5) |
| CEC | 11 (8,1) |
| Pré‐maligna | 21 (15,4) |
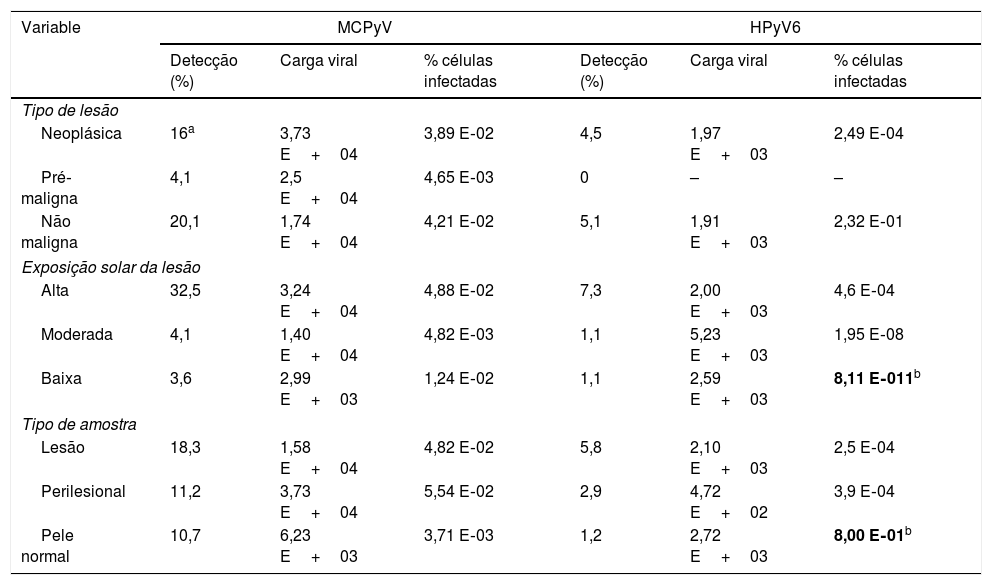
A detecção de MCPyV foi elevada no total de biópsias estudadas (40,2%) em comparação com HPyV6 (9,6%). Embora a detecção tenha sido estatisticamente semelhante por tipo de lesão (tabela 2), o MCPyV foi mais frequente em amostras neoplásicas e pré‐malignas em conjunto do que em amostras não malignas (p=0,047). As cargas de MCPyV e porcentagem de células infectadas não foram associadas ao tipo de lesão, tipo de amostra e exposição solar. Curiosamente, a porcentagem de células infectadas com HPyV6 foi maior (p=0,012) em amostras de áreas com baixa exposição solar e pele normal, embora a amostragem baixa exija cautela. As cargas de MCPyV foram maiores no subtipo CEC do que no CBC (p=0,016), mas não em porcentagem de células infectadas (p=0,721; dados não mostrados).
Frequência de detecção, médias de cargas virais e porcentagem de células infectadas por MCPyV e HPyV6 em amostras de CPNM
| Variable | MCPyV | HPyV6 | ||||
|---|---|---|---|---|---|---|
| Detecção (%) | Carga viral | % células infectadas | Detecção (%) | Carga viral | % células infectadas | |
| Tipo de lesão | ||||||
| Neoplásica | 16a | 3,73 E+04 | 3,89 E‐02 | 4,5 | 1,97 E+03 | 2,49 E‐04 |
| Pré‐maligna | 4,1 | 2,5 E+04 | 4,65 E‐03 | 0 | – | – |
| Não maligna | 20,1 | 1,74 E+04 | 4,21 E‐02 | 5,1 | 1,91 E+03 | 2,32 E‐01 |
| Exposição solar da lesão | ||||||
| Alta | 32,5 | 3,24 E+04 | 4,88 E‐02 | 7,3 | 2,00 E+03 | 4,6 E‐04 |
| Moderada | 4,1 | 1,40 E+04 | 4,82 E‐03 | 1,1 | 5,23 E+03 | 1,95 E‐08 |
| Baixa | 3,6 | 2,99 E+03 | 1,24 E‐02 | 1,1 | 2,59 E+03 | 8,11 E‐011b |
| Tipo de amostra | ||||||
| Lesão | 18,3 | 1,58 E+04 | 4,82 E‐02 | 5,8 | 2,10 E+03 | 2,5 E‐04 |
| Perilesional | 11,2 | 3,73 E+04 | 5,54 E‐02 | 2,9 | 4,72 E+02 | 3,9 E‐04 |
| Pele normal | 10,7 | 6,23 E+03 | 3,71 E‐03 | 1,2 | 2,72 E+03 | 8,00 E‐01b |
Os resultados estatisticamente significativos (p <0,05) estão em negrito.
A concordância da detecção de MCPyV entre lesão e pele perilesional foi razoável (kappa=0,301), indicando disseminação viral modesta ao redor da lesão (tabela 3). A baixa taxa de detecção de HPyV6 tornou esta análise inconclusiva.
DiscussãoO presente estudo mostrou que a detecção de MCPyV é significativamente maior em amostras neoplásicas e pré‐malignas combinadas, embora a carga viral não tenha seguido o mesmo padrão. É possível que a resposta inflamatória e/ou processos de transformação no tecido lesado criem condição mais permissiva para a replicação de baixo nível de MCPyV, ou a infecção por MCPyV promova estado permissivo que possibilita o desenvolvimento de lesão tecidual/transformação celular. Essas hipóteses foram feitas principalmente para o desenvolvimento de CCM positivo para MCPyV.8,9 Um dos pilares do CCM positivo para MCPyV é a integração clonal do DNA viral antes ou nos estágios iniciais da proliferação de células tumorais, o que se traduz em alta porcentagem de células infectadas.1,9 Isso não foi observado no presente estudo, apoiando o entendimento de que a integração clonal de MCPyV é relevante para o desenvolvimento do CCM, mas não para outros tipos de CPNM ou condições pré‐malignas.
Este é o primeiro estudo a detectar HPyV6 em amostras de pele saudável em uma população brasileira, com relato anterior mostrando apenas uma amostra com DNA de HPyV6 detectável em uma lesão de sarcoma de Kaposi (SK).10 Relatos de outros grupos populacionais mostram positividade mais alta (14% a 27,6%) de HPyV6 em amostras de pele saudáveis de indivíduos imunocompetentes.3,11 Em conjunto, esses resultados podem sugerir uma infecção geral menor em indivíduos brasileiros, mas a certeza exigiria uma análise populacional maior. Além disso, o HPyV6 foi encontrado em 42,3% dos ceratoacantomas (CA), bem como com alta carga em uma única lesão de CA de um paciente com melanoma.12,13 Neste estudo, entretanto, a presença de HPyV6 não foi detectada em amostras de CA, mas isso pode ser devido ao pequeno tamanho da amostra (n=3).
Outro achado digno de nota é que o HPyV6 apresentou maior porcentagem de células infectadas em amostras de pele saudável, bem como em lesões em áreas com baixa exposição solar (p=0,012). A carga viral não mostrou significância variável. A presença de HPyV6 em todos os tipos de amostras com carga semelhante indica que a infecção não é afetada positiva ou negativamente por alterações teciduais ou processos tumorigênicos. O contrário também pode ser deduzido: que a infecção por HPyV6 parece não favorecer nem dificultar tais processos, tornando improvável um mecanismo oncogênico sinérgico por meio de mera infecção.
Os presentes achados de cargas virais semelhantes independentemente do tipo de amostra (lesão, pele perilesional e pele normal) indicam que a presença viral não está condicionada à presença ou ausência de lesão neoplásica. Isso leva a algumas hipóteses não mutuamente exclusivas: i) a dispersão viral é independente do desenvolvimento da lesão e o vírus pode estar presente antes do início do desenvolvimento da lesão; ii) o vírus se dissemina de ou para a lesão de forma variável, sem participar do processo oncogênico; iii) a infecção viral promove um estado permissivo para transformação celular e, após o início do processo oncogênico, o vírus não é mais detectado na lesão devido a um mecanismo hit‐and‐run.14 Considerando este último, as proteínas do antígeno T dos poliomavírus humanos, que são conhecidas por possuírem propriedades oncogênicas,15 poderiam induzir a transformação maligna sem a necessidade de persistência viral.
ConclusãoOs achados de maior porcentagem de células infectadas por HPyV6 na pele normal e MCPyV sendo mais frequente no grupo neoplásico e pré‐maligno são intrigantes. No geral, esses resultados aumentam o conhecimento sobre infecções por HPyV em diferentes CPNM, embora uma amostra maior possa gerar novas correlações.
Suporte financeiroEste estudo foi financiado pelo FUNADERM (Fundo de Apoio à Dermatologia). Este estudo também foi parcialmente financiado pela FAPERJ (Fundação de Pesquisa do Rio de Janeiro) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) – Código Financeiro 001. Varella RB. Recebeu suporte financeiro parcial do Conselho Nacional de Desenvolvimento Científico e Tecnológico – CNPq.
Contribuição dos autoresMarianna Venceslau: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Gabriella Costa: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Maria Angelica Guimarães: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Rafael Varella: Análise estatística; Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Flavio Luz: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Venceslau MT, Costa GRM, Guimarães MAAM, Varella RB, Luz FB. Quantification of human polyomaviruses MCPyV and HPyV6 in malignant and non‐malignant skin lesions. An Bras Dermatol. 2023;98:198–202.
Trabalho realizado no Departamento de Medicina Preventiva, Hospital Universitário Clementino Fraga Filho, Universidade Federal do Rio de Janeiro, Rio de Janeiro, RJ, Brasil e Departamento de Medicina Clínica, Setor de Dermatologia, Hospital Universitário Antônio Pedro, Universidade Federal Fluminense, Niterói, RJ, Brasil.