A psoríase é doença inflamatória sistêmica crônica, com prevalência mundial de aproximadamente 2%. Atualmente, mesmo com as dificuldades enfrentadas diariamente por pacientes e médicos em países com poucos recursos, a literatura que descreve as necessidades exatas do tratamento da psoríase na América Latina continua escassa.
ObjetivoInvestigar as necessidades não atendidas no tratamento da psoríase na América Latina.
MétodosFoi realizada revisão sistemática seguindo a declaração PRISMA nas bases de dados PubMed, Embase e LILACS de estudos publicados de janeiro de 2011 a março de 2021, abordando os desafios do tratamento da psoríase na América Latina.
ResultadosA estratégia de busca identificou 3.837 artigos, dos quais 19 foram incluídos na análise final. A maioria era do Brasil (58%; n=11), todos eram observacionais e a maioria era transversal (84%; n=16). As dificuldades enfrentadas pelos pacientes com psoríase na América Latina incluíram alta prevalência de infecções oportunistas e endêmicas (42% dos estudos abordaram esse assunto; n=8), atraso no diagnóstico (5%; n=1), comprometimento da produtividade no trabalho (16%; n=3), acesso limitado a medicamentos/cuidados médicos (37%; n=7), baixa adesão ao tratamento (5%; n=1) e baixa adesão às orientações (11%; n=2).
Limitações do estudoNúmero reduzido e qualidade dos estudos atualmente disponíveis sobre o assunto.
ConclusõesAs diretrizes atuais sobre psoríase nem sempre levam em conta as características epidemiológicas, financeiras e culturais dos pacientes. A maioria dos estudos disponíveis é do Brasil, o que pode não representar com precisão a América Latina como um todo. Numa região em que as doenças negligenciadas e os recursos escassos continuam a ser realidade, é imperativo que seja oferecida formação dermatológica aos prestadores de cuidados primários, permitindo condutas padronizadas e diagnósticos mais precoces.
A psoríase (Pso) é doença inflamatória sistêmica crônica que apresenta manifestações cutâneas, ungueais e articulares, afetando cerca de 2% da população mundial.1,2 A carga da doença psoriásica na América Latina permanece em grande parte desconhecida, mas sua prevalência é estimada em 2,1%.3 A Pso pode afetar profundamente múltiplas dimensões da vida do paciente, incluindo o bem‐estar físico, emocional, ocupacional, social e econômico.4 Também está associada a comorbidades como síndrome metabólica, eventos cardiovasculares, depressão e ansiedade, complicando ainda mais o manejo da doença.5
O acesso aos cuidados de saúde em muitas partes da América Latina continua a ser um desafio significante, especialmente para indivíduos que residem em áreas rurais ou remotas, onde o atraso no diagnóstico é ocorrência comum. A maioria desses países ainda está em desenvolvimento, e uma proporção importante da população tem recursos financeiros limitados, tornando difícil a obtenção até mesmo de medicamentos tópicos para o tratamento da Pso com lesões discretas. Embora os tratamentos sistêmicos tenham se tornado mais acessíveis nos últimos anos, o ritmo dessas mudanças não acompanhou os avanços na área, levando a ações judiciais contra o sistema de saúde.6
A maior prevalência de doenças oportunistas e endêmicas na América Latina, como tuberculose (TB), leishmaniose, hanseníase e hepatite C, representa um desafio adicional na utilização de terapias imunossupressoras para Pso moderada e grave. Atualmente, é premente a necessidade de desenvolvimento de diretrizes específicas para enfrentar esses desafios na população latino‐americana.7
A maioria dos estudos sobre Pso foi realizada em países desenvolvidos, potencialmente falhando em capturar com precisão as circunstâncias únicas da América Latina em virtude de suas diferenças culturais e sociais. Assim, esta revisão sistemática procura avaliar os desafios associados ao manejo de Pso na América Latina a fim de identificar estratégias direcionadas para melhorar os resultados do tratamento dos pacientes nessa região.
MétodosConduzimos revisão sistemática abrangente para abordar as necessidades não atendidas no manejo de Pso na América Latina, aderindo às diretrizes Preferred Reporting Items for Systematic Reviews and Meta‐analyses (PRISMA).8 Este estudo foi registrado na base de dados PROSPERO (CRD 42021241881).
Os critérios de inclusão abrangeram artigos de pesquisa originais que examinaram populações de pacientes com Pso residentes em qualquer país da América Latina. Não foram impostas restrições com base na idade dos participantes do estudo, presença ou ausência de tratamento ou tipo de tratamento recebido (tópico, sistêmico ou fototerapia). Foram aceitos todos os níveis de gravidade da psoríase (leve, moderada e grave). Os principais critérios de exclusão foram artigos de revisão e estudos de pacientes não originários de países latino‐americanos.
Para se qualificarem para a inclusão, os estudos tinham que avaliar as dificuldades regionais encontradas pelos pacientes com Pso e pelos profissionais de saúde que poderiam impactar negativamente o diagnóstico e o tratamento da doença. Foram analisados os seguintes desfechos: acesso limitado ao tratamento e judicialização; infecções oportunistas e endêmicas; baixa adesão ao tratamento e conhecimento sobre a doença; atraso no diagnóstico; produtividade no trabalho e situação socioeconômica; e adesão às diretrizes de tratamento.
Foram pesquisados nas bases de dados PubMed, Embase e LILACS artigos publicados entre janeiro de 2011 e março de 2021, e incluídos todos os estudos originais escritos em inglês, português ou espanhol. Havia apenas um artigo escrito em francês, que foi excluído. Decidiu‐se não incluir resumos de congressos, exceto nos casos em que a informação tenha sido considerada crucial e o resumo publicado tenha fornecido a informação completa sobre o assunto.
O protocolo de pesquisa foi o seguinte: para a base de dados Pubmed “Psoriasis”[Mesh] OR “Psoriasis” AND “Latin America”[Mesh] OR “Latin America” OR “Argentina” OR “Bolivia” OR “Brazil” OR “Brasil” OR “Chile” OR “Colombia” OR “Ecuador” OR “French Guiana” OR “Guyana Francesa” OR “Guyana” OR “Paraguay” OR “Peru” OR “Suriname” OR “Uruguay” OR “Venezuela” OR “Belize” OR “Costa Rica” OR “El Salvador” OR “Guatemala” OR “Honduras” OR “Mexico” OR “Nicaragua” OR “Panama” OR “Cuba” OR “Dominican Republic” OR “Republica Dominicana” OR “Haiti” OR “Guadeloupe” OR “Martinique” OR “Puerto Rico” OR “Saint‐Barthélemy” OR “Saint‐Martin” OR “Guadalupe” OR “Martinica” OR “San Bartolome” OR “San Martin” OR “Guyane francaise”. Para a base de dados Embase: ‘psoriasis’/exp OR ‘psoriasis’ AND ‘South and Central America’/exp OR ‘South America’ OR ‘Central America’ OR ‘Latin America’ OR ‘Argentina’ OR ‘Bolivia’ OR ‘Brazil’ OR ‘Brasil’ OR ‘Chile’ OR ‘Colombia’ OR ‘Ecuador’ OR ‘French Guiana’ OR ‘Guyana Francesa’ OR ‘Guyana’ OR ‘Paraguay’ OR ‘Peru’ OR ‘Suriname’ OR ‘Uruguay’ OR ‘Venezuela’ OR ‘Belize’ OR ‘Costa Rica’ OR ‘El Salvador’ OR ‘Guatemala’ OR ‘Honduras’ OR ‘Mexico’ OR ‘Nicaragua’ OR ‘Panama’ OR ‘Cuba’ OR ‘Dominican Republic’ OR ‘Republica Dominicana’ OR ‘Haiti’ OR ‘Guadeloupe’ OR ‘Martinique’ OR ‘Puerto Rico’ OR ‘Saint‐Barthélemy’ OR ‘Saint‐Martin’ OR ‘Guadalupe’ OR ‘Martinica’ OR ‘San Bartolome’ OR ‘San Martin’ OR ‘Guyane francaise’. Para a base de dados LILACS: “psoriase” OR “psoríase” OR “psoriasis”. Também foi adicionado filtro para pesquisas em seres humanos nos três sites.
A seleção dos artigos foi realizada utilizando a ferramenta Rayyan QCRI.9 Os resumos foram analisados de maneira independente por dois pesquisadores distintos e, quando necessário, o texto completo também foi avaliado. As divergências foram resolvidas por meio de consenso entre os dois pesquisadores.
A extração de dados foi realizada por outra dupla de pesquisadores independentes; as discrepâncias foram resolvidas por consenso. Todos os artigos foram avaliados quanto ao risco de viés de acordo com as ferramentas de avaliação crítica do Instituto Joanna Briggs.10–13 A determinação do risco de viés foi realizada por dois pesquisadores independentes, e quaisquer discrepâncias foram resolvidas por consenso.
Além dos dados relativos aos resultados do estudo, foram extraídos dos artigos os seguintes dados: características gerais do estudo (ou seja, ano de publicação, país de origem), desenho do estudo, financiamento (público, privado ou misto), tamanho amostral e dados demográficos.
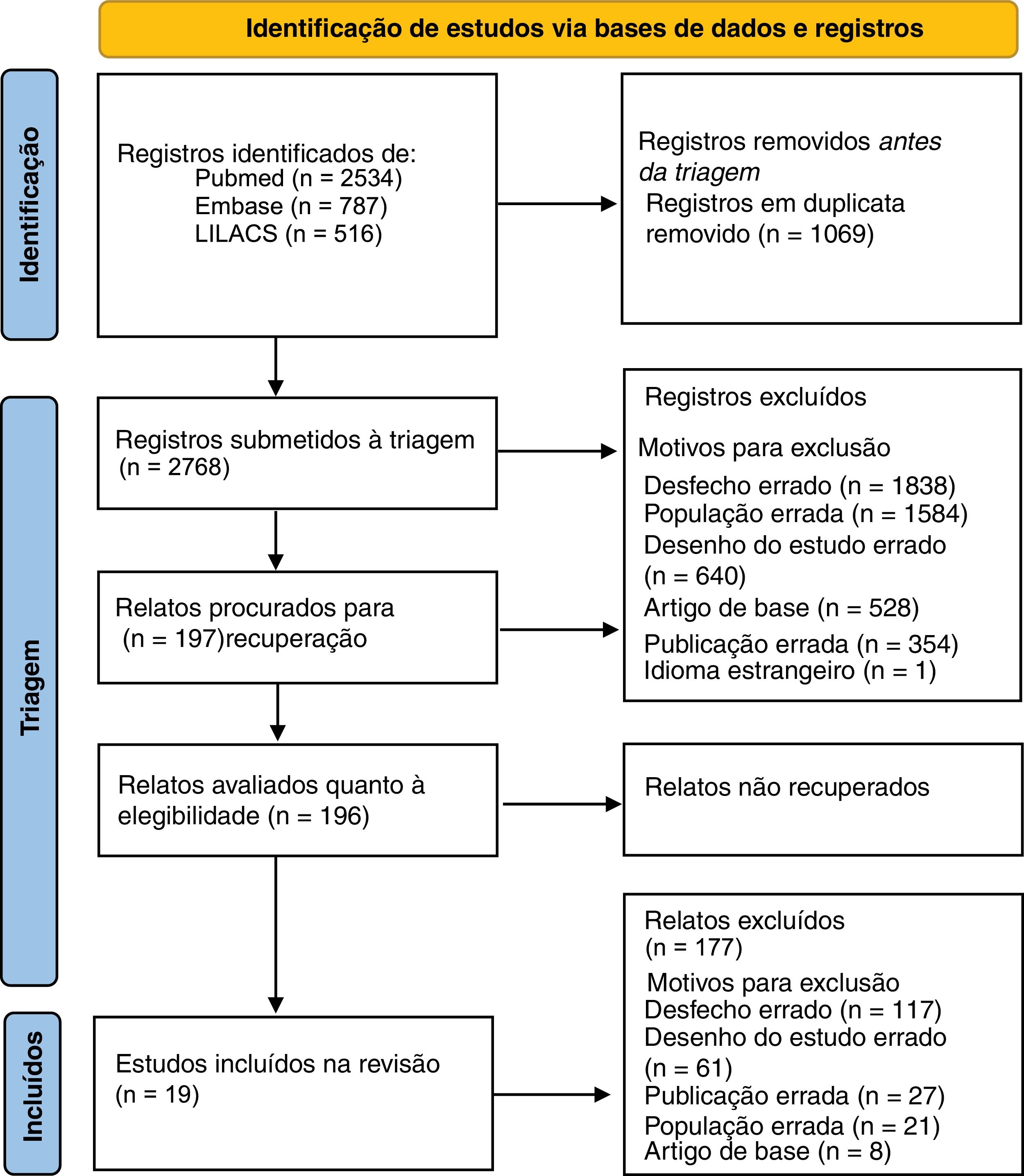
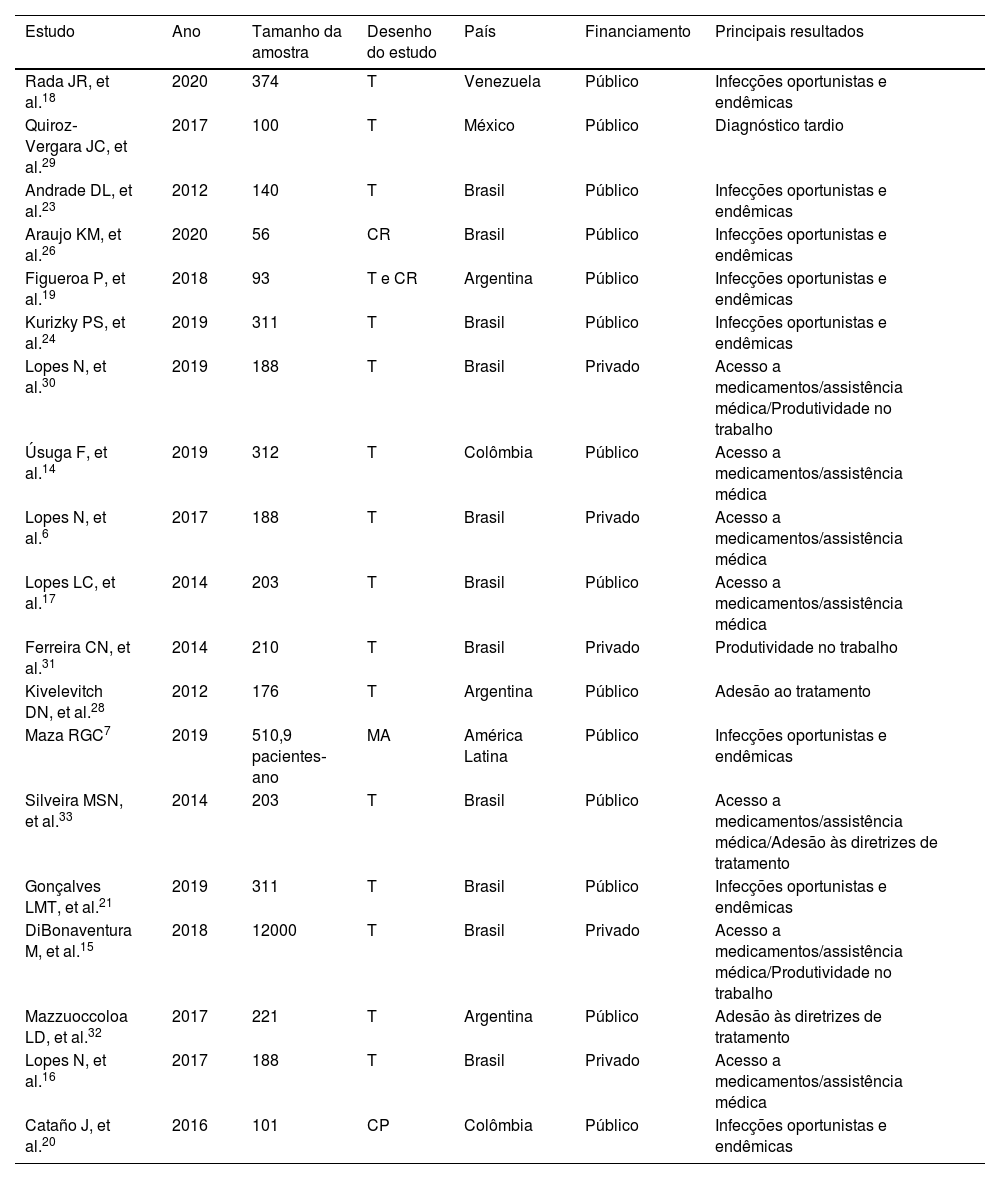
ResultadosA busca inicial encontrou 3.837 artigos, dos quais 19 foram incluídos na análise final. A maioria dos artigos teve origem no Brasil (n=11). Os motivos para a exclusão do artigo da presente revisão foram os seguintes: resultado errado (n=1.838), população errada (país errado ou doença errada; n=1.584), desenho de estudo errado (n=640), artigo de base (n=528), tipo errado de publicação (resumos de congressos; n=354) e idioma estrangeiro (n=1). Alguns artigos foram incluídos em múltiplas categorias de exclusão. Um diagrama estilo PRISMA detalhando cada etapa da seleção dos artigos é apresentado na figura 1, e a tabela 1 fornece um resumo de todos os artigos incluídos.
Características dos artigos incluídos
| Estudo | Ano | Tamanho da amostra | Desenho do estudo | País | Financiamento | Principais resultados |
|---|---|---|---|---|---|---|
| Rada JR, et al.18 | 2020 | 374 | T | Venezuela | Público | Infecções oportunistas e endêmicas |
| Quiroz‐Vergara JC, et al.29 | 2017 | 100 | T | México | Público | Diagnóstico tardio |
| Andrade DL, et al.23 | 2012 | 140 | T | Brasil | Público | Infecções oportunistas e endêmicas |
| Araujo KM, et al.26 | 2020 | 56 | CR | Brasil | Público | Infecções oportunistas e endêmicas |
| Figueroa P, et al.19 | 2018 | 93 | T e CR | Argentina | Público | Infecções oportunistas e endêmicas |
| Kurizky PS, et al.24 | 2019 | 311 | T | Brasil | Público | Infecções oportunistas e endêmicas |
| Lopes N, et al.30 | 2019 | 188 | T | Brasil | Privado | Acesso a medicamentos/assistência médica/Produtividade no trabalho |
| Úsuga F, et al.14 | 2019 | 312 | T | Colômbia | Público | Acesso a medicamentos/assistência médica |
| Lopes N, et al.6 | 2017 | 188 | T | Brasil | Privado | Acesso a medicamentos/assistência médica |
| Lopes LC, et al.17 | 2014 | 203 | T | Brasil | Público | Acesso a medicamentos/assistência médica |
| Ferreira CN, et al.31 | 2014 | 210 | T | Brasil | Privado | Produtividade no trabalho |
| Kivelevitch DN, et al.28 | 2012 | 176 | T | Argentina | Público | Adesão ao tratamento |
| Maza RGC7 | 2019 | 510,9 pacientes‐ano | MA | América Latina | Público | Infecções oportunistas e endêmicas |
| Silveira MSN, et al.33 | 2014 | 203 | T | Brasil | Público | Acesso a medicamentos/assistência médica/Adesão às diretrizes de tratamento |
| Gonçalves LMT, et al.21 | 2019 | 311 | T | Brasil | Público | Infecções oportunistas e endêmicas |
| DiBonaventura M, et al.15 | 2018 | 12000 | T | Brasil | Privado | Acesso a medicamentos/assistência médica/Produtividade no trabalho |
| Mazzuoccoloa LD, et al.32 | 2017 | 221 | T | Argentina | Público | Adesão às diretrizes de tratamento |
| Lopes N, et al.16 | 2017 | 188 | T | Brasil | Privado | Acesso a medicamentos/assistência médica |
| Cataño J, et al.20 | 2016 | 101 | CP | Colômbia | Público | Infecções oportunistas e endêmicas |
Características de todos os artigos incluídos na revisão.
T, transversal; CR, coorte retrospectiva; CP, coorte prospectiva; MA, metanálise.
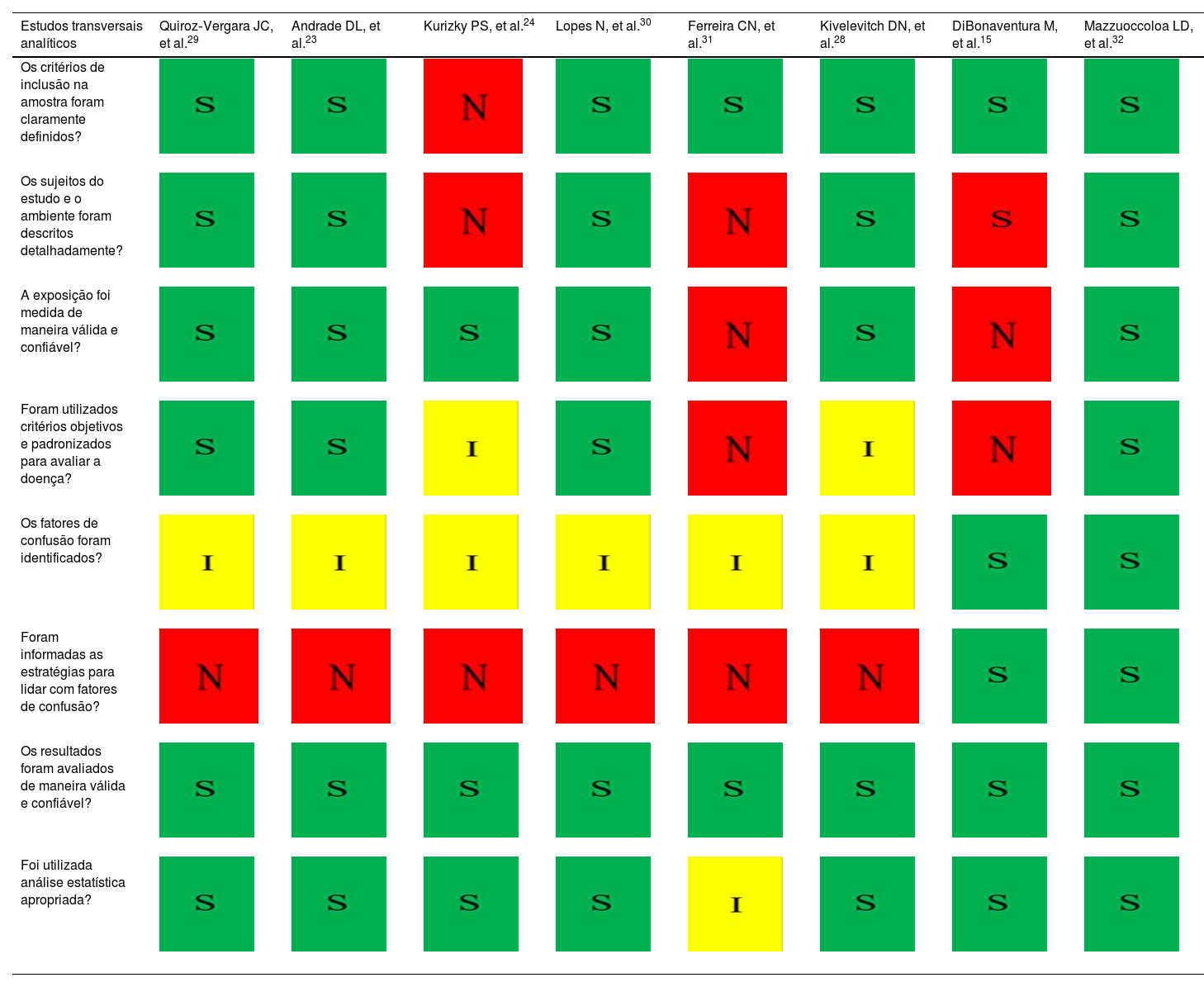
A qualidade geral dos estudos incluídos variou de moderada a baixa. A maioria dos estudos não afirmou claramente se foi realizada estimativa do tamanho da amostra, complicando a interpretação dos resultados de prevalência. Essa questão é particularmente proeminente para estudos descritivos que carecem de análise estatística apropriada. Além disso, a maioria dos estudos não discutiu estratégias para identificar ou abordar vieses de confusão. Os resultados da avaliação de risco de viés podem ser encontrados na tabela 2.
Avaliação do risco de viés
| Estudos transversais analíticos | Quiroz‐Vergara JC, et al.29 | Andrade DL, et al.23 | Kurizky PS, et al.24 | Lopes N, et al.30 | Ferreira CN, et al.31 | Kivelevitch DN, et al.28 | DiBonaventura M, et al.15 | Mazzuoccoloa LD, et al.32 |
|---|---|---|---|---|---|---|---|---|
| Os critérios de inclusão na amostra foram claramente definidos? | ||||||||
| Os sujeitos do estudo e o ambiente foram descritos detalhadamente? | ||||||||
| A exposição foi medida de maneira válida e confiável? | ||||||||
| Foram utilizados critérios objetivos e padronizados para avaliar a doença? | ||||||||
| Os fatores de confusão foram identificados? | ||||||||
| Foram informadas as estratégias para lidar com fatores de confusão? | ||||||||
| Os resultados foram avaliados de maneira válida e confiável? | ||||||||
| Foi utilizada análise estatística apropriada? |
| Estudos transversais descritivos | Rada JR, et al.18 | Figueroa P, et al.19 | Úsuga F, et al.14 | Lopes N, et al.6 | Lopes LC, et al.17 | Silveira MSN, et al.33 | Gonçalves LMT, et al.21 | Lopes N, et al.16 |
|---|---|---|---|---|---|---|---|---|
| A base da amostra foi apropriada para abordar a população‐alvo? | ||||||||
| Os participantes do estudo foram amostrados de maneira apropriada? | ||||||||
| O tamanho da amostra foi adequado? | ||||||||
| Os sujeitos e o ambiente do estudo foram descritos detalhadamente? | ||||||||
| A análise dos dados foi realizada com cobertura suficiente da amostra identificada? | ||||||||
| Foram utilizados métodos válidos para a identificação da doença? | ||||||||
| A doença foi avaliada de forma padronizada e confiável para todos os participantes? | ||||||||
| Houve análise estatística apropriada? | ||||||||
| A taxa de resposta foi adequada e, caso contrário, a baixa taxa de resposta foi manejada de maneira adequada? |
| Estudos de coorte | Araujo KM, et al.26 | Cataño J, et al.20 | ||||||
|---|---|---|---|---|---|---|---|---|
| Os dois grupos eram semelhantes e foram recrutados na mesma população? | ||||||||
| As exposições foram medidas de modo semelhante para distribuir as pessoas nos grupos expostos e não expostos? | ||||||||
| A exposição foi avaliada de maneira válida e confiável? | ||||||||
| Os fatores de confusão foram identificados? | ||||||||
| Foram informadas as estratégias para lidar com fatores de confusão? | ||||||||
| Os grupos/participantes estavam livres do desfecho no início do estudo (ou no momento da exposição)? | ||||||||
| Os resultados foram avaliados de maneira válida e confiável? | ||||||||
| O tempo de seguimento foi relatado e foi longo o suficiente para que os resultados ocorressem? | ||||||||
| O seguimento foi completo e, caso contrário, os motivos da perda do seguimento foram descritos e explorados? | ||||||||
| Foram utilizadas estratégias para abordar o seguimento incompleto? | ||||||||
| Foi utilizada análise estatística apropriada? |
| Metanálise | Maza, RGC.7 | |||||||
|---|---|---|---|---|---|---|---|---|
| A questão em revisão é clara e explicitamente declarada? | ||||||||
| Os critérios de inclusão foram apropriados para a questão em revisão? | ||||||||
| A estratégia de busca foi adequada? | ||||||||
| As fontes e recursos utilizados na busca de estudos foram adequados? | ||||||||
| Os critérios de avaliação dos estudos foram adequados? | ||||||||
| A avaliação crítica foi conduzida por dois ou mais revisores de modo independente? | ||||||||
| Havia métodos para minimizar erros na extração de dados? | ||||||||
| Os métodos utilizados para combinar os estudos foram adequados? | ||||||||
| A probabilidade de viés de publicação foi avaliada? | ||||||||
| As recomendações de políticas e/ou práticas foram apoiadas pelos dados relatados? | ||||||||
| As diretrizes específicas para novas pesquisas foram apropriadas? |
A avaliação crítica foi realizada utilizando Joanna Briggs Institute Tools;10–13 as listas de verificação apropriadas foram aplicadas de acordo com o desenho do estudo.
S, sim; N, não; I, incerto; NA, não aplicável.
Úsuga et al. investigaram 312 pacientes colombianos com Pso, relatando que 23% não haviam recebido orientação médica. Além disso, 30% deles não tiveram acesso aos imunobiológicos (IMB) que lhes foram prescritos.14
DiBonaventura et al. analisaram dados da Pesquisa Nacional de Saúde e Bem‐Estar (NHWS, do inglês National Health and Wellness Survey) de 2012 do Brasil (n=12.000) e verificaram que indivíduos relatados com Pso eram mais propensos a ter diploma universitário, maior renda familiar anual, maior taxa de emprego, seguro privado, estar com sobrepeso/obesidade e ter histórico de tabagismo. A Pso era moderada em 20% e grave em 5,24% da população desse estudo.15
De maneira similar, estudo multicêntrico brasileiro (n=188) constatou que 34,8% dos pacientes relataram dificuldades para obter medicamentos prescritos; 12,8% recorreram à judicialização para conseguir o tratamento. Os principais motivos foram a indisponibilidade de medicamentos (43,1%) e questões financeiras (38,5%). Os pacientes com Pso obtiveram medicamentos por meio do Sistema Único de Saúde (SUS) e do próprio bolso (38,5%); exclusivamente do próprio bolso (35,8%); exclusivamente pelo SUS (19,8%) e exclusivamente por planos de saúde privados (1,1%). Entre os participantes do estudo, 30,5% estavam tomando IMB.6 Lopes et al. sugeriram que o subtratamento da psoríase pode ser uma realidade em virtude do acesso limitado aos IMB.16
Lopes et al. estudaram 203 pacientes com Pso que receberam IMB por ordem judicial em São Paulo, Brasil, de 2004 a 2010, constatando que 59,5% dos pacientes obtiveram o medicamento por meio de mandado de segurança; 86,2% nunca tentaram obtê‐lo em uma organização de saúde pública ou privada antes de tomar medidas legais. A maioria dos pacientes (69,5%) conseguiu os IMB pelo SUS com prescrição privada, e 70,3% não realizaram exames de seguimento.17
Infecções oportunistas e endêmicasTuberculoseRada et al. investigaram a prevalência de tuberculose latente (TBL) em 374 pacientes venezuelanos com Pso17 candidatos ao tratamento com IMB.18 Os autores descobriram que 70,9% dos pacientes tiveram teste de derivado de proteína purificada (PPD) não reativo e 10,4% tiveram uma reação ≥ 10mm. Figueroa et al. relataram uma prevalência de TBL de 16% e uma taxa de incidência de 5% ao ano em 93 pacientes argentinos que receberam tratamento sistêmico.19
Em contrapartida, Cataño et al. estudaram 101 pacientes colombianos submetidos a tratamento imunobiológico19 e descobriram alta prevalência de testes PPD positivos (99%).20 Notavelmente, sua amostra era composta por pacientes atendidos em um ambulatório de doenças infecciosas e, portanto, tinham maior probabilidade pré‐teste de ter TBL. A radiografia de tórax na avaliação inicial foi sugestiva de granulomas tuberculosos calcificados em 65,3% dos casos. Dos pacientes com diagnóstico de TBL, 82 (81,2%) completaram nove meses de quimioprofilaxia com isoniazida e 16,8% desenvolveram intolerância/toxicidade. No seguimento, três pacientes desenvolveram TB ativa. Desses, um caso apresentou‐se como TB extrapulmonar. Em relação à terapia com IMB, dois dos pacientes estavam em uso de etanercepte, e um em uso de adalimumabe.
Por fim, uma metanálise estimou a incidência de TB em pacientes latino‐americanos com Pso que tomavam IMB (os pacientes estavam usando infliximabe, adalimumabe ou etanercepte).7 Essa metanálise incluiu estudos do Brasil, Argentina, Chile, Colômbia e México. A incidência média de TB relatada foi de 636 em 100 mil pacientes‐ano (IC 95% 145‐1.764 por 100 mil pacientes/ano). Essa taxa de incidência foi consideravelmente superior à esperada para essa população em 2016 (41 casos por 100 mil pacientes‐ano). A incidência de TBL variou de 18,8% a 100% (três estudos).
HanseníaseGonçalves et al. estudaram a prevalência do DNA do Mycobacterium leprae em pacientes ambulatoriais com Pso e/ou artrite psoriásica (APs) em um hospital universitário em Brasília, Brasil.21 Brasília está localizada no Distrito Federal do Brasil, que em 2021 foi classificada como área moderadamente endêmica.22 O estudo incluiu 311 pacientes, dos quais 96 estavam em uso de IMB, 94 em uso de metotrexato (MTX), 69 em tratamento sistêmico não imunossupressor (TSNI) e 52 eram controles. A PCR para M. leprae foi positiva em cinco indivíduos (um controle, um tratado com MTX e três em uso de IMB). O teste anti‐PGL1 apresentou resultados positivos em 18 dos 70 pacientes (dois tratados com TSNI, quatro tratados com MTX e 12 com IMB), enquanto as baciloscopias foram negativas para todos os pacientes.
Vírus da hepatite CAndrade et al. avaliaram a prevalência do vírus da hepatite C (HCV) entre 140 pacientes com Pso em Salvador (Brasil)22 e descobriram que 10 pacientes (7,1%) tiveram infecção pelo HCV confirmada por PCR.23 A prevalência neste estudo foi superior à estimada para a população geral da cidade no mesmo período (1,5%; p=0,003). Em seis pacientes, o diagnóstico de Pso precedeu o diagnóstico de infecção pelo HCV.
LeishmanioseA prevalência de leishmaniose em pacientes com Pso em Brasília foi relatada por Kurizky et al. (n=311).24 O Distrito Federal do Brasil é considerado área endêmica para leishmaniose.25 Os indivíduos foram divididos em quatro grupos: IMB (n=96; subdivididos em grupos anti‐TNF, IL‐12/23 e inibidores de IL‐17A), imunossupressores convencionais (MTX; n=24), tratamentos não imunossupressores (n=69; anti‐inflamatórios não esteroides, acitretina, fototerapia e agentes tópicos) e controles (n=52). No grupo IMB, os pacientes estavam em uso dos seguintes medicamentos: adalimumabe (n=24), etanercepte (n=29), infliximabe (n=25), ustequinumabe (n=9) e secuquinumabe (n=9). A provável positividade para leishmaniose na população‐alvo foi fixada em 5%. Embora nenhum caso clinicamente ativo tenha sido detectado, sete indivíduos testaram positivo por sorologia, 13 por PCR convencional e nove por PCR em tempo real. Nenhuma diferença significante foi encontrada entre as três estratégias de triagem. No grupo IMB, apenas os pacientes em uso de anti‐TNF tiveram resultados positivos (dois deles estavam em uso de etanercepte e um estava utilizando infliximabe).24
Infecções por arbovírusAraújo et al. acompanharam 56 pacientes com Pso no Rio de Janeiro, Brasil, que estavam tomando IMB por pelo menos 12 meses, analisando a incidência de zika, chikungunya e dengue.26 Dezenove pacientes (36,5%) estavam em uso de adalimumabe, 15 (28,8%) de etanercepte, nove (17,3%) de infliximabe, oito (15,4%) de ustequinumabe e um (1,9%) fazia uso de secuquinumabe. Durante o período do estudo, seis pacientes (10,7%) tiveram infecções confirmadas por arbovírus [chikungunya (n=3), dengue (n=2) e zika (n=1)]. Desses, quatro [7,1%; chikungunya (n=2), dengue (n=1) e zika (n=1)] sofreram exacerbação de Pso (p<0,01), dos quais três foram tratados de modo conservador sem descontinuar a terapia com IMB. As taxas de incidência de dengue, chikungunya e zika no Rio de Janeiro variaram durante o período do estudo (2016‐2018). Em 2016 elas foram, respectivamente, 523,2/100 mil pessoas‐ano, 94,9/100 mil pessoas‐ano e 432,7/100 mil pessoas‐ano. Contudo, em 2017, todos os indicadores melhoraram significantemente (4,4/100.0000 pessoas‐ano, 1,1/100.000 pessoas‐ano e 0,3/100.000 pessoas‐ano, respectivamente).27
Fraca adesão ao tratamento e conhecimento da doençaKivelevitch et al. estudaram a adesão ao tratamento em pacientes argentinos com Pso (n=176) e relataram que 33% dos pacientes se automedicaram, enquanto 77% não aderiram ao tratamento. Os pacientes avaliados nessa amostra estavam em uso de medicamentos tópicos (97%) e sistêmicos em 29%.28 As causas mais comuns de não adesão foram falta de resposta ao tratamento (63%), melhora clínica (26%), fatores econômicos (16%) e efeitos adversos (10%). Quando combinados, os grupos de automedicação e não adesão representaram 82% da amostra. Notavelmente, 24% dos pacientes acreditavam que a Pso podia ser curada e 86% afirmaram não terem sido informados sobre os riscos de suspender ou modificar o tratamento sem supervisão.
Diagnóstico tardioQueiroz‐Vergara et al. investigaram os fatores que contribuem para o atraso no diagnóstico de Pso no México (n=100).29 Seus achados revelaram que apenas 42% dos pacientes receberam diagnóstico dentro de um ano após apresentarem os sintomas e, entre esses, 89% foram diagnosticados por um dermatologista, embora a primeira consulta médica tenha sido com um clínico geral (CG) em 61% de casos. Destes pacientes, 31% iniciaram o tratamento no primeiro ano de diagnóstico.
Produtividade no trabalho e status socioeconômicoLopes et al. avaliaram o impacto da Pso sobre a produtividade no trabalho e nas atividades diárias em 188 pacientes brasileiros.30 O presenteísmo foi mais frequente que o absenteísmo, com média (desvio padrão, DP) de 14,4% (5,5%) contra 6,3% (13,8%). O presenteísmo é definido como o ato de comparecer ao trabalho estando doente ou enfrentando condição médica que impeça a plena capacidade laboral. Os autores estimaram que os pacientes precisariam aumentar a jornada de trabalho em aproximadamente 5% para compensar as perdas de produtividade causada pela Pso, com média de 4,7 horas (DP=5,4). Em contrapartida, Ferreira et al. não encontraram diferenças significantes no absenteísmo, no presenteísmo, no comprometimento geral do trabalho e no comprometimento da atividade em vários níveis de gravidade da Pso.31
DiBonaventura et al. estimaram que, no Brasil, entre 28% e 40% das horas de trabalho foram perdidas ou tornadas ineficazes em virtude da Pso (n=210).15 O presenteísmo foi mais frequente entre os pacientes com Pso em comparação aos pacientes sem Pso (22,08% vs. 16,95%; p<0,05). Os autores estimaram que essa diferença equivale a 10 dias adicionais por funcionário por ano. O comprometimento das atividades (26,52% vs. 20,97%) e o número de consultas médicas (5,18 vs. 4,27) também foram significantemente mais comuns entre os pacientes com Pso (p<0,05). No entanto, não foram observadas diferenças entre os níveis de gravidade.
Adesão às diretrizes de tratamentoMazzuoccoloa et al. realizaram uma pesquisa sobre o uso de MTX para tratamento de Pso entre dermatologistas argentinos (n=221)32 e descobriram que dois terços dos dermatologistas incluíram o teste PPD e/ou radiografia de tórax em sua avaliação pré‐tratamento. Metade deles esperava uma resposta clinicamente significante entre as semanas quatro e seis do tratamento com MTX, 44% entre as semanas oito e 12 e 6% após 12 semanas. Aproximadamente 76% afirmaram que considerariam falha do tratamento se nenhuma resposta significante fosse observada após 12 semanas. Em relação à eficácia, 30% dos dermatologistas argentinos consideraram o MTX ineficaz. A única variável associada ao uso sub‐ótimo do MTX foi a percepção do prescritor sobre sua ineficácia (OR=2,29; IC 95% 1,05–5,00, p=0,037).32
Silveira et al. examinaram a adesão às diretrizes para prescrição de IMB em 203 pacientes processando o estado de São Paulo, Brasil, de 2004 a 2011.33 Os autores descobriram que mais de 20% dos pacientes não haviam utilizado nenhuma intervenção convencional antes de iniciar o processo. Agentes tópicos foram utilizados por 16% dos pacientes, e fototerapia por 36,9%. Cerca de 71% dos pacientes já haviam utilizado tratamento sistêmico não imunossupressor. Como as diretrizes brasileiras determinam o uso de terapia tópica e sistêmica antes de iniciar o tratamento com IMB, apenas 34 (16,7%) pacientes atenderam aos requisitos das diretrizes. Todos os pacientes consultaram um médico pelo menos uma vez por ano, mas 25,2% deles não realizaram nenhum exame laboratorial. Em geral, a adesão completa às diretrizes foi observada em 14,2% dos casos.33
DiscussãoAcesso limitado a medicamentos e cuidados médicosA maioria dos artigos foi publicada no Brasil antes de 2019, quando um novo protocolo clínico e diretriz terapêutica (PCDT) para Pso disponibilizou adalimumabe, etanercepte, ustequinumabe e secuquinumabe sem necessidade de ação legal.34 Após essa disponibilização, o número de ações judiciais diminuiu no país10 e, posteriormente, o risanquizumabe foi adicionado ao PCDT.35
Na última década, no Brasil, a maior parte dos IMB para Pso foram adquiridos por meio de ações judiciais, levando ao monitoramento inadequado dos pacientes6,33 e à interrupção do tratamento em decorrência de efeitos adversos. A falta de requisitos de prescrição claros também contribui para que os médicos desconsiderem as diretrizes.6,33 De acordo com Silveira et al., mais de 20% dos pacientes não havia utilizado nenhuma terapia convencional antes de recorrer a ações legais.33 Atrasos na inclusão de medicamentos no PCDT e em sua aquisição pelo sistema de saúde levaram muitas empresas farmacêuticas a fornecer medicamentos para o início do tratamento, o que pode ter contribuído para o aumento das reclamações judiciais por medicamentos. Lopes et al. afirmaram que as indústrias farmacêuticas mantinham comunicação frequente com a maioria dos pacientes.17
Os pacientes brasileiros com Pso tendem a ter maior escolaridade, renda e taxas de seguro privado do que os controles, sugerindo que têm maior probabilidade de serem diagnosticados em virtude do melhor acesso a cuidados médicos. Estudos franceses e italianos sugerem que níveis mais baixos de escolaridade e rendimento estão associados a doença mais grave, menos consultas médicas e menos prescrições de tratamento sistêmico.36,37 Nos EUA, a idade mais jovem, o rendimento mais baixo e a falta de seguro foram associados a dificuldades em adquirir IMB.38,39 Portanto, é razoável supor que a prevalência de Pso e o acesso ao tratamento na América Latina possam estar grosseiramente subestimados por razões socioeconômicas.
Lopes et al. constataram que 34,8% dos pacientes relataram dificuldades na obtenção dos medicamentos prescritos. A maioria das prescrições de medicamentos tópicos no Brasil, como os corticosteroides tópicos (CT) de alta potência, apesar de estarem incluídas no PCDT, exigem requisição especial e excessiva burocracia, tornando seu processo de aquisição demorado.6 Na prática clínica dos autores em um hospital público terciário no Sul do Brasil, frequentemente atendemos pacientes comprando CT com recursos próprios ou utilizando CT de baixa potência prontamente disponíveis, que não são adequados para o tratamento de Pso.40
Infecções oportunistas e endêmicasEstudos da Venezuela18 e da Argentina19 relataram taxas semelhantes de infecção latente por tuberculose (ILTB) em pacientes com Pso (10,4% e 16%, respectivamente). Na Colômbia,20 a prevalência foi significantemente maior, de 99%. Ao analisar os dados deste estudo, no entanto, é crucial considerar a influência potencial do viés de seleção. Globalmente, existe grande variedade de diferenças regionais, com estimativas de ILTB variando entre 8,3% e 86,1%.41–47 Os dados tornam‐se ainda mais contrastantes quando comparamos países desenvolvidos e em desenvolvimento.
Uma metanálise latino‐americana7 que avaliou pacientes com Pso submetidos a tratamento anti‐TNF encontrou uma taxa de incidência de TB de 636 casos por 100 mil pacientes‐ano, o que é consideravelmente superior à prevalência esperada para a população em geral durante o mesmo período. Além disso, um estudo colombiano20 relatou diagnósticos de TB mesmo após quimioprofilaxia de nove meses com isoniazida. Achados semelhantes foram relatados em publicações da Turquia,48 França49 e EUA.45 Consequentemente, sugere‐se que as medidas profiláticas possam não evitar totalmente a TB e que rastreios periódicos devam ser realizados, especialmente em regiões endêmicas.
Os agentes anti‐TNF são geralmente considerados IMB de primeira linha para o tratamento de Pso em virtude de seu custo‐benefício.35 Entretanto, sua utilização pode ser limitada pelo risco potencial de reativação da ILTB em pacientes com Pso, levando os médicos a preferirem opções mais caras de IMB, o que subsequentemente aumenta a carga econômica.50 Além disso, o teste PPD demonstrou ter limitações, especificamente sua baixa especificidade em cenários de elevada cobertura vacinal com BCG e sua dependência da imunocompetência do paciente para obter resultados confiáveis. Foi relatado que testes alternativos, como ensaios de liberação de interferon‐gama (IGRA, do inglês interferon‐gamma release assays), são mais específicos, mas sua disponibilidade permanece limitada em decorrência de seu alto custo.51
Em relação a outras doenças negligenciadas, a investigação científica no contexto da Pso é escassa. Estudos sugeriram que o uso de anti‐TNF pode ser fator de risco para hanseníase ou reativação de infecções subclínicas, o que possivelmente poderia ser explicado por uma interferência na formação de granulomas.52–54 A literatura também cita leishmaniose, especialmente casos viscerais, como potenciais complicações infecciosas da imunossupressão com anti‐TNF.55,56 Na ausência de diretrizes específicas, determinar o rastreamento apropriado e as estratégias terapêuticas pode ser um desafio.
Fraca adesão ao tratamento e conhecimento da doençaUm estudo argentino destacou a automedicação e a não adesão como barreiras significantes ao tratamento da Pso na América Latina, estimando‐as em 82% dos pacientes.28 Do mesmo modo, Zhang et al. relataram que 82,4% dos pacientes chineses descontinuaram os medicamentos prescritos pelo médico ou recorreram à automedicação.57 Por outro lado, uma revisão britânica descobriu que até 40% dos pacientes não usam medicamentos conforme as instruções,58 enquanto um estudo turco observou uma taxa de não adesão significantemente menor, de 44,8%.59
Na Argentina, 86% dos pacientes afirmaram não ter sido informados sobre os riscos de mudanças de tratamento não supervisionadas;28 além disso, 24% acreditavam que a Pso poderia ser curada. A falta de conhecimento sobre a doença também foi relatada na China,57 onde uma porcentagem maior de pacientes no grupo de automedicação esperava cura completa (68,9 vs. 57,9%; p<0,001), e a duração da consulta estava relacionada à taxa de adesão ao tratamento.
A elevada procura por cuidados médicos resulta frequentemente em interações mais curtas entre médico e paciente, especialmente em ambientes com poucos recursos. Os médicos podem não alocar tempo suficiente para educar os pacientes sobre sua condição, especificamente sobre a natureza controlável mas incurável da Pso, o que leva a expectativas de tratamento não satisfeitas e, subsequentemente, à fraca adesão. Isso é especialmente importante porque maior satisfação com o tratamento da Pso foi estatisticamente associada a maior adesão.59
Diagnóstico tardioParece haver uma necessidade premente de melhorar o treinamento dermatológico para CG.29 No México, 61% dos pacientes consultaram inicialmente um médico de família, mas 89% foram finalmente diagnosticados por um dermatologista. Isso contrasta com a situação no Reino Unido, onde 82% dos pacientes com Pso recebem tratamento exclusivamente no ambiente de cuidados de saúde primários.60
Griffiths et al. estudaram o impacto das diretrizes de tratamento nos encaminhamentos apropriados para atendimento especializado no Reino Unido.61 Eles encontraram melhora significante nos encaminhamentos adequados no grupo de intervenção (78%) em comparação com o grupo controle (59%; diferença=19,1%; Odds Ratio [OR=2,47], IC95% 1,31–4,68; CCI=0). Na Austrália, os CG encontram casos de Pso aproximadamente apenas dez vezes durante seu período de treinamento de três anos,62 o que não é o suficiente para que se familiarizem adequadamente com uma doença tão complexa. Um estudo português relatou que os CG tendem a não ver a Pso como doença sistêmica.63
A implementação das diretrizes de Pso direcionadas aos cuidados de saúde primários na América Latina poderia potencialmente reduzir o tempo até o diagnóstico e equipar melhor os CG para o manejo da doença, bem como aliviar a carga de trabalho nos centros terciários. Alternativa custo‐efetiva seria a difusão da telemedicina. Dessa maneira, os prestadores de cuidados primários teriam a opção, quando necessário, de consultar um dermatologista treinado sobre as opções de tratamento e a necessidade de encaminhamento para um centro terciário. Essa abordagem pode levar a tratamento mais oportuno e eficaz para pacientes com Pso, melhorando assim sua qualidade de vida em geral.
Produtividade no trabalho e status socioeconômicoAo contrário da maioria dos estudos publicados em outras regiões,64–68 a literatura latino‐americana não encontrou diferença estatisticamente significante em relação à produtividade no trabalho entre os níveis de gravidade da Pso.15,31 Essa discrepância, no entanto, pode ser atribuída ao pequeno tamanho das amostras desses estudos.
O estudo de Lopes et al. foi o único que utilizou o Work Productivity and Activity Impairment Questionnaire para avaliar a perda de produtividade no trabalho.30 A descoberta da predominância de presenteísmo está alinhada com os dados de um estudo multinacional conduzido por Villacorta et al.64 Vale ressaltar que as taxas de absenteísmo e presenteísmo descobertas em ambos os estudos foram semelhantes, mas o escore médio do Dermatology Life‐Quality Index (DLQI) em Lopes et al. foi maior do que em Villacorta et al. (média=7,2 [DP=6,8]; 5,1 [IC 95% 4,8–5,4]). Isso poderia ser um indicador positivo, uma vez que os escores do DLQI foram associados a pior comprometimento no trabalho.64,69 Além disso, Lopes et al. incluíram apenas pacientes com Pso moderada ou grave, enquanto Villacorta et al. avaliaram 32,6% dos pacientes com Pso leve.30,64 Ademais, a taxa de desemprego (12,2%) foi comparável à taxa de desemprego geral da população brasileira durante o mesmo período (12,7%).70
Bronckers et al., por outro lado, encontraram taxas mais altas de absenteísmo em comparação ao presenteísmo [média (DP) 50% (46%); 20% (60%), respectivamente].71 Isso pode ser parcialmente explicado pela elevada percentagem de mulheres na amostra (70,7%).71,72 Lopes et al. encontraram índice médio de perda de produtividade de 4,7% (DP=5,4%) no Work Limitations Questionnaire, valor inferior ao relatado por Schmitt et al. (média de 7,6% [DP=9,1%]).30,69 No geral, o prejuízo no trabalho causado pela Pso na América Latina parece ser semelhante ao de outras regiões.
Adesão às diretrizes de tratamentoMazzuoccoloa et al. relataram uso de MTX abaixo do ideal por 76% dos dermatologistas na Argentina.32 Resultados comparáveis foram encontrados na Holanda, onde 11% dos dermatologistas não estavam bem informados sobre as diretrizes. Embora 80% dos dermatologistas holandeses usem MTX na prática clínica, apenas 52% aderem às diretrizes de tratamento ao prescrevê‐lo.73 Em uma pesquisa global sobre o uso de MTX em 63 países (38% europeus; 22,7% sul‐americanos), aproximadamente 40% dos dermatologistas prescreveram doses de manutenção de MTX insuficientes,74 e 32,4% relataram nunca ou raramente aumentarem as doses de MTX em pacientes com resposta inicial inadequada.74 Isso poderia explicar por que 30% dos dermatologistas argentinos consideram o MTX ineficaz.32
Em relação ao rastreio pré‐tratamento, a frequência relativamente elevada de radiografias de tórax e testes de HIV e PPD observada na África deve‐se provavelmente à elevada prevalência de HIV e TB na região.74 Isso também pode explicar as altas taxas de testes positivos de triagem de TB pré‐IMB relatadas na Argentina.32
As limitações da atual revisão sistemática sobre Pso na América Latina decorrem principalmente da disponibilidade limitada e da baixa qualidade dos estudos sobre o assunto, com a maioria das pesquisas concentrada no Brasil, dificultando potencialmente a generalização dos resultados para toda a região. O pequeno tamanho das amostras em alguns estudos, as diferenças metodológicas e a variabilidade na adesão às diretrizes de tratamento podem impactar ainda mais a confiabilidade e a consistência dos resultados. Além disso, a falta de dados sobre aspectos específicos, como a relação com doenças negligenciadas, limita as conclusões que podem ser obtidas nessas áreas. Apesar dessas limitações, a presente revisão oferece informações valiosas e destaca áreas onde são necessárias mais pesquisas e melhorias.
ConclusãoNa América Latina, onde o acesso aos cuidados de saúde e às opções de tratamento pode ser limitado, a incidência Pso pode ser substancial. Isso enfatiza a necessidade crítica de diagnóstico precoce, tratamento eficaz e manejo abrangente da Pso para melhorar a qualidade de vida e o bem‐estar geral dos indivíduos afetados.
Apesar dos recentes avanços na acessibilidade ao tratamento da Pso, particularmente à luz das políticas de saúde relativas aos IMB, ainda há falta de dados objetivos para avaliar seu impacto na América Latina. Numa região onde prevalecem doenças negligenciadas e recursos limitados, é crucial oferecer formação dermatológica aos prestadores de cuidados primários. Essa abordagem encorajaria práticas padronizadas e permitiria um diagnóstico mais rápido da Pso.
Entretanto, a maioria dos estudos incluídos nesta revisão é de qualidade moderada a baixa, obrigando a uma interpretação cautelosa de seus resultados. Além disso, extrapolar as conclusões relativas a alguns países para abranger todo o continente é inerentemente um desafio. A fim de desenvolver uma compreensão mais precisa do estado atual do tratamento da Pso na América Latina, é essencial realizar mais estudos bem planejados em vários países. Esses estudos serviriam para preencher as lacunas de conhecimento existentes e orientar futuras melhorias no atendimento aos pacientes, beneficiando, em última análise, as pessoas afetadas pela Pso na região.
Suporte financeiroNenhum.
Contribuição dos autoresBruna Ossanai Schoenardie: Concepção e planejamento do estudo; obtenção dos dados ou análise e interpretação dos dados; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Rodrigo Oliveira Almeida: Obtenção dos dados, ou análise e interpretação dos dados; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Thaísa Hanemann: Obtenção dos dados, ou análise e interpretação dos dados; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Arthur Ossanai Schoenardie: Obtenção dos dados, ou análise e interpretação dos dados; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação da versão final do manuscrito.
André Lucas Ribeiro: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Juliana Catucci Boza: Concepção e planejamento do estudo; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Ossanai Schoenardie B, Oliveira Almeida R, Hanemann T, Schoenardie AO, Ribeiro AL, Boza JC. Unmet needs in the management of psoriasis in Latin America: a systematic review. An Bras Dermatol. 2024;99:244–58.
Trabalho realizado no Hospital de Clínicas de Porto Alegre, Porto Alegre, RS, Brasil.