O tumor glômico (TG) é neoplasia benigna que se origina de células mesenquimais. Apresenta‐se com sensibilidade e alodinia ao frio nos dedos, principalmente na região subungueal. Existem poucos estudos que investigaram o mecanismo da dor.
ObjetivosAnalisar as características clinicopatológicas do TG e identificar nele a expressão de IL‐1β, IL‐6 e CGRP, além de explorar o possível mecanismo da dor.
MétodosOs dados clínicos e patológicos de 60 pacientes com TG foram analisados retrospectivamente. Microensaios teciduais e avaliação imuno‐histoquímica foram utilizados para medir a expressão de IL‐1β, IL‐6 e CGRP.
ResultadosO TG é mais comum em mulheres, e a proporção entre homens e mulheres foi próxima de 1:2, principalmente em pessoas de meia‐idade. Ocorre frequentemente nas pontas dos dedos das mãos, especialmente nos polegares. Os pacientes geralmente apresentam dor espontânea, sensibilidade e hipersensibilidade ao frio. Ambos os mediadores da dor IL‐1β e IL‐6 foram altamente expressos em células de TG de pacientes com e sem hipersensibilidade ao frio, embora o CGRP não tenha sido expresso em TG.
Limitações do estudoPequeno tamanho amostral; mais pesquisas são necessárias para explorar o mecanismo específico.
ConclusõesIL‐1β e IL‐6 foram altamente expressos em células de TG, sugerindo que tenham certo papel nociceptivo no TG. Nos quatro pacientes com intolerância ao frio, a intensidade da expressão de IL‐1β e IL‐6 também foi forte, sugerindo que podem não desempenhar papel na hipersensibilidade ao frio. No entanto, como haviam apenas quatro pacientes com intolerância ao frio, é necessário realizar pesquisas mais aprofundadas utilizando amostra maior. O papel específico do CGRP no TG ainda não foi encontrado.
O tumor glômico (TG) é neoplasia benigna de origem mesenquimal que surge do corpo glômico. Em geral. ocorre nos dedos, especialmente no leito ungueal.1 O TG é frequentemente diagnosticado incorretamente, causando dor e atraso no tratamento. Alodinia, sensibilidade localizada e hipersensibilidade ao frio são a chave para diagnosticar o TG. No entanto, na prática, os pacientes nem sempre apresentam esses sintomas simultaneamente. Embora estudos anteriores tenham demonstrado que fibras nervosas, mastócitos e ciclooxigenase‐2 são abundantes no TG,2–4 a compreensão dos mecanismos da dor ainda é incompleta. O presente estudo realizou análise retrospectiva de série de casos de 60 pacientes com TG. Foram avaliadas as expressões de interleucina‐1 beta (IL‐1β), interleucina‐6 (IL‐6) e peptídio relacionado ao gene da calcitonina (CGRP, do inglês calcitonin gene related peptide) em amostras de TG, e seu possível papel no TG foi analisado.
Materiais e métodosColeta de amostras de tumor glômicoForam coletados os dados de 60 casos de TG, todos atendidos no General Hospital of Northern Theater Command no período de 2002 a 2019 e diagnosticados com TG por meio de exame anatomopatológico de rotina (coloração com Hematoxilina & eosina). Os dados clínicos foram recuperados do registro eletrônico de casos. Todos os casos foram reconfirmados por dois dermatopatologistas. Existem três tipos de TG com base nas proporções de células glômicas, estruturas vasculares e músculo liso: TG sólido, glomangioma e glomangiomioma.5
Microensaios teciduais (TMA do inglês tissue microarray)Blocos de parafina e lâminas histológicas das 60 amostras de TG foram coletados e avaliados microscopicamente. Um ponto de 1–2mm dentro de cada fragmento tecidual emblocado foi selecionado, e uma broca de tecido semiautomática foi usada para isolar um cilindro de tecido (1–2mm de diâmetro) ou no centro do bloco doador, onde as células do TG estavam predominantemente localizadas. Esses cilindros isolados foram, então, inseridas em um novo bloco de parafina para TMA. O TMA (3μm de espessura) foi fatiado com um sistema automático de cortes em parafina. A análise imuno‐histoquímica foi realizada nesses cortes histológicos.
ImunomarcaçãoTodas as amostras patológicas foram seccionadas. Os cortes histológicos foram desparafinizados e reidratados em xileno e bateria de álcoois. Os cortes histológicos foram, então, bloqueados com albumina de soro bovino a 2%, incubadas com anticorpo IL‐1β policlonal de coelho (China, Servicebio, 16806‐1‐AP) em diluição de 1:200; pAb de coelho anti‐IL‐6 (China, Servicebio, Gb1117) em diluição de 1:800; anticorpo anti‐CGRP (China, Servicebio, 16630‐1‐AP) em diluição de 1:200 por duas horas, seguido de incubação com anticorpos secundários biotinilados por 90 min e depois estreptavidina ligada à peroxidase de rábano. Posteriormente, 3‐amino‐9‐etilcarbazol foi adicionado gota a gota durante 3–5 minutos, e os cortes foram contracorados com hematoxilina.
Avaliação de amostraOs resultados da avaliação imuno‐histoquímica com IL‐1β, IL‐6 e CGRP no TG foram registrados para determinar as diferenças entre os grupos. As três imunomarcações foram digitalizadas eletronicamente e analisadas utilizando CaseViewer. A imunomarcão para IL‐1β e IL‐6 foi citoplasmática. Os resultados foram expressos combinando a intensidade e a porcentagem da imunomarcação, como descrito.6 A intensidade da imunomarcação foi pontuada da seguinte maneira: 0 ‐ sem marcação; 1 ‐ marcação fraca; 2 ‐ marcação média; e 3 ‐ marcação forte. A porcentagem de imunomarcação foi pontuada como se segue: ponto 0: 0% a 5% do total de células foram marcadas; 1 ponto: marcação de 6% a 25%; 2 pontos: marcação de 26% a 50%; 3 pontos: 51% a 75% de marcação; e 4 pontos: >75%. Os resultados foram apresentados com base no produto da intensidade pela porcentagem da marcação: 0 ‐ negativo (–); 1 a 7 – fracamente positivo (+); 8 a 10 – positividade média (++); e 11 a 12 – fortemente positivo (+++).
Análise estatísticaA análise foi realizada utilizando o programa IBM SPSS 26 (SPSS Inc., Chicago, IL). Os testes estatísticos incluíram o teste U de Mann‐Whitney. O valor de p<0,05 foi necessário para que os resultados fossem considerados estatisticamente significantes.
ResultadosCaracterísticas clinicopatológicas de 60 TGs (tabela 1)Histopatologia do TGResumo dos achados clinicopatológicos em 60 pacientes com tumor glômico
| Características | Valor |
|---|---|
| Sexo, n | |
| Masculino:Feminino | 21:39 |
| Idade ao diagnóstico, anos | |
| Média (variação) | 40 (8‐92) |
| Duração, anos | |
| Média (variação) | 6,31 (10 dias‐30 anos) |
| Localização, n | |
| Dígito: extradígito | 38:22 |
| Mãos e artelhos | 40 |
| Braços e pernas | 13 |
| Tronco | 6 |
| Face | 1 |
| Mão esquerda: mão direita | 21:17 |
| Polegar | 8:6 |
| Indicador | 2:3 |
| Dedo médio | 4:3 |
| Indicador | 3:2 |
| Anelar | 3:2 |
| Palma da mão | 1:1 |
| Subungueal: pele | 21:39 |
| Tamanho, cm | |
| Média (variação) | 0,79 (0,1‐3,3) |
| Sintoma, n | |
| Dor (intolerância ao frio) | 58 (4) |
| Indolor | 2 |
| Patologia, n | |
| Tumor glômico sólido | 33 |
| Glomangioma | 27 |
| Glomangiomioma | 0 |
| Diagnóstico inicial, n (%) | |
| Tumor glômico | 38 (63,3%) |
| Tumor vascular | 8 (13,3%) |
| Cisto | 6 (10%) |
| Edema | 3 (5%) |
| Granuloma piogênico | 2 (3,3%) |
| Fibroma | 2 (3,3%) |
| Corpo estranho | 1 (1,7%) |
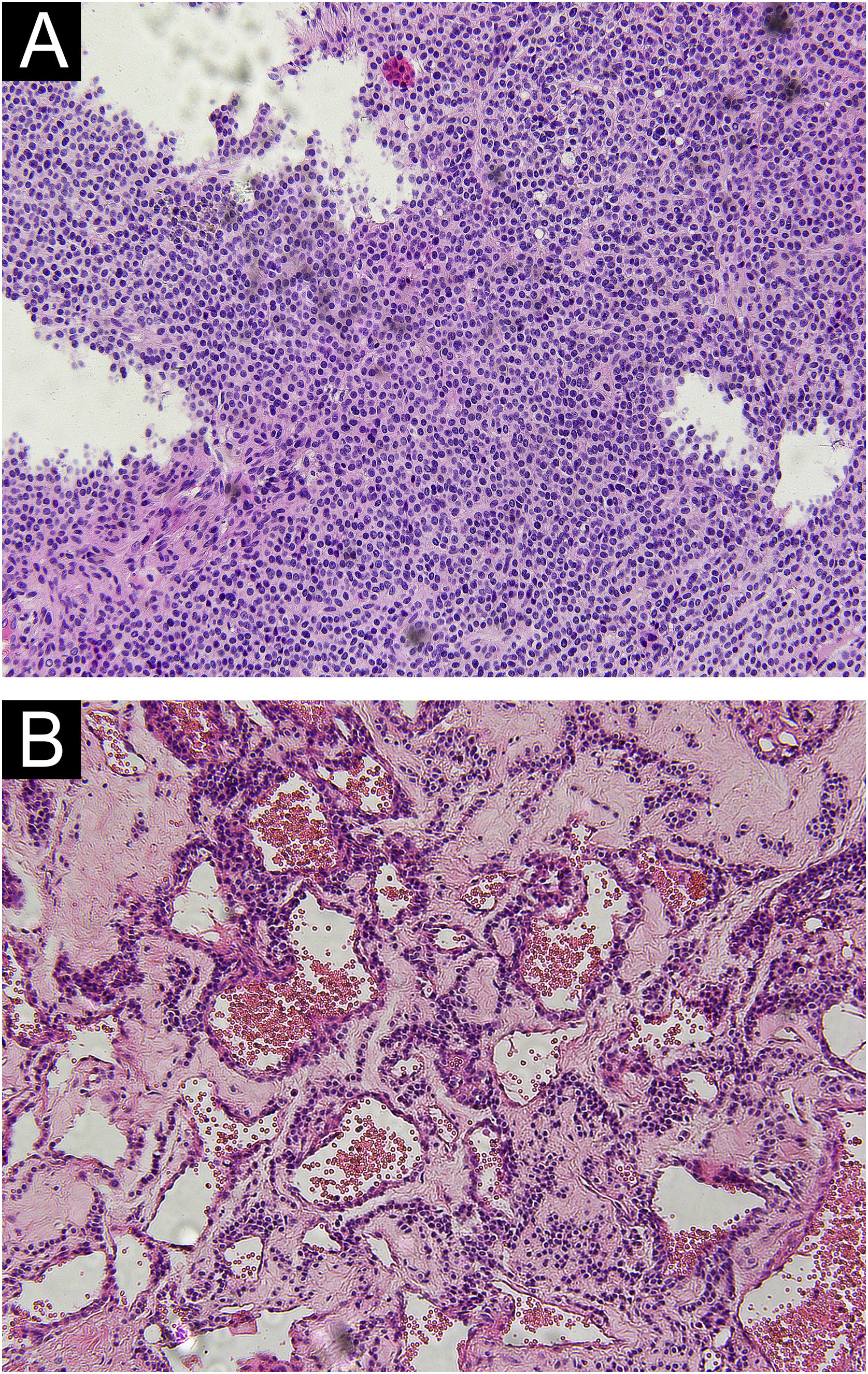
Todos os tipos histopatológicos de TG contêm células glômicas, lúmens vasculares e células musculares lisas vasculares, mas a proporção é diferente. O TG sólido é composto principalmente de células glômicas; o glomangioma é composto de células glômicas que circundam um grande número de vasos sanguíneos; e um grande número de células musculares lisas vasculares pode ser visto no glomangiomioma. No presente estudo, apenas dois tipos histopatológicos de TG sólido e glomangioma foram encontrados (fig. 1).
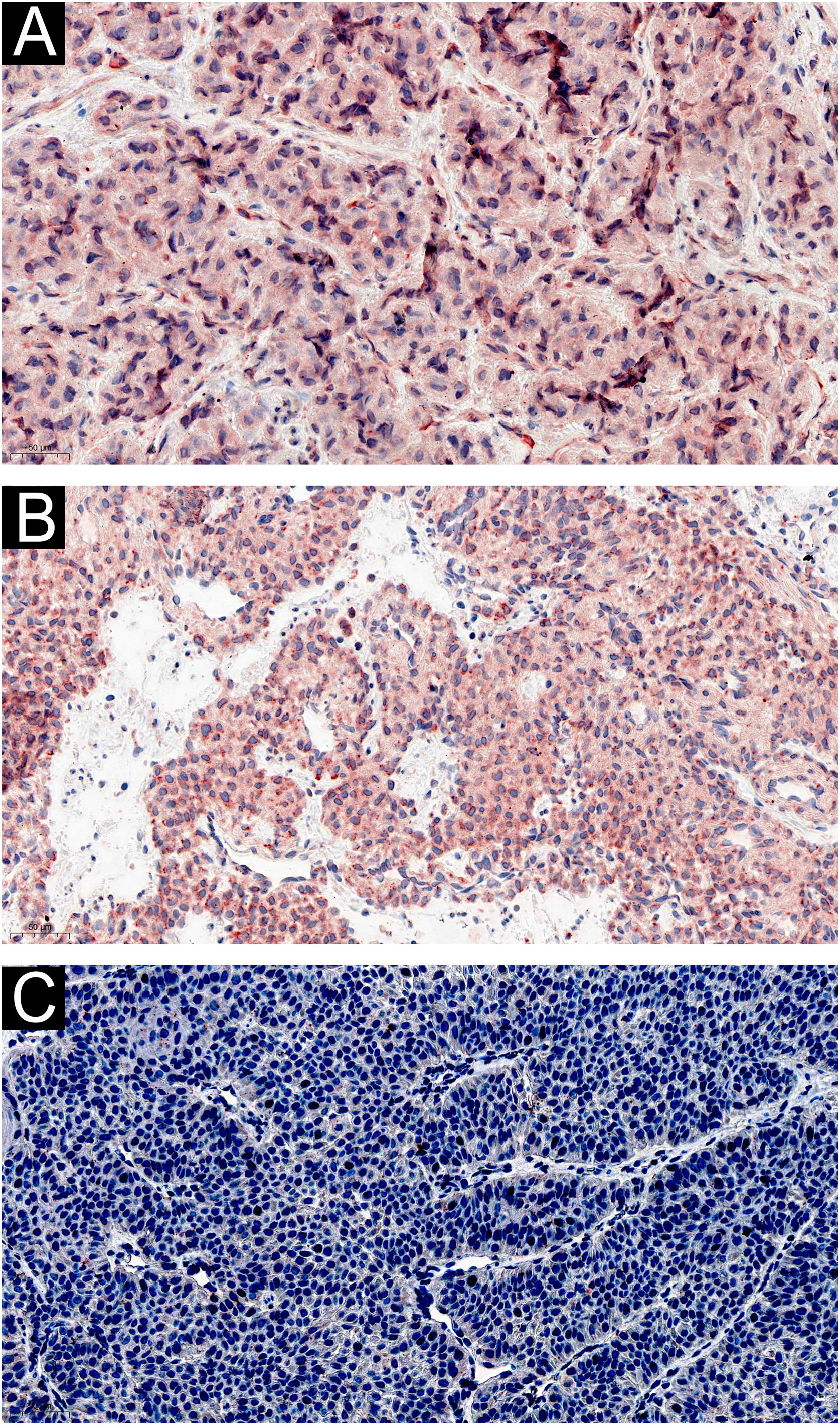
Expressão de IL‐1β, IL‐6 e CGRP em TGImuno‐histoquimicamente, as células tumorais em todos os 60 casos apresentaram imunomarcação difusa para IL‐1β e IL‐6 (fig. 2A‐B). Não houve diferença perceptível na intensidade da marcação entre IL‐1β e IL‐6 (Z=‐0,750, p=0,492). Não houve diferença na expressão de IL‐1β nos diferentes tipos histopatológicos de TG (Z=–1,567, p=0,155), nem de IL‐6 (Z=–0,685, p=0,452). CGRP não foi expresso em TG (fig. 2C).
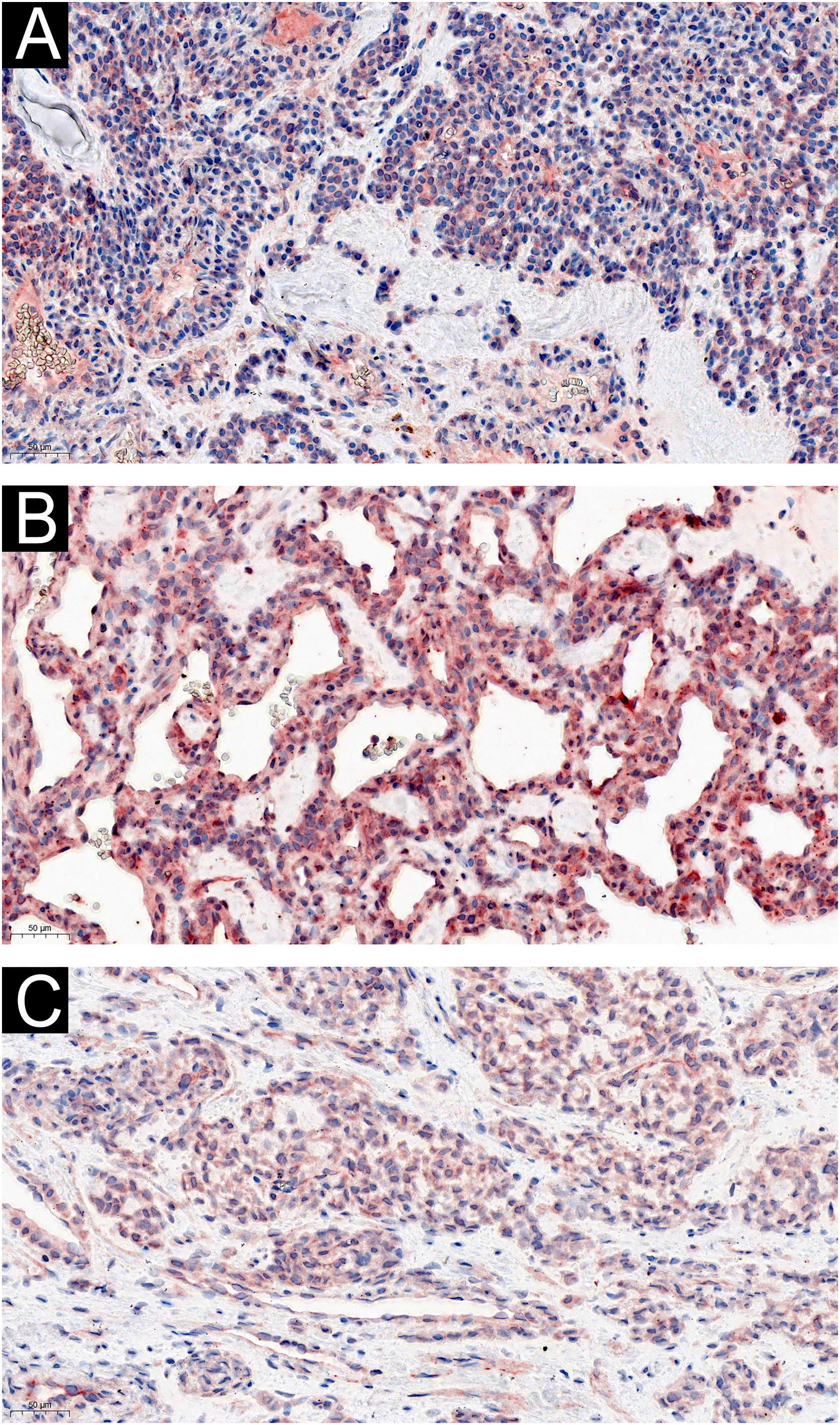
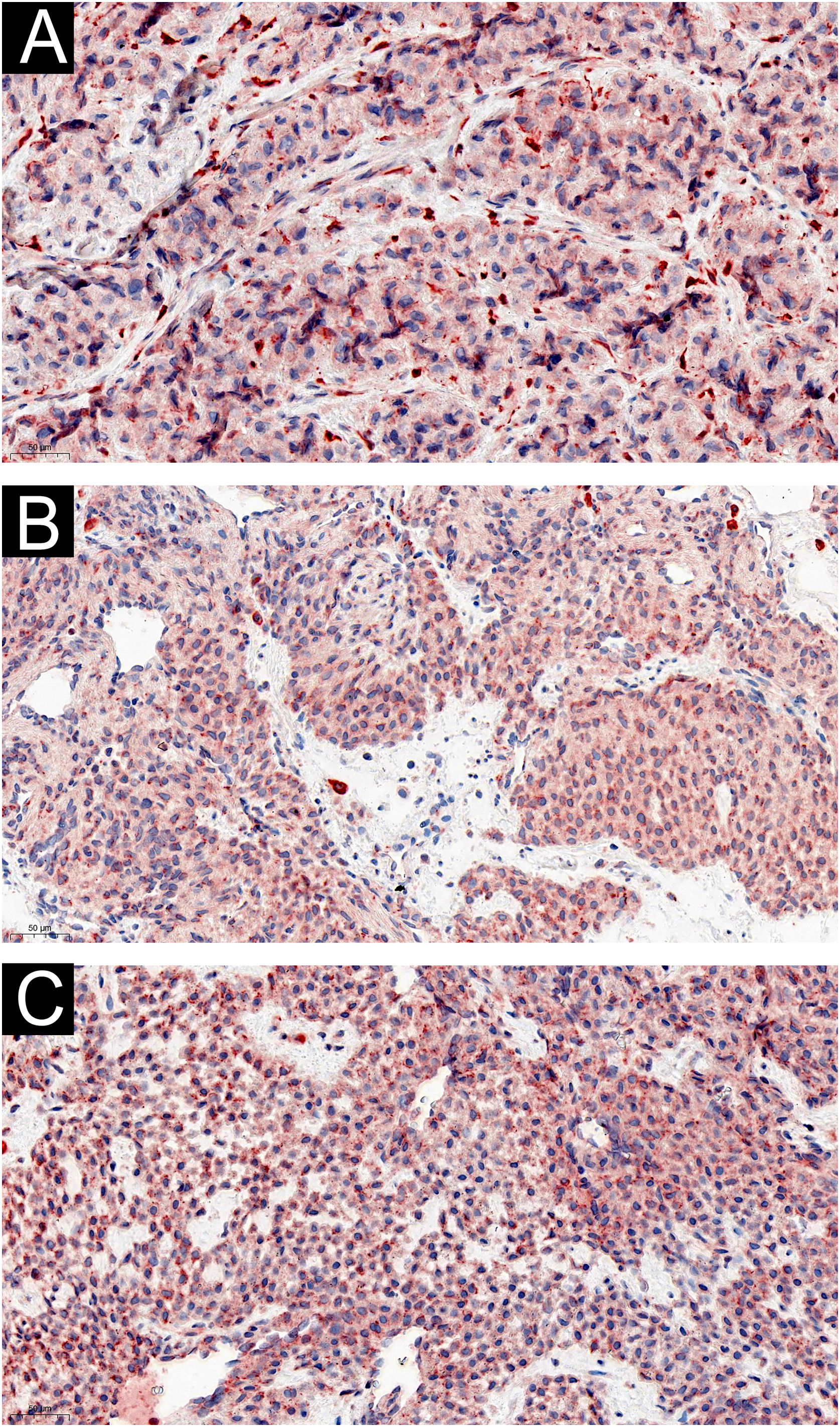
Dois dos 60 pacientes com TG eram assintomáticos, e a expressão de IL‐1β (fig. 3) e IL‐6 (fig. 4) foi moderada ou fortemente positiva. Quatro pacientes que se queixaram de sensibilidade ao frio apresentaram coloração difusa fortemente positiva para IL‐1β (fig. 3) e IL‐6 (fig. 4). A expressão de IL‐1β não diferiu entre os casos que apresentavam dor, sem ou com intolerância ao frio (Z=–0,989, p=0,580), nem a da IL‐6 (Z=–0,878, p=0,609).
Os estudos atuais sobre TG foram principalmente relatos de casos. O presente estudo descreve as características clinicopatológicas por meio de um estudo retrospectivo de série de casos de 60 TG. Havia mais pacientes do sexo feminino, e a proporção entre homens e mulheres foi próxima de 1:2 (21:39), o que foi consistente com pesquisas anteriores.7 O TG é mais comum em pessoas jovens e de meia‐idade, e essas geralmente apresentam maior duração da doença. Todos os pacientes deste estudo apresentavam uma única lesão. Mais da metade dos 60 casos eram localizados nos dedos, especialmente nos polegares. A falange distal é a localização dolorosa mais comum.8 O corpo glômico é uma estrutura neurovascular termorreguladora. Assim, quando a temperatura muda, a pressão intracapsular do tumor muda e causa dor. Clinicamente, o TG pode ocorrer em outros órgãos, como estômago,9 rim,10 brônquios segmentares11 por exemplo. Embora raros, o número de relatos tem crescido nos últimos anos. A etiologia do TG é desconhecida, mas alguns pesquisadores indicaram que pacientes com neurofibromatose tipo 1 frequentemente apresentam TG, e mutações do gene da neurofibromatose tipo 1 em ambos os alelos foram encontradas nas células glômicas.12 Não houve casos de neurofibromatose no presente estudo e não foram encontradas outras doenças específicas concomitantes. O tamanho médio do tumor é de 0,79cm, o comprimento máximo do tumor é de 3cm. O TG costuma ser benigno e não cresce indefinidamente. Cinquenta e oito casos apresentaram dor, e apenas dois casos eram assintomáticos; isso pode ser decorrente de diferenças individuais, pois cada pessoa tem uma percepção e limiar de dor diferentes. A maioria dos casos foi classificada histopatologicamente como TG sólido e glomangioma. Não havia glomangiomioma, o que foi consistente com estudo anterior.13 O diagnóstico inicial incluiu TG, tumor vascular, cistos e edema, e a taxa de diagnósticos corretos foi de 63,3%.
Sensibilidade localizada em algum ponto, dor intensa e hipersensibilidade ao frio são manifestações clínicas típicas de TG, embora possam não estar presentes ao mesmo tempo. Poucas pesquisas exploraram o mecanismo da dor no TG.2,14 A tríade de dor típica do TG é semelhante à da dor neuropática: dor espontânea, hiperalgesia e dor evocada (particularmente ao toque leve e ao frio).15 Os autores acreditam que a dor causada pelo TG seja neuropática. O mecanismo da dor neuropática é complexo, envolvendo sensibilização central e periférica. IL‐1β e IL‐6 são dois tipos de mediadores da dor.
Estudos anteriores mostraram que a IL‐1β pode induzir dor e inflamação neuropática,16 e a redução de sua expressão pode reduzir a dor.17 No núcleo vermelho, a IL‐6 medeia a dor neuropática induzindo a produção de TNF‐α e IL‐1β. A IL‐6 induz a produção de IL‐1β por meio das vias JAK2/STAT3 e ERK. A dor neuronal ou a dor após lesão nervosa depende fortemente da transdução de sinal de citocinas (particularmente IL‐1β). A concentração intratecal de IL‐1β correlacionou‐se com o grau de dor mecânica anormal.18 A própria IL‐1β, por meio de autoestimulação em células endoteliais, é o mecanismo de superexpressão sustentada de IL‐1β.19 O TG é formado pela proliferação patológica do corpo glômico, que é composto por células endoteliais; portanto, a IL‐1β pode estar relacionada à patogênese do TG.
A IL‐6 é regulada positivamente em vários modelos pré‐clínicos de dor neuropática, incluindo lesão periférica, dor oncológica e neuropatia periférica diabética. Os níveis de IL‐6 em pacientes com herpes‐zóster estão significantemente aumentados, relacionados à gravidade da dor.20 Após a lesão nervosa, os níveis de IL‐6 estão associados à alodinia em virtude do aumento da síntese de neurônios ou células imunológicas. A IL‐6 interage com neurônios na via da dor e induz a excitabilidade excessiva dos nociceptores.21,22
O neuropeptídio CGRP é o principal neurotransmissor da fibra nervosa classe C, desempenhando papel essencial no início e na manutenção da dor neuropática.23 O presente estudo descobriu que o CGRP não foi expresso no TG, sugerindo que o mesmo pode não desempenhar papel significante na dor relacionada ao TG. A liberação ou expressão de CGRP é um dos fatores‐chave na dor. As concentrações de CGRP no plasma, líquido sinovial e líquido cefalorraquidiano estão elevadas durante a dor,24 mas a expressão de CGRP nos tecidos tem sido pouco estudada e o mecanismo exato não foi totalmente descrito. Não existem estudos sobre a correlação entre CGRP e TG. O papel do CGRP na dor é mais evidente em doenças como a enxaqueca.25 O TG é um pequeno tumor superficial localizado, e o papel específico do CGRP em diferentes doenças pode ser diferente.
Foi demonstrado que a expressão de IL‐1β e IL‐6 era alta nas células de TG, sugerindo que IL‐1β e IL‐6 tenham certo papel nociceptivo no TG. Sensibilidade localizada e dor intensa geralmente coexistem. Nos quatro pacientes com intolerância ao frio, a intensidade da imunomarcação com IL‐1β e IL‐6 também foi forte, sugerindo que podem não desempenhar papel na hipersensibilidade ao frio. No entanto, como havia apenas quatro pacientes com intolerância ao frio, é necessário aprofundar a pesquisa com amostra maior.
ConclusõesO TG é raro porém é mais comum em mulheres. Às vezes, sua aparência é difícil de distinguir do hemangioma, cisto epidérmico e outros tumores. O diagnóstico deve ser baseado nas manifestações clínicas combinadas com o exame histopatológico. A maioria dos pacientes apresenta alodinia, e alguns pacientes apresentam dor induzida pelo frio. IL‐1β e IL‐6 foram expressos em todos os casos de TG, sugerindo que podem participar do mecanismo da dor, mas não da causa da hipersensibilidade ao frio. Ainda não foi observado que o CGRP desempenhe qualquer papel nesse tumor.
Suporte financeiroEste trabalho recebeu suporte financeiro da National Natural Science Foundation of China (21874014).
Contribuição dos autoresYuehua Sun: Obtenção, análise e interpretação dos dados, elaboração e redação do manuscrito, análise estatística.
Ruiqun Qi: Participação efetiva na orientação da pesquisa, concepção e planejamento do estudo.
Ze Wu: Revisão crítica da literatura.
Xiaodong Zhang: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados, revisão crítica do manuscrito.
Jun Niu: Aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Os autores gostariam de agradecer à National Natural Science Foundation of China pelo financiamento deste trabalho. Gostaríamos de agradecer aos revisores anônimos por seus comentários úteis. Agradecemos ao editor associado e aos revisores por seu feedback útil, que aprimorou este artigo.
Como citar este artigo: Sun YH, Qi RQ, Wu Z, Zhang XD, Niu J. The clinicopathologic and immunohistochemical features of 60 cutaneous glomus tumor: a retrospective case series study. An Bras Dermatol. 2024;99:238–43.
Trabalho realizado no Key Laboratory of Immunodermatology, The First Hospital of China Medical University, Shenyang, China