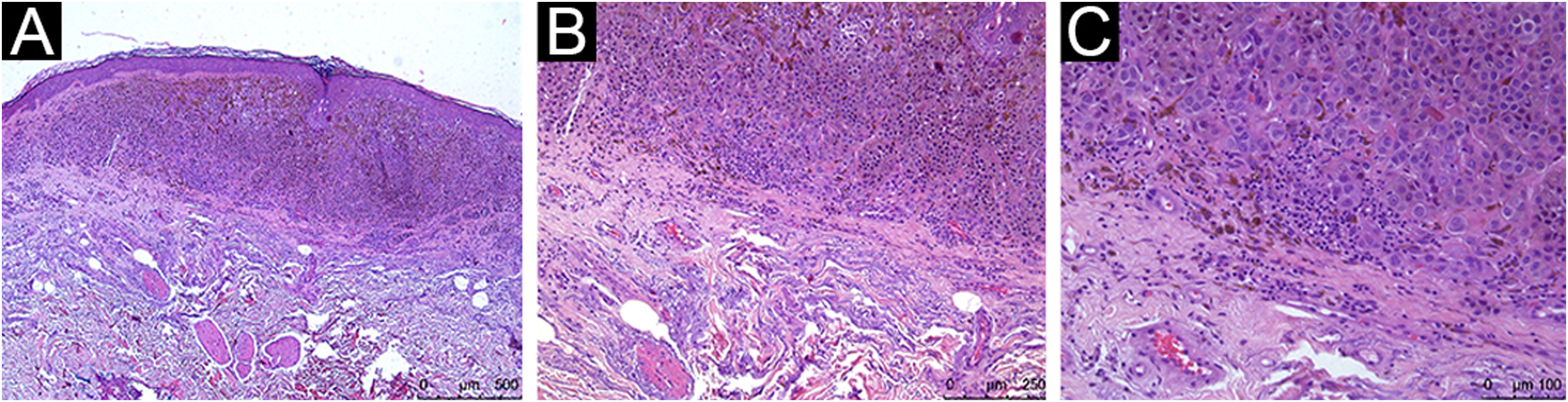
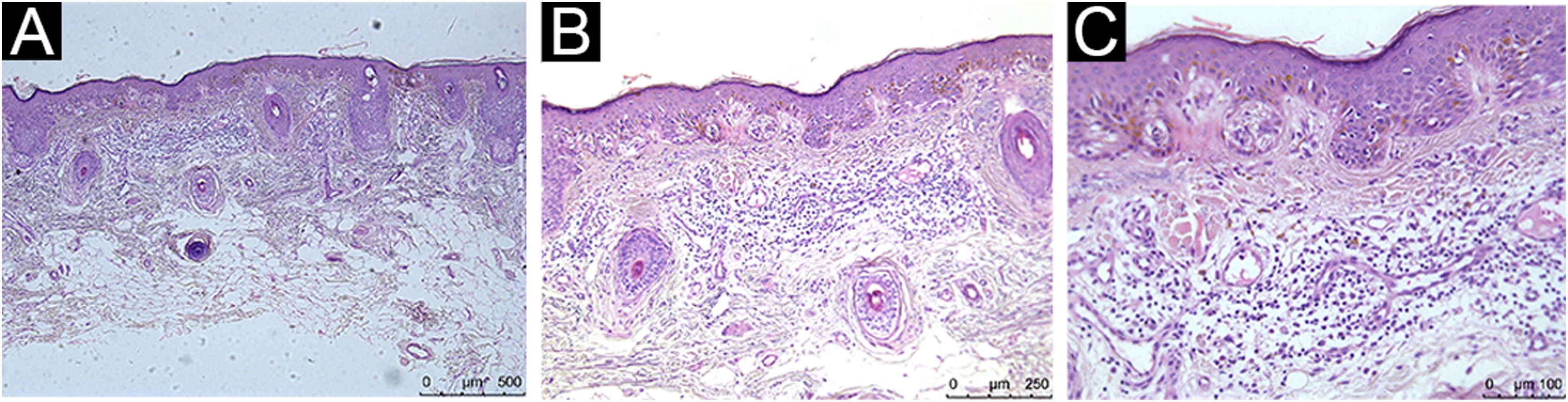
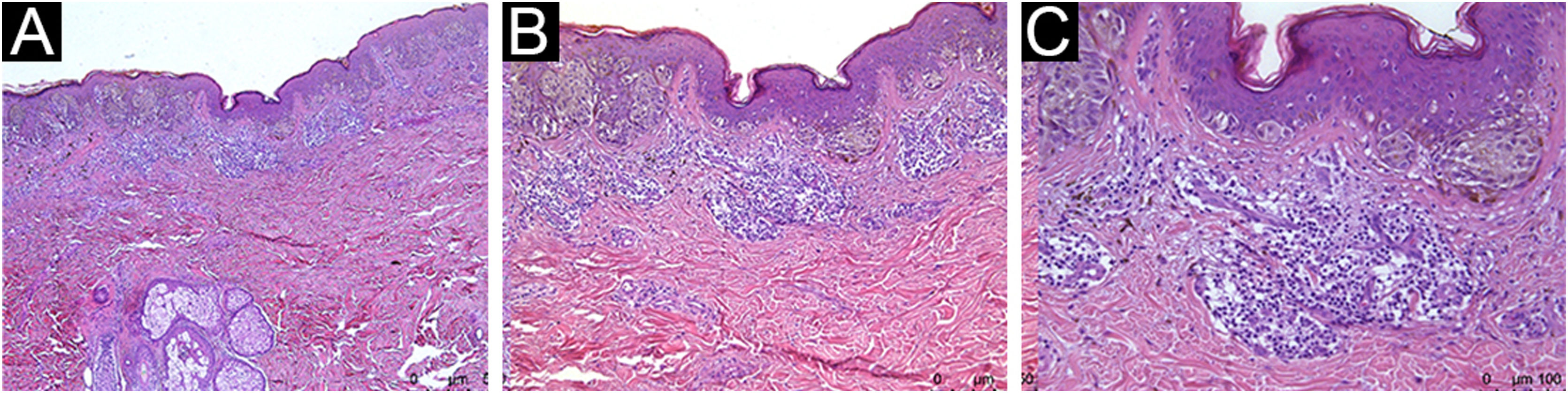
Nos melanomas cutâneos em geral, o infiltrado inflamatório tumoral (IIT) pode proteger de metástases a distância, mas não há consenso quando apenas os melanomas cutâneo primários finos (MCPFs) são considerados.
ObjetivoInvestigar a presença do IIT nos MCPFs e a relação entre o IIT e a ocorrência de metástases.
MétodosEstudo caso‐controle que incluiu 50 pacientes com MCPF, dos quais 22 eram metastáticos (grupo CM) e 28 não metastáticos (grupo CNM). A presença do IIT foi avaliada e, se presente, qualificada em leve, moderada ou acentuada.
ResultadosA idade média foi de 50,7 anos no CM e de 56,2 anos no CNM (p=0,234), e o sexo masculino predominou no CM (63,6%). A espessura média segundo Breslow foi maior no CM quando comparada à observada no CNM (respectivamente 0,8 vs. 0,6mm, p=0,012). Houve ulceração em 22,7% do CM e em 17,9% do CNM (p=0,732). O IIT esteve presente em todos os 50 MCPFs, sendo acentuado e moderado em 67,9% do CNM e em 54,5% do CM (p=0,503). Na análise multivariada, a presença de IIT moderado e acentuado apresentou odds ratio (OR) de 0,57 (intervalo de confiança [IC] de 95% de 0,18‐1,8) e OR ajustado de 0,68 (95% IC 0,13‐3,99).
Limitações do estudoReduzido valor amostral.
ConclusõesO IIT esteve presente em todos os MCPFs (com e sem metástases), e não foi possível comprovar efeito protetor do IIT para o surgimento de metástases.
O melanoma cutâneo primário é a forma mais letal de câncer de pele, correspondendo a aproximadamente 90% das mortes relacionadas a tumores cutâneos.1 A incidência dessa neoplasia maligna continua em ascensão, com cerca de 232.000 novos casos por ano em todo o mundo, representando 7% de todos os cânceres malignos diagnosticados, exceto câncer de pele não melanoma.1
Melanomas cutâneos primários finos (MCPFs) são aqueles com espessura de Breslow ≤ 1mm.2 Estudos mostram que as avaliações dermatológicas periódicas e o uso cada vez mais acurado do dermatoscópio favoreceram a detecção mais precoce de MCPFs e de melanomas in situ.3–6
O índice de mortalidade causado por melanoma é conhecido por estar fortemente associado à espessura da lesão primária (índice de Breslow).2 Atualmente, a maioria dos novos casos de melanoma cutâneo é diagnosticada como MCPFs; aproximadamente 90% são diagnosticados como tumores primários sem evidência de metástases, na abordagem inicial, de acordo com Aitken et al.3 De fato, há diversidade de dados estatísticos quanto à presença de metástases no acompanhamento de MCPFs. Estudos relatam incidências de 3% a 5% e de até 20% de doença a distância em MCPFS.7–9
Esse comportamento biológico ocasiona, consequentemente, cenários com prognósticos desfavoráveis.10,11 Gimotty et al.2 indicam que 15% das mortes por melanoma resultam de metástases de lesões finas. Os fatores específicos para a identificação de pacientes com MCPF em risco para metástases ainda não foram completamente elucidados.12 Muitos detalhes do comportamento biológico e da apresentação histopatológica dos MCPFs metastáticos são parcialmente desconhecidos.
Linfócitos e células mononucleares associados ao câncer humano são descritos há mais de um século.13 Wallace Clark usou o termo “infiltração linfocitária tumoral” para se referir às células imunes presentes no infiltrado inflamatório como parte da resposta do hospedeiro ao câncer.14 Quando se trata de melanoma cutâneo, acredita‐se que a presença dos linfócitos infiltrantes esteja associada a um desfecho favorável ao paciente, embora isso seja um tópico controverso.
Pesquisas sobre a influência da infiltração linfocitária, especificamente nos MCPFs, são escassas, e o fenômeno é incipientemente compreendido. Assim, este estudo investigou a presença do infiltrado inflamatório tumoral (IIT) em MCPFs e a relação entre o IIT e a ocorrência de metástases.
MétodosPopulação e desenho experimentalEste estudo caso‐controle retrospectivo foi realizado em dois centros (um na Itália e outro na região Sul do Brasil), a partir de dados encontrados nos registros dos serviços de patologia do Istituto Dermopatico dell’Immacolata (Roma, Itália) e da Irmandade Santa Casa de Misericórdia (Porto Alegre, Brasil), no período de dois anos (2017‐2019). A avaliação histopatológica foi conduzida pelo serviço de patologia dos dois centros. Todas as lâminas histopatológicas foram novamente avaliadas por um terceiro especialista em patologia (AVH) da Universidade Federal de Ciências da Saúde de Porto Alegre, que definiu o diagnóstico histopatológico final.
As seguintes variáveis clínicas e histopatológicas foram observadas: sexo, topografia do melanoma, sítio de metástases, tempo entre o diagnóstico do melanoma e a detecção de metástases, subtipo de melanoma, índice de Breslow, fase de crescimento, presença de ulceração, regressão tumoral e presença de IIT.
A interpretação do IIT seguiu definições usadas por Fortes et al.:15
- •
Grau 1 (leve): poucos linfócitos infiltram o tumor focalmente ou multifocalmente ao longo ou na base do componente dérmico (≤ 30% do componente estava infiltrado por linfócitos);
- •
Grau 2 (moderado): quantidades moderadas de linfócitos infiltram o tumor focalmente ou multifocalmente, mas não ao longo de toda a base do componente dérmico (31% a 64% do componente estava infiltrado por linfócitos);
- •
Grau 3 (marcado): uma banda contínua de linfócitos estava presente na base ou ao longo do componente dérmico de melanoma (≥ 65% do componente estava infiltrado por linfócitos).
Para fins de análise, foram somados os casos de IIT moderado e marcado, que foram então comparados aos casos de IIT leve.
Aspectos éticosO estudo seguiu os protocolos determinados pelo Comitê de Ética da instituição e foi aprovado sob o número 12447213.8.0000.5345. O Termo de Consentimento Livre e Esclarecido assinado foi obtido dos pacientes ou de seus responsáveis legais. Os autores assinaram um documento concordando em preservar a anonimidade do paciente em relação ao uso de seus dados.
Análise estatísticaOs dados quantitativos foram apresentados como média e desvio padrão. Na presença de assimetria de dados, foi usada a mediana com valores mínimos e máximos. As variáveis categóricas foram contadas e transformadas em porcentagens. O teste t de Student ou seu correspondente não paramétrico (teste de Mann‐Whitney) foi usado para comparação de dados quantitativos. O teste do Qui‐Quadrado ou o teste exato de Fischer foi usado para as proporções, quando necessário. Os ajustes para possíveis efeitos confundidores foram conduzidos por regressão logística. O nível de significância adotado foi p < 0,05. Os dados foram analisados no SPSS, versão 22.0.
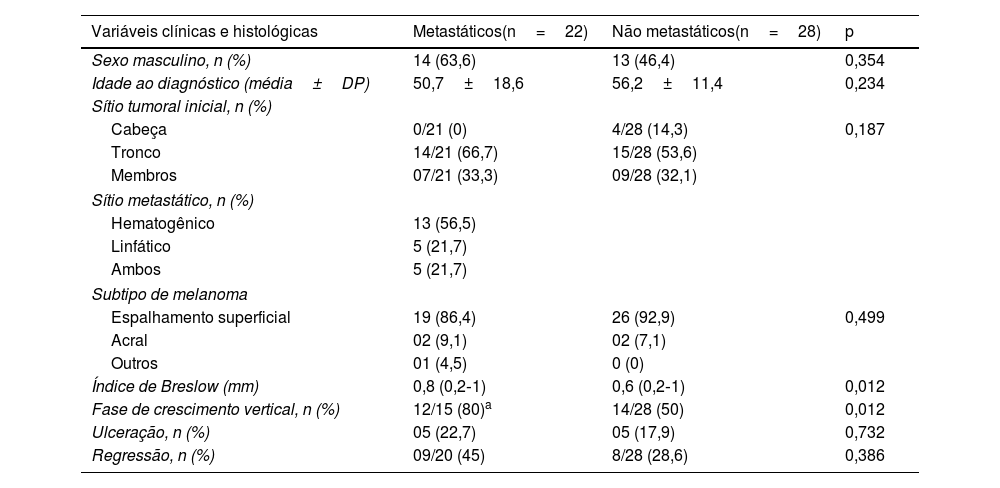
ResultadosEste estudo incluiu 50 pacientes, dos quais 22 pacientes apresentavam MCPF metastático (grupo cutâneo metastático, CM) e 28 pacientes tinham MCPF não metastático (grupo cutâneo não metastático, CNM). A média de idade foi de 50,7 anos no grupo CM e de 56,2 anos no grupo CNM (p=0,234). Homens predominaram no CM, enquanto no CNM o predomínio foi de mulheres (63,6% e 53,6%, respectivamente; p=0,354). O tronco foi o sítio tumoral principal do tumor primário em ambos os grupos (p=0,187), e o sítio principal de metástases foi o hematogênico, acometendo o pulmão em nove casos (39,1%) no CM.
O principal subtipo tumoral foi o espalhamento superficial, observado em 86,4% do CM e em 92,9% do CNM (p=0,499). A espessura média de Breslow foi de 0,8mm e 0,6mm, respectivamente para CM e CNM (p=0,012), e a presença de ulceração foi evidente em 22,7% do CM e em 17,9% do CNM (p=0,732). Regressão histológica foi observada em 45% do CM e em 28,6% do CNM (p=0,386). A tabela 1 apresenta os dados gerais da amostra.
Perfil da amostra de pacientes com melanoma cutâneo primário fino (n=50)
| Variáveis clínicas e histológicas | Metastáticos(n=22) | Não metastáticos(n=28) | p |
|---|---|---|---|
| Sexo masculino, n (%) | 14 (63,6) | 13 (46,4) | 0,354 |
| Idade ao diagnóstico (média±DP) | 50,7±18,6 | 56,2±11,4 | 0,234 |
| Sítio tumoral inicial, n (%) | |||
| Cabeça | 0/21 (0) | 4/28 (14,3) | 0,187 |
| Tronco | 14/21 (66,7) | 15/28 (53,6) | |
| Membros | 07/21 (33,3) | 09/28 (32,1) | |
| Sítio metastático, n (%) | |||
| Hematogênico | 13 (56,5) | ||
| Linfático | 5 (21,7) | ||
| Ambos | 5 (21,7) | ||
| Subtipo de melanoma | |||
| Espalhamento superficial | 19 (86,4) | 26 (92,9) | 0,499 |
| Acral | 02 (9,1) | 02 (7,1) | |
| Outros | 01 (4,5) | 0 (0) | |
| Índice de Breslow (mm) | 0,8 (0,2‐1) | 0,6 (0,2‐1) | 0,012 |
| Fase de crescimento vertical, n (%) | 12/15 (80)a | 14/28 (50) | 0,012 |
| Ulceração, n (%) | 05 (22,7) | 05 (17,9) | 0,732 |
| Regressão, n (%) | 09/20 (45) | 8/28 (28,6) | 0,386 |
Todos os pacientes avaliados apresentaram IIT, com diferentes classificações qualiquantitativas (tabela 2). IIT moderado a marcado esteve presente em 54,5% do CM e em 68% do CNM. Para os dados brutos, obteve‐se um odds ratio (OR) de 0,57 (95% IC 0,18‐1,8; p=0,338). A análise multivariada com ajustes para índice de Breslow, sexo e idade ao diagnóstico do melanoma foi aplicada, e a presença de IIT moderado a marcado apresentou OR de 0,68 (95% IC 0,13‐3,99; p=0,669). As figuras 1, 2 e 3 mostram imagens histopatológicas de IIT leve, moderado e marcado em paciente com MCPF.
Relação entre infiltrado inflamatório tumoral (ITT) e ocorrência de metástases em melanoma cutâneo primário fino (MCPF)
| Característica | MCPF metastático(n=22) | MCPF não metastático(n=28) | Odds ratio (95% IC) |
|---|---|---|---|
| IIT marcado a moderado | 12 (54,5%) | 19 (67,9%) | 0,57 (0,18‐1,80); p=0,338 |
| 0,68 (0,13‐3,99); p=0,669a |
O papel da resposta imune no melanoma cutâneo vem ganhando atenção nos últimos anos, particularmente com o advento de terapias imunomoduladoras para a doença avançada.16 O IIT compreende um grupo heterogêneo de linfócitos que diferem entre si pela habilidade de potencializar o sistema imune em sua capacidade antitumoral.14
Vários estudos correlacionaram melhor sobrevida do melanoma cutâneo com a presença de IIT, em particular os infiltrados densos (marcados). Clark et al.17 demonstraram que a intensidade do IIT é associada à sobrevida livre de doença, e Clemente et al.18 encontraram um índice de sobrevida de 77% após cinco anos em pacientes com IIT denso, comparado com 53% naqueles com IIT não denso e 37% em pacientes sem IIT. Tuthill et al.19 evidenciaram um índice de sobrevida de 100% após cinco anos e 93% após dez anos em pacientes com IIT denso.
No entanto, alguns estudos não revelam associação significante entre IIT e índice de sobrevida em pacientes com melanoma.14,20 Esses resultados podem ser decorrentes da inclusão de dados sobre MCPFs que estão na fase de crescimento radial, visto que, durante essa fase, há pouco embasamento para considerar o IIT um preditor de resultados, ou em virtude da classificação errônea de linfócitos encontrados próximos ao tumor como sendo um IIT.21
No presente estudo, variáveis clínicas e histopatológicas estiveram de acordo com achados de estudos prévios.7,22,23 Houve alta frequência da fase de crescimento vertical em pacientes com metástases em comparação àqueles livres de disseminação maligna (p=0,012), com maior espessura de Breslow naqueles afetados por metástases (p=0,012). Com relação à topografia, a maior ocorrência de melanoma foi no tronco, e o subtipo mais frequentemente encontrado foi o melanoma de espalhamento superficial. O sexo masculino foi o mais comum entre os pacientes metastáticos (63,6%). A presença de ulceração não é achado frequente nos MCPFs, mas, quando presente, altera o estadiamento do câncer de T1a a T1b (de acordo com o American Joint Committee on Cancer).24 Neste estudo, não foi observada diferença na presença de ulceração entre os dois grupos. A regressão tumoral na histopatologia ocorre em 10% a 35% dos melanomas cutâneos.15,25 Neste estudo, ela esteve mais presente em indivíduos metastáticos (45% vs. 28,6%; p=0,386). Um estudo multicêntrico recente26 relatou que a regressão é altamente relacionada com o IIT, mas apenas o IIT está significantemente associado com metástases linfonodais e sobrevida global em pacientes com melanoma (a regressão, isoladamente, não se associou aos desfechos).
Ainda que se admita a baixa incidência de metástases em pacientes com MCPF, quando comparado aos melanomas invasivos, há controvérsias na literatura quanto aos dados. Essas diferenças podem estar relacionadas à fase de diagnóstico do tumor primário ou a outros fatores do indíviduo e das características bioimunológicas de determinados tumores.7,8
Os dados do presente estudo não conseguiram atestar a proteção do IIT para o desenvolvimento de metástases, pois todos os pacientes avaliados, com e sem metástases, apresentavam o infiltrado. Ainda que os pacientes com MCPF não metastático apresentassem mais frequentemente IIT moderado a marcado, quando comparados aos pacientes metastáticos – 67,9% vs. 54,5%; respectivamente – não houve demonstração de significância estatística (OR=0,68; p=0,669).
A presença de IIT em todos os pacientes com melanomas finos (metastáticos ou não) neste estudo pode revelar que o papel das infiltrações linfocíticas seja o de tentar evitar precocemente que o melanoma progrida para a fase de maior invasão, ainda que não consiga evitar a disseminação metastática de alguns poucos MCPFs.
A limitação deste estudo decorre da pequena frequência de ocorrência de casos metastáticos nos MCPFs, com impacto no número amostral reduzido para a realização da avaliação. Por outro lado, o fato de neste estudo terem sido encontradas variáveis já estabelecidas na literatura quanto à caracterização do melanoma, incluindo fatores prognósticos como a espessura de Breslow e a fase de crescimento vertical, demonstra a adequada qualidade dos dados obtidos.
Estudos sobre o IIT são cada vez mais oportunos dada a importância conhecida do sistema imunológico na determinação do comportamento do câncer e o papel emergente da inibição do controle imunológico no tratamento do melanoma. Para resultados mais consistentes, sugere‐se a condução de estudos longitudinais e com maior número amostral. Como perspectiva, a caracterização do imunofenótipo do IIT pode trazer informações relevantes. Por fim, é importante ressaltar que, antes de serem adotados na prática clínica, os biomarcadores tumorais devem ter validação clínica e analítica, além de demonstração de utilidade clínica.27
ConclusãoTodos os pacientes com MCPF apresentaram IIT, e não houve diferenças estatísticas detectáveis entre metastáticos e não metastáticos, ainda que a frequência de IIT marcado a moderado tenha ocorrido, principalmente em MCPF não metastático.
Suporte financeiroNenhum.
Contribuição dos autoresMariele Bevilaqua: Concepção e desenho do estudo; levantamento de dados; análise ou interpretação dos dados; análise estatística, redação do artigo; revisão crítica do conteúdo; aprovação da versão final do manuscrito.
Maria Carolina Rey: Levantamento de dados; análise ou interpretação dos dados; aprovação da versão final do manuscrito.
Gian Carlo Antonini Cappellini: Levantamento de dados; análise ou interpretação dos dados; revisão crítica do conteúdo; aprovação da versão final do manuscrito.
Felice Riccardi: Levantamento de dados; revisão crítica do conteúdo; aprovação da versão final do manuscrito.
Cristina Fortes: Levantamento de dados; revisão crítica do conteúdo; aprovação da versão final do manuscrito.
Adriana Vial Roehe: Levantamento de dados; análise ou interpretação dos dados; revisão crítica do conteúdo; aprovação da versão final do manuscrito.
Renan Rangel Bonamigo: Concepção e desenho do estudo; redação do artigo; revisão crítica do conteúdo; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Agradecemos à Dra. Tatiane Wittee Neetzow Nunes, ao Dr. Jeferson Kawcyk de Oliveira, à Dra. Helena Andrade e a Cristiane Bundchen pelo interesse neste estudo.
Como citar este artigo: Bevilaqua M, Rey MCW, Cappellini GCA, Riccardi F, Fortes C, Roehe AV, et al. Tumoral inflammatory infiltrate does not predict metastases in thin primary cutaneous melanomas. An Bras Dermatol. 2023;98:793–8.
Trabalho realizado no Programa de Pós‐Graduação em Patologia, Universidade Federal de Ciências da Saúde de Porto Alegre, Santa Casa de Misericórdia de Porto Alegre, Porto Alegre, RS, Brasil; Istituto Dermopatico dell’Immacolata, Roma, Itália.