O pênfigo vulgar (PV) e o pênfigo foliáceo (PF) são subtipos de pênfigo com características clínicas e laboratoriais distintas. A transição entre esses dois subtipos foi raramente relatada anteriormente.
MétodosOs dados de pacientes com PV que apresentaram transição clínica e imunosorológica para PF durante o período de seguimento foram avaliados retrospectivamente quanto às suas características demográficas, clínicas e laboratoriais.
ResultadosDe 453 pacientes diagnosticados com PV, 13 (2,9%) pacientes apresentaram transição clínica e imunosorológica de PV para PF. A média de idade dos pacientes com PV no momento do diagnóstico era de 39,8±14,7 (19‐62) anos, dos quais sete (53,8%) eram do sexo feminino. Esses pacientes apresentaram transição clínica e imunosorológica de PV para PF após período que variou de quatro meses a 13 anos (média de 36,2±41 meses). Além das características clínicas típicas do PF, todos os pacientes apresentavam anticorpos antidesmogleína‐1 positivos e antidesmogleína‐3 negativos após a transição clínica, sem nenhum envolvimento da mucosa. Durante o período médio de seguimento de 7,8±5,5 (2‐21) anos após a transição de PV para PF, apenas uma paciente do sexo feminino experimentou retransição para PV, caracterizada por recidiva da doença envolvendo superfícies mucosas com anticorpos antidesmogleína‐3 positivos após período de remissão de cinco anos sem tratamento.
Limitações do estudoEstudo unicêntrico, com desenho de estudo retrospectivo.
ConclusãoA presente série é o maior grupo de pacientes relatados que mostraram transição de PV para PF até o momento, com longo período de seguimento. A razão da negativação dos anticorpos anti‐desmogleína‐3 e a patogênese desse fenômeno ainda não foram elucidadas.
O pênfigo vulgar (PV) e o pênfigo foliáceo (PF) são dois subtipos principais de pênfigo com diferentes características clínicas e histopatológicas, bem como diferentes perfis de anticorpos antidesmogleína (Dsg). O PV difere do PF pelo envolvimento da mucosa e acantólise suprabasal e é subdividido em um tipo predominante na mucosa (PVm) que tem anticorpos anti‐Dsg3 e um subtipo mucocutâneo (PVmc) que apresenta anticorpos anti‐Dsg1 e anti‐Dsg3. Pacientes com PF apresentam envolvimento exclusivo da pele com acantólise subcórnea causada por anticorpos anti‐Dsg1.1,2
A transição entre esses dois subtipos de pênfigo foi raramente relatada nos últimos 30 anos. A transição de PV para PF é rara e as alterações imunológicas subjacentes não são bem compreendidas. Que seja de conhecimento dos autores, há apenas 36 casos de transição de PV para PF descritos na literatura até o momento.2–17 No presente estudo, os autores objetivam descrever as características clínicas e imunosorológicas de 13 pacientes que apresentaram transição de PV para PF durante o curso da doença com longo período de seguimento de até 21 anos após a transição e revisão detalhada da literatura sobre esse tópico.
Materiais e métodosOs prontuários médicos de pacientes diagnosticados com PV entre 1987 e 2021 no Ambulatório de Doenças Bolhosas Autoimunes no centro hospitalar terciário dos autores foram analisados retrospectivamente. O diagnóstico dos pacientes com pênfigo foi estabelecido com base em características clínicas, histopatológicas, imunofluorescência direta (IFD), imunofluorescência indireta (IFI) e ensaio de imunoabsorção enzimática (ELISA) para Dsg, quando disponível. Os dados dos pacientes quanto às informações demográficas, subtipo de PV (PVm e PVmc), tratamentos aplicados antes da transição, tempo de duração da doença até a transição e dados de seguimento após a transição foram registrados. A transição de PV para PF foi definida com base nos achados clínicos e nos níveis de anti‐Dsg por ELISA, quando disponíveis.
O estudo foi aprovado pelo Comitê de Ética institucional e conduzido de acordo com a Declaração de Helsinque (número de aprovação: E‐29624016‐050.99‐358339).
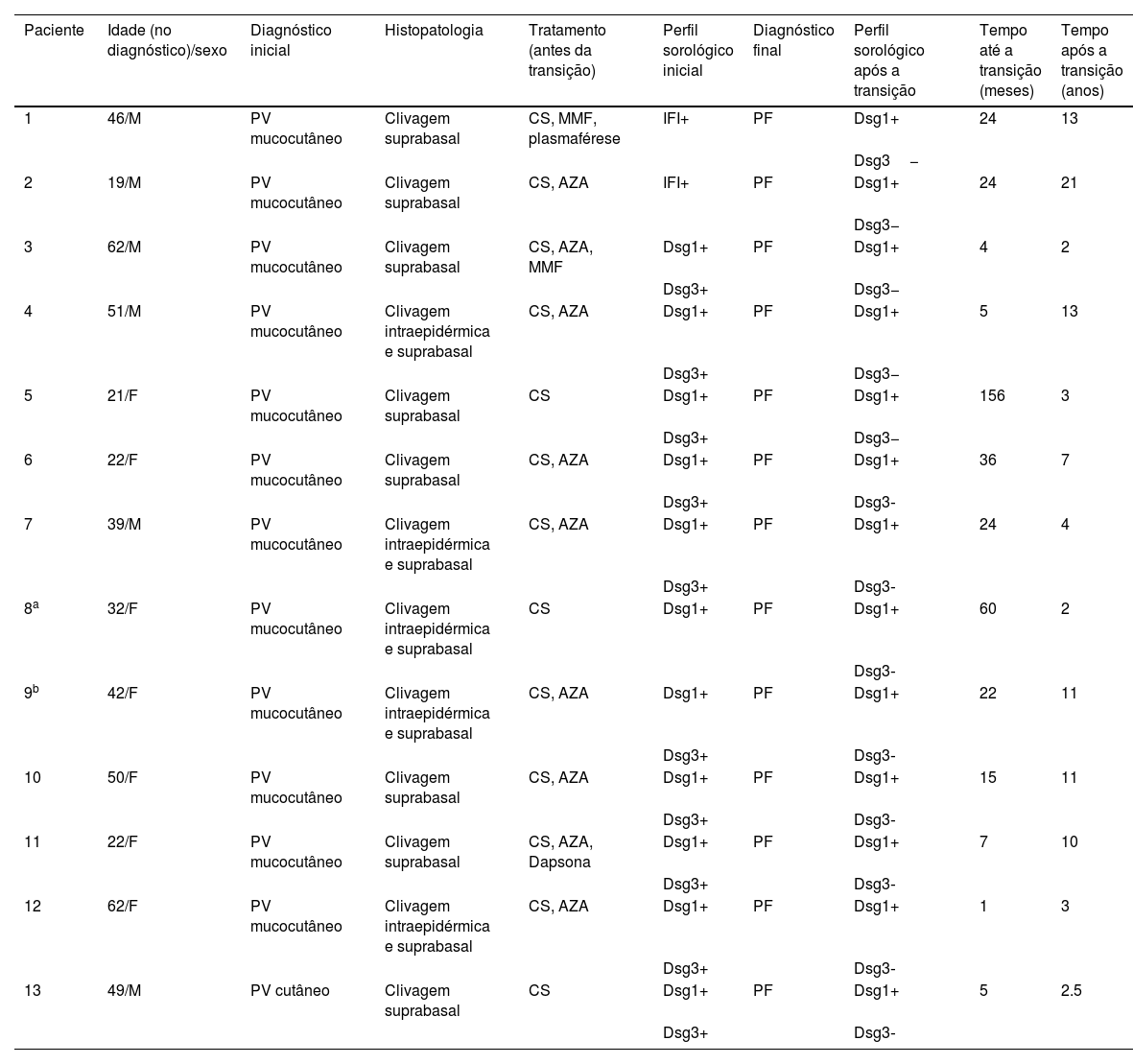
ResultadosDe um total de 453 pacientes diagnosticados com PV no Departamento, 13 (2,9%) pacientes apresentaram transição clínica e imunosorológica de PV para PF durante o período de seguimento. Dados demográficos, clínicos, histopatológicos e características sorológicas desses pacientes são apresentados na tabela 1.
Características demográficas, clínicas, histopatológicas e sorológicas de pacientes com transição de pênfigo vulgar para pênfigo foliáceo
| Paciente | Idade (no diagnóstico)/sexo | Diagnóstico inicial | Histopatologia | Tratamento (antes da transição) | Perfil sorológico inicial | Diagnóstico final | Perfil sorológico após a transição | Tempo até a transição (meses) | Tempo após a transição (anos) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 46/M | PV mucocutâneo | Clivagem suprabasal | CS, MMF, plasmaférese | IFI+ | PF | Dsg1+ | 24 | 13 |
| Dsg3− | |||||||||
| 2 | 19/M | PV mucocutâneo | Clivagem suprabasal | CS, AZA | IFI+ | PF | Dsg1+ | 24 | 21 |
| Dsg3− | |||||||||
| 3 | 62/M | PV mucocutâneo | Clivagem suprabasal | CS, AZA, MMF | Dsg1+ | PF | Dsg1+ | 4 | 2 |
| Dsg3+ | Dsg3− | ||||||||
| 4 | 51/M | PV mucocutâneo | Clivagem intraepidérmica e suprabasal | CS, AZA | Dsg1+ | PF | Dsg1+ | 5 | 13 |
| Dsg3+ | Dsg3− | ||||||||
| 5 | 21/F | PV mucocutâneo | Clivagem suprabasal | CS | Dsg1+ | PF | Dsg1+ | 156 | 3 |
| Dsg3+ | Dsg3− | ||||||||
| 6 | 22/F | PV mucocutâneo | Clivagem suprabasal | CS, AZA | Dsg1+ | PF | Dsg1+ | 36 | 7 |
| Dsg3+ | Dsg3‐ | ||||||||
| 7 | 39/M | PV mucocutâneo | Clivagem intraepidérmica e suprabasal | CS, AZA | Dsg1+ | PF | Dsg1+ | 24 | 4 |
| Dsg3+ | Dsg3‐ | ||||||||
| 8a | 32/F | PV mucocutâneo | Clivagem intraepidérmica e suprabasal | CS | Dsg1+ | PF | Dsg1+ | 60 | 2 |
| Dsg3‐ | |||||||||
| 9b | 42/F | PV mucocutâneo | Clivagem intraepidérmica e suprabasal | CS, AZA | Dsg1+ | PF | Dsg1+ | 22 | 11 |
| Dsg3+ | Dsg3‐ | ||||||||
| 10 | 50/F | PV mucocutâneo | Clivagem suprabasal | CS, AZA | Dsg1+ | PF | Dsg1+ | 15 | 11 |
| Dsg3+ | Dsg3‐ | ||||||||
| 11 | 22/F | PV mucocutâneo | Clivagem suprabasal | CS, AZA, Dapsona | Dsg1+ | PF | Dsg1+ | 7 | 10 |
| Dsg3+ | Dsg3‐ | ||||||||
| 12 | 62/F | PV mucocutâneo | Clivagem intraepidérmica e suprabasal | CS, AZA | Dsg1+ | PF | Dsg1+ | 1 | 3 |
| Dsg3+ | Dsg3‐ | ||||||||
| 13 | 49/M | PV cutâneo | Clivagem suprabasal | CS | Dsg1+ | PF | Dsg1+ | 5 | 2.5 |
| Dsg3+ | Dsg3‐ |
AZA, azatioprina; CS, corticosteroide; Dsg1, anti‐desmogleína‐1 IgG; Dsg3, anti‐desmogleína‐3 IgG; F, feminino; M, masculino; MMF, micofenolato mofetil; PV, pênfigo vulgar; PF, pênfigo foliáceo.
a O paciente 8 tinha níveis positivos de anti‐Dsg1, mas a Dsg3 não pôde ser testada no momento do diagnóstico; o teste de Dsg não foi possível no momento da apresentação dos pacientes 1 e 2.
b O paciente 9 apresentou retransição de PF para PV.
Seis pacientes do sexo masculino e sete do sexo feminino, com média de idade de 39,8±14,7 (19‐62) anos no momento do diagnóstico, foram incluídos neste estudo. Doze pacientes foram diagnosticados com PVmc, e apenas um paciente com PV cutâneo, de acordo com as características clínicas, histopatológicas e imunosorológica (tabela 1). Dez pacientes apresentaram níveis positivos de anti‐Dsg1 e anti‐Dsg3 detectados por ELISA no momento do diagnóstico de PV; um paciente apresentou níveis positivos de Dsg1, mas os níveis de anti‐Dsg3 não puderam ser testados. Entretanto, esse paciente tinha PVmc clinicamente e clivagem suprabasal e intraepidérmica na análise histopatológica. Infelizmente, o teste de Dsg por ELISA não estava disponível no momento da apresentação dos outros dois pacientes que tinham o maior período de seguimento no presente estudo (13 e 21 anos; tabela 1). Durante o seguimento, observou‐se que todos esses pacientes apresentaram clinicamente transição de PV para PF após um período que variou de quatro meses a 13 anos (média: 36,2±41 meses). Além das características clínicas típicas do PF, todos os pacientes apresentaram níveis positivos de anti‐Dsg1 e níveis negativos de anti‐Dsg3 após a transição clínica, sem nenhum envolvimento da mucosa. Durante um período médio de seguimento de 7,8±5,5 (2‐21) anos após a transição de PV para PF, apenas uma paciente do sexo feminino experimentou retransição para PV, caracterizada por recidiva da doença envolvendo superfícies mucosas com níveis de anticorpos anti‐Dsg3 positivos após um período de remissão de cinco anos sem tratamento.
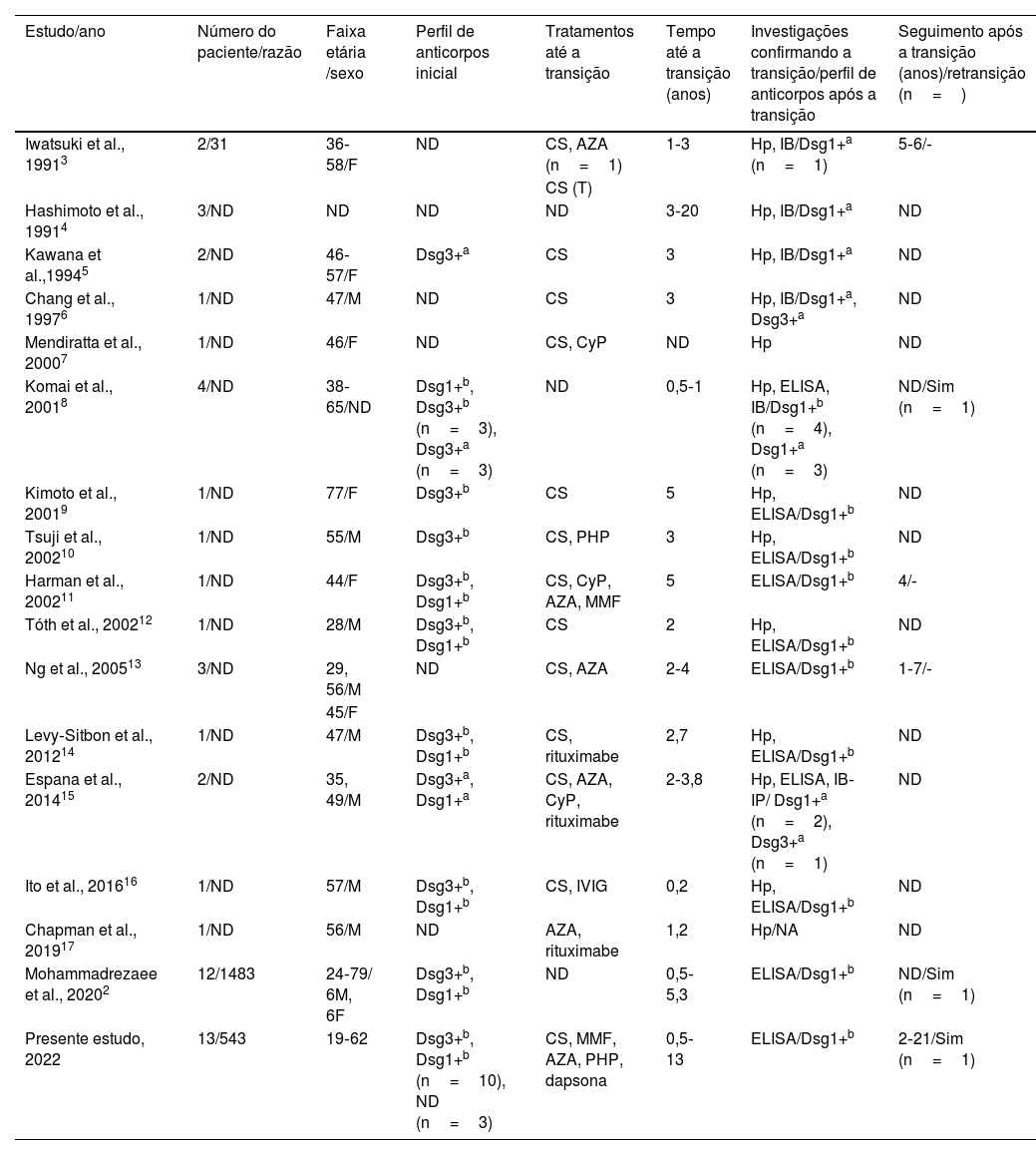
DiscussãoOs dois principais subtipos de pênfigo, PV e PF, têm suas próprias características clínicas, histopatológicas e imunológicas distintas.1,6 A transição de PV para PF é um fenômeno incomum e, que seja do conhecimento dos autores, apenas 36 casos foram relatados na literatura (tabela 2).2–17 Neste estudo retrospectivo, foi avaliada uma grande série de pacientes com PV, dos quais 13 (2,9%) apresentaram transição de PV para PF, incluindo seus dados durante o período de seguimento em longo prazo após a transição de até 21 anos.
Revisão da literatura de pacientes com transição de pênfigo vulgar para pênfigo foliáceo
| Estudo/ano | Número do paciente/razão | Faixa etária /sexo | Perfil de anticorpos inicial | Tratamentos até a transição | Tempo até a transição (anos) | Investigações confirmando a transição/perfil de anticorpos após a transição | Seguimento após a transição (anos)/retransição (n=) |
|---|---|---|---|---|---|---|---|
| Iwatsuki et al., 19913 | 2/31 | 36‐58/F | ND | CS, AZA (n=1) | 1‐3 | Hp, IB/Dsg1+a (n=1) | 5‐6/‐ |
| CS (T) | |||||||
| Hashimoto et al., 19914 | 3/ND | ND | ND | ND | 3‐20 | Hp, IB/Dsg1+a | ND |
| Kawana et al.,19945 | 2/ND | 46‐57/F | Dsg3+a | CS | 3 | Hp, IB/Dsg1+a | ND |
| Chang et al., 19976 | 1/ND | 47/M | ND | CS | 3 | Hp, IB/Dsg1+a, Dsg3+a | ND |
| Mendiratta et al., 20007 | 1/ND | 46/F | ND | CS, CyP | ND | Hp | ND |
| Komai et al., 20018 | 4/ND | 38‐65/ND | Dsg1+b, Dsg3+b (n=3), Dsg3+a (n=3) | ND | 0,5‐1 | Hp, ELISA, IB/Dsg1+b (n=4), Dsg1+a (n=3) | ND/Sim (n=1) |
| Kimoto et al., 20019 | 1/ND | 77/F | Dsg3+b | CS | 5 | Hp, ELISA/Dsg1+b | ND |
| Tsuji et al., 200210 | 1/ND | 55/M | Dsg3+b | CS, PHP | 3 | Hp, ELISA/Dsg1+b | ND |
| Harman et al., 200211 | 1/ND | 44/F | Dsg3+b, Dsg1+b | CS, CyP, AZA, MMF | 5 | ELISA/Dsg1+b | 4/‐ |
| Tóth et al., 200212 | 1/ND | 28/M | Dsg3+b, Dsg1+b | CS | 2 | Hp, ELISA/Dsg1+b | ND |
| Ng et al., 200513 | 3/ND | 29, 56/M | ND | CS, AZA | 2‐4 | ELISA/Dsg1+b | 1‐7/‐ |
| 45/F | |||||||
| Levy‐Sitbon et al., 201214 | 1/ND | 47/M | Dsg3+b, Dsg1+b | CS, rituximabe | 2,7 | Hp, ELISA/Dsg1+b | ND |
| Espana et al., 201415 | 2/ND | 35, 49/M | Dsg3+a, Dsg1+a | CS, AZA, CyP, rituximabe | 2‐3,8 | Hp, ELISA, IB‐IP/ Dsg1+a (n=2), Dsg3+a (n=1) | ND |
| Ito et al., 201616 | 1/ND | 57/M | Dsg3+b, Dsg1+b | CS, IVIG | 0,2 | Hp, ELISA/Dsg1+b | ND |
| Chapman et al., 201917 | 1/ND | 56/M | ND | AZA, rituximabe | 1,2 | Hp/NA | ND |
| Mohammadrezaee et al., 20202 | 12/1483 | 24‐79/ 6M, 6F | Dsg3+b, Dsg1+b | ND | 0,5‐5,3 | ELISA/Dsg1+b | ND/Sim (n=1) |
| Presente estudo, 2022 | 13/543 | 19‐62 | Dsg3+b, Dsg1+b (n=10), ND (n=3) | CS, MMF, AZA, PHP, dapsona | 0,5‐13 | ELISA/Dsg1+b | 2‐21/Sim (n=1) |
F, feminino; Hp, histopatologia; IB, ımmunoblotting; IP, ımunoprecipitação; M, masculino; PV, pênfigo vulgar; PF, pênfigo foliáceo; CYC, ciclofosfamida; PHP, plasmaférese realizada em apenas 1 deles.
Convencionalmente, o fenótipo clínico do PV e do PF permanece inalterado no curso da progressão clínica em cada paciente, e a transição de PV para PF é um evento incomum (tabela 2).2–17 O tempo até a transição variava de 1,5 meses a 20 anos nos casos relatados anteriormente, enquanto no presente estudo o tempo variou de quatro meses a 13 anos. Além disso, não houve predileção por sexo em relação à transição de PV para PF, tanto no presente estudo (M/F: 0,9) quanto na literatura (M/F: 1,1; tabela 2).2–17
Embora a possibilidade de transição de PV para PF, ou vice‐versa, seja mencionada desde a década de 1960,18,19 em 1991 Iwatsuki et al. foram os primeiros a relatar duas mulheres entre 31 pacientes com pênfigo, mostrando a transição de PV para PF com alterações nas características clínicas e achados histopatológicos que foi corroborada pela análise utilizando a técnica de immunoblotting em um desses casos.3 Kawana et al. relataram a primeira investigação demonstrando de maneira completa mudanças nos perfis de antígenos a nível molecular, com análise de immunoblotting consistente com a transição de PV para PF.5 No entanto, como o immunoblotting não é uma técnica quantitativa, pode não ser uma boa opção para mostrar essa transição, pois pode levar a resultados incorretos.12 Que seja de conhecimento dos autores, o primeiro estudo mostrando a correlação entre a transição clínica de PV para PF e as mudanças no perfil de autoanticorpos demonstradas pelo sistema ELISA, além de imunofluorescência e immunoblotting, foi relatado em 2001.8 Curiosamente, naquele estudo, três pacientes foram descritos como tendo características concomitantes de PV e PF, que é um fenômeno descrito com menos frequência, enquanto cinco pacientes apresentaram transição de PV para PF (dois deles foram relatados anteriormente em outro lugar),5 um paciente apresentou transição de PV (anti‐Dsg1‐3 positivo com ELISA, anti‐Dsg3 positivo com immunoblotting) para PF (anti‐Dsg1 positivo tanto com ELISA quanto com immunoblotting) e posteriormente apresentou retransição para PV (anti‐Dsg1 positivo e anti‐Dsg3 positivo com ELISA, anti‐Dsg3 positivo com immunoblotting) no período de um ano.8 No presente estudo, apenas uma paciente do sexo feminino apresentou transição de PV para PF 22 meses após o diagnóstico e, posteriormente, apresentou retransição de PF para PV após período de remissão de cinco anos sem tratamento. Além disso, em alguns estudos, no período de seguimento de pacientes que apresentaram transição de PV para PF, foi observada retransição para PV.2,8 Curiosamente, entre os pacientes relatados anteriormente apresentando transição de PV para PF, dois apresentaram níveis elevados de anticorpos anti‐Dsg1 e anti‐Dsg3 após a transição.6,15 Embora a conversão do subtipo em pacientes com pênfigo seja extremamente rara, a transição de PF para PV é ainda mais rara (tabela 2). A razão dessa tendência ainda não foi elucidada e precisa ser mais bem avaliada em estudos futuros.
O fenômeno de exposição de epítopos e a restrição de HLA foram sugeridos como possíveis explicações para a conversão inter‐subtipo de pacientes com pênfigo.8 O fenômeno de exposição de epítopos pode ser descrito como um processo que resulta em dano tecidual, o qual leva à exposição de certos componentes proteicos imunologicamente ocultos ao sistema imunológico, evocando uma resposta autoimune secundária.9,20 No PV, ambos os epítopos intramoleculares são expostos, levando ao reconhecimento de múltiplos epítopos da Dsg3, bem como a ocorrência de disseminação de epítopos intermoleculares, já demonstrada de Dsg3 para Dsg1. Além disso, a exposição de epítopos intramoleculares e intermoleculares pode estar associada à progressão do PV de PVm puro para PVmc.17,20 A semelhança bioquímica entre Dsg1 e Dsg3 levantou a hipótese de que o fenômeno de exposição de epítopos pode desempenhar um papel na transição entre PV e PF.6,20 Entretanto, a hipótese de exposição de epítopos não pode ser aplicada a pacientes que apresentam transição de PF para PV, e nesses pacientes o mecanismo fisiopatológico ainda permanece controverso.16,20 Além disso, a razão para a negativação de anticorpos anti‐Dsg3 em pacientes com transição de PV para PF, como observado nos casos do presente estudo, ainda é desconhecida.10 Em um estudo, foi demonstrado que os domínios extracelulares da Dsg3 são alterados, levando à perda de reatividade nos pacientes que apresentam transição de PV para PF na análise de imunoprecipitação e immunoblotting.15 O mecanismo subjacente a essa alteração ainda não foi elucidado. Além disso, anteriormente, discutiu‐se se a transição de PV para PF é permanente ou transitória.
É uma questão de debate se a interrupção do tratamento leva à reprodução de anticorpos anti‐Dsg3 que estavam anteriormente mascarados nos pacientes mostrando transição para PF sob tratamento, resultando em recidiva, com recorrência do fenótipo de PV com envolvimento da mucosa, como visto em um dos pacientes do presente estudo.11,13 Chang et al. relataram um paciente que apresentou autoanticorpos contra Dsg3 e Dsg1 após a transição de PV para PF, o que foi confirmado clínica e histopatologicamente. Os autores afirmaram que os autoanticorpos patogênicos mudaram de anticorpos Dsg3 para Dsg1.6 Essa transição significa a perda de antigenicidade da anti‐Dsg3. A hipótese de exposição de epítopos não pode ser aplicada a esses casos.16
ConclusãoA transição entre os subtipos de pênfigo é um fenômeno inesperado, e os relatos desses casos são extremamente raros. A presente série de 13 pacientes é o maior grupo de pacientes relatado com transição de PV para PF até o momento, com um longo período de seguimento. A transição foi confirmada por meio das características clínicas e perfis sorológicos. Pouco se sabe sobre o mecanismo da transição clínica e imunosorológica de PV para PF. Melhor esclarecimento da patogênese e estudos imunológicos adicionais são necessários para elucidar a transição entre os subtipos de pênfigo em estudos futuros.
Suporte financeiroNenhum.
Contribuição dos autoresRifkiye Kucukoglu: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Tugba Atci: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Gizem Pınar Sun: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Conflito de interessesNenhum.
Como citar este artigo: Kucukoglu R, Atci T, Sun GP. Is transition between subtypes of pemphigus possible? A series of pemphigus vulgaris patients showing the transition to pemphigus foliaceus. An Bras Dermatol. 2023;98:787–92.
Trabalho realizado na Faculdade de Medicina, Istanbul University, Istambul, Turquia.