A alopecia androgenética na população pediátrica é raramente discutida na literatura. Embora a prevalência da síndrome metabólica aumente em pacientes com alopecia androgenética de início precoce, a presença de fatores de risco da síndrome metabólica na alopecia androgenética pediátrica é desconhecida.
ObjetivoAvaliar os dados demográficos, história médica e familiar, características clínicas e tricoscópicas, hormônios androgênicos e fatores de risco para síndrome metabólica na alopecia androgenética pediátrica.
MétodosOs relatórios médicos de pacientes pediátricos com alopecia androgenética foram revisados.
ResultadosO estudo incluiu 23 pacientes (12 do sexo feminino e 11 do sexo masculino) com média de idade de 15,3± 2,1 anos. Dezesseis pacientes apresentaram alopecia androgenética na adolescência e sete na infância. Nove pacientes relataram história familiar, todos com alopecia androgenética na adolescência. Hiperandrogenismo foi observado em três pacientes com alopecia androgenética na adolescência. O padrão de queda de cabelo mais comum foi o afinamento difuso na região da coroa com preservação da linha frontal capilar que foi observado em 10 pacientes (43,5%), seis deles do sexo masculino. Quatorze pacientes (60,9%) apresentavam pelo menos um fator de risco para síndrome metabólica. O fator de risco mais comum foi obesidade ou sobrepeso (47,8%), seguido por resistência à insulina (21,7%), glicemia de jejum elevada (13%), hipertensão arterial (4,4%) e anormalidades lipídicas (4,4%).
Limitações do estudoEstudo retrospectivo; sem grupo controle.
ConclusãoA alopecia androgenética pediátrica está frequentemente associada a fatores de risco para síndrome metabólica. Portanto, a alopecia androgenética na população pediátrica pode ser um sinal de presença de síndrome metabólica futura e garante um diagnóstico preciso e imediato para triagem e tratamento precoces.
Em crianças e adolescentes, alopecia areata e tricotilomania são as formas mais comuns de alopecia, mas sugere‐se que a alopecia androgenética (AAG) seja mais frequente do que o previsto anteriormente.1–3 Tanto os hormônios androgênicos quanto a predisposição genética têm um papel no desenvolvimento de AAG e o início, portanto, não é esperado em pacientes pré‐púberes sem níveis anormais de androgênio.3–5 No último século, o início da adrenarca e da puberdade sofreu alteração para idades mais jovens, provavelmente em decorrência de uma dieta hiperinsulinêmica e do aumento da exposição aos hormônios ambientais e sexuais.4,5 Assim, é proposto que a prevalência de AAG pediátrica aumenta à medida que essa população é exposta a níveis elevados de andrógenos circulantes em idades mais jovens, o que leva ao desenvolvimento precoce de AAG em crianças geneticamente suscetíveis.2,4
Em razão de sua predileção por adultos, a AAG na população pediátrica costuma ser pouco reconhecida, e raramente é discutida na literatura. Portanto, pouco se sabe sobre a história natural, as características clínicas e tricoscópicas e as doenças e anormalidades hormonais associadas em pacientes pediátricos com AAG.1–7 Testosterona livre e total, sulfato de de‐hidroepiandrosterona (DHEAS) e androstenediona são os andrógenos mais comumente avaliados nesses pacientes.1–3,5 Foi relatado que a AAG, por si só, está associada a muitas doenças relacionadas ao metabolismo, como síndrome metabólica (SM), doença cardiovascular (DCV), resistência à insulina (RI), hipertensão, dislipidemia e obesidade em adultos.8–15
Entre elas, a SM recebeu maior interesse e constatou‐se que sua prevalência está aumentada, especialmente em pacientes com AAG de início precoce (idade<35 anos).9–13,15 Entretanto, a presença de SM ou seus fatores de risco na AAG pediátrica não foi investigada até agora.
A AAG é processo genético vitalício que também pode afetar a população pediátrica. Portanto, é fundamental conhecer sua apresentação clínica com as potenciais anormalidades hormonais e metabólicas associadas nesse grupo de pacientes para realizar um diagnóstico oportuno, intervenção médica apropriada e tratamento. Neste estudo retrospectivo, avaliamos os dados demográficos, históricos médicos e familiares, e características clínicas, juntamente com os achados tricoscópicos, hormônios androgênicos e fatores de risco para SM em pacientes pediátricos com AAG.
MétodosEste estudo foi aprovado pelo Comitê de Ética Institucional, Başkent University (Projeto n° KA 21/137) e todos os pacientes deram consentimento informado para a publicação de seus dados.
Os prontuários médicos de 23 pacientes pediátricos com diagnóstico de AAG entre dezembro de 2015 e junho de 2020 foram revisados retrospectivamente. O diagnóstico de AAG foi feito pelo padrão característico da alopecia e pela presença de> 20% de variação no diâmetro dos fios de cabelo na tricoscopia. Teste de tração dos cabelos, tricoscopia e exames laboratoriais (hemograma total, níveis de ferritina e hormônio estimulador da tireoide no sangue) foram realizados; os fatores desencadeantes (febre alta, grande intervenção cirúrgica, medicamentos, dieta pesada, estresse emocional) foram questionados para excluir eflúvio telógeno e alopecia areata difusa.
Foram anotados a idade e o sexo dos pacientes, sua história médica e familiar, a idade no início da doença, a duração da AAG e doenças dermatológicas associadas. Os achados clínicos e tricoscópicos foram registrados. As imagens foram reavaliadas e, se houvesse características anteriormente não registradas, as mesmas eram adicionadas. Os resultados do hemograma completo, níveis de ferritina, hormônio estimulador da tireoide, testosterona livre e total, DHEAS, androstenediona, triglicerídeos, lipoproteína de alta densidade‐colesterol (HDL‐c), colesterol total, lipoproteína de baixa densidade‐colesterol (LDL‐c), glicemia de jejum e o modelo de avaliação da homeostase de resistência à insulina (HOMA‐IR) foram registrados.
Na primeira hospitalização, todos os pacientes pediátricos com diagnóstico de AAG foram encaminhados à pediatria para avaliação do desenvolvimento sexual e de um distúrbio endócrino subjacente. Pressão arterial, índice de massa corporal (IMC), presença de puberdade precoce e sinais de hirsutismo ou virilização foram registrados. O diagnóstico de distúrbio endócrino ou cardiovascular, como diabetes mellitus, hiperandrogenismo, síndrome dos ovários policísticos (SOP), hiperlipidemia, hipertensão ou SM, se realizado, também foram anotados quando presentes.
Fatores de risco para SM foram particularmente registrados para cada paciente, como descrito anteriormente.16,17 Eles incluíram RI (HOMA‐IR> 2,7), glicemia de jejum elevada (> 100mg/dL), sobrepeso (IMC: 25 a 30kg/m2) ou obesidade (IMC ≥ 30kg/m2), hipertensão arterial (≥ 130/85mmHg) e anormalidades lipídicas (triglicérides> 150mg/dL ou HDL‐colesterol<40mg/dL).
A AAG pediátrica foi classificada como AAG na infância e AAG na adolescência se o início ocorreu antes da puberdade e após a puberdade, respectivamente. Para esse propósito, questionamos os pacientes ou seus pais quanto à existência de desenvolvimento mamário, crescimento de pelos pubianos e axilares, menstruação e ejaculação no momento do início da queda de cabelo. Se não fosse possível determinar o estado puberal na idade de início da AAG, definíamos como adolescente na idade superior a 10 anos (conforme proposto pela Organização Mundial da Saúde).
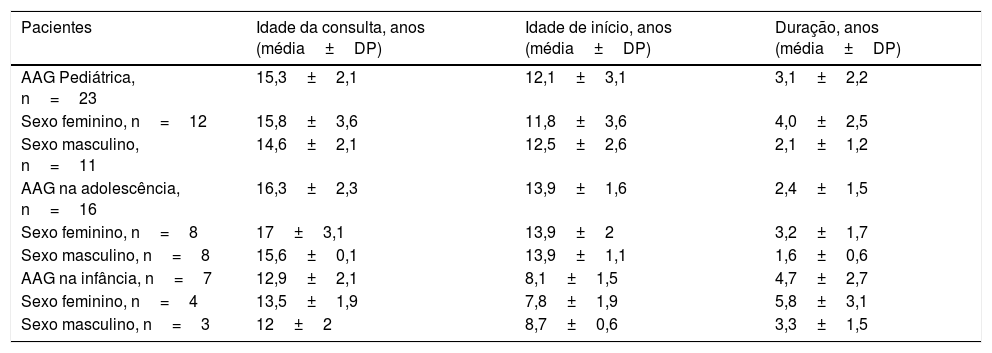
ResultadosO estudo incluiu 12 indivíduos do sexo feminino e 11 do sexo masculino com média de idade de 15,3± 2,1 anos (variação, 10 a 21 anos). Dezesseis pacientes apresentaram AAG na adolescência (oito do sexo feminino e oito do sexo masculino; média de idade: 16,3± 2,3 anos; variação, 11 a 21 anos) e sete pacientes apresentaram AAG na infância (quatro do sexo feminino e três do sexo masculino; média de idade: 12,9± 2,1 anos; variação 12 a 19 anos). A tabela 1 mostra a idade da primeira consulta, idade de início e duração da AAG.
Idade de apresentação, idade de início e duração da AAG em 16 pacientes com AAG na adolescência, em sete pacientes com AAG na infância e no total de 23 pacientes com AAG pediátrica
| Pacientes | Idade da consulta, anos (média±DP) | Idade de início, anos (média±DP) | Duração, anos (média±DP) |
|---|---|---|---|
| AAG Pediátrica, n=23 | 15,3±2,1 | 12,1±3,1 | 3,1±2,2 |
| Sexo feminino, n=12 | 15,8±3,6 | 11,8±3,6 | 4,0±2,5 |
| Sexo masculino, n=11 | 14,6±2,1 | 12,5±2,6 | 2,1±1,2 |
| AAG na adolescência, n=16 | 16,3±2,3 | 13,9±1,6 | 2,4±1,5 |
| Sexo feminino, n=8 | 17±3,1 | 13,9±2 | 3,2±1,7 |
| Sexo masculino, n=8 | 15,6±0,1 | 13,9±1,1 | 1,6±0,6 |
| AAG na infância, n=7 | 12,9±2,1 | 8,1±1,5 | 4,7±2,7 |
| Sexo feminino, n=4 | 13,5±1,9 | 7,8±1,9 | 5,8±3,1 |
| Sexo masculino, n=3 | 12±2 | 8,7±0,6 | 3,3±1,5 |
AAG, alopecia androgenética; n, número.
História familiar de queda de cabelo com padrão androgenético em um parente de primeiro grau estava presente em nove (56,3%) de 16 pacientes com AAG na adolescência (seis do sexo masculino, três do sexo feminino). Seis pacientes do sexo masculino tinham apenas o pai, duas pacientes do sexo feminino tinham apenas a mãe e uma paciente do sexo feminino tinha ambos os pais afetados. Um dos dois pacientes do sexo masculino sem história familiar de AAG apresentava acne associada, enquanto o outro não apresentava anormalidades clínicas ou laboratoriais. Nenhum dos pacientes com AAG na infância relatou história familiar em parentes de primeiro grau. Duas pacientes do sexo feminino com AAG na adolescência tinham história prévia de RI e uma paciente com AAG adolescente relatou história prévia de SOP. Uma das pacientes com RI também apresentava hipertensão associada.
Doenças dermatológicas concomitantes foram observadas em 11 (47,8%) dos 23 pacientes. Desses, oito pacientes (72,7%; cinco do sexo masculino, três do feminino) e três pacientes (27,3%; duas do sexo feminino, um do masculino) apresentavam acne e dermatite seborreica, respectivamente. Hirsutismo foi observado em duas pacientes do sexo feminino, uma das quais também tinha dermatite seborreica. Um dos pacientes do sexo masculino com acne e uma das pacientes do sexo feminino com dermatite seborreica, que eram adolescentes na apresentação inicial, tinham tido AAG na infância. O desenvolvimento sexual e os parâmetros de crescimento dos pacientes eram adequados para a idade, exceto para a paciente do sexo feminino com puberdade precoce, hirsutismo e dermatite seborreica.
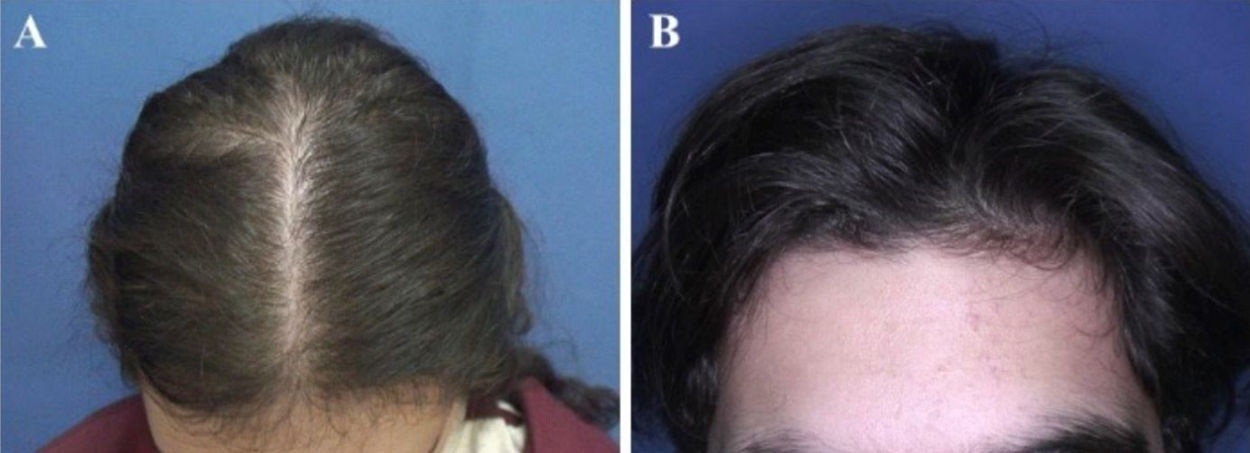
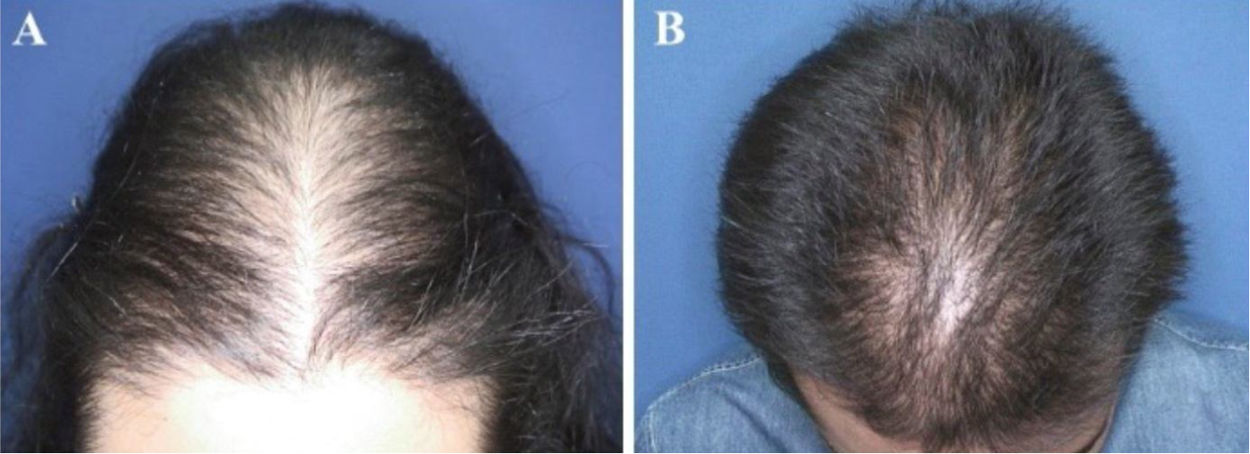
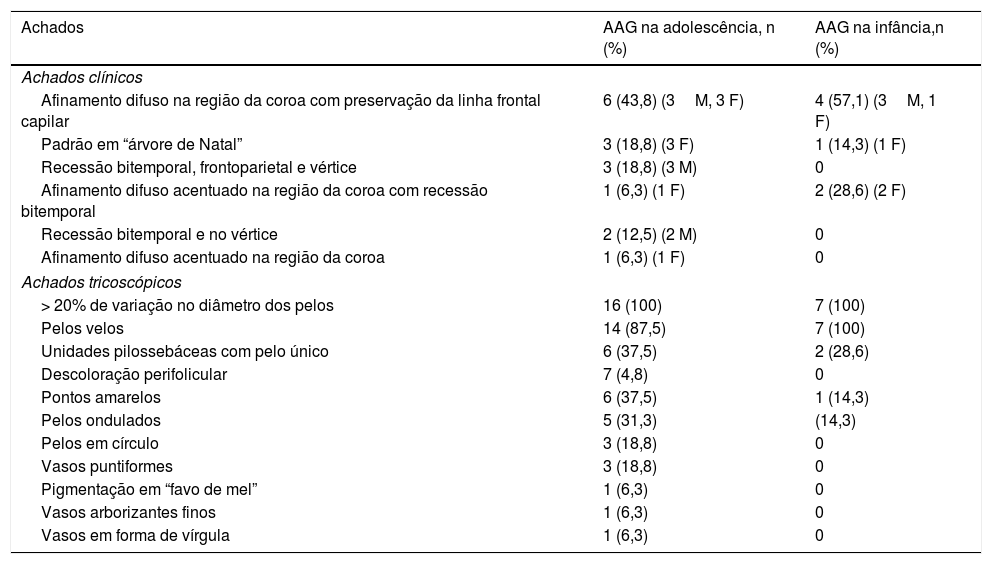
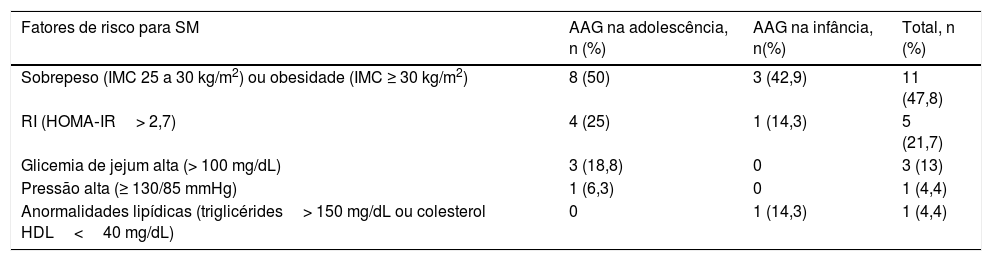
O padrão de queda de cabelo mais comum foi o afinamento difuso na região da coroa com preservação da linha frontal capilar (fig. 1) que foi observado em dez (43,5%) dos 23 pacientes com AAG pediátrica. Foi seguido pelo padrão em “árvore de Natal” (fig. 2A) em quatro (17,4%), recessão bitemporal, na região frontoparietal e no vértice (fig. 2B) em três (13%), afinamento difuso acentuado na região da coroa com recessão bitemporal em três (13%), recessão bitemporal e no vértice em dois (8,7%) pacientes e afinamento difuso acentuado na região da coroa em um paciente (4,4%). O teste de tração dos cabelos foi negativo em todos os pacientes. Seis (54,5%) dos 11 pacientes do sexo masculino apresentaram afinamento difuso na coroa com preservação da linha frontal capilar. No sexo feminino, as apresentações clínicas mais frequentes foram o afinamento difuso da região da coroa, com preservação da linha frontal capilar e o padrão em “árvore de Natal”, cada um observado em quatro (33,3%) das 12 pacientes do sexo feminino (tabela 2).
Padrões de queda de cabelos observados na alopecia androgenética pediátrica. (A), Afinamento difuso na região da coroa com preservação da linha frontal capilar em uma paciente do sexo feminino com alopecia androgenética na adolescência. (B), Preservação da linha frontal capilar em um paciente do sexo masculino com alopecia androgenética na adolescência apresentando afinamento difuso na região da coroa.
Padrões de queda de cabelos observados na alopecia androgenética pediátrica. (A), Padrão em “árvore de Natal” em uma paciente do sexo feminino com alopecia androgenética na adolescência. (B), Recessão bitemporal, frontoparietal e no vértice em um paciente do sexo masculino com alopecia androgenética na adolescência.
Achados clínicos e tricoscópicos em 16 pacientes com AAG na adolescência e em sete pacientes com AAG na infância
| Achados | AAG na adolescência, n (%) | AAG na infância,n (%) |
|---|---|---|
| Achados clínicos | ||
| Afinamento difuso na região da coroa com preservação da linha frontal capilar | 6 (43,8) (3M, 3 F) | 4 (57,1) (3M, 1 F) |
| Padrão em “árvore de Natal” | 3 (18,8) (3 F) | 1 (14,3) (1 F) |
| Recessão bitemporal, frontoparietal e vértice | 3 (18,8) (3 M) | 0 |
| Afinamento difuso acentuado na região da coroa com recessão bitemporal | 1 (6,3) (1 F) | 2 (28,6) (2 F) |
| Recessão bitemporal e no vértice | 2 (12,5) (2 M) | 0 |
| Afinamento difuso acentuado na região da coroa | 1 (6,3) (1 F) | 0 |
| Achados tricoscópicos | ||
| > 20% de variação no diâmetro dos pelos | 16 (100) | 7 (100) |
| Pelos velos | 14 (87,5) | 7 (100) |
| Unidades pilossebáceas com pelo único | 6 (37,5) | 2 (28,6) |
| Descoloração perifolicular | 7 (4,8) | 0 |
| Pontos amarelos | 6 (37,5) | 1 (14,3) |
| Pelos ondulados | 5 (31,3) | (14,3) |
| Pelos em círculo | 3 (18,8) | 0 |
| Vasos puntiformes | 3 (18,8) | 0 |
| Pigmentação em “favo de mel” | 1 (6,3) | 0 |
| Vasos arborizantes finos | 1 (6,3) | 0 |
| Vasos em forma de vírgula | 1 (6,3) | 0 |
AAG, alopecia androgenética; F, sexo feminino; M, sexo masculino; n, número.
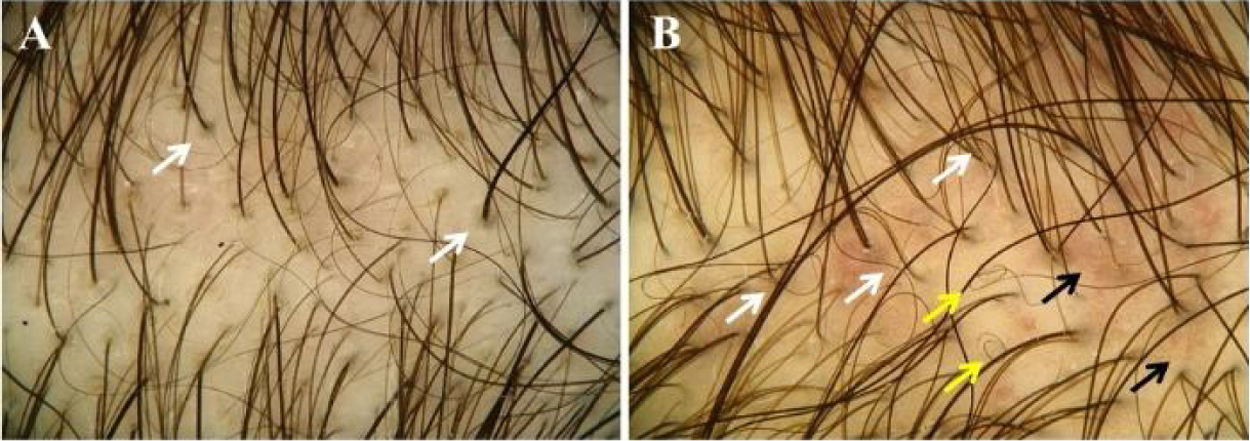
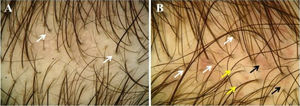
A tricoscopia (fig. 3) mostrou> 20% de variação no diâmetro dos fios de cabelo em todos os 23 (100%) pacientes. Achados adicionais foram pelos velos (91,3%), unidades pilossebáceas com pelo único (34,8%), descoloração perifolicular (30,4%), pontos amarelos (30,4%), pelos ondulados (26,1%), pelos em círculo (13%), vasos puntiformes (13%), pigmentação em favo de mel (4,4%), vasos arborizantes finos (4,4%) e vasos em forma de vírgula (4,4%; tabela 2).
Achados tricoscópicos da alopecia androgenética pediátrica. (A e B), Variação no diêmetro dos fios de cabelo e unidades pilossebáceas com pelo único. (A), Descoloração perifolicular (setas brancas). (B), Pelos ondulados (setas brancas), pelos em círculos (setas amarelas), vasos puntiformes e em vírgula (setas pretas).
Quatorze pacientes (60,9%) com AAG pediátrica (dez com AAG na adolescência e quatro com AAG na infância, oito do sexo feminino e seis do sexo masculino) tinham pelo menos um dos fatores de risco para SM. Obesidade ou sobrepeso era o único fator de risco para SM em oito pacientes (34,8%) (cinco com AAG na adolescência e três com AAG na infância, seis do sexo feminino e cinco do masculino). Dos cinco pacientes restantes com AAG na adolescência, dois eram obesos ou tinham sobrepeso e apresentavam RI, um dos quais também apresentava hipertensão, dois tinham glicemia e RI elevadas em jejum e um era obeso e apresentava glicemia elevada em jejum. Um paciente com AAG na infância apresentava RI e anormalidades lipídicas (tabela 3). Dos cinco pacientes com RI, três eram do sexo feminino e dois do masculino. Todos os três pacientes com glicemia elevada em jejum e um paciente com pressão arterial elevada eram do sexo feminino. O único paciente com anormalidades lipídicas era do sexo masculino.
Fatores de risco para SM em 16 pacientes com AAG na adolescência, em sete pacientes com AAG na infância e no total de 23 pacientes com AAG pediátrica
| Fatores de risco para SM | AAG na adolescência, n (%) | AAG na infância, n(%) | Total, n (%) |
|---|---|---|---|
| Sobrepeso (IMC 25 a 30 kg/m2) ou obesidade (IMC ≥ 30 kg/m2) | 8 (50) | 3 (42,9) | 11 (47,8) |
| RI (HOMA‐IR> 2,7) | 4 (25) | 1 (14,3) | 5 (21,7) |
| Glicemia de jejum alta (> 100 mg/dL) | 3 (18,8) | 0 | 3 (13) |
| Pressão alta (≥ 130/85 mmHg) | 1 (6,3) | 0 | 1 (4,4) |
| Anormalidades lipídicas (triglicérides> 150 mg/dL ou colesterol HDL<40 mg/dL) | 0 | 1 (14,3) | 1 (4,4) |
AAG, alopecia androgenética; IMC, índice de massa corporal; HDL, lipoproteína de alta densidade; HOMA‐IR, modelo de avaliação da homeostase de resistência à insulina; n, número; RI, resistência à insulina; SM, síndrome metabólica.
Outras investigações laboratoriais mostraram aumento do nível de colesterol total em cinco pacientes (três com AAG na infância e dois com AAG na adolescência), dos quais dois com AAG na infância também apresentavam nível de LDL‐colesterol elevado. Desses cinco pacientes, três eram obesos ou tinham sobrepeso. Os níveis sanguíneos de testosterona livre e total e androstenediona estavam aumentados em dois pacientes (uma do sexo feminino e um do masculino) e uma do sexo feminino, respectivamente, todos com AAG na adolescência. Um paciente com nível sanguíneo aumentado de testosterona livre e total apresentava sobrepeso. Os resultados do hemograma completo, níveis sanguíneos de ferritina, hormônio estimulador da tireoide e DHEAS estavam dentro dos níveis normais.
DiscussãoEmbora a AAG pediátrica seja raramente relatada na literatura, ela presumivelmente não é excepcional.1,3,5–7 Na população pediátrica, a AAG geralmente começa na adolescência, mas também foi relatado que ela ocorre na idade pré‐púbere.1–3,5–7 Gonzalez et al.1 relataram que entre 438 pacientes pediátricos com queixa de queda de cabelo, 57 foram diagnosticados com AAG, que foi identificada como o segundo diagnóstico mais comum após alopecia areata nesta população. Desses 57 pacientes, 52 estavam na adolescência e a AAG foi o tipo de alopecia mais prevalente em adolescentes, ocorrendo em 42%. Além disso, foi observada predominância do sexo masculino nesse grupo de pacientes como um todo e também em pacientes adolescentes. Kim et al.5 observaram 43 adolescentes com AAG em um período de quase cinco anos e o sexo masculino também superou o feminino em seu estudo. Em ambos os estudos, a idade de início e a apresentação inicial foram ligeiramente maiores no sexo masculino do que no feminino.1,5 Na série de Gonzalez et al.,1 o sexo masculino teve um atraso menor no diagnóstico, enquanto Kim et al.5 relataram maior duração da doença no sexo masculino. Tosti et al.3 diagnosticaram 20 crianças pré‐púberes em quatro anos. Em sua série, contrastando com os dados dos adolescentes, a AAG foi mais frequente no sexo feminino, mas teve início, e os pacientes buscaram atendimento em idades semelhantes em ambos os sexos. Em seu estudo, a idade mais jovem de início da doença foi aos 6 anos, embora a AAG tenha se iniciado em um paciente com apenas 5 anos de idade.3,7 Semelhante a dados anteriores, nesta série de pacientes pediátricos a AAG foi mais comum em adolescentes. Entretanto, o sexo masculino e o feminino foram afetados com frequência semelhante durante a infância e a adolescência. Diferente de relatos anteriores, a idade da apresentação inicial e a duração da AAG foram maiores no sexo feminino, tanto na AAG na adolescência quanto na infância. A idade de início foi notavelmente próxima no sexo masculino e no feminino na AAG na adolescência, enquanto a queda de cabelo começou em idade mais avançada no sexo masculino com AAG na infância. Semelhante a relatos anteriores, o início mais precoce da AAG foi aos 5 anos de idade no presente estudo.
No sexo masculino e em alguns pacientes do sexo feminino, a AAG resulta da ação da di‐hidrotestosterona, o metabólito 5α reduzido da testosterona, em folículo capilar geneticamente suscetível.4 Consequentemente, ocorre a miniaturização folicular na área frontotemporal e no vértice no sexo masculino e na região da coroa no sexo feminino, pois essas áreas são mais sensíveis aos efeitos dos andrógenos.4,13 Clinicamente, a maioria dos adolescentes do sexo masculino com AAG apresenta afinamento do cabelo consistente com o padrão típico de queda de cabelos no sexo masculino, como observado em homens adultos.1,2,5 Entretanto, um padrão feminino foi registrado em 20% e 34% dos pacientes masculinos com AAG na adolescência em dois estudos diferentes.1,5 Tosti et al. relataram em sua série de crianças pré‐púberes que, em ambos os sexos, a AAG apresentava padrão feminino, consistindo em afinamento capilar e aumento da área central de partição dos pelos no couro cabeludo com preservação da linha frontal capilar.2 A observação do padrão feminino de AAG em crianças pré‐púberes e adolescentes do sexo masculino suscitou a crença de que a AAG pode não ser necessariamente andrógeno‐dependente, pelo menos em alguns pacientes pediátricos.1,3,5 Em concordância com os estudos anteriores, também observamos padrão feminino em um terço dos pacientes masculinos com AAG adolescente e em todos os pacientes masculinos com AAG na infância. Entretanto, curiosamente, duas pacientes do sexo feminino com AAG na infância e uma paciente com AAG na adolescência exibiram recessão bitemporal, além de afinamento difuso acentuado na região da coroa. Nossos resultados mostram que o padrão clínico da AAG em alguns de nossos pacientes pediátricos era o contrário dos padrões adultos, com os pacientes do sexo masculino exibindo um padrão feminino e as do sexo feminino apresentando um padrão masculino. No entanto, essa observação ainda não tem uma explicação precisa.
Os achados tricoscópicos em nossos pacientes pediátricos com AAG foram semelhantes aos observados em adultos.18 Além de variação> 20% no diâmetro dos fios de cabelo, que aparece como consequência da miniaturização folicular, o aumento da proporção de pelos velos, unidades pilossebáceas com pelo único, descoloração perifolicular, pontos amarelos e pelos ondulados foram os achados mais frequentes. A tricoscopia também mostrou pelos em círculo, pigmentação em favo de mel e, muito provavelmente, devido à dermatite seborreica associada ou como um achado normal no couro cabeludo, vasos puntiformes, em vírgula ou arborizantes finos.
Espera‐se que o início da AAG ocorra após a puberdade, quando há testosterona suficiente disponível para ser transformada em di‐hidrotestosterona.1–3,5–7 Como as crianças pré‐púberes normalmente não produzem quantidades suficientes de andrógenos adrenais e gonadais, a observação da AAG pode indicar uma anormalidade hormonal nesses pacientes.1–5 Entretanto, o estudo de Tosti et al.,3 que é um relato de caso7 e também o presente estudo mostraram que a AAG não está associada a níveis elevados de hormônios androgênicos no sangue além do esperado para o estágio de desenvolvimento sexual em crianças pré‐púberes. Essa observação sugere que a AAG em crianças pode não ser causada por andrógenos gonadais ou que os andrógenos adrenais podem ter um papel direto.1,3,7 A secreção adrenal dos hormônios andrógenos começa a aumentar dois a três anos antes do início da puberdade, chamada de adrenarca, que ocorre independentemente da maturação gonadal.3 Propõe‐se que a forte predisposição genética, uma característica comum aos pacientes nos relatos anteriores, poderia ser responsável por um aumento da sensibilidade aos andrógenos e, portanto, os andrógenos adrenais podem ser adequados para induzir AAG em crianças predispostas.1,3,4 A idade cada vez mais jovem de início da adrenarca pode favorecer esse processo.3,4 Ainda assim, até o momento, a hipótese de hipersensibilidade androgênica do folículo piloso na AAG não foi precisamente comprovada em crianças e a AAG com padrão feminino, seja em crianças ou adultos do sexo feminino, podem ter caminhos patogenéticos diferentes das peculiaridades do metabolismo androgênico subjacente à queda de cabelo de padrão masculino. Em nosso estudo, nenhum dos pacientes com AAG na infância tinha história familiar positiva em seus parentes de primeiro grau, o que também apoia essa sugestão.
Às vezes, a AAG pode ser o único achado dermatológico de SOP.2 Embora níveis elevados de androgênio sejam encontrados em um pequeno subconjunto de pacientes adolescentes, a SOP é observada em quase metade das adolescentes do sexo feminino com AAG.1,4 Uma forte história familiar também é frequentemente observada em adolescentes do sexo masculino e feminino com AAG.1,2,5 No presente estudo, em concordância com os dados da literatura, a AAG foi relatada em parentes de primeiro grau de mais da metade dos pacientes e quase todos os pacientes do sexo masculino com AAG na adolescência. Além disso, a associação com acne, dermatite seborreica ou hirsutismo, que refletem os efeitos dos andrógenos, foi observada em quase metade dos pacientes pediátricos, quase todos com AAG na adolescência. Entretanto, o hiperandrogenismo não foi um achado frequente em geral, e SOP ou puberdade precoce foi observada em apenas duas pacientes do sexo feminino. Como proposto anteriormente, também acredita‐se que, como em crianças com níveis pré‐púberes de testosterona, os andrógenos adrenais podem contribuir para o desenvolvimento de AAG ou pode ter ocorrido por um mecanismo completamente independente do efeito dos hormônios androgênicos nas adolescentes com perfis hormonais normais.
A SM descreve um conjunto de obesidade central, distúrbio do metabolismo da glicose, hipertensão e dislipidemia, e a presença de três ou mais desses componentes aumenta significativamente o risco de desenvolver DCV e diabetes.8,12,17 Há muitos estudos que mostram a relação entre AAG e SM e seus componentes individuais em adultos.8–15 Em particular, a AAG de início precoce em adultos (antes dos 35 anos de idade) demonstrou ser um fator de risco para o início precoce de DCV grave, e alguns estudos encontraram prevalência mais alta de RI e SM neste grupo de pacientes.8,11,13,15 O mecanismo subjacente que liga AAG e SM não foi totalmente estabelecido. Entretanto, foi afirmado que a RI, o mecanismo‐chave no desenvolvimento da SM, também pode contribuir para a AAG.8,13,19 A hiperinsulinemia pode desempenhar um papel na produção local de andrógenos a partir do colesterol e por meio da conversão local de testosterona em di‐hidrotestosterona.8,19 As substâncias vasoativas produzidas na RI causam ainda mais vasoconstrição e hipóxia de tecidos ao nível folicular e contribuem para a miniaturização dos folículos capilares.8,13,19 Além disso, altos níveis séricos de andrógenos e sensibilidade periférica aos andrógenos observados na AAG pode aumentar o risco de desenvolver hipertensão através de receptores mediados por andrógenos encontrados no endotélio da parede arterial e desempenham um papel adicional na associação de AAG e SM.8,13
Como na idade adulta, a obesidade (e, portanto, a RI na infância e na adolescência) representa um problema crescente, e os pediatras cada vez mais diagnosticam SM nos últimos anos.20,21 Ter SM e seus fatores de risco durante a idade pediátrica não prevê que os mesmos persistam na idade adulta.20 Ainda assim, a importância da identificação precoce de crianças e adolescentes em risco de desenvolver SM e subsequentemente progredir para diabetes e DCV mais tarde na vida adulta não deve ser subestimada.20,21 Apesar da existência de muitos estudos em adultos, a associação de AAG e SM na população pediátrica ainda não foi investigada. No presente estudo, mais da metade dos pacientes pediátricos com AAG apresentava pelo menos um fator de risco para SM. A frequência desses fatores de risco foi semelhante no sexo feminino e no masculino. Obesidade ou sobrepeso, a causa mais comum de RI e o principal determinante da SM,16,17,19 foi observada em quase metade dos pacientes e foi o único fator de risco para um terço deles. A RI e glicose de jejum elevada, que são sinais de metabolismo da glicose prejudicado, foram o segundo fator de risco de SM mais comumente observados. Outros fatores de risco, incluindo hipertensão e anormalidades lipídicas, foram raros nos pacientes pediátricos. Como o presente estudo não teve um grupo controle, é difícil determinar se existe ou não uma verdadeira associação entre AAG pediátrica e a presença de fatores de risco para SM. Entretanto, acredita‐se que os achados do presente estudo são críticos para enfatizar a necessidade de triagem de pacientes pediátricos com AAG para os fatores de risco da SM, uma vez que a maioria desses distúrbios é assintomática, mas está relacionada a DCV e diabetes posteriores.
O caráter retrospectivo e a falta de um grupo controle foram as principais limitações do presente estudo. Além disso, os achados observados na AAG na adolescência e na infância e também nos sexos feminino e masculino não puderam ser comparados estatisticamente em razão do número insuficiente de pacientes.
ConclusãoOs resultados do presente estudo mostram que a AAG é mais prevalente em adolescentes do que em crianças na população pediátrica e apresenta características clínicas e tricoscópicas semelhantes às relatadas anteriormente. O hiperandrogenismo não é um achado comum e provavelmente não contribui para a ocorrência de AAG na maioria das crianças e adolescentes. Em contraste, a predisposição genética pode desempenhar um papel na AAG na adolescência. Pacientes pediátricos com AAG frequentemente apresentam pelo menos um dos fatores de risco para SM. Portanto, acredita‐se que a AAG em pacientes pediátricos pode ser um sinal de ocorrência futura de SM e, portanto, garante um diagnóstico preciso e imediato para triagem precoce e interrupção da progressão desta síndrome. Estudos prospectivos controlados esclarecerão melhor a associação da AAG pediátrica com fatores de risco para SM.
Suporte financeiroNenhum.
Contribuição dos autoresDeren Özcan: Aprovação da versão final do manuscrito; revisão crítica da literatura, obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito, concepção e planejamento do estudo.
Conflito de interessesNenhum.
Como citar este artigo: Özcan D. Pediatric androgenetic alopecia: a retrospective review of clinical characteristics, hormonal assays and metabolic syndrome risk factors in 23 patients. An Bras Dermatol. 2022;97:166–72.
Trabalho realizado no Departamento de Dermatologia, Başkent University Faculty of Medicine, Ankara, Turquia.