A urticária crônica espontânea (UCE) é condição associada a urticária pruriginosa recorrente e/ou angioedema com duração superior a seis semanas e é conhecida por afetar 1% da população. A dor neuropática pode ser definida como dor anormal no sistema nervoso periférico ou central após lesão, e resulta de disfunções no sistema nervoso periférico ou central sem estimulação de nociceptores periféricos. A histamina aparece na patogênese tanto da UCE quanto do espectro de doenças com dor neuropática.
ObjetivoAvaliar os sintomas de dor neuropática em pacientes com UCE usando escalas.
MétodoForam incluídos no estudo 51 pacientes com UCE e 47 controles saudáveis pareados por sexo e idade.
ResultadosOs resultados do short‐form McGill Pain Questionnaire revelaram que os escores nos domínios sensorial e afetivo, os escores da Escala Visual Analógica (EVA) e os índices de dor foram significantemente maiores no grupo de pacientes (p <0,05 para todos os casos), enquanto a avaliação geral da dor e a avaliação sensorial com base na escala de dor Self‐Administered Leeds Assessment of Neuropathic Symptoms and Signs (S‐LANSS) também foram significantemente maiores no grupo de pacientes. Com base na suposição de que escores> 12 indicavam neuropatia, 27 (53%) dos pacientes do grupo de pacientes e 8 (17%) do grupo de controle apresentavam neuropatia (p <0,05).
Limitações do estudoRealização de estudo transversal, amostra pequena de pacientes e utilização de escalas autorreferidas.
ConclusãoAlém do prurido, os pacientes com UCE devem estar cientes da possibilidade de apresentar dor neuropática concomitante. Nesta doença crônica que sabidamente afeta a qualidade de vida, a abordagem integrada dos pacientes e a identificação dos problemas associados são tão importantes quanto o tratamento da doença dermatológica.
A urticária espontânea crônica (UCE) é condição associada a urticária pruriginosa recorrente e/ou angioedema que dura mais de seis semanas e é conhecida por afetar 1% da população.1 Medicamentos, alimentos, aditivos alimentares, infecções (bacterianas, virais e fúngicas), infestações parasitárias, alérgenos e neoplasias malignas foram todos implicados na etiologia da UCE, embora a causa não possa ser identificada em 50% dos casos.2,3 Mediadores vasoativos liberados pelos mastócitos dérmicos desempenham papel fundamental na patogênese da UCE. Apesar da presença de eicosanoides, citocinas e proteases, a histamina é a principal citocina que afeta os receptores H1 (85%) e H2 (15%) na pele. A ligação da histamina aos receptores H1 causa prurido (estimulação das fibras C), enquanto a ligação aos receptores nos capilares leva à vasodilatação, aumento da permeabilidade vascular e edema.4
A dor neuropática pode ser definida como dor anormal no sistema nervoso periférico ou central após lesão e resulta de disfunções no sistema nervoso periférico ou central sem estimulação de nociceptores periféricos.5 A dor neuropática é problema comum na prática clínica e pode ser um desafio diagnóstico em razão das diferenças metodológicas na definição e avaliação, embora sua prevalência estimada seja de 7% a 10% na população em geral.6 Os mecanismos de indução da dor são altamente diversos e ainda não foram totalmente esclarecidos. Estudos recentes relataram que os mastócitos se acumulam ao redor das bainhas nervosas e desempenham papel na fisiopatologia da dor neuropática ao secretar ampla variedade de citocinas, incluindo a histamina.7
A histamina aparece na patogênese tanto da UCE quanto das doenças do espectro da dor neuropática. O presente estudo investiga os sintomas de dor neuropática em pacientes com UCE utilizando escalas, como o método mais simples e fácil.
MétodoAmostra do estudoEste estudo transversal e de caso‐controle, com base em questionários, foi aprovado pelo Comitê de Ética local (Decreto n° 2017‐KAEK‐189_2019.07.10_04) e foi conduzido de acordo com os princípios da Declaração de Helsinque.
Após obter o consentimento informado, 51 pacientes com UCE e 47 controles saudáveis pareados por sexo e idade foram incluídos no estudo. Todos os participantes tinham idade superior a 18 anos. Foram excluídos do estudo os participantes com gravidez, em lactação, relatando consumo de álcool, presença de doença importante do sistema nervoso central, comprometimento cognitivo e comorbidade psiquiátrica. Apenas pacientes com UCE foram incluídos no estudo. Pacientes com urticária crônica induzível e urticária aguda foram excluídos.
As medidas de peso corporal e estatura foram obtidas para o cálculo do índice de massa corporal (IMC), bem como dados sociodemográficos, tempo de doença, comorbidades, uso de medicamentos, presença de angioedema e resultados de exames clínicos de pacientes com UCE atendidos em ambulatórios de Dermatologia.
MedidasEscore de atividade de urticária por sete dias consecutivos (UAS7, Urticaria Activity Score for 7 consecutive days)Essa é uma ferramenta de desfecho relatado pelo paciente estabelecida e amplamente aceita para a medida prospectiva da atividade da UCE. Escores UAS7 ≤ 6 indicam urticária bem controlada, 7‐15 leve, 16‐27 moderada e 28‐42 indicam urticária grave.8
Short‐form McGill Pain Questionnaire (SF‐MPQ)O componente principal do SF‐MPQ compreende 15 descritores (11 sensoriais; 4 afetivos) classificados em uma escala de intensidade de 0=nenhum, 1=leve, 2=moderada ou 3=intensa, e três escores de dor são derivados do soma dos valores do graduação da intensidade das palavras escolhidas para os descritores sensorial, afetivo e total. O SF‐MPQ também inclui o índice de intensidade da dor atual do MPQ padrão e uma escala visual analógica (EVA).9
Questionário Self‐Administered Leeds Assessment of Neuropathic Symptoms and Signs (S‐LANSS)Objetiva identificar a dor de origem predominantemente neuropática, distinta da dor nociceptiva, sem a necessidade de exame clínico. O S‐LANSS é um questionário de cinco itens relacionado a sintomas de dor e com dois itens relacionados a sinais clínicos envolvendo testes sensoriais autoadministrados para a presença de alodinia e diminuição da sensação de picada de alfinete. Os escores variam de 0 a 24; um escore de 12 ou mais sugere dor neuropática.10
A validade e a confiabilidade da versão em turco dessas escalas foram verificadas.
Análise de dadosTodas as análises estatísticas foram realizadas utilizando o pacote estatístico IBM SPSS Statistics (Versão 20.0. Armonk, NY: IBM Corp.). As variáveis contínuas foram expressas como média±DP, e os testes t de Student foram usados para comparar as médias entre dois grupos. Para variáveis categóricas, teste Qui‐quadrado foi usado para testar as diferenças entre os grupos. A análise de correlação de Spearman foi utilizada para a correlação entre os testes de neuropatia e as características da doença. Salvo indicação ao contrário, p <0,05 foi considerado significante.
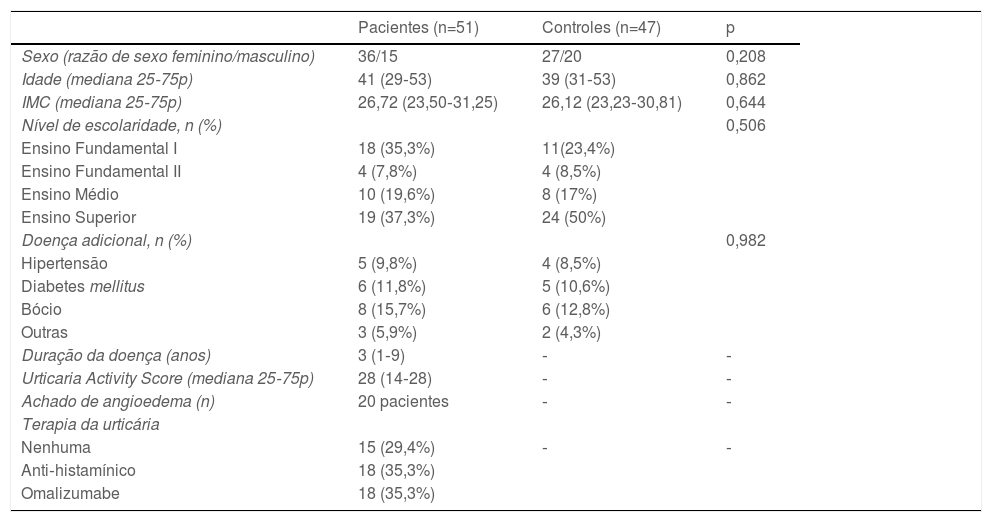
ResultadosO estudo incluiu 51 pacientes (36 mulheres, 15 homens) e 47 controles (27 mulheres, 20 homens); ambos os grupos tinham características sociodemográficas semelhantes (p <0,05). No grupo de pacientes, 18 estavam em uso de omalizumabe e 18 em uso de anti‐histamínicos, enquanto os demais não estavam recebendo tratamento no momento da admissão no estudo (tabela 1).
Dados demográficos gerais e características clínicas do grupo de pacientes
| Pacientes (n=51) | Controles (n=47) | p | |
|---|---|---|---|
| Sexo (razão de sexo feminino/masculino) | 36/15 | 27/20 | 0,208 |
| Idade (mediana 25‐75p) | 41 (29‐53) | 39 (31‐53) | 0,862 |
| IMC (mediana 25‐75p) | 26,72 (23,50‐31,25) | 26,12 (23,23‐30,81) | 0,644 |
| Nível de escolaridade, n (%) | 0,506 | ||
| Ensino Fundamental I | 18 (35,3%) | 11(23,4%) | |
| Ensino Fundamental II | 4 (7,8%) | 4 (8,5%) | |
| Ensino Médio | 10 (19,6%) | 8 (17%) | |
| Ensino Superior | 19 (37,3%) | 24 (50%) | |
| Doença adicional, n (%) | 0,982 | ||
| Hipertensão | 5 (9,8%) | 4 (8,5%) | |
| Diabetes mellitus | 6 (11,8%) | 5 (10,6%) | |
| Bócio | 8 (15,7%) | 6 (12,8%) | |
| Outras | 3 (5,9%) | 2 (4,3%) | |
| Duração da doença (anos) | 3 (1‐9) | ‐ | ‐ |
| Urticaria Activity Score (mediana 25‐75p) | 28 (14‐28) | ‐ | ‐ |
| Achado de angioedema (n) | 20 pacientes | ‐ | ‐ |
| Terapia da urticária | |||
| Nenhuma | 15 (29,4%) | ‐ | ‐ |
| Anti‐histamínico | 18 (35,3%) | ||
| Omalizumabe | 18 (35,3%) | ||
IMC, índice de massa corporal; p <0,05 estatisticamente significante.
Os achados são dados como mediana e intervalo interquartil (25‐75p).
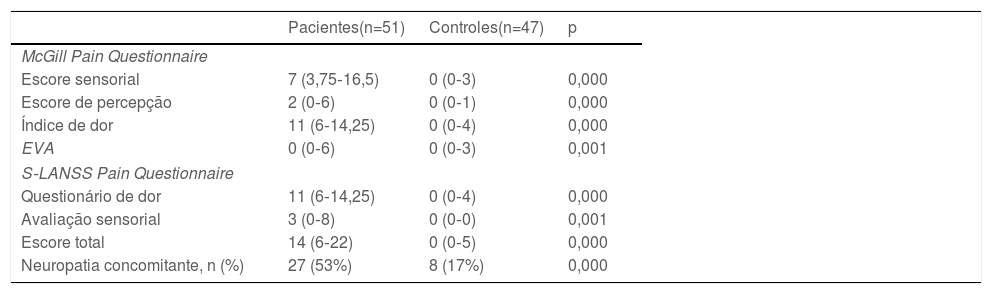
Uma avaliação dos resultados do short‐form McGill Pain Questionnaire revelou que os escores nos domínios sensorial e afetivo, escores EVA e índices de dor eram significantemente maiores no grupo de pacientes (p <0,05 para todos os casos), enquanto a avaliação geral da dor e avaliação sensorial com base na escala de dor S‐LANSS também foram significantemente maiores no grupo de pacientes. Com base na suposição de que escores> 12 indicavam neuropatia, 27 (53%) indivíduos do grupo de pacientes e 8 (17%) do grupo controle apresentavam neuropatia (p <0,05). Uma análise dos resultados do questionário revelou que a mediana do escore total de neuropatia no grupo de pacientes foi de 14, o que foi estatisticamente compatível com os achados de neuropatia (intervalo: 0‐33; tabela 2).
Avaliação das perguntas dos questionários McGill Pain Scale Short Form e S‐LANSS Pain nos grupos
| Pacientes(n=51) | Controles(n=47) | p | |
|---|---|---|---|
| McGill Pain Questionnaire | |||
| Escore sensorial | 7 (3,75‐16,5) | 0 (0‐3) | 0,000 |
| Escore de percepção | 2 (0‐6) | 0 (0‐1) | 0,000 |
| Índice de dor | 11 (6‐14,25) | 0 (0‐4) | 0,000 |
| EVA | 0 (0‐6) | 0 (0‐3) | 0,001 |
| S‐LANSS Pain Questionnaire | |||
| Questionário de dor | 11 (6‐14,25) | 0 (0‐4) | 0,000 |
| Avaliação sensorial | 3 (0‐8) | 0 (0‐0) | 0,001 |
| Escore total | 14 (6‐22) | 0 (0‐5) | 0,000 |
| Neuropatia concomitante, n (%) | 27 (53%) | 8 (17%) | 0,000 |
EVA, Escala Analógica Visual. Os achados são dados como mediana e intervalo interquartil (25p‐75p).
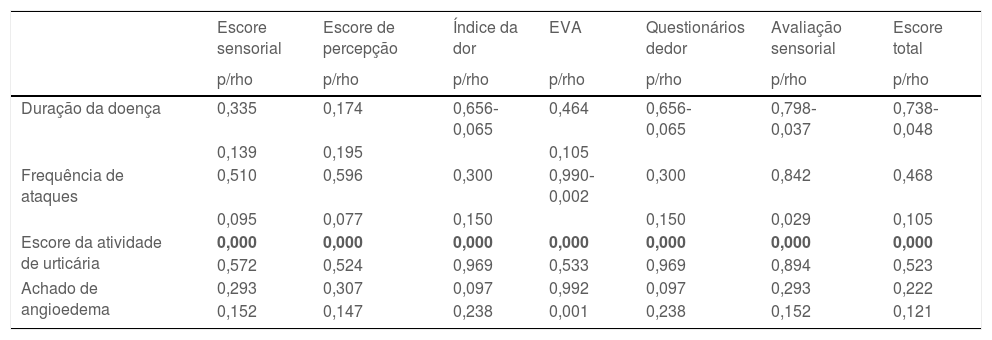
Uma análise das correlações entre os achados de ativação da doença (duração da doença, frequência dos ataques, escore de atividade de urticária e presença de angioedema) e neuropatia revelou correlação positiva estatisticamente forte, especialmente com o escore de atividade da urticária (p <0,001; variação de rho: 0,524‐0,969; tabela 3).
Correlação entre duração da doença, frequência das crises, escore de atividade de urticária, achado de angioedema e testes para neuropatia
| Escore sensorial | Escore de percepção | Índice da dor | EVA | Questionários dedor | Avaliação sensorial | Escore total | |
|---|---|---|---|---|---|---|---|
| p/rho | p/rho | p/rho | p/rho | p/rho | p/rho | p/rho | |
| Duração da doença | 0,335 | 0,174 | 0,656‐0,065 | 0,464 | 0,656‐0,065 | 0,798‐0,037 | 0,738‐0,048 |
| 0,139 | 0,195 | 0,105 | |||||
| Frequência de ataques | 0,510 | 0,596 | 0,300 | 0,990‐0,002 | 0,300 | 0,842 | 0,468 |
| 0,095 | 0,077 | 0,150 | 0,150 | 0,029 | 0,105 | ||
| Escore da atividade de urticária | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 |
| 0,572 | 0,524 | 0,969 | 0,533 | 0,969 | 0,894 | 0,523 | |
| Achado de angioedema | 0,293 | 0,307 | 0,097 | 0,992 | 0,097 | 0,293 | 0,222 |
| 0,152 | 0,147 | 0,238 | 0,001 | 0,238 | 0,152 | 0,121 |
Análise de correlação de Spearman.
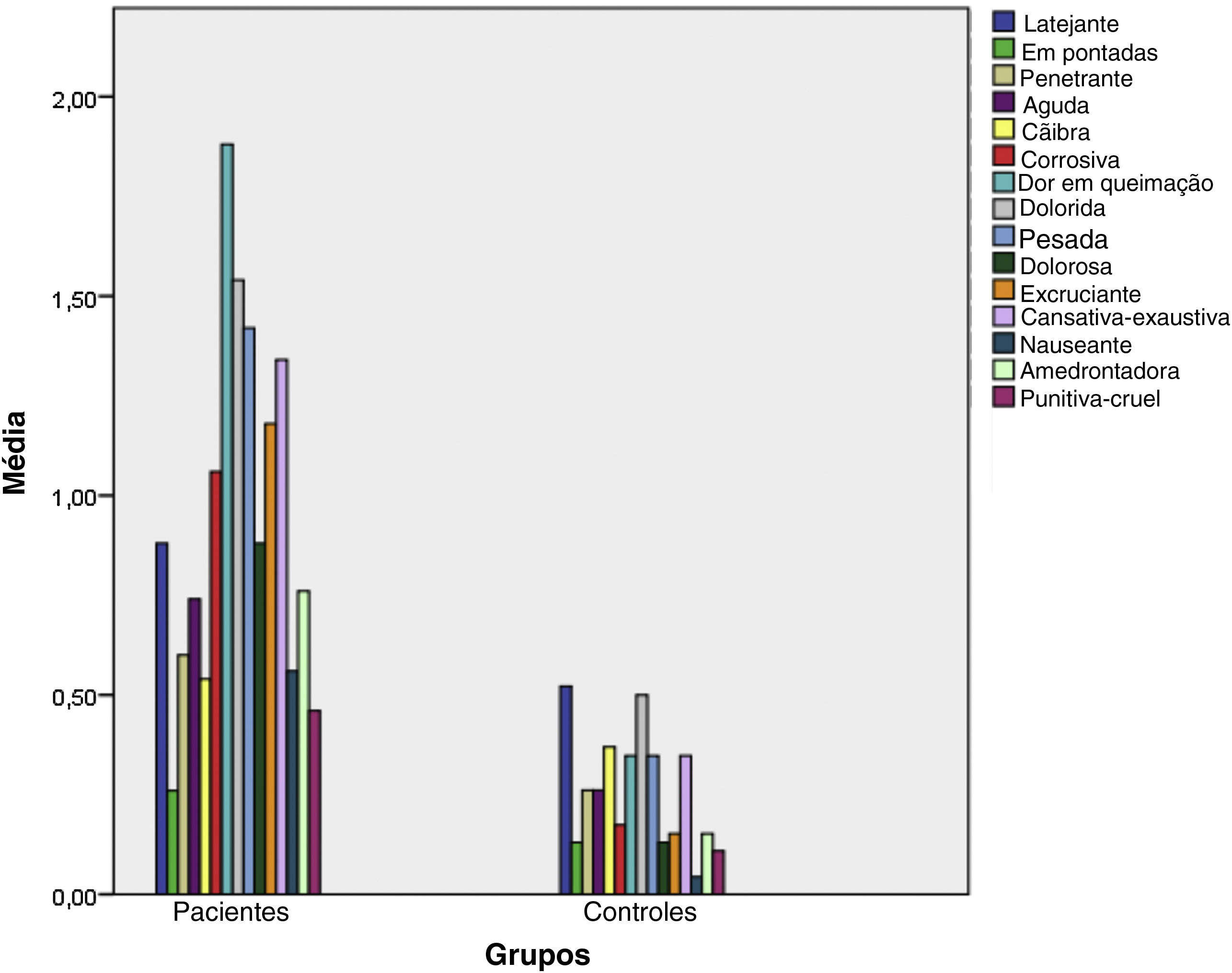
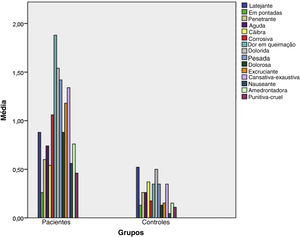
A figura 1 apresenta um gráfico de barras dos sintomas do grupo de pacientes e do grupo controle de acordo com os itens do Questionário McGill. Como pode ser visto, os descritores estatisticamente fortemente significantes foram dolorida, dor pesada, dolorosa, corrosiva e dor em queimação (p <0,001 para todos). Quanto ao domínio afetivo, os descritores significantes mais fortes foram cansativa‐exaustiva (p <0,001), nauseante e amedrontadora (p=0,001), enquanto outros eram latejante (p=0,195), súbita (p=0,591), penetrante (p=0,041), aguda (p=0,042), cãibras (p=0,591), excruciante (p=0,090) e punitiva‐cruel (p=0,018).
DiscussãoNo presente estudo, os escores significantemente mais altos foram identificados nos domínios sensorial e afetivo do short‐form McGill Pain Questionnaire, bem como nos escores EVA e índices de dor no grupo de pacientes. As avaliações gerais de dor e as avaliações sensoriais identificadas na escala de dor S‐LANSS também foram significantemente maiores no grupo de pacientes. Neuropatia foi detectada em 27 indivíduos do grupo de pacientes e 8 dos controles, respectivamente. Houve correlação positiva estatisticamente forte entre o escore de atividade de urticária e os escores do teste de neuropatia.
A dor neuropática é um problema comum na prática clínica, que afeta muitos aspectos da vida diária e está associada a problemas de saúde geral, redução da qualidade de vida, sono ruim e níveis mais altos de ansiedade e depressão. As medidas de qualidade de vida de indivíduos com dor neuropática crônica foram tão baixas quanto daqueles com depressão, doença arterial coronariana, infarto do miocárdio recente ou diabetes mellitus não controlado.11
Os mastócitos são células imunológicas que se distribuem por diferentes partes do corpo, com relatos de influência em diversas condições patológicas, como hipersensibilidade, aterosclerose, hipertensão pulmonar e infertilidade. Também há estudos relatando importante influência na patogênese da dor neuropática de várias etiologias.7 Olsson12 relatou pela primeira vez o papel dos mastócitos na dor neuropática e demonstrou a degranulação dos mastócitos no epineuro, perineuro e tecido conjuntivo endoneural em resposta ao trauma. Estudos posteriores revelaram o papel do aumento dos mastócitos nas regiões ao redor dos nervos e seus mediadores (principalmente histamina e 5‐HT) na etiologia da dor neuropática.13–15 Considerando a patogênese da UCE, parece provável que seja principalmente uma doença por ação dos mastócitos. Citocinas como histamina e fator ativador de plaquetas, triptase e leucotrienos liberados pelos mastócitos causam ativação do nervo sensorial, vasodilatação e extravasamento de plasma.16 Assim sendo, os mastócitos aparecem na etiopatogenia de doenças como a UCE e a dor neuropática. Foi hipotetizado no presente estudo que os sintomas relacionados à dor neuropática podem ser mais comuns em pacientes com UCE. Que seja de conhecimento dos autores, entretanto, não há nenhum estudo abordando esse assunto na literatura até o momento. Consequentemente, o presente estudo é o primeiro a avaliar a relação entre UCE e sintomas de neuropatia.
Já foi bem estabelecido que os mastócitos sensibilizados podem causar alergias e anafilaxia, e que também são conhecidos por contribuir para vários processos biológicos e patológicos, como fisiologia vascular, dor, prurido e câncer.17–19 Entre os estudos anteriores na literatura avaliando a relação entre doenças dermatológicas e sintomas de neuropatia, Di Carlo et al. examinaram 118 pacientes com artrite psoriásica e aplicaram questionários por meio dos quais detectaram sintomas de neuropatia em 25,4% dos pacientes.20 Garcovich et al. avaliaram sintomas de dor neuropática em 110 pacientes com hidradenite supurativa utilizando questionários e classificaram 33 (30%) dos 110 pacientes como tendo “provável dor neuropática”, 32 (29,1%) com “possível dor neuropática” e 45 (40,9%) com “dor neuropática improvável”. Os escores de dor e prurido foram correlacionados, e os pacientes relataram que suas atividades diárias foram significantemente prejudicadas em decorrência da dor. Os autores enfatizaram os fatores complexos e multifatoriais que determinam o fenótipo da dor na hidradenite supurativa.21 Inflamação perineural eosinofílica e inervação anormal de mastócitos foram demonstradas na histopatologia da pele lesional e perilesional de pacientes com hidradenite supurativa, sugerindo potencial correlato anatômico de dor “neuropática”.22 Mediadores inflamatórios derivados da lipo‐oxigenase, eicosanoides e leucotrieno B4 estão aumentados na pele lesionada e são conhecidos por serem indutores de inflamação periférica e hiperalgesia.23 À luz dessas informações, não é surpresa que os pacientes com hidradenite supurativa tendam a apresentar sintomas concomitantes de dor neuropática.
A dermatite atópica apresenta prurido intenso, semelhante à UCE, e estudos recentes relataram sintomas de dor concomitantes, além de prurido em pacientes com dermatite atópica, identificando a necessidade de questionar os pacientes a esse respeito.24–26 A dor era comumente descrita como “em queimação” e “em fisgadas” por pacientes com dermatite atópica26 que descreveram sua experiência de prurido como dolorosa, latejante, cortante, em fisgada, em queimação, aguda, com formigamento, tipo alfinetada e/ou associada a sensações de rastejamento sob a pele.24,25 Todas essas características clínicas apoiam parcialmente (mas não totalmente) o componente neuropático do prurido.
Wallis et al. examinaram 35 pacientes com paquioníquia congênita – rara doença autossômica dominante – e avaliaram a gravidade e o tipo de dor, como principal sintoma desses pacientes, por meio de questionários e testes sensoriais quantitativos. Os autores relataram que 62% dos pacientes apresentavam dor neuropática e o restante apresentava sintomas de dor nociceptiva.27 Da mesma maneira, Brill et al. fizeram um estudo recente sobre a origem da dor em pacientes com paquioníquia congênita, no qual foram aplicados os questionários McGill e Douleur Neuropathique‐4 em 62 pacientes e 45 controles que foram também submetidos a testes sensoriais. Os autores descobriram que a dor pode ser de origem neuropática e sugeriram que os pacientes poderiam se beneficiar de tratamentos orientados para a neuropatia.28
O presente estudo apresenta algumas limitações, principalmente seu desenho transversal, a pequena amostra de pacientes e o uso de escalas autorreferidas. Comorbidades como diabetes tipo 2 poderiam estar associadas à dor neuropática, mas estavam presentes em apenas uma pequena proporção da amostra e não houve diferença nas comorbidades dos dois grupos. Além disso, outra limitação foi a não realização de testes de avaliação eletrofisiológica. Os questionários aplicados podem ser considerados válidos e confiáveis para uso em testes de avaliação e, em alguns casos, podem auxiliar na identificação de doenças que não podem ser detectadas pela eletrofisiologia.
ConclusãoAlém do prurido, os pacientes com UCE devem estar cientes da possibilidade de dor neuropática concomitante. Nessa doença crônica que sabidamente afeta a qualidade de vida, a abordagem integrada dos pacientes e a identificação dos problemas associados são tão importantes quanto o tratamento da doença dermatológica. Estudos prospectivos sobre esse assunto são necessários, nos quais métodos descritivos e metodológicos sejam aplicados juntos em grandes séries de pacientes para apoiar os achados do presente estudo.
Suporte financeiroNenhum.
Contribuição dos autoresGG., H.S foram responsáveis pelo desenho do estudo. G.G recrutou os participantes. G.G e H.S participaram da obtenção de dados. H.S fez a análise estatística. G.G e H.S interpretaram os dados. GG redigiu a primeira versão do manuscrito e todos os autores revisaram criticamente o artigo.
Conflito de interessesNenhum.