A capecitabina (Xeloda®) é um agente quimioterápico citotóxico, antimetabólito. Seus eventos adversos mais comuns são diarreia, síndrome mão‐pé (SMP), hiperbilirrubinemia, hiperpigmentação, fadiga, dor abdominal e outros efeitos gastrintestinais. A SMP é reação adversa decorrente da terapia com agentes quimioterápicos, classificada em três graus. A hiperpigmentação, como efeito adverso da capecitabina, pode ocorrer em diferentes locais e em diferentes padrões. A pele, as unhas e a membrana da mucosa oral podem ser acometidas.
ObjetivoRelatar e discutir a hiperpigmentação oral associada à SMP pelo uso da capecitabina, ainda pouco descrita na literatura.
MetodologiaRevisão de literatura utilizando as bases de dados on‐line PubMed, Scielo, BVS, Lilacs, Medline, BBO e Google Acadêmico, associando os descritores “Capecitabina”, “Transtornos da Pigmentação”, “Mucosa bucal”, “Câncer” e “Síndrome Mão‐Pé”, os quais foram relacionados e utilizados para exemplificar, discutir e relatar o caso clínico exposto.
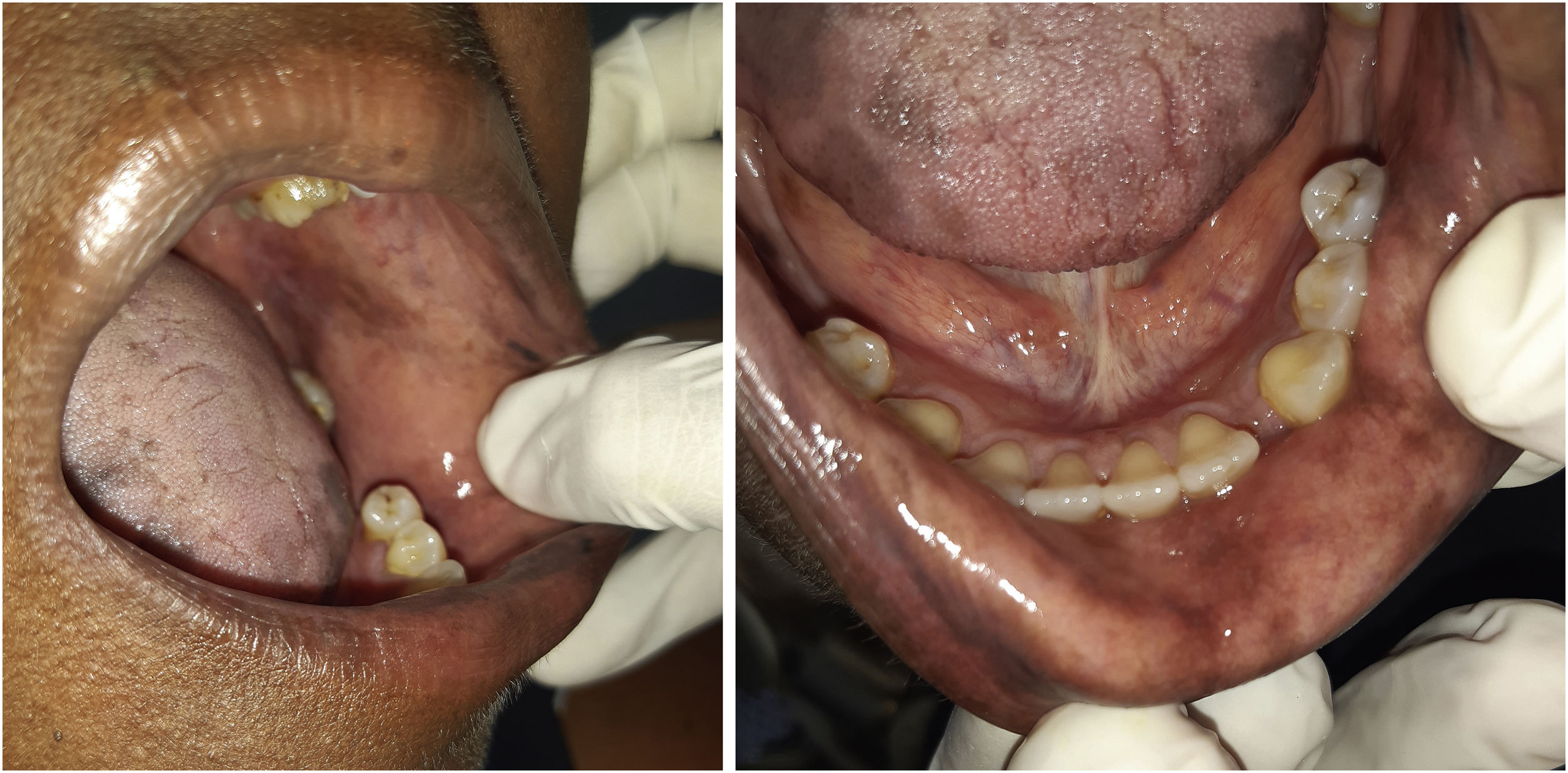
ResultadosEste relato de caso corrobora com a literatura quanto ao sexo feminino e a pele negra da paciente que foi acometida pela SMP quando sob terapia antineoplásica com capecitabina e apresentou hiperpigmentação das mãos, pés e mucosa oral. Na mucosa oral, as manchas hiperpigmentadas se apresentaram de maneira difusa, com coloração enegrecida e bordas irregulares, embora de fisiopatologia ainda desconhecida.
Limitações do estudoPoucos artigos citando pigmentação associada a capecitabina.
ConclusõesEspera‐se que este estudo possa contribuir para a identificação e o correto diagnóstico das hiperpigmentações em cavidade oral, bem como acerca dos efeitos adversos relacionados à capecitabina.
Os medicamentos antineoplásicos, amplamente utilizados no tratamento do câncer, constituem um grupo heterogêneo de substâncias químicas capazes de inibir o crescimento e/ou os processos vitais das células tumorais, visando destruir sua multiplicação desordenada.1 Podem ser administrados pelas vias oral, subcutânea, intra‐arterial, intramuscular, intratecal, intraperitoneal, intravesical, por aplicação tópica e intrarretal; a via intravenosa é a mais utilizada. Esses medicamentos podem ser agrupados nas seguintes categorias: agentes alquilantes, antimetabólitos, compostos de platina, alcaloides vegetais, antibióticos antitumorais, enzimas, hormônios e modificadores da resposta biológica.2–4
A capecitabina (Xeloda®) é um agente quimioterápico citotóxico, antimetabólito, aprovado para uso desde 1998. Trata‐se de um pró‐fármaco de fluoropirimidina (5’‐deoxi‐5‐fluorouridina) para administração oral, amplamente usado, eficaz e bem tolerado no tratamento de uma série de cânceres, incluindo câncer de mama, de cólon e reto, gástrico, pancreático e outros.5,6 A capecitabina (N‐4‐pentiloxicarbonil‐5′‐desoxi‐5‐fluorocitidina) foi projetada para ser enzimaticamente convertida em sua forma ativa, o 5‐fluorouracil (5‐FU), que atua como antimetabólito para retardar o crescimento do tumor.7,8
Por ser medicação de administração oral, sua vantagem em relação ao 5‐FU é a facilidade de administração, uma vez que o 5‐FU é injetável, apresentando meia‐vida curta, além da necessidade de acesso venoso central, gerando maior desconforto para o paciente e risco de complicações como infecção.8
Em geral, a capecitabina é bem tolerada e tem perfil de tolerabilidade melhorado em comparação com 5‐FU, mas tem efeito inespecífico e acaba lesando também células de tecido saudável, causando efeitos adversos. Seus eventos adversos limitantes de dose mais comuns são diarreia, síndrome mão‐pé (SMP), hiperbilirrubinemia, hiperpigmentação, fadiga, dor abdominal e outros efeitos gastrintestinais, como náuseas/vômitos e estomatite.4,5,9 A maioria das reações é reversível com a redução das doses ou o aumento dos intervalos entre elas.10
A SMP foi descrita em associação com quimioterápicos pela primeira vez por Zuehlke, em 1974. O National Câncer Institute (NCI)11 dos Estados Unidos classifica os eventos adversos em três graus, classificando a SMP da seguinte maneira:
- •
Grau I: o paciente apresenta alterações cutâneas mínimas, como dormência, disestesia, parestesia, edema, eritema e/ou desconforto nas mãos e/ou nos pés, porém não há dor.
- •
Grau II: apresenta manifestações de eritema doloroso, descamação, fissuras e edema nas mãos e/ou nos pés afetando a execução das atividades diárias.
- •
Grau III: apresenta alterações graves da pele, como descamação úmida, edema, ulcerações, surgimento de bolhas, com dor intensa e limitação de atividades diárias, de autocuidado e laborais.
A hiperpigmentação, como efeito adverso da capecitabina, pode ocorrer em diferentes locais e em diferentes padrões. A pele, as unhas e as membranas mucosas, como a mucosa oral, podem ser acometidas. Elas podem começar dias a meses após o início do tratamento e, na maioria das vezes, desaparecem meses após a descontinuação da terapia.4,12 É classificada pelo NCI em dois graus:11
- •
Grau I: hiperpigmentação afetando menos de 10% da área corpórea, sem impacto psicossocial.
- •
Grau II: hiperpigmentação afetando mais de 10% da área corpórea, associado a impacto psicossocial.
As manifestações clínicas de pigmentações relacionadas ao uso de fármacos variam. A maioria produz melanose cutânea difusa e na superfície da mucosa oral, porém outras podem causar padrão de mancha única e uniforme.13 Quando induzidas por fármacos, as manchas são mais enegrecidas e exibem bordas irregulares, cujo aspecto é semelhante a lesões malignas como os melanomas, enfatizando a importância do diagnóstico diferencial.14
É importante que os profissionais de saúde, como cirurgiões‐dentistas e médicos, saibam identificar os aspectos clínicos de alterações sistêmicas e da coloração da mucosa produzida pelo uso de medicamentos antineoplásicos, tendo em vista o diagnóstico diferencial com as diversas manifestações orais expressas por mudança de cor.
Objetivou‐se neste estudo relatar a hiperpigmentação da mucosa oral associada à SMP pelo uso da capecitabina, ainda pouco descrita na literatura.
MetodologiaFoi realizada revisão de literatura utilizando as bases de dados on‐line PubMed, Scielo, BVS, Lilacs, Medline, BBO e Google Acadêmico, associando os descritores “Capecitabina”, “Transtornos da Pigmentação”, “Mucosa bucal”, “Câncer” e “Síndrome Mão‐Pé”, os quais foram relacionados e utilizados para exemplificar, discutir e relatar o caso clínico exposto. Não houve restrições de idiomas e todos os tipos de estudos foram considerados.
A participante do relato de caso assinou o Termo de Consentimento Livre e Esclarecido, consentindo a divulgação de seu caso para fins acadêmicos. Este subprojeto integra projeto aprovado pelo Comitê de Ética em Pesquisa da Universidade de Pernambuco sob o parecer n° 3.184.856, realizado no Centro de Oncologia do Hospital Universitário Oswaldo Cruz da Universidade de Pernambuco (CEON/HUOC/UPE), localizado na cidade do Recife, Pernambuco, Brasil.
As fotos que ilustram o trabalho são do Acervo do Serviço de Odontologia do CEON‐ODONTO/HUOC/UPE.
ResultadosCaso clínicoPaciente do sexo feminino, negra, obesa, 54 anos, diagnosticada com carcinoma ductal invasivo em mama direita, triplo negativo, estádio T2N0M0 (AP: 176123) em 2018 e acompanhada no CEON/HUOC/UPE. Inicialmente, foi realizada mastectomia com esvaziamento axilar e quimioterapia com esquema AC‐T (doxorrubicina, ciclofosfamida e paclitaxel) até janeiro de 2019. Em dezembro de 2019 houve colapso parcial da vértebra L3 e diagnóstico de recidiva com metástase óssea, para o qual foi indicado radioterapia em coluna lombar (3.000 cGy); iniciou‐se, em janeiro de 2020, quimioterapia com capecitabina e ácido zoledrônico (Zometa®).
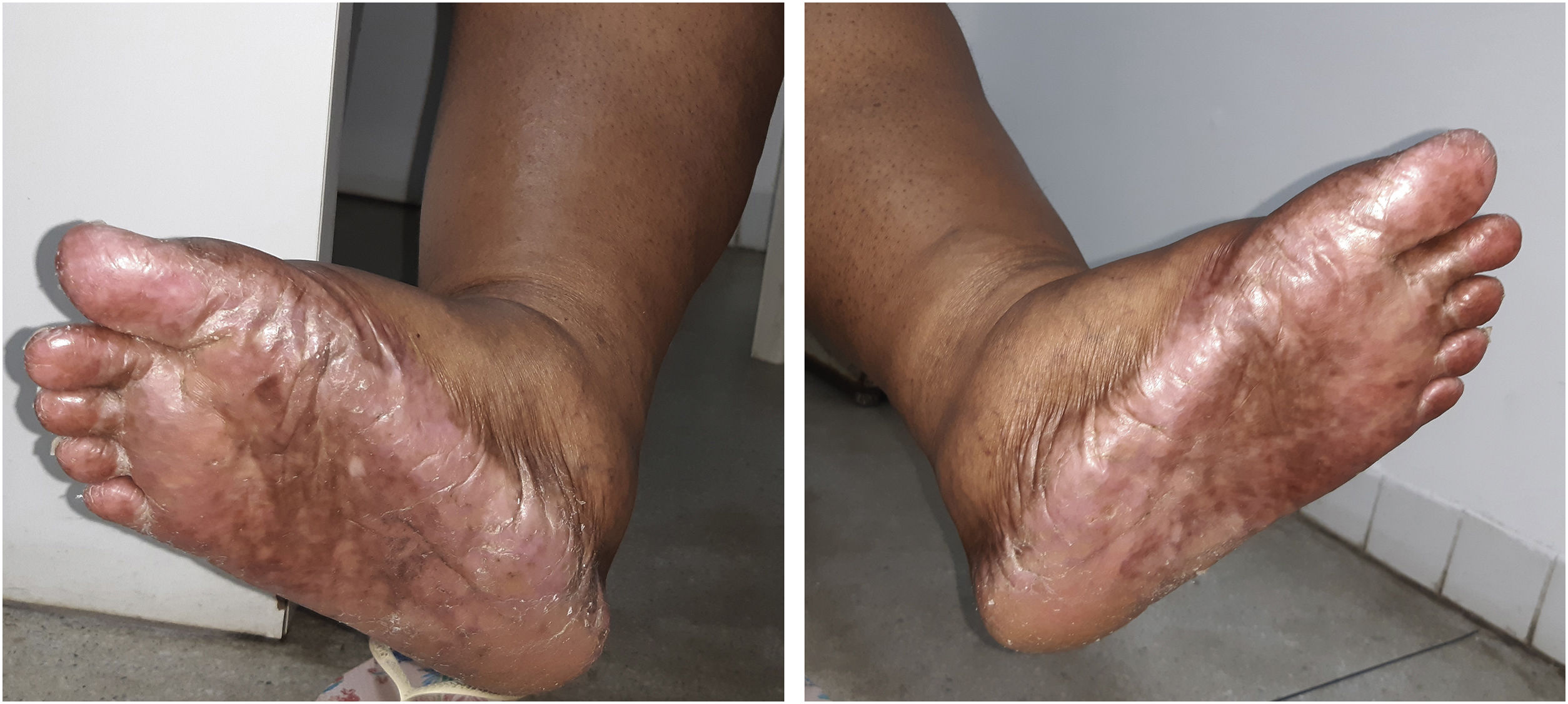
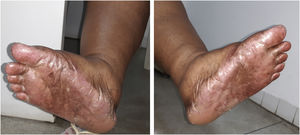
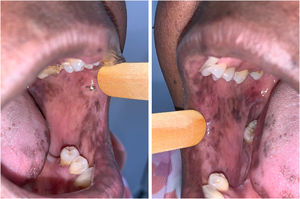
A dose recomendada para monoterapia de capecitabina é de 1.250 mg/m2, 2×/dia, equivalente à dose diária de 2.500mg/m2. Como se tratava de paciente obesa, sua superfície corpórea era equivalente a mais ou menos 1,5 m2, por isso a dose prescrita foi de 3.000 a 3.500 mg diários por 21 dias, seguidos por sete dias sem o medicamento. Após dois ciclos de uso da capecitabina, a paciente começou a apresentar a SMP, caracterizada por vermelhidão, ressecamento e inchaço nas palmas e plantas, com sensação de formigamento ou queimação, e apresentou hiperpigmentação em mãos, pés (fig. 1) e mucosa oral. Não havia história de lesões semelhantes ou reação adversa a outros fármacos.
A SMP variou do grau 1 ao 3 ao longo do tratamento, com surgimento de bolhas nos pés e nas mãos no grau mais avançado, impedindo a paciente de realizar as atividades diárias, havendo necessidade de pausa na medicação e uso tópico de hidratantes com ureia a 10% ou 20%, nas mãos e nos pés.
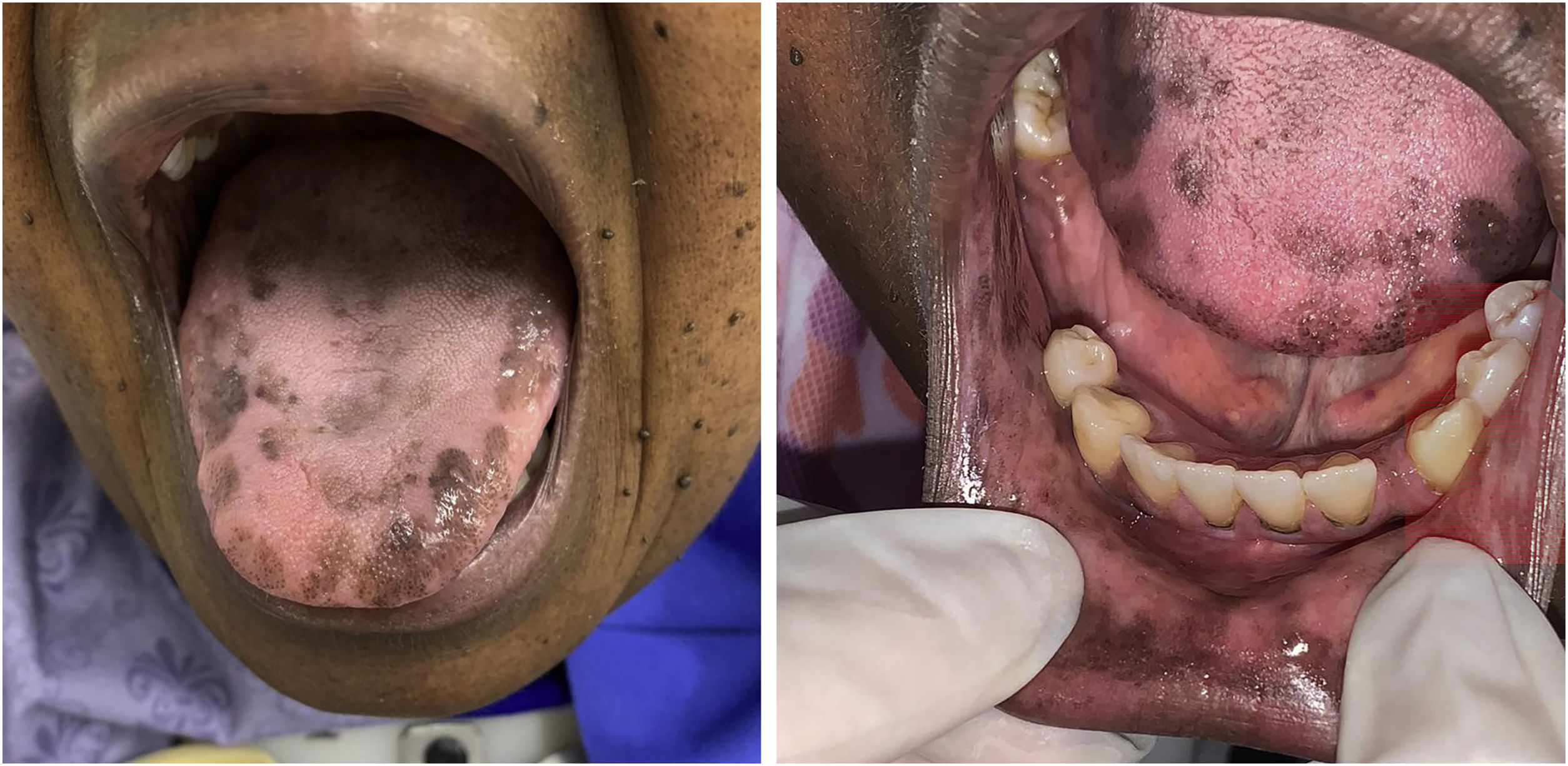
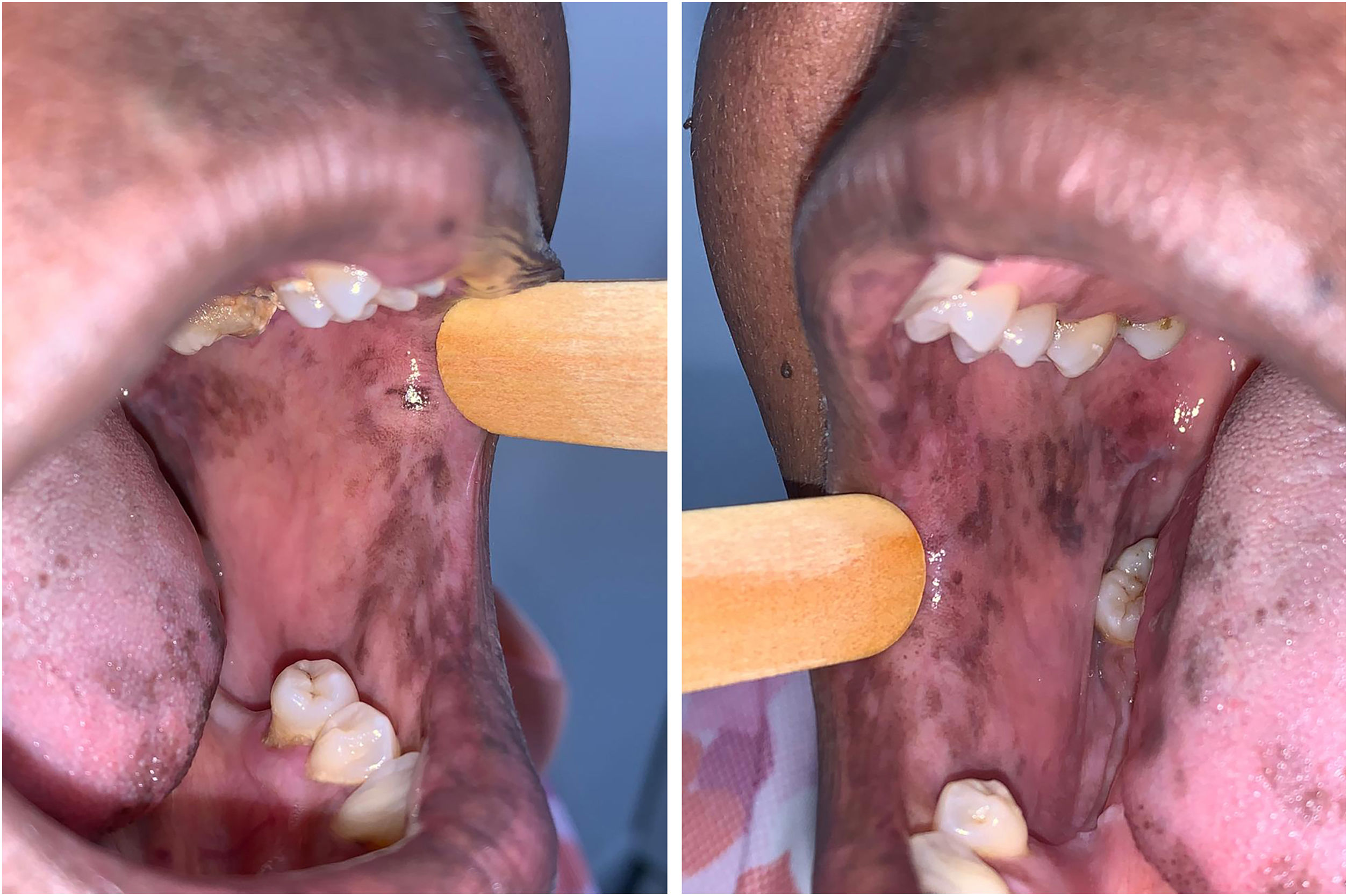
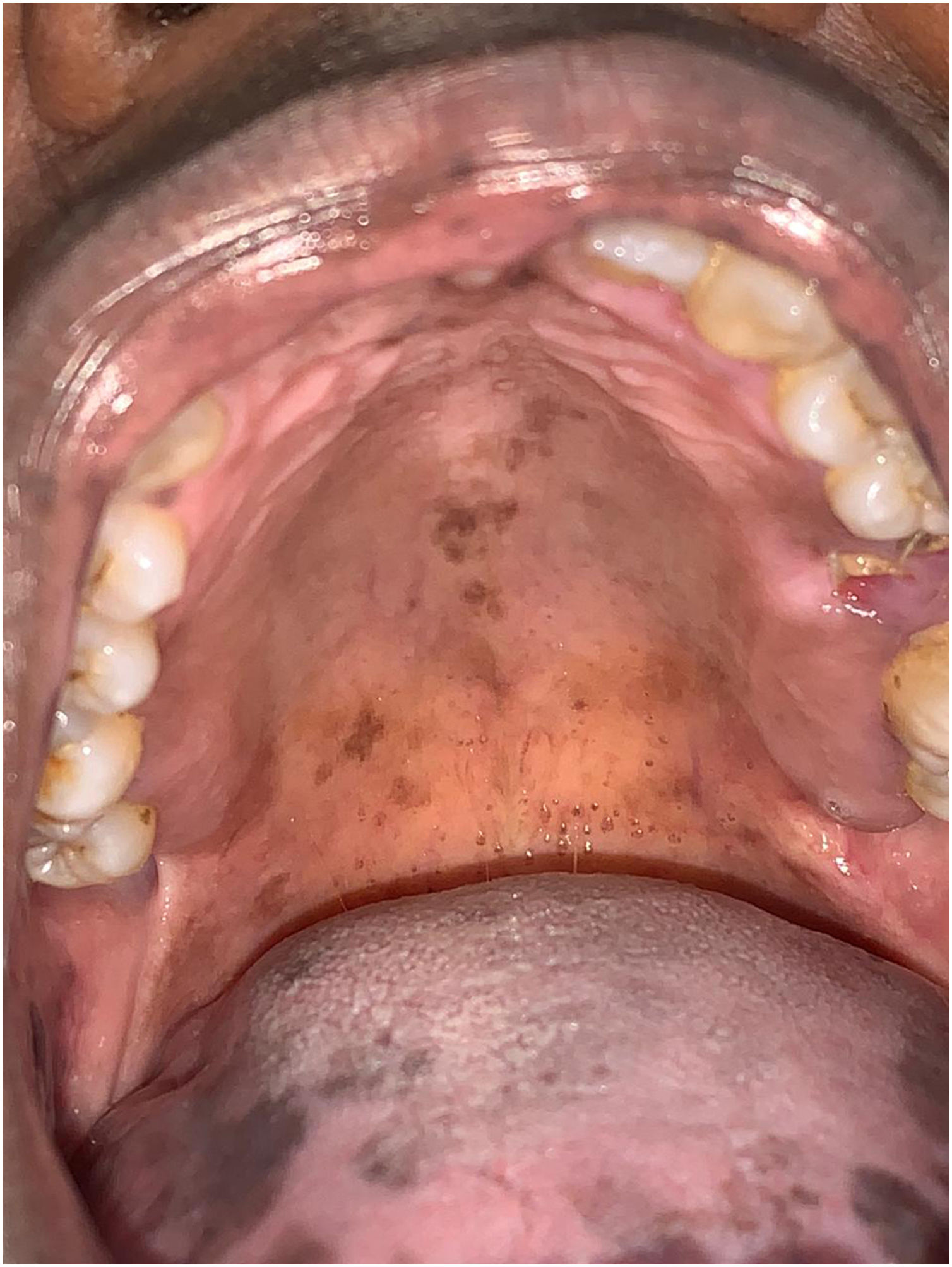
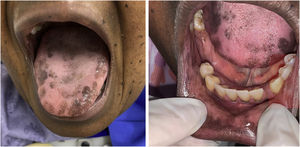
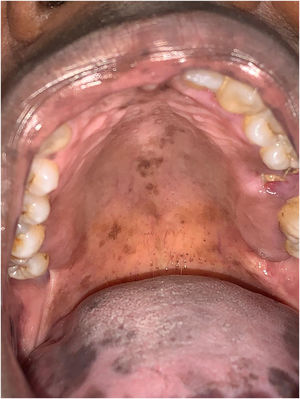
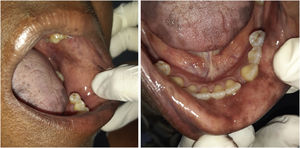
A paciente foi encaminhada ao Serviço de Odontologia do CEON/HUOC/UPE. Ao exame extraoral, foram observadas hiperpigmentação perioral e manchas pigmentadas nas mãos e nos pés envolvendo dorso e palmas, principalmente na região sobre as articulações interfalangianas proximais e metacarpofalangiana, dorso e peito do pé. Intraoralmente, foram identificadas manchas hiperpigmentadas na língua e na região interna dos lábios (fig. 2), na mucosa jugal bilateral (fig. 3) e no palato duro (fig. 4), parcialmente dentada, apresentando um dente fraturado e higienização oral insatisfatória. Foi detectada a necessidade de tratamento dentário clínico restaurador, periodontal e instituído o Protocolo Operacional Padrão de cuidados Orais (POP‐Oral) para a prevenção e o controle dos efeitos colaterais orais decorrentes da quimioterapia.15 A paciente foi orientada acerca da contraindicação de procedimentos cirúrgicos orais em virtude do uso de ácido zoledrônico e de seus efeitos. Durante as consultas de acompanhamento, observou‐se diminuição leve das manchas em mucosa oral (fig. 5), mãos e pés em momentos de pausa da medicação e aumento da hiperpigmentação ao retornar o ciclo com capecitabina.
Atualmente, a paciente segue em quimioterapia com capecitabina, no geral tolerando bem o regime; as áreas pigmentadas seguem inalteradas, com episódios de diminuição e aumento de acordo com o ciclo da quimioterapia. A paciente segue em acompanhamento com as equipes de Oncologia e de Odontologia do CEON/HUOC/UPE.
DiscussãoA Organização Mundial de Saúde define reação adversa a medicamento (RAM) como resposta nociva e não intencional a um medicamento e que ocorre nas doses normalmente usadas em seres humanos para profilaxia, diagnóstico e tratamento de doenças ou para a modificação de funções fisiológicas.16 Em pacientes oncológicos, algumas dessas reações podem ser fatais, sendo necessária maior cautela do profissional que presta assistência em saúde.17
De acordo com Sanches Jr. et al.,10 a identificação do padrão de reação adversa relacionado com o fármaco desencadeante e da toxicidade é de extrema importância para os profissionais de saúde, assim como o diagnóstico diferencial com processos infecciosos e manifestações específicas da neoplasia.
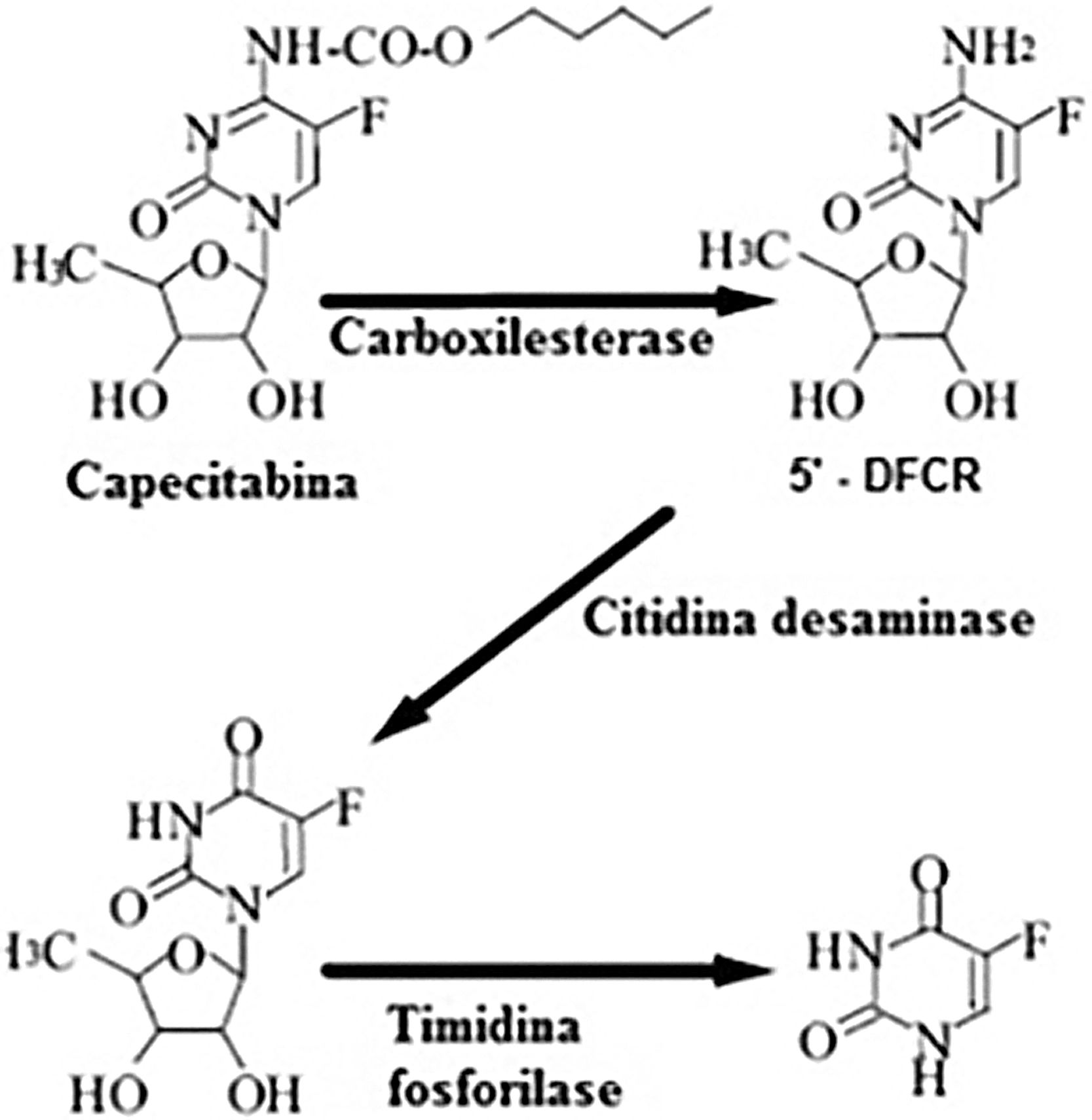
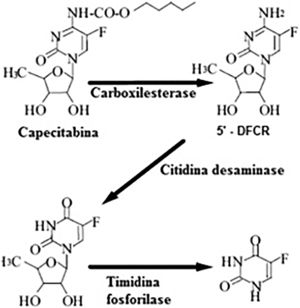
O pró‐fármaco da capecitabina é facilmente absorvido a partir do trato gastrintestinal e é metabolizado rapidamente em 5‐FU, por meio de um processo enzimático de três etapas (fig. 6). Na primeira etapa, a capecitabina é hidrolisada pela carboxilesterase no fígado, para o intermediário 5’‐desoxi‐5‐fluorocitidina (5’‐DFCR). Na segunda etapa, o 5’‐DFCR é convertido em 5′‐desoxi‐5‐fluorouridina (5′‐DFUR) pela citidina desaminase, que é altamente ativa no fígado e no tecido tumoral. Na terceira etapa, o 5′‐DFUR é convertido em 5‐FU pela timidina fosforilase (TF), presente no tecido tumoral, resultando na liberação de 5‐FU preferencialmente no tecido tumoral.5–7
Via metabólica de transformação da capecitabina em 5‐fluorouracil.
Fonte: Martins et al.6.
Rodriguez et al.18 e Dean et al.17 relatam que uma vez que a capecitabina é ativada para 5‐FU, começa a exercer sua atividade citotóxica, inibindo a síntese de DNA, o processamento do RNA e a síntese de proteínas, causando danos celulares e efeitos adversos.
Segundo Surjushe et al.,19 a SMP, também conhecida como eritrodisestesia palmoplantar ou eritema acral, é reação adversa decorrente da terapia com agentes quimioterápicos e biológicos, e é citada por Rocha Filho,20 Bispo Junior et al.21 e Costa et al.22 como o efeito adverso mais comum e limitante do uso da capecitabina, diagnosticado em cerca de 50% dos pacientes tratados com esse quimioterápico. A bula da capecitabina, com base em informações obtidas no pós‐venda, indica que a SMP foi classificada como reação adversa muito comum; entre todos os pacientes que desenvolveram a reação, 17,0% apresentaram grau 3, tal qual ora relatado.23
O mecanismo que leva à ocorrência da SMP ainda é desconhecido, porém várias teorias vêm sendo propostas. Um mecanismo proposto por Cruz et al.24 e Simão et al.25 consiste no extravasamento dos antineoplásicos por capilares, principalmente de mãos e pés, por serem locais do corpo mais sujeitos a traumas em decorrência de atividades cotidianas, levando a danos nos tecidos locais e subjacentes, e também por características específicas das mãos e dos pés, como maior exposição a variações de temperatura, microvascularização diferenciada, grandes quantidades de queratinócitos, glândulas écrinas e células epidérmicas em constante divisão celular.
Já Milano et al.5 explicam que a ocorrência da SMP em pacientes que fazem uso da capecitabina também poderia ser justificada pela presença da enzima TF, responsável pela metabolização do pró‐fármaco a 5‐FU nos queratinócitos, o que poderia levar à produção local e ao acúmulo dos metabólitos ativos nas mãos e nos pés, lesando as células da pele.
O diagnóstico da SMP é feito com base em suas características clínicas e, neste relato de caso, a paciente foi diagnosticada com todos os graus em diferentes momentos. Quando no estágio mais debilitante, houve a necessidade de pausa na medicação, conduta preconizada por Farr e Safwat,26 que relatam que o manejo mais efetivo da SMP consiste no aumento do intervalo entre as administrações do fármaco capecitabina, diminuição da dose ou interrupção do tratamento até a redução da toxicidade para graus 1 ou zero. Outras medidas para o tratamento da SMP incluem o uso de emolientes tópicos, antibióticos para prevenção de infecções secundárias, esteroides tópicos, piridoxina e inibidores da COX‐2.27
A maioria dos relatos de caso encontrados na literatura traz a mulher como principal paciente a desenvolver a SMP, o que pode ser afirmado num estudo realizado por Costa et al.,22 que relatou que a população feminina predominou entre os casos de SMP (53,3% mulheres e 46,6% homens); Miller et al.28 consideraram o sexo feminino fator de risco para o desenvolvimento da SMP. Ainda no estudo realizado por Costa et al.,22 notou‐se que a idade média dos pacientes que desenvolveram a SMP era de 57 anos, diferente do que diz Rocha Filho,20 que aponta não ter observado nenhuma predileção por idade e sexo com o uso da capecitabina.
Os estudos de Narasimhan et al.29 e Saif e Sandoval30 encontraram maior frequência de SMP entre pacientes negros tratados com capecitabina do que em pacientes brancos sob o mesmo regime terapêutico. Os autores observaram que, em negros, a capecitabina administrada na dosagem recomendada leva à hiperpigmentação das palmas e plantas, o que ainda não foi relatado em pacientes brancos. Assim, os estudos indicam que o padrão de manifestações da SMP é diferente entre diferentes origens étnicas, e corroboram com as características clínicas encontradas na paciente, negra, do presente relato, que também apresentou hiperpigmentação em mãos e pés. Vasudevan31 afirma que a hiperpigmentação das mãos e pés, em vez do eritema, é considerada manifestação inicial na maioria dos pacientes.
Saif e Sandoval,30 inclusive, recomendam que outra classificação seja feita, com base nas características encontradas na SMP em negros:
- •
Grau 1: hiperpigmentação das palmas e plantas.
- •
Grau 2: espessamento da pele das palmas e plantas, com descamação, dor e perda de função.
- •
Grau 3: ulceração, dermatite ou descamação úmida, dor intensa e perda de função.
Segundo informações da bula do medicamento, a hiperpigmentação ocorreu em menos de 5% dos pacientes incluídos nos estudos clínicos realizados no desenvolvimento da capecitabina.23
Sabe‐se que a hiperpigmentação ocorre ao mesmo tempo que a SMP, embora não esteja claro se ambas estão relacionadas ou são entidades separadas que ocorrem simultaneamente. No entanto, a maioria dos estudos a tratam como uma variação e parte da apresentação inicial da SMP.32
Variações da SMP podem ser encontradas, como ceratodermia, esclerodermia, melanoníquia e pigmentações cutâneas. De acordo com Vasudevan,31 seu estudo foi o primeiro a relatar e descrever um caso de pigmentação oral associado a SMP como efeito colateral da capecitabina. O paciente do caso descrito por Vasudevan31 era um homem negro, de 59 anos, que durante terapia com a capecitabina apresentou hiperpigmentação de pés e mãos, além de manchas hiperpigmentadas em dorso de língua.
Posteriormente, Caprez et al.32 apresentou, ao que tudo indica ser, o segundo relato de caso relatado na literatura sobre pigmentação oral associada ao uso da capecitabina. Tratava‐se de uma paciente negra, de 80 anos, que após início da quimioterapia começou a apresentar hiperpigmentação de mãos, pés e face, além de manchas hiperpigmentadas em língua e rebordo alveolar superior e inferior.
Ambos os casos relatados apresentam semelhanças com o presente estudo, tanto na associação com a SMP quanto nos locais de acometimento das manchas em mucosa oral, bastante incomuns e raros.
Sweetman9 e Cury‐Martins et al.4 citam em seus trabalhos os distúrbios da pigmentação da pele e hiperpigmentação das mucosas como eventos adversos que podem ocorrer com o uso da capecitabina, mas a fisiopatologia exata ainda não é bem compreendida. Segundo Alfreijat,33 foi sugerido que o hormônio estimulador dos melanócitos (MSH) pode ser potencializado por certos agentes quimioterápicos, e que isso pode ser responsável pela maior prevalência desse efeito adverso em pacientes de pele escura. Neville et al.34 expõem que como em muitos casos de pigmentação melânica aumentada, as mulheres são mais sensíveis, muito provavelmente porque existe uma interação com os hormônios sexuais.
Outros estudos relatam casos de pigmentação oral envolvendo outros quimioterápicos, como os casos apresentados por Blaya e Saba35 e Alfreijat,33 que relatam aparecimento de manchas hiperpigmentadas na língua dos pacientes, assintomáticos, sem qualquer envolvimento com nenhuma outra parte do corpo, durante quimioterapia com doxorrubicina e ciclofosfamida. Segundo Neville et al.,34 a pigmentação da mucosa oral relacionada aos medicamentos quimioterápicos é mais comumente associada ao uso de doxorrubicina, bussulfano, ciclofosfamida ou 5‐FU.
Inúmeros medicamentos têm sido considerados causadores de pigmentações na mucosa oral. Essas alterações pigmentares têm sido associadas ao uso de fenolftaleína, minociclina, tranquilizantes, antimaláricos, estrogênio, agentes quimioterápicos e alguns medicamentos antirretrovirais.34 Neville et al.34 referem também que as apresentações clínicas da pigmentação relacionada ao uso de fármacos variam e qualquer superfície mucosa pode estar envolvida, mas a gengiva inserida e a mucosa jugal são os sítios mais afetados, podendo ter aparência similar com a pigmentação racial.
Nesse caso, a paciente apresentou manchas difusas, com coloração enegrecida e bordas irregulares, espalhadas por bordas e dorso de língua, mucosa julgal bilateral, palato duro, região perioral e interna dos lábios, sem necessidade de tratamento, embora possa haver preocupações estéticas, pois foi observada melhora significante da SMP e da hiperpigmentação quando a medicação foi interrompida, confirmando que a SMP com comprometimento hiperpigmentar oral está associada ao uso do antineoplásico capecitabina.
ConclusãoÉ imprescindível a identificação e o conhecimento acerca dos efeitos colaterais de medicamentos antineoplásicos, tendo em vista a necessidade de seu controle a fim de favorecer o sucesso do tratamento e a qualidade de vida do paciente durante e após a terapia antineoplásica.
A hiperpigmentação oral induzida pelo uso da capecitabina e associada à SMP já é uma realidade conhecida, embora ainda haja necessidade de estudos mais aprofundados sobre a temática abordada, a fim de elucidar dúvidas e fornecer mais explicações sobre sua fisiopatologia, além de novas atualizações na bula e classificação dos efeitos adversos. Uma ampla variedade de lesões e condições pode resultar em pigmentação anormal da pele e da mucosa oral. Diante disso, espera‐se que este estudo possa contribuir para a identificação e o correto diagnóstico das hiperpigmentações em cavidade oral, bem como acerca dos efeitos adversos relacionados à capecitabina.
Suporte financeiroSecretaria Estadual de Saúde, Recife, PE, Brasil.
Contribuição dos autoresAnna Danielly Almeida do Nascimento: Concepção e o desenho do estudo; redação do artigo.
Débora Maria Porto: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Aurora Karla de Lacerda Vidal: Participação efetiva na orientação da pesquisa.
Conflito de interessesNenhum.
Como citar este artigo: Nascimento ADA, Porto DM, Vidal AKL. Capecitabine‐induced oral mucosal hyperpigmentation associated with hand‐foot syndrome – a literature review. An Bras Dermatol. 2023;98:302–9.
Trabalho realizado no Centro de Oncologia, Hospital Universitário Oswaldo Cruz, Universidade de Pernambuco, de Recife, PE, Brasil.