Bleomicina é quimioterápico utilizado para tratamento de várias neoplasias, incluindo câncer de pele não melanoma, e é eficaz no tratamento do carcinoma basocelular (CBC) via infiltração intralesional. A técnica dermatológica de drug delivery, que abrange tecnologias como laser de CO2, Dermapen, Dermaroller e microinfusão de medicamento na pele (MMP®), entregam a medicação desejada para tratar neoplasias cutâneas e também atuam no rejuvenescimento.
ObjetivoTratar lesões de CBC utilizando bleomicina via MMP®.
MétodosForam tratadas 98 lesões de CBC em diferentes áreas anatômicas utilizando a tecnologia de MMP® para administrar e distribuir bleomicina de maneira uniforme em toda lesão e na margem de segurança delimitada.
ResultadosA taxa de cura após seis meses foi de 96,94%; sendo que as recidivas não estiveram associadas a tamanho e/ou profundidade das lesões. Os efeitos adversos foram os esperados.
Limitações do estudoO seguimento foi de apenas seis meses.
ConclusãoA via terapêutica MMP® mostrou‐se promissora e eficaz.
O carcinoma basocelular (CBC), considerado o câncer de pele mais comum no mundo,1 está entre os de maior prevalência no Brasil. Apesar do baixo risco de metástases, é um câncer com caráter destrutivo no local que se encontra. O CBC tem diferentes tipos histológicos, que podem se comportar com baixa agressividade (tipos superficial e nodular) ou alta agressividade (tipos esclerodermiforme e micronodular). As diferentes partes do corpo também têm suas divisões de risco; a localização pode ser classificada como áreas de baixo risco em tronco e membros, médio risco em cabeça e pescoço e alto risco no “H” da face, genital, mãos e pés.2
A indicação terapêutica padrão ouro para o CBC é a exérese cirúrgica. Pode‐se optar pela cirurgia convencional ou cirurgia micrográfica de Mohs – a escolha vai depender de localização anatômica, tipo histológico, número de recidivas, imunossupressão, comorbidades, estado nutricional, porte cirúrgico, dentre outros fatores. Dentre as terapias superficiais, radioterapia, imiquimode, 5‐fluouracil, crioterapia e terapia fotodinâmica tiveram o melhor desempenho, nesta ordem, em relação ao sucesso do tratamento.3
A escolha do método ideal para cada paciente vai depender de todos os fatores possíveis de serem avaliados, como idade, comorbidades, área anatômica, quantidade de lesões, facilidade de acesso ao tratamento, disponibilidade do tratamento na rede privada e pública, tipo histológico do tumor, além da experiência prática de cada médico. Portanto, avaliar novas técnicas de tratamento, unindo terapêuticas já consagradas, torna‐se interessante do ponto de vista da prática médica.
A aplicação de medicamentos na pele, realizada a partir de diferentes modalidades terapêuticas (tópica, infiltração, mesoterapia, drug‐delivery – Dermapen®, Dermaroller®, laser CO2), tem como objetivo diferentes aplicabilidades terapêuticas, dependentes de cada técnica e medicação empregada. Na técnica de microinfusão de medicamento na pele (MMP®), simultaneamente ao momento em que a pele está sendo perfurada, a medicação está sendo injetada na pele. Nessa técnica, a máquina é ajustada para que a agulha atinja o nível desejado (derme superficial, média ou profunda) e a medicação seja levada ao nível escolhido.
O sulfato de bleomicina é um antibiótico,4 antitumoral ou citotóxico, administrado por diferentes vias (subcutânea, intramuscular, intrapleural e endovenosa), aprovado pela Food and Drug Administration (FDA, EUA) como agente quimioterápico para tratar malignidades. A bleomicina tem como suas principais indicações o carcinoma espinocelular, carcinoma de testículo, linfomas e derrame pleural maligno.5 Seu uso no manejo do CBC, administrado pela via intralesional na pele, também se mostrou eficaz em alguns estudos.6
Além da bleomicina, outros agentes intralesionais mais comumente usados (principalmente off‐label) no tratamento do CBC são metotrexato (MTX), 5‐fluorouracil (5‐FU) e interferona – interferona‐α e 5‐FU são mais amplamente utilizados.5 Existem relatos de tratamento bem‐sucedido com bleomicina em lesões cutâneas de verrugas, queloides, hemangioma, ceratoacantoma, carcinoma de células escamosas em estágio inicial e lesões únicas de sarcoma de Kaposi e micose fungoide.7
Procurando avaliar a eficácia terapêutica dessa nova tecnologia associada ao consagrado quimioterápico bleomicina, propôs‐se neste trabalho tratar lesões de CBC.
Materiais e métodosO presente estudo foi submetido à apreciação e aprovação do Comitê de Ética em Pesquisa do Hospital Universitário Júlio Muller (Cep‐HUJM) da Universidade Federal do Mato Grosso (UFMT). Este ensaio clínico experimental foi realizado no Ambulatório de Cirurgia Dermatológica da Residência de Dermatologia do HUJM. Os pacientes foram selecionados por amostra de conveniência entre todos os pacientes encaminhados ao Ambulatório de Cirurgia Dermatológica do HUJM.
Dentre os pacientes atendidos que tiveram o diagnóstico clínico‐dermatoscópico de CBC, foram incluídos todos os maiores de 18 anos que não apresentassem os seguintes critérios de exclusão: lesões em área de alto risco, em cuja avaliação clínica fosse imperativo tratamento cirúrgico; mulheres gestantes e em amamentação; lesões que estivessem localizadas em áreas que comprometessem a execução da técnica (borda ciliar, conduto auditivo interno, região genital e interglútea); lesões em localização anatômica que o tratamento viesse a comprometer funcionalmente o paciente; lesões em mucosa labial; lesões com duas ou mais recidivas; lesões aderidas a planos profundos; condições clínicas que tornassem inviável a realização da técnica (imunossupressão, transplantados); não aceitação pelo paciente em tratar com essa opção terapêutica.
Aos que atendiam os critérios preestabelecidos, foi oferecida a possibilidade de tratamento pela técnica MMP®. Dentre os que aceitaram participar do estudo, foi entregue o termo de consentimento livre e esclarecido (TCLE) e submetidos à biopsia por fuso das lesões para se obter a comprovação diagnóstica, o tipo histológico, a espessura da biopsia e a espessura do tumor.
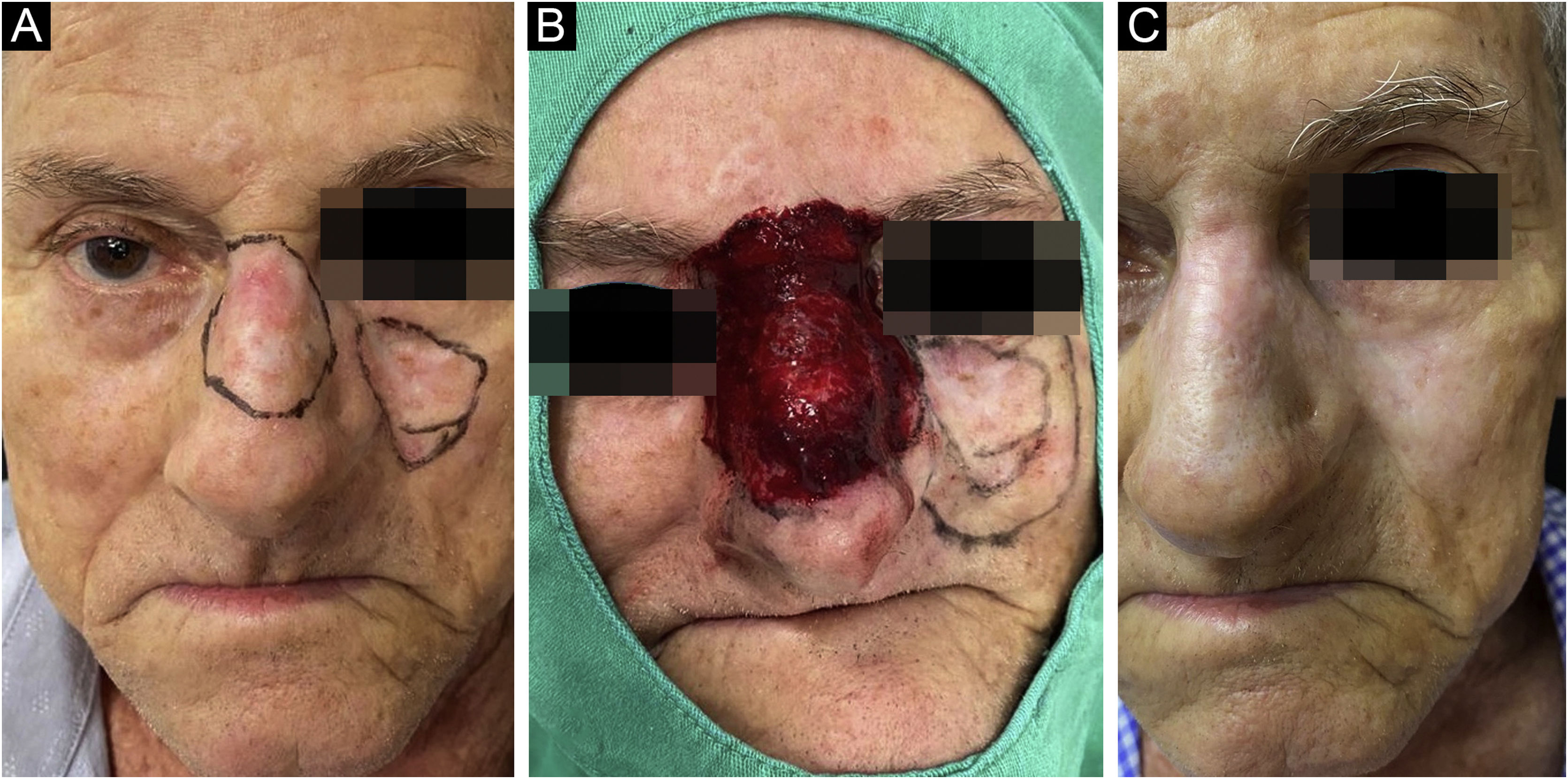
Confirmado o diagnóstico, os pacientes seguiram todos os cuidados de uma cirurgia convencional, com delimitação da lesão pela dermatoscopia, demarcação das margens cirúrgicas – que variaram de 0,5 a 1cm, conforme a localização anatômica – e definição das margens, seguida de antissepsia local, colocação de campos cirúrgicos estéreis e anestesia local com lidocaína e vasoconstritor para a realização do procedimento, sem interferência da dor e redução do sangramento (fig. 1).
As lesões que apresentassem elevação acima da pele adjacente foram submetidas a shaving, para que toda a superfície tratada se localizasse no mesmo plano e as agulhas atingissem a mesma profundidade dentro da lesão e da margem de segurança.
A intervenção foi feita usando máquina de tatuagem Cheyenne e cartuchos estéreis e descartáveis da mesma marca, ambos de MT.DERM (Berlin, Alemanha) e aprovada pela Agência Nacional se Vigilância Sanitária (ANVISA) para uso médico e drug‐delivery.8 Neste estudo, foram utilizados cartuchos Magnum Art.‐Nr. E‐MC17‐R35LB contendo 17 agulhas com 0,35mm de diâmetro.
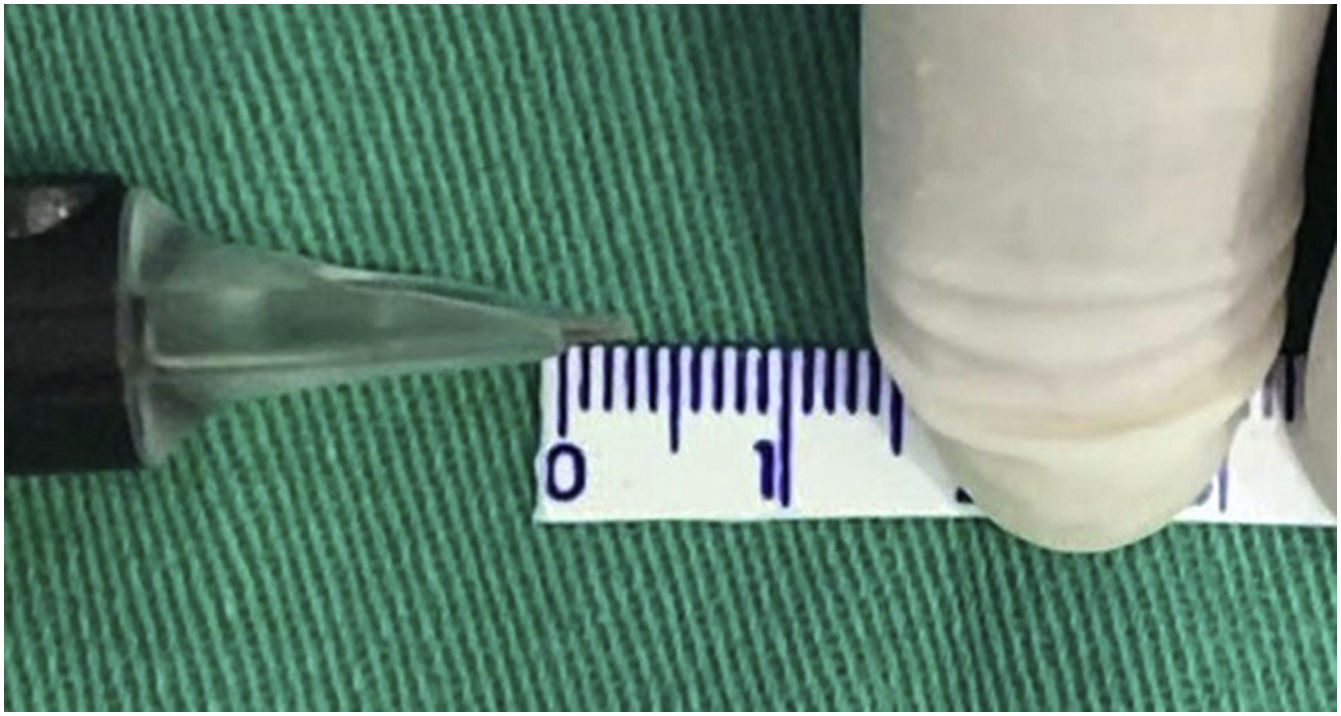
Levando em consideração que a máquina tem ajuste para regular a profundidade das agulhas, ajustamos como parâmetro fixo a profundidade máxima possível para critério de uniformização do tratamento e da técnica, que corresponde a aproximadamente 3mm (fig. 2).
O sulfato de bleomicina de 15μ foi diluído de maneira padrão em 5mL de água destilada, resultando em 3μ/1mL. Essa solução estéril foi aspirada por seringa descartável estéril B.D Ultra‐fine™ de 30 unidades (equivalente a 0,3mL) e transportada para o cartucho Magnum. A quantidade necessária foi usada conforme a necessidade de cada lesão, com base no tamanho e na absorção observados durante o procedimento. Durante a realização do microagulhamento, toda a lesão e toda a margem de segurança predeterminada foram tratadas com ao menos duas passagens no mesmo ponto. Após microagulhamento homogêneo, a área tratada foi ocluída e isolada com plástico‐filme por 12 horas. Creme cicatrizante Cicaplast® ou Bepantol baby® foram prescritos para uso até total cicatrização da área tratada. O retorno de primeira avaliação foi agendado com prazo de 30 dias a fim de mensurar resposta terapêutica e de possíveis sinais e sintomas ocorridos nesse período, e após seis meses para uma nova biopsia, realizada no local da cicatriz correspondente à primeira biopsia.
Os pacientes tratados continuaram em acompanhamento no ambulatório por ao menos cinco anos, para avaliação de eventuais recidivas tardias. Caso haja recidiva precoce ou tardia do câncer de pele, eles serão tratados por técnica de eleição conforme orientação do National Comprehensive Cancer Network (NCCN).
ResultadosNeste estudo prospectivo, inicialmente foram incluídos 32 pacientes, dos quais obtivemos 116 biopsias. Dessas lesões, 112 confirmaram o diagnóstico de CBC e foram tratadas com a presente técnica. Foram excluídas de serem tratadas com essa técnica duas lesões de ceratoses actínicas, um cisto epidérmico e um carcinoma epidermoide.
De todos os 32 pacientes tratados, 26 retornaram para realização de biopsia após seis meses de tratamento, totalizando 98 lesões incluídas nos dados finais para análise estatística. Foi realizada busca ativa dos seis pacientes faltantes, sem sucesso. Assim, foram excluídas 14 lesões de CBC tratadas inicialmente. Todos os pacientes que completaram o tratamento seguiram o protocolo de biopsias e retornos para avaliação dos resultados.
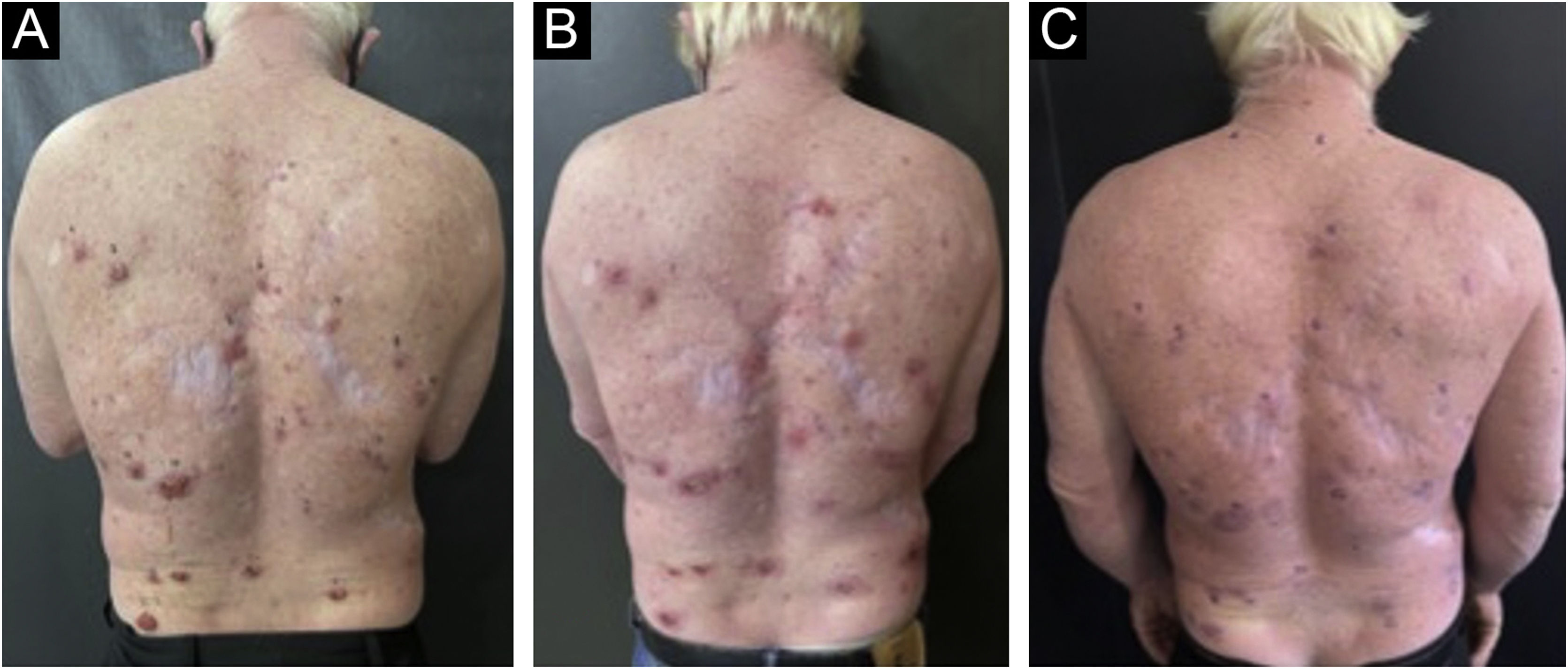
Os dados analisados demonstraram 58% dos pacientes do sexo feminino e 42% do sexo masculino. Dos participantes do estudo, três pacientes eram albinos; os demais eram do fototipo I, II e III segundo classificação de Fitzpatrick. Dentre os 32 pacientes incluídos no estudo, dois dos pacientes albinos foram os que apresentaram mais lesões de CBC, totalizando 32 lesões. Apenas um paciente fazia uso de tratamento anticoagulante e precisou suspender a medicação três dias antes. Mesmo com esse cuidado, a paciente relatou sangramento acima do habitual em relação aos demais pacientes nas primeiras horas pós‐procedimento (fig. 3).
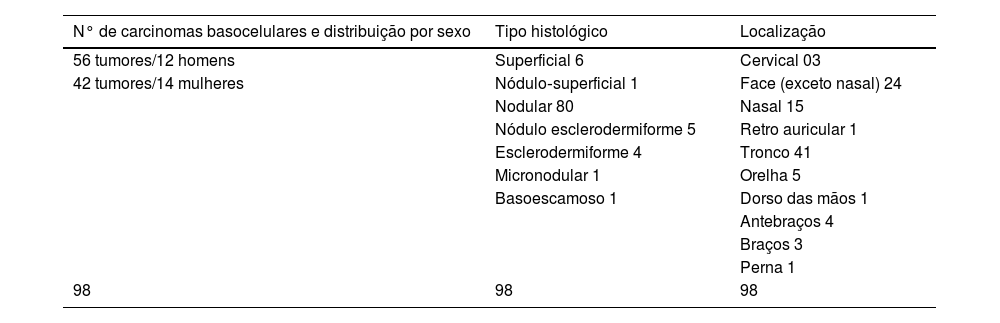
O predomínio das lesões se deu na região de cabeça e pescoço (48%), seguidos de tronco (41%) e membros (11%). Os pacientes albinos participantes deste estudo demonstraram maior concentração de lesões em área de baixo risco (tronco seguido de membros). A média de tamanho das lesões foi de 3,46 cm2 – 0,24 cm2 e 33 cm2, respectivamente, a menor e a maior lesão tratadas (tabela 1).
Resumo dos casos, 2021
| N° de carcinomas basocelulares e distribuição por sexo | Tipo histológico | Localização |
|---|---|---|
| 56 tumores/12 homens | Superficial 6 | Cervical 03 |
| 42 tumores/14 mulheres | Nódulo‐superficial 1 | Face (exceto nasal) 24 |
| Nodular 80 | Nasal 15 | |
| Nódulo esclerodermiforme 5 | Retro auricular 1 | |
| Esclerodermiforme 4 | Tronco 41 | |
| Micronodular 1 | Orelha 5 | |
| Basoescamoso 1 | Dorso das mãos 1 | |
| Antebraços 4 | ||
| Braços 3 | ||
| Perna 1 | ||
| 98 | 98 | 98 |
Fonte: Tratamento quimioterápico com bleomicina do carcinoma basocelular via microinfusão de medicamento na pele (MMP®).
As 112 biopsias realizadas nos pacientes incluídos inicialmente no trabalho evidenciaram histologia com predomínio de padrão nodular (80,3%), seguidos pelo misto (8%, dos quais 7,1% nódulo‐esclerodermiforme e 0,9% nódulo‐superficial), superficial (5,4%), esclerodermiforme (3,6%), micronodular (1,8%) e basoescamoso (0,9%).
Foram realizadas as medidas da espessura tumoral e da peça anatômica nas biópsias pré‐tratamento. A espessura média das peças foi de 2,83mm entre os diferentes sítios anatômicos, (0,7mm a menor e 6,8mm a maior). Quanto à lesão tumoral, a espessura média foi de 1,93mm (0,2mm a menor e 5,5mm a maior).
A dosagem média de bleomicina utilizada foi calculada em cima da área tumoral tratada; a média utilizada foi de 2,26 U (volume mensurado da seringa B.D ultra‐fine™ de 30 U) equivalentes a 0,0266mL/cm2 da solução diluída de bleomicina. O volume médio por paciente foi de 7,8μ, ou 0,078mL da solução, variando entre 3μ e 30μ da solução.
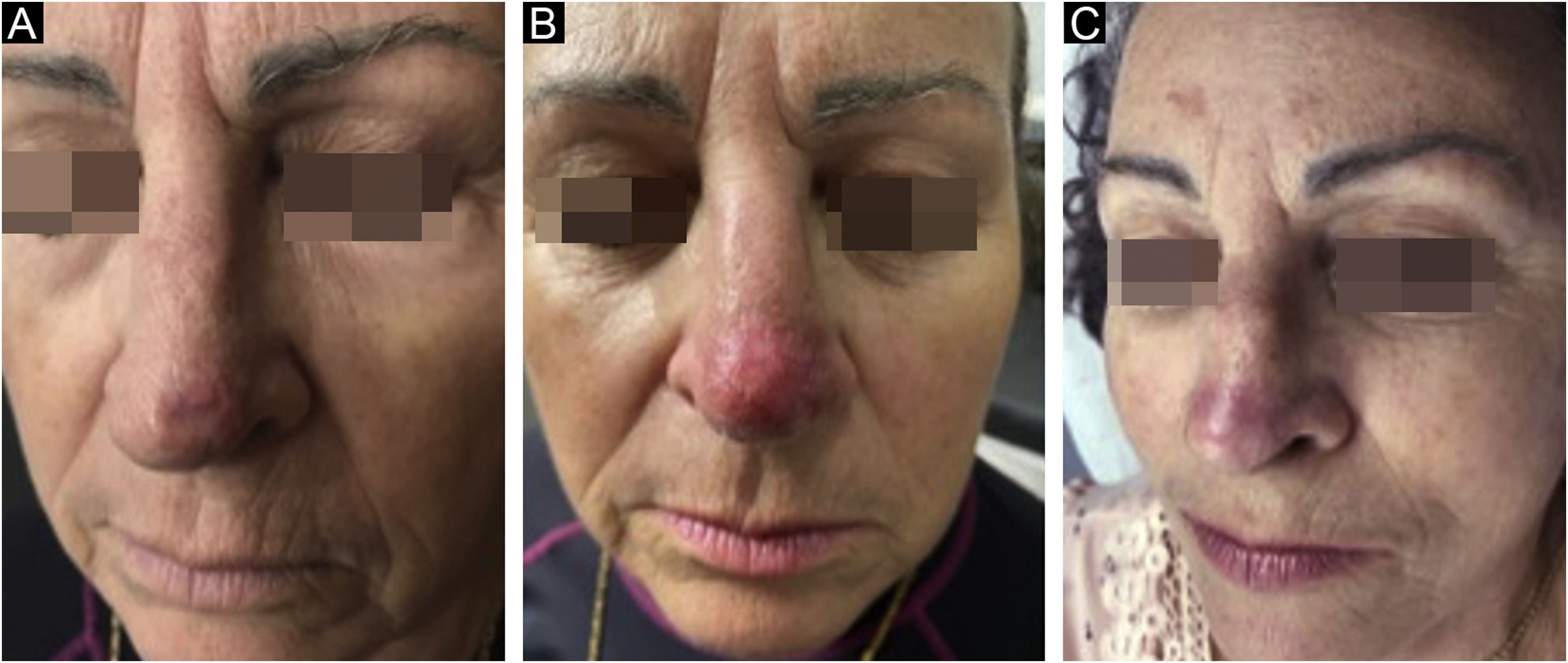
As biopsias de controle realizadas após seis meses do tratamento evidenciaram cicatriz com ausência de neoplasia em 96,9%, e somente 3,1% apresentaram doença residual –dois carcinomas basocelulares nodulares e um nódulo‐esclerodermiforme. Analisando as lesões persistentes, observou‐se que o CBC com a maior área (8,4 cm2) foi tratado com dosagem média de 1,67μ de bleomicina, inferior à média do trabalho (2,26μ). O carcinoma de padrão histológico misto apresentou espessura tumoral próxima ao alcançado pela agulha (3mm), podendo ser esse o motivo da persistência (fig. 4).
No primeiro retorno após tratamento, os pacientes foram questionados quanto a sinais e sintomas que pudessem ter ocorrido em decorrência do procedimento. Vinte pacientes (62,5%) queixaram‐se de dor nas primeiras horas pós‐procedimento, 18 (56,3%) acerca de prurido no processo de cicatrização, 20 (62,5%) sobre sangramento nas primeiras 12 horas, dois (6,3%) acerca de hipercromia residual, seis (18,8%) queixaram‐se de cicatrizes espessadas e nove (28,1%) pacientes notaram cicatrizes atróficas. De maneira geral, os efeitos colaterais foram bem tolerados; nenhum paciente ficou descontente com o resultado obtido, por tratar‐se de tratamento de câncer de pele.
DiscussãoA bleomicina, originalmente isolada do fungo Streptomyces verticillus,9 é frequentemente usada como agente antitumoral. A presença da bleomicina hidrolase nos tecidos inativa a bleomicina hidrolisando a ligação amida na porção beta‐aminoalaninoamida. A deficiência da enzima nos pulmões e na pele10,11 leva a maior concentração do fármaco na pele,12 e a toxicidade induzida pela bleomicina ocorre predominantemente nesses órgãos. Nos tratamentos sistêmicos com bleomicina, em razão das altas doses, pode haver lesões fibróticas na pele semelhantes a esclerodermia13 induzidas pela medicação.
Em dermatologia, a bleomicina é usada principalmente como tratamento intralesional, e a dosagem geralmente não excede 2 U a 6 U por sessão.4,14 A dosagem de bleomicina foi convertida para os Estados Unidos em unidades de farmacopeia (U): 1 U representa 1 mg (por potência) ou 1.000 Unidades Internacionais (IU).15 Doses tão baixas quanto 0,01 U/mL induziram uma resposta inflamatória clínica mensurável, e o endurecimento e inflamação máximos atingiram uma dose de 0,1 U/mL.16 No presente estudo, pela técnica de MMP®, foi utilizado de 3 U a 30 U, ou seja, de 0,03mL a 0,3mL.
A bleomicina injetada intralesionalmente leva à citotoxicidade direta e indireta dos queratinócitos e do epitélio écrino.17 A imunocitoquímica demonstra a fixação tecidual de bleomicina em todos os níveis da epiderme, exceto na camada basal e mais proeminentemente na camada granular.18 As reações observadas após administração intralesional incluem gangrena, onicodistrofia, fenômeno de Raynaud, esclerodermia e flagelado eritema.19–22 Após injeções de bleomicina na pele, reações locais e sintomas transitórios podem ocorrer (eritema, edema, escurecimento, formação de escara, dor e alterações pigmentares).23,24
Diferente da infiltração intralesional que deposita a medicação “em bolus”, a distribuição uniforme e em mesmo plano realizada pela microinfusão demonstrou reações iniciais de sangramento nas primeiras horas pós‐procedimento e dor leve. Houve formação subsequente de crosta, seguida de formação de cicatriz atrófica. Após um mês, em alguns pacientes de fototipo III ocorreu leve hiperpigmentação. Embora os pacientes se apresentassem com cicatriz atrófica no primeiro mês após a realização do procedimento, e esse tenha sido o resultado cicatricial predominante, em alguns pacientes surgiram posteriormente hipertrofia nas lesões tratadas e localizadas na região central da face. Tal reação ocorreu possivelmente pelo fato de este trabalho ter sido realizado em um período no qual o uso de máscara facial se fazia necessário para a prevenção à COVID‐19.
Farmacologicamente, a bleomicina demonstrou bloquear o ciclo celular em G2,25 clivar DNA de fita simples e dupla26 e degradar RNA celular.27 Isso se dá pela ligação ao DNA por uma atração eletrostática.28 A bleomicina forma um complexo com íons metálicos, como Fe (II), que é subsequentemente oxidado a Fe (III), resultando na redução de oxigênio para radicais livres. Esses radicais livres causam quebras de DNA levando, em última análise, à morte celular.29,30 A atividade antitumoral da bleomicina reside principalmente em sua capacidade de clivar o DNA. A carga positiva do grupo amino terminal carregado da bleomicina é eletrostaticamente atraída pela carga negativa do grupo fosfato carregado no DNA, e o grupo bitiazol planar é intercalado no DNA de fita dupla. A cadeia de DNA é clivada pela molécula de oxigênio ativada no complexo ferroso da bleomicina.31
Além disso, a bleomicina é conhecida por induzir apoptose in vitro.32 Esse efeito pró‐apoptótico da bleomicina é citado como outra de suas propriedades antitumorais. Ao afetar a síntese de proteínas, a bleomicina provoca uma série de alterações bioquímicas que levam à apoptose e necrose epidérmica total. Esses efeitos são dose‐dependentes, e injeções frequentes de baixas doses de bleomicina são relatadas como as mais eficazes.33
Outro possível mecanismo subjacente à eficácia da bleomicina está na indução de fator de necrose tumoral (TNF).16 O TNF também é conhecido por regular positivamente a expressão da molécula de adesão intercelular‐1 (ICAM‐1), molécula de adesão de leucócitos endoteliais‐1 (ELAM‐1) e molécula de adesão de células vasculares‐1 (VCAM‐1), para induzir uma atividade pró‐coagulante semelhante a fator de tecido em células endoteliais humanas, e para causar necrose hemorrágica de tumores.34
A infiltração intralesional de bleomicina suplementada com lidocaína, além do efeito anestésico, aumenta a captação intracelular desse antibiótico quimioterápico. A lidocaína atua como um anestésico local e aumenta a captação de agentes quimioterápicos hidrofílicos, como a bleomicina, por meio de efeito estabilizador de membrana.6
Templeton et al.16 avaliaram a resposta provocada pela bleomicina quando aplicada intradermicamente em pele normal humana e observaram que a reação inflamatória começou em 10 a 12 horas após as injeções, atingiu o pico em 24 a 48 horas e muitas vezes durou mais de 8 a 10 dias. Que alterações histológicas foram observadas superficial e profundamente na pele? A inflamação perineural de densidade variável também esteve presente em quatro das cinco amostras iniciais de biopsia. A microscopia de imunofluorescência demonstrou que a pele tratada com bleomicina apresentou aumento acentuado de HLA‐DR em ceratinócitos epidérmicos, indução focal de ICAM‐1 em queratinócitos epidérmicos e suprarregulação da expressão de ICAM‐1 em vasos sanguíneos dérmicos superficiais. O curso de tempo da resposta inflamatória foi semelhante nos locais de injeção de todas as concentrações de bleomicina.16 No presente trabalho, observou‐se clinicamente que as lesões tratadas apresentaram processo inflamatório acompanhado de crosta em 48 horas, e esse processo inflamatório permaneceu de maneira regressiva nos primeiros 30 dias, momento em que se observou cicatriz com eritema róseo e descamação residuais.
Em revisão de literatura, encontraram‐se maiores taxas de cura de CBC com infiltração intralesional de bleomicina em comparação com outros agentes como MTX, 5‐FU e interferona; no entanto, o tamanho da amostra foi menor para o grupo da bleomicina em comparação com os outros grupos.35
Dentre as técnicas de drug‐delivery utilizadas na terapêutica de patologias cutâneas, a MMP® tem‐se mostrado eficaz. Sua principal característica é a injeção e distribuição uniforme da medicação, que ocorre simultaneamente à perfuração e que pode ter sua profundidade regulada conforme a patologia a ser tratada, a área anatômica de localização da lesão e a medicação definida para cada situação. No presente estudo, por ser tratar de lesão de CBC, o tratamento foi realizado de acordo com o protocolo cirúrgico de delimitação da lesão e das margens cirúrgicas, aplicação e distribuição homogênea da medicação conforme demonstrados no modelo ilustrativo (fig. 5).
O dispositivo de tatuagem utilizado na MMP® usa agulhas sólidas e a medicação envolve a superfície externa das microagulhas. O atrito gerado pela rápida penetração dessas agulhas na derme cria tensão de cisalhamento e um turbilhão turbulento do fármaco que aumenta sua difusão dérmica.36 Portanto, ao escolher usar uma agulha hipodérmica oca de mão ou uma de máquina de tatuagem, os médicos devem estar cientes que essas intervenções produzem diferentes padrões de difusão de medicação na derme. Dentre as diferentes opções de agulhas disponíveis, no presente trabalho foi selecionado o modelo que apresentava texturização (Tx), característica que agride um pouco mais a pele.
O uso da técnica de microagulhamento usando máquina de tatuagem em condições cirúrgicas assépticas também pode minimizar os efeitos adversos relatados em outros procedimentos de tatuagem. Há de se considerar que a bleomicina também apresenta ação antibiótica, o que torna o procedimento ainda mais seguro quanto a risco de infecção.
Ao analisar a farmacocinética dos medicamentos injetados na pele, independentemente do uso de seringas, dispositivos de tatuagem ou lasers de CO2 fracionados, acreditamos que a absorção sistêmica do fármaco em sua entrega é inegável, embora possam existir diferenças de caminho na absorção sistêmica (corrente sanguínea ou linfática), além da natureza química, do peso molecular da medicação37 e do volume utilizado. Já foi demonstrado inclusive que os pigmentos da tatuagem podem migrar para os linfonodos regionais porque as partículas de tinta são capazes de mover‐se através dos vasos linfáticos.38 No presente trabalho, embora não tenha sido feita dosagem ou investigação frente absorção da bleomicina, não houve queixas de sintomas sistêmicos nem enfartamento ganglionar pelos pacientes, possivelmente pelas baixas doses utilizadas.
Quanto ao perfil histológico evidenciado no presente trabalho, este se mostra congruente com os dados encontrados na literatura, em que o tipo histológico predominante é o CBC de baixo risco (nodular e superficial). Embora nesta amostragem a proporção de mulheres acometidas tenham sido maior (58%) que homens, eles apresentaram individualmente maior quantidade de lesões que as mulheres. Em contexto particular a este trabalho, os pacientes albinos foram os mais acometidos.
A presença de padrão esclerodermiforme misto mais frequente em mulheres e em região de cabeça e pescoço foi compatível com a literatura.39 A espessura média tumoral encontrada nas lesões tratadas foi de 1,93mm, compatível com a espessura máxima média de 1,76±1,03mm (intervalo de 1‐9,5) demonstradas por Amici et al.40
A utilização da bleomicina via MMP® se mostrou eficaz nos resultados de biopsia obtidos após seis meses de tratamento. Sabemos que o tempo de segmento ideal é de ao menos cinco anos, e neste intervalo os dados estatísticos podem sofrer algumas alterações. Para tanto, os pacientes manterão acompanhamento ambulatorial.
Embora tenham sido excluídos casos avançados e que sabidamente necessitassem de abordagem cirúrgica, seja pela extensão da doença ou pelas estruturas comprometidas ou pelo aspecto infiltrativo da lesão, este trabalho incluiu e tratou lesões com padrão histológico de alto risco segundo o NCCN e em áreas também de alto risco da face para que se pudesse avaliar a eficácia terapêutica da técnica, situação em que a medicação atrelada com a técnica se mostrou complementar e segura para ser usada na face.
Além da eficácia, a técnica se mostrou pertinente e por vezes vantajosa no tratamento simultâneo de múltiplas lesões em um mesmo paciente, situação desfavorável ao procedimento cirúrgico convencional. Na prática clínica, a indicação correta dessa técnica deverá basear‐se no NCCN, na espessura tumoral que pode ser solicitada na biopsia prévia e na experiência de cada médico, levando em consideração cada paciente e suas peculiaridades.
ConclusãoO tratamento com bleomicina via MMP® mostrou‐se eficaz para o tratamento de CBC em um período de seis meses. A MMP® é uma técnica de média complexidade e de fácil reprodutibilidade, e muito vantajosa para o tratamento de múltiplas lesões. Será necessário acompanhamento por mais tempo para consolidarmos resultados em longo prazo.
Suporte financeiroNenhum.
Contribuição dos autoresPaulo Rodrigo Pacola: Aprovação da versão final do manuscrito; Concepção e planejamento do estudo; Elaboração e redação do manuscrito; Obtenção, análise e interpretação dos dados; Participação efetiva na orientação da pesquisa; Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; Revisão crítica da literatura; Revisão crítica do manuscrito.
Renato Roberto Liberato Rostey: Análise estatística; Aprovação da versão final do manuscrito; Participação efetiva na orientação da pesquisa; Revisão crítica do manuscrito.
Fernanda de Figueiredo Arruda Rizzo: Obtenção, análise e interpretação dos dados.
Conflito de interessesNenhum.
Como citar este artigo: Pacola PR, Rostey RRL, Rizzo FFA. Chemotherapeutical treatment of basal cell carcinoma with bleomycin via microinfusion of the drug into the skin (MMP®). An Bras Dermatol. 2023;98:587–94.
Trabalho realizado no Hospital Universitário Júlio Muller, Cuiabá, MT, Brasil.