A displasia ectodérmica‐síndrome da sindactilia‐1 (EDSS1) é doença hereditária rara caracterizada por defeitos nos dentes, cabelos e unhas em associação com a fusão dos dígitos. Geneticamente, os fenótipos da doença são causados por variantes homozigóticas e heterozigóticas compostas no gene NECTIN4.
ObjetivoO principal objetivo do estudo foi identificar variantes na sequência patogênica para triagem familiar e identificação de portadores.
MétodosNo presente estudo, os autores investigaram uma grande família consanguínea de origem paquistanesa segregando EDSS1 autossômica recessiva. Todos os éxons codificadores do gene NECTIN4 foram sequenciados diretamente utilizando primers específicos do gene.
ResultadosOs indivíduos afetados apresentaram as características clínicas clássicas da EDSS1, incluindo cabelos ralos, unhas hipoplásicas com lâmina ungueal grossa, plana e descolorida, dentes em forma de pino, cônicos e amplamente espaçados com hipoplasia do esmalte, sindactilia proximal e dos pés. A análise da sequência da região codificadora do NECTIN4 identificou uma nova variante nonsense [c.163C>T; p.(Arg55*)] no éxon 2 do gene. A análise computacional da estrutura da proteína revelou que a variante induziu a terminação prematura em Arg55 localizado na região de loop V semelhante a Ig, levando à perda de domínios do tipo Ig‐C2 e região transmembrana, e provavelmente a função da nectina‐4 será perdida.
Limitação do estudoNão houve estudos de expressão gênica que fortaleceriam os achados da análise computacional.
ConclusãoO presente estudo ampliou o espectro fenotípico e de mutação do gene NECTIN4. Além disso, o estudo pode ajudar na testagem de portadores e no diagnóstico pré‐natal das famílias afetadas.
As displasias ectodérmicas (DEs) constituem um grupo de alterações congênitas que afetam a pele ou seus anexos, incluindo cabelos, dentes, unhas e glândulas sudoríparas. As DEs são heterogêneas tanto nas causas genéticas quanto nos fenótipos clínicos, com mais de 200 formas diferentes relatadas até o momento e prevalência estimada de aproximadamente 7/10.000 nascimentos em todo o mundo.1 Os sistemas de classificação iniciais foram estabelecidos com base principalmente nas características fenotípicas e no modo de herança. Abordagens mais recentes incluem uma variedade de dados moleculares que facilitam o estabelecimento da relação do defeito genético com o efeito na estrutura e função da proteína e os fenótipos resultantes.2
DE envolvendo anormalidades congênitas dos cabelos junto com sindactilia é forma muito rara que foi mapeada nos cromossomos 1q23.1‐q23.3 e 7p21.1‐p14.3, causando a DE‐síndrome de sindactilia‐1 (EDSS1; OMIM 613573) e EDSS2 (OMIM 613576), respectivamente. Os achados clínicos característicos incluem cabelos/pelos ralos ou ausentes no couro cabeludo, sobrancelhas e cílios, dentição anormal (dentes em forma de pino, coroas cônicas e defeitos no esmalte), unhas hipoplásicas, ceratodermia palmoplantar e sindactilia parcial bilateral, afetando de maneira variável os dedos das mãos e dos pés.3,4 Foi relatado que a EDSS1 é causada por variantes no gene relacionado ao receptor do poliovírus 4 (PVRL4), recentemente denominado molécula de adesão celular Nectina‐4 (NECTIN4). A NECTIN4 codifica um membro da família de nectinas de moléculas de adesão celular, Nectina‐4, que mostra alta expressão nas junções de aderência (JA) da epiderme suprabasal, folículos pilosos, queratinócitos cultivados e na separação de dígitos do embrião murino.4 O gene causador da EDSS2 ainda não foi relatado.
O presente estudo relata uma grande família paquistanesa com 15 indivíduos afetados segregando EDSS1 autossômico recessivo. Todos os indivíduos afetados apresentavam anormalidades capilares e dentárias, além de sindactilia bilateral. O sequenciamento direto do gene candidato identificou uma nova variante nonsense em homozigose [c.163C>T; p.(Arg55*)] no gene NECTIN4, expandindo assim o espectro fenotípico e molecular dessa doença rara.
MétodosO estudo foi conduzido de acordo com a Declaração de Helsinque de 2013. O consentimento informado por escrito foi obtido dos participantes do estudo e a aprovação foi obtida do Comitê de Ética institucional e do Comitê de Revisão Ética (F. n° 73/HU/ORIC/2021/754) da instituição controladora.
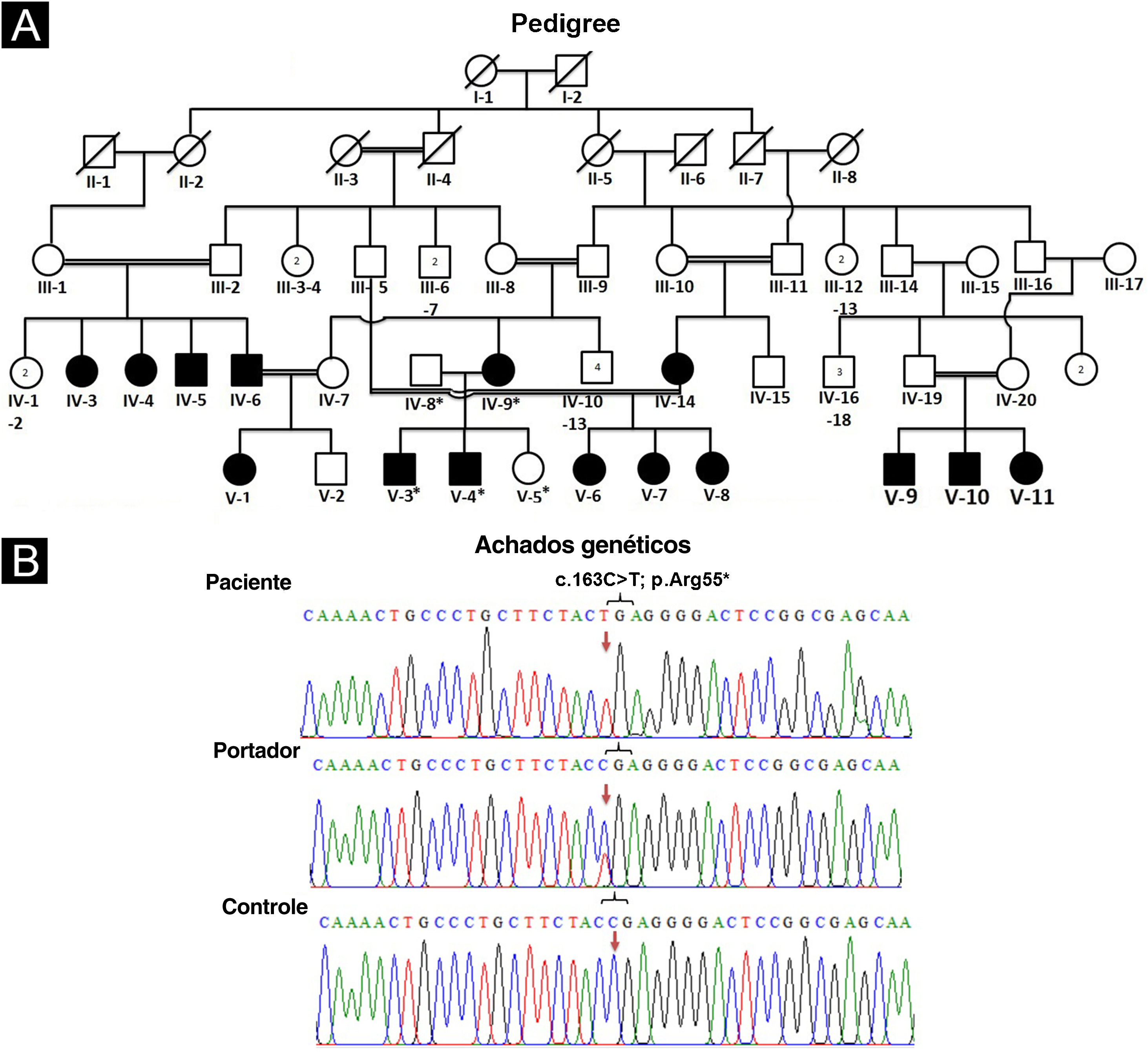
Desenho da linhagem e extração de DNAPara a elaboração da linhagem (fig. 1A), coleta de sangue e diagnóstico clínico, os membros afetados (IV‐9, V‐3, V‐4) foram visitados em sua residência no distrito de Mansehra, divisão de Hazara, Khyber Pakhtunkhwa, Paquistão. Todos os indivíduos participantes foram informados sobre o objetivo e as consequências do projeto de pesquisa. Após serem informados, os idosos da família foram entrevistados para traçar a linhagem e o início da doença. Amostras de sangue venoso foram obtidas da veia antecubital. O sangue coletado foi armazenado em tubos contendo EDTA rotulados com as identificações dos indivíduos. O DNA genômico foi extraído de todas as amostras de sangue coletadas utilizando o procedimento padrão com fenol‐clorofórmio. O DNA foi quantificado utilizando‐se espectrofotômetro Nanodrop‐1000 (Thermal Scientific, Wilmington, MA).
(A) Linhagem de família afetada mostrando segregação de EDSS1 na forma autossômica recessiva. (B) Cromatograma de sequenciamento do gene NECTIN4 indicando variante nonsense (c.163C>T) em homozigose em indivíduos afetados (painel superior), em heterozigose em portador IV‐8 (painel do meio) e alelo do tipo selvagem homozigoto (C) em indivíduo normal (painel inferior). As setas são utilizadas para destacar a posição da variante
Com base no padrão de herança da doença, consanguinidade e associação do gene NECTIN4 com fenótipos semelhantes da doença, o sequenciamento de Sanger direcionado para a mutação foi realizado utilizando DNA de um indivíduo afetado (IV‐9). Primers para sequenciamento dos éxons de codificação e os limites íntron‐éxon de NECTIN4 foram projetados a partir de regiões intrônicas utilizando o software PRIMER‐3 (http://frodo.wi.mit.edu/primer3). A especificidade dos primers foi verificada usando ferramenta básica de busca de alinhamento local (BLAST; http://www.ncbi.nlm.nih.gov/blast). As sequências de nucleotídios dos primers estão disponíveis mediante solicitação. Os primers foram amplificados, purificados e sequenciados usando condições padrão.5 Os produtos amplificados por PCR foram purificados utilizando kit comercialmente disponível (Axygen, CA, EUA). O sequenciamento de Sanger foi realizado usando kit Big Dye Terminator v3.1 Cycle Sequencing (Life Technologies, Carlsbad, CA, EUA). O editor de alinhamento de sequências BIOEDIT, versão 6.0.7 (Ibis Biosciences, Carlsbad, CA, EUA) foi utilizado para a identificação das variantes. MutationTaster (http://www.mutationtaster.org/) foi usado para calcular o escore de patogenicidade da variante identificada.
Estrutura secundária e terciária da Nectina‐4A estrutura cristalina do fragmento extracelular de Nectina‐4 humana foi recuperada do Protein Data Bank (PDB) (https://www.rcsb.org/) com PDBID:4FRW. A estrutura cristalina está disponível na conformação de dímeros abrangendo o domínio extracelular D1‐D2da Nectina‐4. Chimera 1.5.6,6 e VEGA ZZ (http://www.ddl.unimi.it) foram usados para minimização de energia e refinamento de estrutura. A estrutura secundária foi recuperada por meio do PDBsum (http://www.ebi.ac.uk).
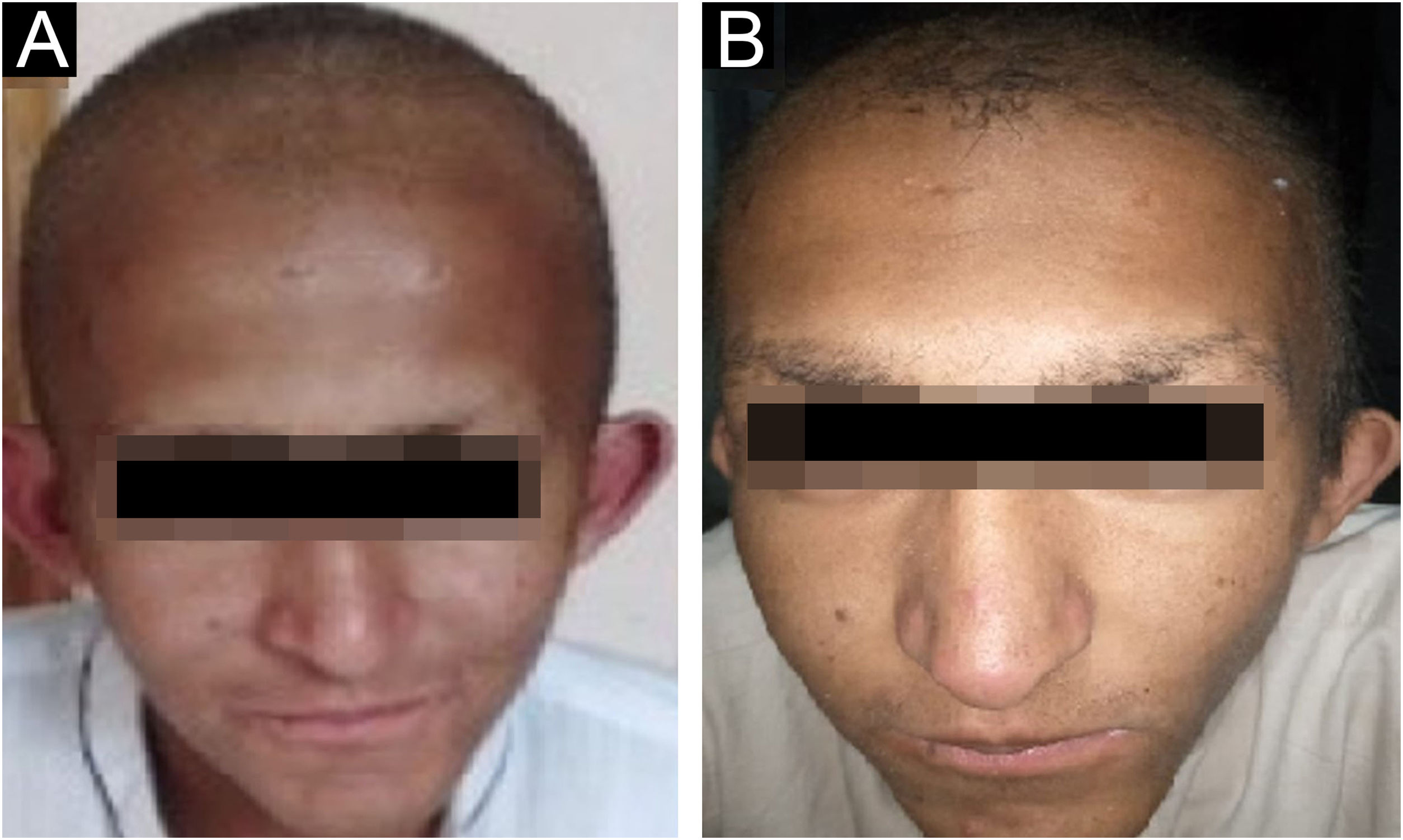
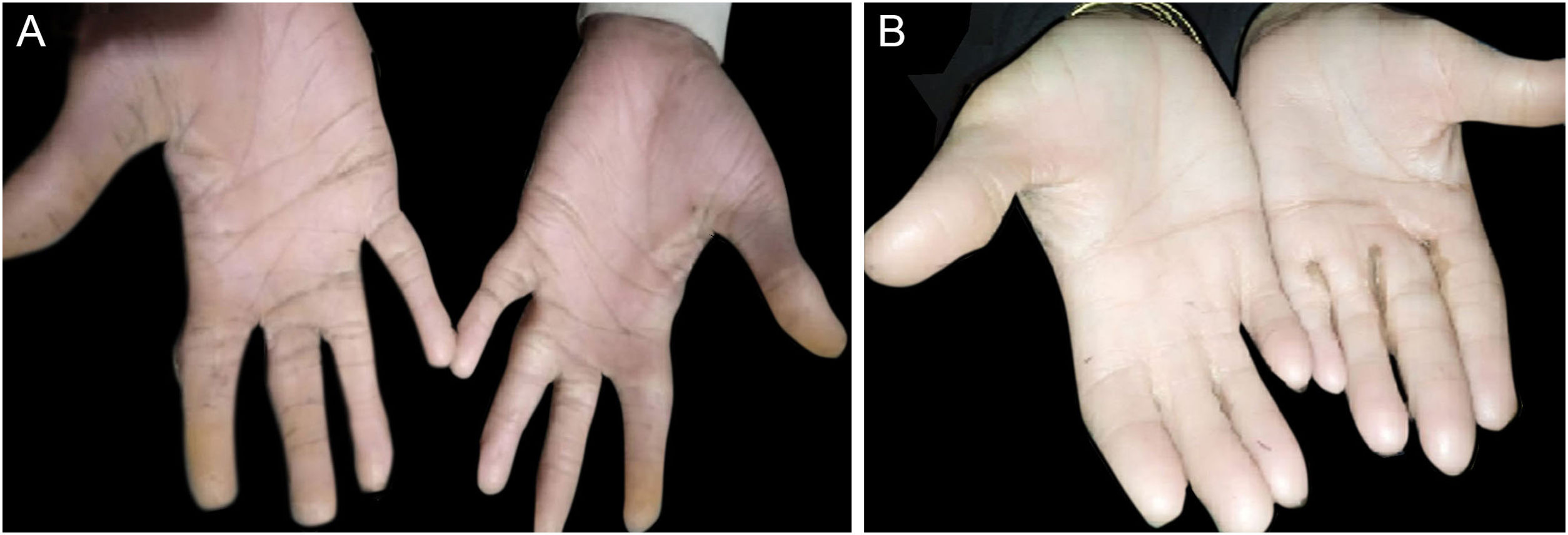
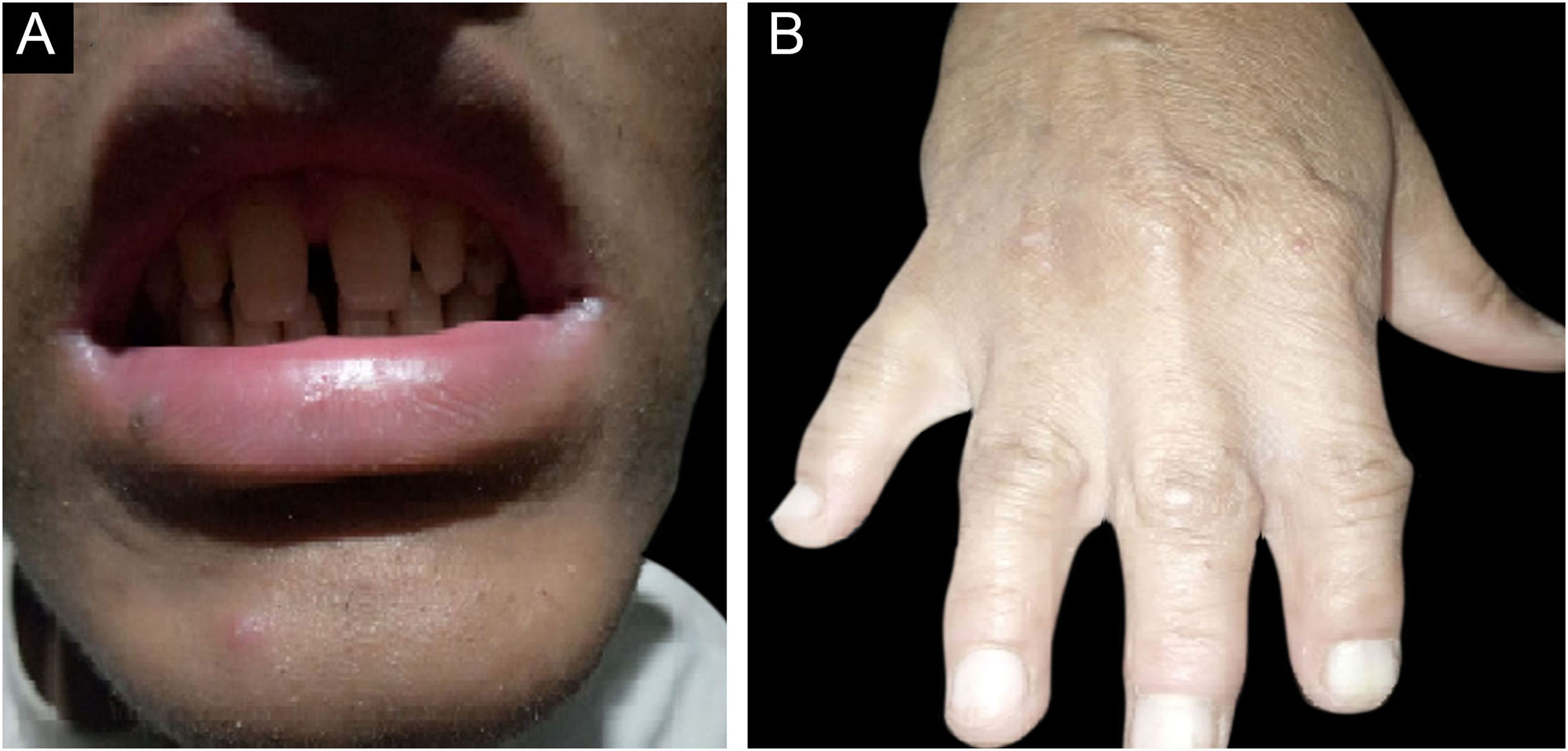
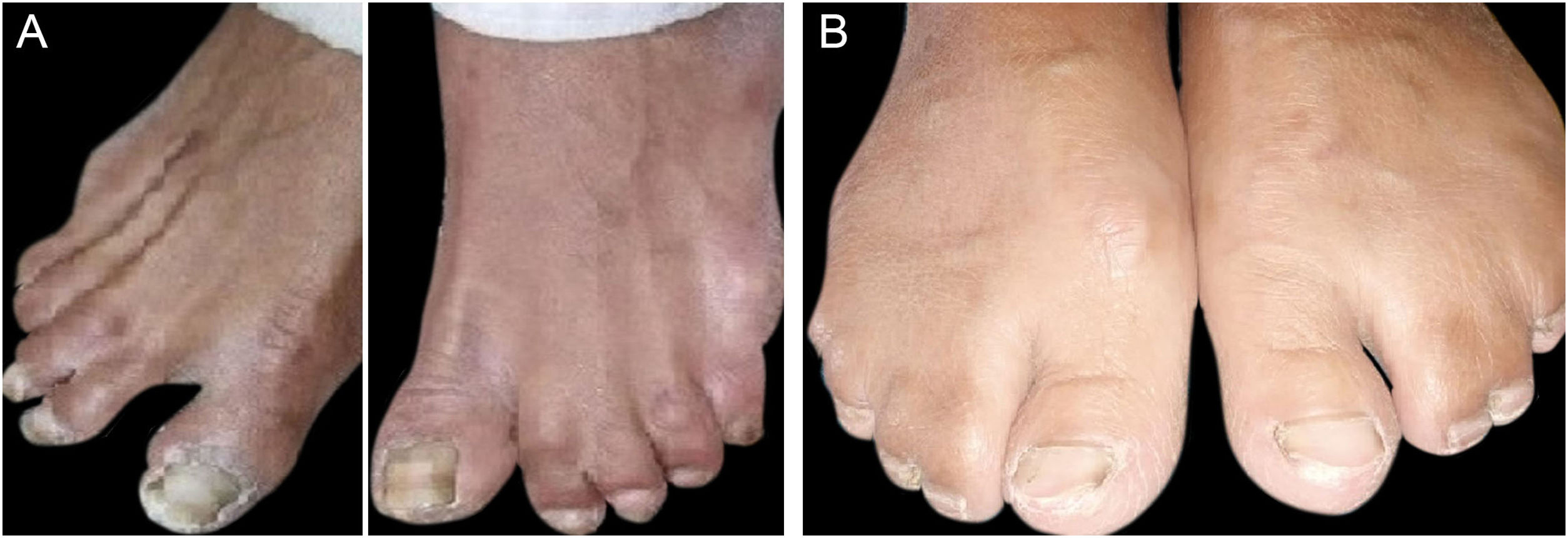
ResultadosAchados clínicosTodos os indivíduos afetados na família apresentaram fenótipos ectodérmicos específicos de EDSS1, isto é, cabelos, dentes, unhas e pele anormais. Os fenótipos de cabelo observados em indivíduos afetados incluíam cabelo ralos no couro cabeludo, sobrancelhas e cílios e pelos ausentes no restante do corpo (fig. 2). A pele era seca, apresentando descamação, com hiperceratose e ceratodermia palmoplantar (fig. 3). Os dentes tinham formato de pino ou eram cônicos e amplamente espaçados, com hipoplasia de esmalte (fig. 4A). Todos os membros afetados tinham palmas grandes e dedos curtos (fig. 2). As unhas eram hipoplásicas com lâmina ungueal descolorida (fig. 4B). Sindactilia cutânea proximal do 2°, 3° e 4° dedos foi observada bilateralmente em dois membros afetados (V‐3, V‐4; fig. 3A) e na mão direita da mãe afetada (IV‐9; fig. 3B). Da mesma maneira, sindactilia do 2° e 3° dedos dos pés foi observada nos pés de V‐3 e V‐4 (fig. 5A), enquanto o 2° ao 5° dedo da mãe (IV‐9) apresentava fusão a nível cutâneo até a articulação interfalangiana distal (fig. 5B). Além disso, eles apresentavam sudorese quase insignificante e enfrentavam intolerância ao calor durante o verão.
A análise da linhagem indicou claramente o padrão de herança autossômica recessiva. A comparação dos resultados de sequenciamento gerados a partir do DNA dos pacientes IV‐9, V‐3, V‐4 com a sequência de referência revelou variante de sequência em homozigose (c.163C>T) no éxon 2 do gene (fig. 1B). O sequenciamento da variante identificada em membros normais (IV‐8, V‐5) confirmou seu estado heterozigoto, consistente com o modo de herança autossômica recessiva. A variante não estava presente em 50 indivíduos saudáveis etnicamente pareados. A patogenicidade da variante obedeceu às diretrizes do American College of Medical Genetics (ACMG)7 e fenótipos clínicos consistentes. A variante não estava presente em ExAC ou 1000G e foi prevista como causadora de doença pelo Mutation Taster.
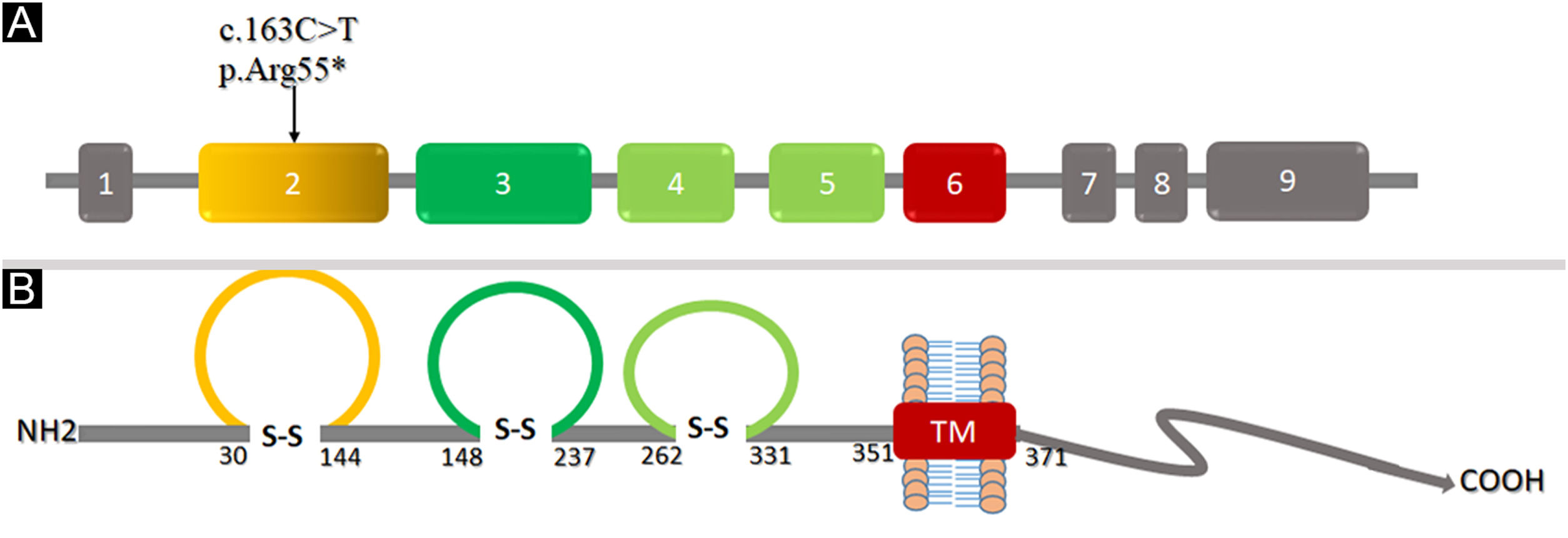
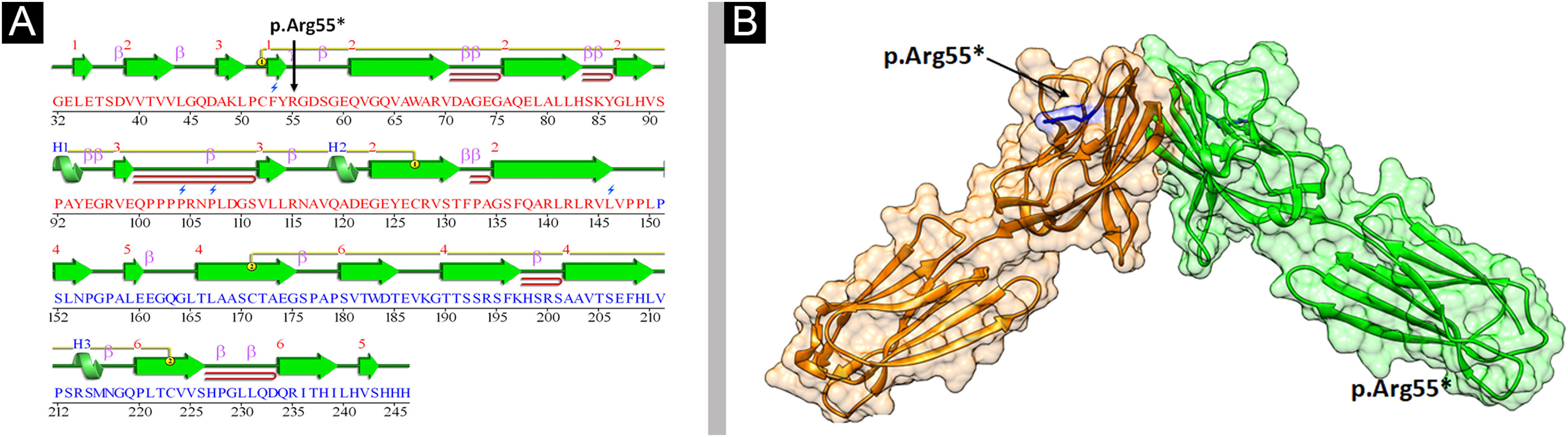
Análise estrutural da Nectina‐4Para entender as mudanças conformacionais na estrutura tridimensional da proteína, é essencial o conhecimento das características da estrutura secundária. A variante identificada (p.Arg55*) foi mapeada no primeiro domínio semelhante a Ig‐V da Nectina‐4 abrangendo 30‐144 resíduos (fig. 6). A análise da estrutura em 2D revelou seis folhas β, três α‐hélices e duas pontes dissulfeto (fig. 7A). A terminação da Nectina‐4 na posição Arg55 resultou na perda de toda a estrutura secundária e, eventualmente, na perda da estrutura terciária e suas interações biológicas.
A análise do modelo em 3D do domínio extracelular D1‐D2da Nectina‐4 indicou que Arg55 está localizada na região de loop V semelhante a Ig, que é crítica para a produção de dímeros cis e trans de Nectina‐4 (fig. 7B), altamente conservada entre espécies diferentes (fig. 8A). Em decorrência do término prematuro, a proteína Nectina‐4 perderá os domínios do tipo Ig‐C2 e a região transmembrana (fig. 8B), provavelmente causando perda da função da Nectina‐4 que levou aos fenótipos EDSS1.
DiscussãoAs nectinas compostas por quatro membros (Nectinas 1‐4) constituem uma família de moléculas de adesão celular que pertencem à superfamília das imunoglobulinas (IgSF). Essas proteínas, independentemente ou com outras proteínas caderinas, desempenham papel significante na formação de junções de aderência que fazem a mediação da adesão célula‐célula.8–11 Todas as nectinas têm estrutura característica composta por um ectodomínio formado por três domínios semelhantes a imunoglobulinas (Ig), uma única região transmembrana e um domínio citoplasmático.12 O domínio citoplasmático reconhece uma afadina, a molécula adaptadora que se liga e recruta grupos de actina filamentosa (actina F), que facilitam a adesão célula‐célula.13,14 Os domínios semelhantes a Ig das nectinas são especializados na mediação das interações homofílicas ou heterofílicas. Particularmente, as trans‐interações de Nectina‐1 e Nectina‐4 regulam a reforma do citoesqueleto de actina por meio da ativação de Rac1, um membro da família Rho de pequenas GTPases que aumenta o agrupamento da molécula de adesão.12,15 A trans‐dimerização defeituosa decorrente da perda ou comprometimento da Nectina‐1 (também conhecida como PVRL1) ou Nectina‐4 causa defeito na adesão célula‐célula normal e causa DE com fenda labial/palatina (CLPED1) e EDSS1, respectivamente,4,16,17 ambas caracterizadas por anormalidades em cabelos e dentes juntamente com sindactilia.
O sequenciamento de Sanger dos éxons codificadores do gene NECTIN4 identificou uma nova variante homozigótica nonsense (c.163C>T) nos indivíduos afetados da família aqui relatada. Prevê‐se que essa variante resulte na perda da função da Nectina‐4 por meio de declínio do mRNA mediado por mutação nonsense (NMD, do inglês nonsense‐mediated mRNA decay) ou por meio da produção de proteína truncada. A análise computacional das estruturas em 2D e 3D da proteína confirmou que essa variante (p.Arg55*) causou o término prematuro da Nectina‐4; portanto, a maior parte do domínio Ig, um domínio transmembrana e um domínio citoplasmático não serão codificados. Assim, a função da proteína Nectina‐4 (adesão célula‐célula) é prejudicada/perdida na via de sinalização RAC1, levando aos fenótipos da doença EDSS1.
Essa é a terceira variante nonsense no gene NECTIN4, elevando assim o número total de variantes para 11. Anteriormente, cinco variantes missense (p.Leu81Pro, p.His83Tyr, p.Pro212Arg, p.Val242Met, p.Arg284Gln), uma variante com mudança de quadro de leitura (variante frameshift: p.Gln384ArgfsTer7), uma deleção no quadro do éxon 2, duas variantes nonsense (p.Asp61Ter, p.Gln77Ter) e uma variante heterozigótica composta (p.Thr185Met; p.Pro304HisfsTer2) tinham sido relatadas no gene NECTIN4.4,18–25 A maioria dos fenótipos clínicos dos pacientes no presente estudo, como sindactilia de dedos 2‐3‐4 e artelhos 2‐3‐4‐5, lâmina ungueal espessa, plana e descolorida com hiperceratose das unhas das mãos e dos pés, ceratodermia palmoplantar, pavilhões auriculares deformados, sudorese insignificante e intolerância ao calor também foram relatados por Raza et al.21 Isso provavelmente se deve ao fato de que ambas as variantes são do tipo nonsense e estão localizadas na região de loop V semelhante a Ig, que é crítica para a produção de dímeros cis e trans de Nectina‐4. Em comparação ao presente estudo, a hipoplasia do esmalte foi mais grave, com morfologia mal definida da superfície da coroa em uma variante nonsense herdada em família da Caxemira (p.Asp61*). Os pacientes do presente estudo tinham cabelos curtos e ralos no couro cabeludo, sobrancelhas e cílios, como relatado anteriormente,23–25 mas a anomalia dos cabelos era congênita e não progressiva, conforme relatado nas famílias descritas por Brancati et al.,4 Fortugno et al.24 e Florian et al.25
Todas as variantes de sequência relatadas até o momento em NECTIN4 em famílias paquistanesas e famílias da Caxemira administrada pelo Paquistão segregando EDSS1 estão presentes no domínio extracelular de Nectina‐4. A variante (p.Arg55*) identificada no presente estudo também está localizada no domínio extracelular. Portanto, sugere‐se que as famílias da mesma origem afetadas com EDSS1 sejam estudadas quanto a variações na região que codifica o domínio extracelular antes de realizar o sequenciamento completo do genoma/exoma.
ConclusãoO estudo não apenas expandiu o espectro de mutações no gene NECTIN4, mas também enfatiza a importância do teste de genes‐alvo como poderosa ferramenta diagnóstica para a determinação conclusiva do tipo específico de DE.
Suporte financeiroNenhum.
Contribuição dos autoresBibi Hajra: Obtenção, análise e interpretação dos dados.
Abdullah Abdullah: Revisão crítica da literatura; participação efetiva na orientação da pesquisa.
Nousheen Bibi: Obtenção, análise e interpretação dos dados.
Fibhaa Syed: Obtenção, análise e interpretação dos dados.
Asmat Ullah: Elaboração e redação do manuscrito.
Wasim Ahmad: Aprovação da versão final do manuscrito; revisão crítica do manuscrito.
Umm‐e‐Kalsoom: Elaboração e redação do manuscrito, concepção e planejamento do estudo.
Conflito de interessesNenhum.
Os autores agradecem a participação da família afetada no presente estudo.
Como citar este artigo: Hajra B, Abdullah A, Bibi N, Syed F, Ullah A, Ahmad W, et al. A novel homozygous nonsense mutation in NECTIN4 gene in a Pakistani family with ectodermal dysplasia syndactyly syndrome 1. An Bras Dermatol. 2023;98:580–6.
Trabalho realizado na Hazara University, Mansehra e Quaid‐i‐Azam University, Islamabad, Paquistão.