A psoríase é uma doença inflamatória crônica da pele1 e cerca de 30% são de pacientes pediátricos.1 Isso impacta não apenas as próprias crianças, mas também seus pais e cuidadores, afetando sua qualidade de vida.2 A maioria dos casos é de pequena gravidade e se beneficia de terapia tópica.3 Entretanto, quando os casos são não responsivos ou mais graves, podem exigir tratamentos sistêmicos, incluindo fototerapia, agentes convencionais (acitretina, metotrexato e ciclosporina) ou biológicos.4,5 A terapia com agentes biológicos representa uma nova e preciosa opção terapêutica para pacientes pediátricos, embora os dados sobre sua eficácia e segurança sejam escassos, pois a maioria dos ensaios clínicos disponíveis é realizada em pequenas populações de estudo e em formas menos graves da doença. Daí a importância de fornecer informações sobre experiências da prática diária sobre psoríase pediátrica tratada com agentes biológicos. Atualmente, o uso de antifatores de necrose tumoral (TNF)‐α (adalimumabe e etanercepte) foi aprovado para crianças a partir de 4 e 6 anos de idade, respectivamente; o anti‐interleucina (IL) 12/23 (ustequinumabe) para pacientes a partir de 6 anos;6–8 e anti‐IL‐17 (secuquinumabe e ixequizumabe) em crianças a partir de 6 anos de idade.9,10 Na Itália, apenas os agentes anti‐TNF‐α são reembolsáveis pelo Sistema Nacional de Saúde, enquanto o ustequinumabe e os anti‐IL‐17 estão aguardando liberação do reembolso. Aqui, relatamos a experiência na prática diária do uso de biológicos reembolsáveis para pacientes pediátricos com psoríase encaminhados à Unidade de Psoríase do Hospital Federico II, Nápoles, de setembro de 2018 a setembro de 2020. Os critérios de inclusão no estudo retrospectivo foram: i) psoríase em placas moderada a grave (definida como PASI > 10 e/ou ASC > 10 e/ou DLQI > 10) diagnosticada pelo menos um ano antes da inclusão; ii) idade < 18 anos; iii) período de washout maior ou igual a quatro semanas para terapias sistêmicas (tratamento com UV incluído) e maior ou igual a duas semanas para terapias tópicas; iv) indivíduos iniciando tratamento biológico (adalimumabe ou etanercepte, original ou biossimilar).
O tratamento foi feito em dosagem pediátrica, com base no peso corporal do paciente. No momento base foram coletados: i) dados pessoais e demográficos; ii) duração e localização da psoríase; iii) presença de artrite psoriática (AP) e duração; iv) comorbidades; v) terapias sistêmicas anteriores; vi) gravidade da psoríase utilizando o Índice de Área e Gravidade da Psoríase (PASI, Psoriasis Area and Severity Index) e a Área de Superfície Corporal (ASC); vii) escore no Índice de Qualidade de Vida em Dermatologia (DLQI, Dermatology Life Quality Index) de pacientes e cuidadores; viii) exames de sangue (hemograma, transaminases, creatinina, azotemia, glicemia, velocidade de hemossedimentação, proteína C‐reativa, níveis de colesterol e triglicérides, eletroforese de proteínas) foram registrados. Em cada consulta de acompanhamento (a cada 12 semanas), PASI e ASC foram avaliados. Além disso, o perfil de segurança foi avaliado por eventos adversos (EAs) decorrentes do tratamento, exame físico e monitoramento de exames laboratoriais. A Declaração de Helsinque foi respeitada durante todo o estudo e o consentimento informado foi obtido e assinado por cada paciente ou cuidador antes do início do estudo. As variáveis contínuas foram apresentadas como média ± desvio‐padrão e as variáveis categóricas como número e proporção de pacientes. O teste t de Student não pareado foi usado para calcular a significância das diferenças nos valores médios em diferentes momentos do tratamento. Um valor de p < 0,05 foi considerado estatisticamente significante. Todas as análises estatísticas foram realizadas no software GraphPad Prism 4.0 (GraphPad Software Inc., La Jolla, CA, EUA).
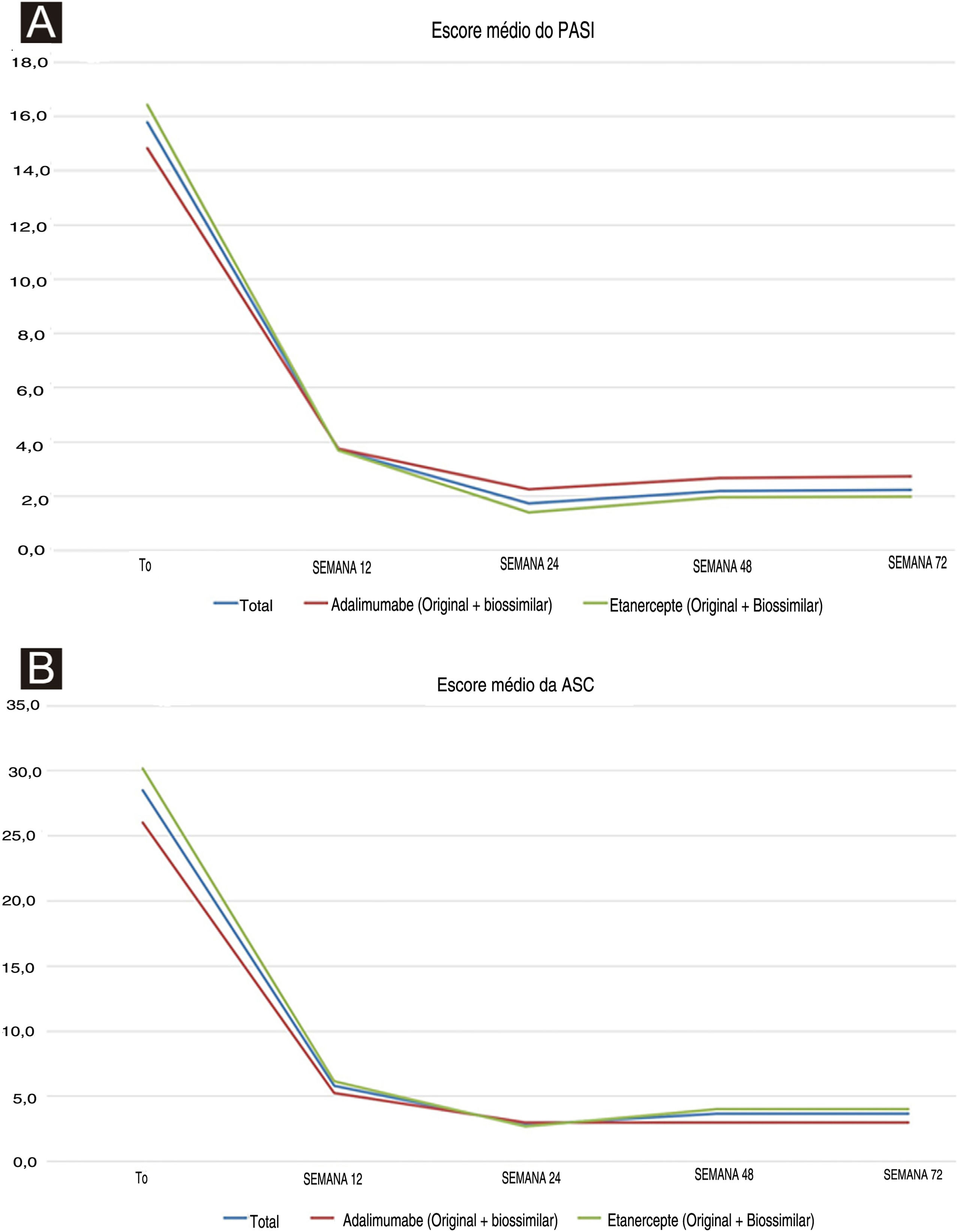
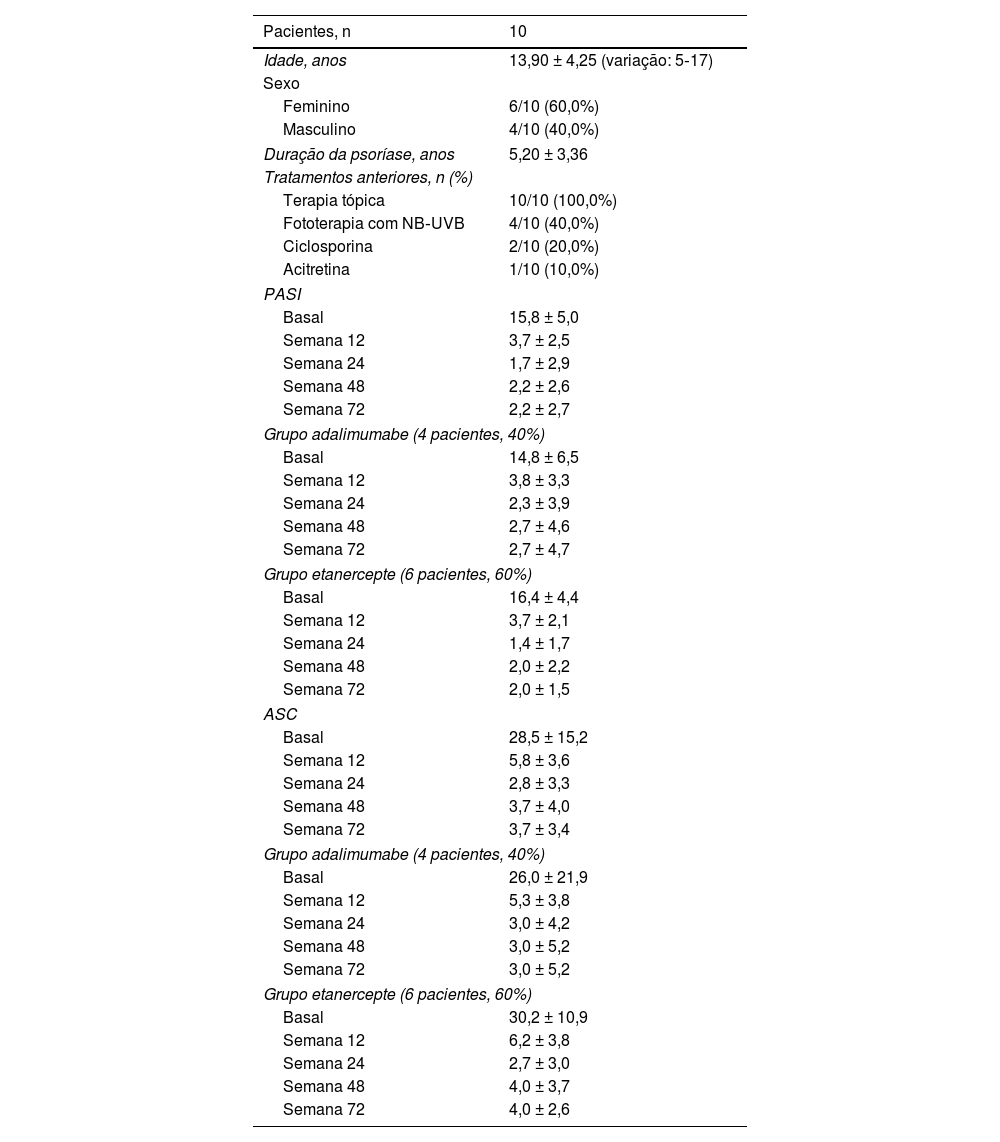
Dez pacientes foram incluídos: 60,0% (n = 6) do sexo feminino e 40,0% (n = 4) do sexo masculino, com média de idade de 13,90 ± 4,25 anos. Todos tinham psoríase em placas, com duração média de 5,20 ± 3,36 anos, e nenhum tinha AP. Um paciente apresentou anemia; não foram encontradas outras comorbidades. Todos os pacientes haviam sido tratados anteriormente com agentes tópicos. Em relação ao tratamento sistêmico prévio, quatro (40,0%) e dois (20,0%) deles receberam fototerapia e terapia sistêmica convencional (acitretina e em seguida ciclosporina, e ciclosporina isoladamente), respectivamente. A maioria (60,0%, n = 6) está atualmente em tratamento com etanercepte original ou biossimilar (duração média de 32,20 ± 10,35 meses), enquanto os demais pacientes (40,0%, n = 4) estão em tratamento com adalimumabe original ou biossimilar (duração média de 12,33 ± 12,09 meses). Um paciente que está atualmente sob tratamento com etanercepte falhou no tratamento anterior com adalimumabe por ineficácia secundária (perda da resposta PASI75 após 12 semanas). O PASI médio melhorou em ambos os pacientes tratados com adalimumabe e etanercepte desde o início até a semana 12, e da semana 24 até a semana 72 foram relatados valores estáveis para ambos os grupos (tabela 1). O PASI médio basal geral foi de 15,8 ± 5,0 (14,8 ± 6,5 para adalimumabe versus 16,4 ± 4,4 para o grupo etanercepte) e diminuiu para 2,2 ± 2,7 na semana 72 (3,0 ± 5,2 para adalimumabe versus 2,0 ± 1,5 para o grupo etanercepte). Embora o grupo etanercepte tenha incluído pacientes com PASI basal mais alto, PASI médio mais baixo foi alcançado nas visitas de seguimento (fig. 1A). Não foram encontradas diferenças estatisticamente significantes. A média da ASC mostrou tendência semelhante, embora tenha aumentado ligeiramente em ambos os grupos a partir da semana 24 (fig. 1B). A melhora significativa da doença também se refletiu na redução do impacto na qualidade de vida: o escore no DLQI diminuiu de 18,5 ± 5,5 no momento basal para 4,1 ± 3 na semana 12, até 2,5 ± 1,3 na semana 72. Em relação aos EAs, apenas um paciente relatou um único episódio de epistaxe após a primeira injeção de adalimumabe, tratada com compressão. O paciente com anemia preexistente apresentou persistência dos níveis de hemoglobina abaixo do limiar (11,0g/dL), sem piora.
Características e resultados da população do estudo
| Pacientes, n | 10 |
|---|---|
| Idade, anos | 13,90 ± 4,25 (variação: 5‐17) |
| Sexo | |
| Feminino | 6/10 (60,0%) |
| Masculino | 4/10 (40,0%) |
| Duração da psoríase, anos | 5,20 ± 3,36 |
| Tratamentos anteriores, n (%) | |
| Terapia tópica | 10/10 (100,0%) |
| Fototerapia com NB‐UVB | 4/10 (40,0%) |
| Ciclosporina | 2/10 (20,0%) |
| Acitretina | 1/10 (10,0%) |
| PASI | |
| Basal | 15,8 ± 5,0 |
| Semana 12 | 3,7 ± 2,5 |
| Semana 24 | 1,7 ± 2,9 |
| Semana 48 | 2,2 ± 2,6 |
| Semana 72 | 2,2 ± 2,7 |
| Grupo adalimumabe (4 pacientes, 40%) | |
| Basal | 14,8 ± 6,5 |
| Semana 12 | 3,8 ± 3,3 |
| Semana 24 | 2,3 ± 3,9 |
| Semana 48 | 2,7 ± 4,6 |
| Semana 72 | 2,7 ± 4,7 |
| Grupo etanercepte (6 pacientes, 60%) | |
| Basal | 16,4 ± 4,4 |
| Semana 12 | 3,7 ± 2,1 |
| Semana 24 | 1,4 ± 1,7 |
| Semana 48 | 2,0 ± 2,2 |
| Semana 72 | 2,0 ± 1,5 |
| ASC | |
| Basal | 28,5 ± 15,2 |
| Semana 12 | 5,8 ± 3,6 |
| Semana 24 | 2,8 ± 3,3 |
| Semana 48 | 3,7 ± 4,0 |
| Semana 72 | 3,7 ± 3,4 |
| Grupo adalimumabe (4 pacientes, 40%) | |
| Basal | 26,0 ± 21,9 |
| Semana 12 | 5,3 ± 3,8 |
| Semana 24 | 3,0 ± 4,2 |
| Semana 48 | 3,0 ± 5,2 |
| Semana 72 | 3,0 ± 5,2 |
| Grupo etanercepte (6 pacientes, 60%) | |
| Basal | 30,2 ± 10,9 |
| Semana 12 | 6,2 ± 3,8 |
| Semana 24 | 2,7 ± 3,0 |
| Semana 48 | 4,0 ± 3,7 |
| Semana 72 | 4,0 ± 2,6 |
(a) Tendências dos escores médios do PASI em toda a população do estudo (linha azul), no grupo adalimumabe (linha vermelha) e no grupo etanercepte (linha verde) no momento basal e nos seguimentos. (b) Tendências dos escores médios de ASC em toda a população do estudo (linha azul), no grupo adalimumabe (linha vermelha) e no grupo etanercepte (linha verde) no momento e nos seguimentos.
O presente estudo da prática diária mostrou boa segurança e eficácia dos biológicos em crianças e adolescentes encaminhados ao centro para tratamento de psoríase moderada a grave. Embora a população do estudo seja limitada, as respostas ao PASI e ASC refletem os resultados relatados em ensaios clínicos, pois o PASI médio diminuiu desde o momento basal (15,79 ± 5,03) até a semana 24 (1,74 ± 2,59) sob tratamento com adalimumabe e etanercepte. A mesma tendência foi observada para ASC média: 28,50 ± 15,16 (momento basal) versus 2,80 ± 3,33 (semana 24). Curiosamente, ambos os valores clínicos mostraram aumento discreto a partir da semana 48 (fig. 1), embora nenhuma diferença estatisticamente significante tenha sido alcançada. Além disso, mesmo que os escores PASI e ASC tenham permanecido estáveis ou levemente aumentados a partir da semana 24, os pacientes e especialmente os cuidadores experimentaram melhora nos escores do DLQI. Com relação aos EAs, esses resultados da prática diária evidenciam incidência menor de infecções do que as relatadas em ensaios clínicos, o que pode ser atribuído ao tamanho diferente das populações entre os ensaios clínicos e os estudos com base na prática diária.11 Experiências da prática diária podem aumentar a população estudada de pacientes psoriásicos pediátricos tratados com agentes biológicos. O tratamento eficaz e seguro da psoríase em crianças ecoa no ambiente familiar, com benefícios que se estendem aos pais/responsáveis.
Suporte financeiroNenhum.
Contribuição dos autoresTodos os autores contribuíram para a concepção e planejamento do estudo. A preparação do material, a coleta e a análise dos dados foram realizadas por Matteo Megna, Gabriella Fabbrocini, Lucia Gallo, Angelo Ruggiero, Elisa Camela, Sonia Sofia Ocampo‐Garza e Eleonora Cinelli. A primeira versão do manuscrito foi redigida por Eleonora Cinelli, Gabriella Fabbrocini e Matteo Megna, e todos os autores comentaram as versões anteriores do manuscrito. Todos os autores leram e aprovaram versão final do manuscrito.
Conflito de interessesO Dr. Matteo Megna atuou como palestrante ou consultor da Novartis, Eli Lilly e Abbvie. A Professora Gabriella Fabbrocini atuou como palestrante ou consultora para Janssen, Leo Pharma, Novartis, Eli Lilly, Abbvie e Almirall. A Dra. Lucia Gallo atuou como palestrante ou consultora da Lilly e da Pfizer. A Dra. Eleonora Cinelli, o Dr. Angelo Ruggiero, a Dra. Elisa Camela e a Dra. Sonia Sofía Ocampo‐Garza não têm conflito de interesses a declarar.
Como citar este artigo: Megna M, Fabbrocini G, Gallo L, Ruggiero A, Camela E, Ocampo‐Garza SS, et al. Treatment of pediatric psoriasis with TNF‐antagonists: a real‐life single‐center case series. An Bras Dermatol. 2022;97:819–22.
Trabalho realizado no Departamento de Dermatologia, University of Naples Federico II, Nápoles, Itália.