Durante a cicatrização, fibroblastos se diferenciam em miofibroblastos, que têm papel fundamental na contração da ferida. Após o fechamento da ferida, os miofibroblastos sofrem apoptose. Mediado por diversos fatores, como estresse mecânico e expressão de TGF‐B1, pode ocorrer estímulo da sobrevivência de miofibroblastos, com desenvolvimento de cicatrizes hipertróficas. Acredita‐se que a toxina botulínica A (TBA) iniba diretamente a diferenciação fibroblasto‐miofibroblasto, suprima a expressão do TGF‐B1, além de inibir a liberação de mediadores inflamatórios que poderiam prevenir a hipertrofia cicatricial, indicando seu potencial uso preventivo em cicatrizes sob áreas de tensão.1–5 Objetivou‐se avaliar a influência da aplicação de TBA no pós‐operatório imediato da exérese de nevos melanocíticos no tronco, a fim de prevenir cicatrizes inestéticas.
Estudo prospectivo de intervenção terapêutica, projeto aprovado pelo Comitê de Ética em Pesquisa Institutional da Faculdade Evangélica do Paraná (n° 1.162.242). Os participantes assinaram Termo de Consentimento Livre e Esclarecido. Os critérios de inclusão foram: idade superior a 12 anos e diagnóstico de nevo melanocítico no tronco com diâmetro entre 0,7 e 1,4cm. Os critérios de exclusão foram: defeitos de cicatrização, coagulopatias, gravidez/amamentação, doença autoimune e tabagismo. Foram selecionadas 23 lesões (n=23) em 16 participantes – nove (n=15) do sexo feminino e sete (n=8) do sexo masculino – com idades entre 16 e 80 anos, fototipos II a IV e subdividas em cinco regiões: tórax anterior (n=2), cervical posterior (n=2), dorso superior (n=11), dorso inferior (n=6) e deltoide (n=2) (tabela 1).
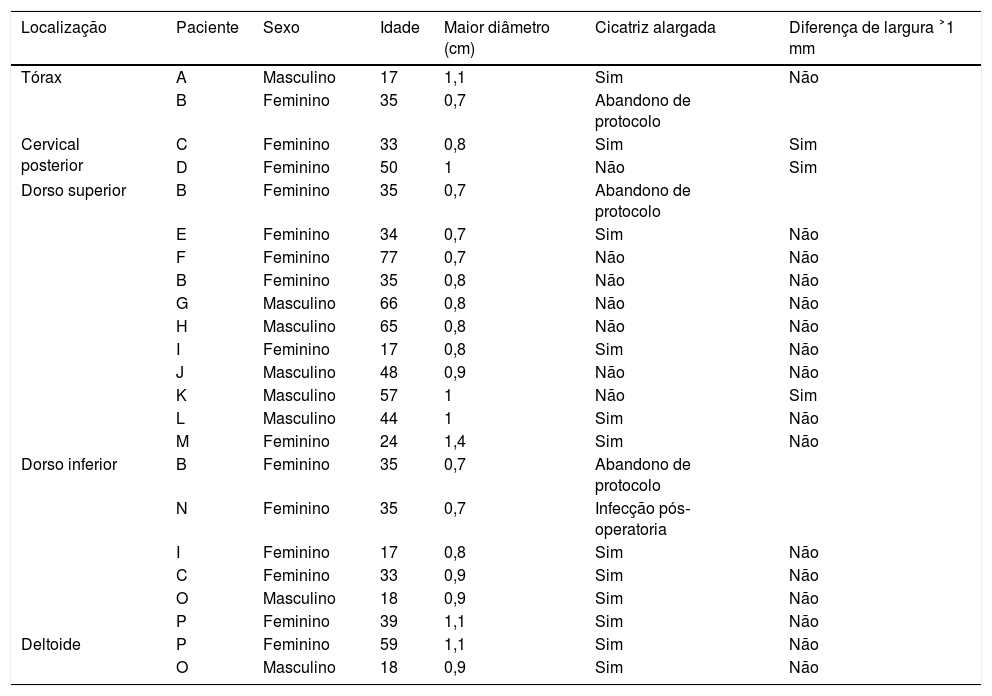
Tabela com os principais dados dos participantes e os resultados obtidos
| Localização | Paciente | Sexo | Idade | Maior diâmetro (cm) | Cicatriz alargada | Diferença de largura ˃1 mm |
|---|---|---|---|---|---|---|
| Tórax | A | Masculino | 17 | 1,1 | Sim | Não |
| B | Feminino | 35 | 0,7 | Abandono de protocolo | ||
| Cervical posterior | C | Feminino | 33 | 0,8 | Sim | Sim |
| D | Feminino | 50 | 1 | Não | Sim | |
| Dorso superior | B | Feminino | 35 | 0,7 | Abandono de protocolo | |
| E | Feminino | 34 | 0,7 | Sim | Não | |
| F | Feminino | 77 | 0,7 | Não | Não | |
| B | Feminino | 35 | 0,8 | Não | Não | |
| G | Masculino | 66 | 0,8 | Não | Não | |
| H | Masculino | 65 | 0,8 | Não | Não | |
| I | Feminino | 17 | 0,8 | Sim | Não | |
| J | Masculino | 48 | 0,9 | Não | Não | |
| K | Masculino | 57 | 1 | Não | Sim | |
| L | Masculino | 44 | 1 | Sim | Não | |
| M | Feminino | 24 | 1,4 | Sim | Não | |
| Dorso inferior | B | Feminino | 35 | 0,7 | Abandono de protocolo | |
| N | Feminino | 35 | 0,7 | Infecção pós‐operatoria | ||
| I | Feminino | 17 | 0,8 | Sim | Não | |
| C | Feminino | 33 | 0,9 | Sim | Não | |
| O | Masculino | 18 | 0,9 | Sim | Não | |
| P | Feminino | 39 | 1,1 | Sim | Não | |
| Deltoide | P | Feminino | 59 | 1,1 | Sim | Não |
| O | Masculino | 18 | 0,9 | Sim | Não |
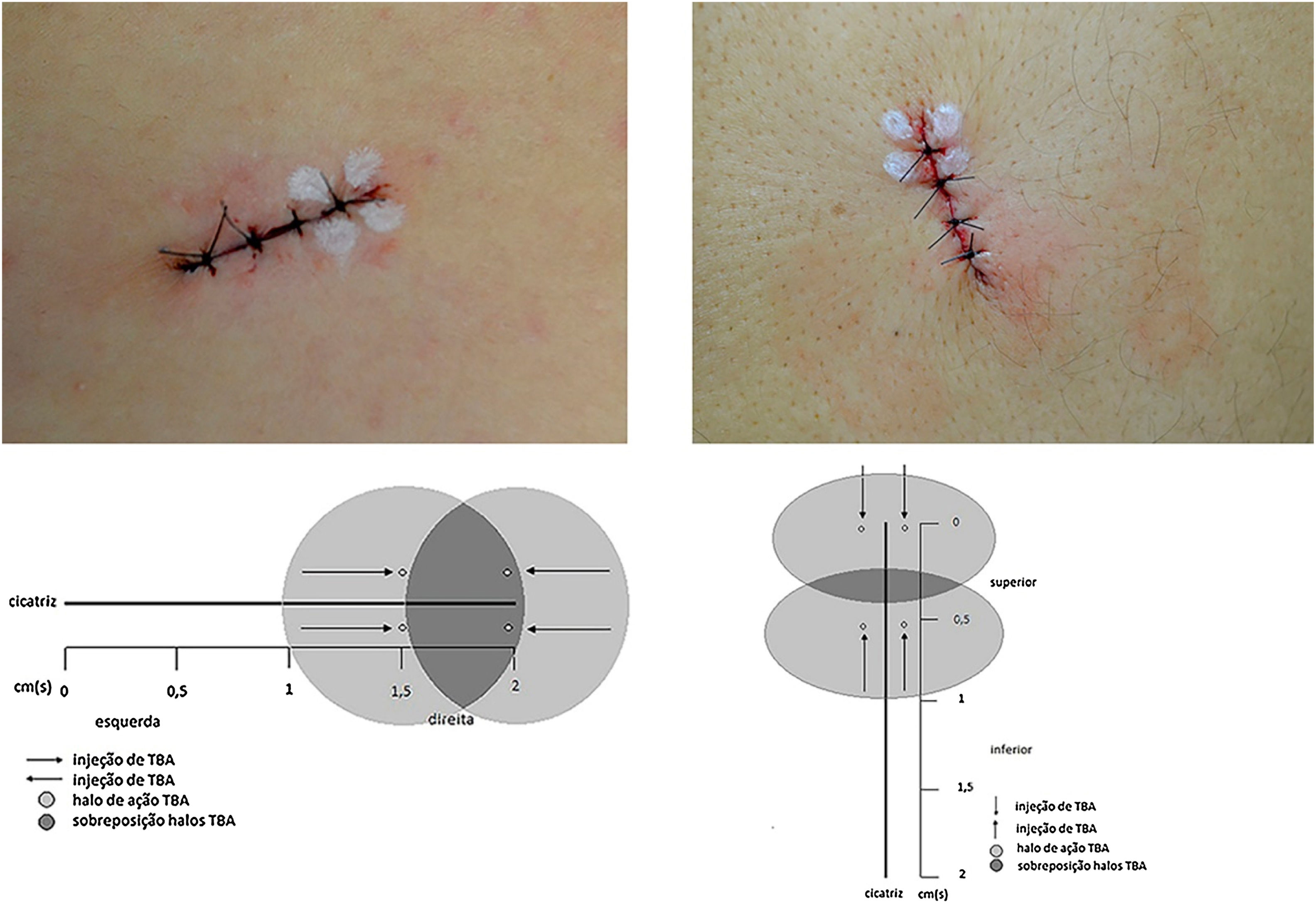
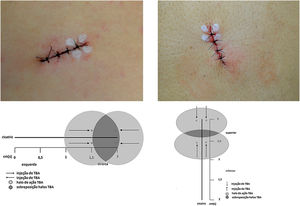
As lesões foram marcadas em elipse de 2cm, seguindo linhas de Langer, englobando o nevo com margem lateral de 2mm, resultando em fusos de mesmo comprimento e largura variável de acordo com o diâmetro do nevo. Realizada antissepsia pré‐operatória com iodopovidona, aplicação perilesional de anestésico lidocaína com vasoconstritor em igual volume para todos os nevos, seguida de incisão, excisão, descolamento das bordas, sutura interna com poliglactina (Vicryl 4.0 Ethicon®) em três pontos fixos equidistantes e sutura externa com mononylon 4.0 (Ethicon®) em quatro pontos equidistantes a 2mm das bordas. Imediatamente após a sutura foram marcados quatro pontos para aplicação intradérmica de 1 Unidade (U) por ponto de TBA (total de 4 U) na metade da linha de incisão. Foi utilizada toxina incobotulínica A/Xeomin® 100 U (Merz Farmacêutica) diluída em 1mL de soro fisiológico a 0,9%. Quando a direção da incisão era longitudinal, aplicou‐se TBA na metade à direita do cirurgião, e quando vertical, na metade superior (fig. 1). O participante não foi informado sobre em qual metade havia sido aplicada a TBA. Nevos excisados foram enviados para análise histopatológica. Os pontos foram retirados após 14 dias. Os participantes tiveram seguimento de seis meses; reavaliação clínica e registros fotográficos foram realizados após dois e seis meses.
Os parâmetros de avaliação dos resultados foram: inspeção das cicatrizes, comparação entre as duas metades, mensurações e opinião dos participantes. Considerou‐se cicatriz alargada quando a largura final era maior que 50% da inicial – ou seja, do fuso antes da sutura, correspondente ao diâmetro do nevo mais 2mm de margem. Cicatrizes com largura inferior a esse parâmetro ou com completa coaptação das bordas foram consideradas não alargadas. Para comparação entre as metades, foi considerado resultado quando a diferença era maior que 1mm, desde que a metade tratada com TBA apresentasse menor largura. Avaliou‐se a opinião dos participantes quanto à largura, espessura e textura entre as metades das cicatrizes.
Variáveis contínuas foram analisadas bivariadamente pelos testes paramétrico t de Student e não paramétrico Mann‐Whitney, dependendo da normalidade das distribuições, avaliada pelo teste de Shapiro‐Wilk. Variáveis categóricas foram comparadas pelo teste exato de Fisher. O intervalo de confiança de 95% das proporções foi calculado pelo método bootstrap. Foram considerados significativos valores de p <0,05.
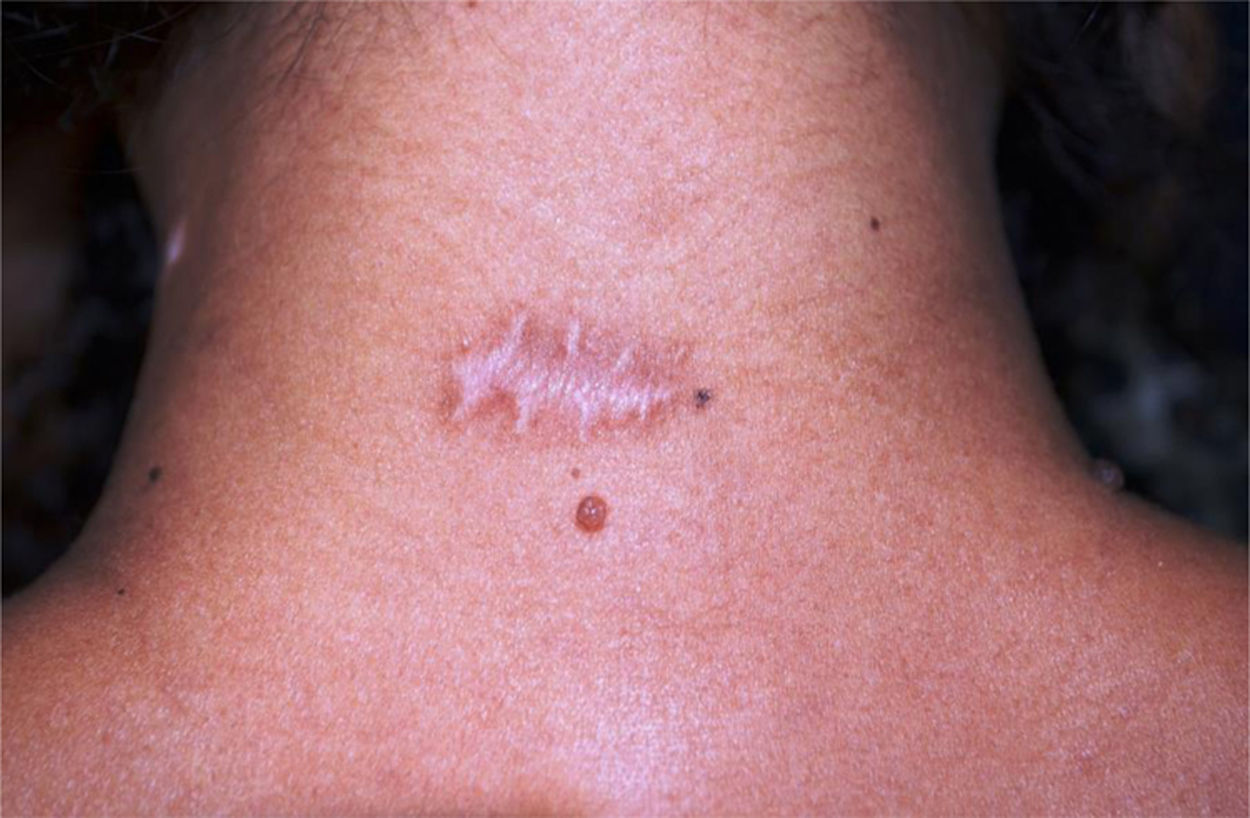
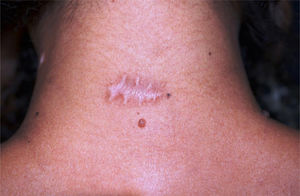
Finalizaram o estudo 14 de 16 pacientes: sete mulheres (n=10) e sete homens (n=8), com idade média de 43,5 anos (17‐77 anos, DP=19,29), totalizando 18 cicatrizes cirúrgicas (n=18). O diâmetro médio dos nevos foi 0,92cm. Observou‐se alargamento em 12/18 cicatrizes (66,67%) (95% IC: 44,5%‐83,3%). Um participante de 18 anos apresentou cicatriz queloide na região deltoide. Mensurou‐se largura menor na metade tratada (fig. 2) com TBA em 3/18 cicatrizes (16,7% [95% IC: 0%‐33%]), das quais duas estavam localizadas na cervical posterior, e uma no dorso superior. Em nenhuma cicatriz a metade controle teve largura menor do que a metade tratada com TBA. O risco de alargamento da cicatriz não esteve correlacionado com o diâmetro do nevo (p=0,307), porém associou‐se inversamente com a idade – cinco vezes menor para participantes com 50 anos de idade ou mais (RR=0,2 [0,05‐0,74]; p=0,013). Na opinião dos participantes, apenas 4/14 (22,2% [95% IC: 5,6%‐33,3%]) notaram diferenças entre as metades, considerando melhora na metade tratada.
Neste estudo, a injeção intradérmica de toxina incobotulínica no pós‐operatório imediato e na dose utilizada não foi capaz de promover alterações significativas na qualidade das cicatrizes.
Suporte financeiroHouve doação de um frasco de incobotulínica A (INCO)/Xeomin® 100U (Merz, Brasil), sem nenhum conflito de interesses, ou seja, a empresa não interferiu em nenhuma etapa do estudo e na redação deste manuscrito.
Contribuição dos autoresRenato Luiz Baldissera: Concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Rafaela Ludvig Lehmkuhl: Concepção e planejamento do estudo; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Juliano Vilaverde Schmitt: Análise estatística.
Deborah Skusa de Torre: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa.
Conflito de interessesNenhum.
Como citar este artigo: Baldissera RL, Lehmkuhl RL, Schmitt JV, Torre DS. Botulinum toxin‐A: evaluation of the influence on the aspect of trunk scars. An Bras Dermatol. 2021;96:362–4.
Trabalho realizado no Departamento de Dermatologia, Hospital Universitário Evangélico de Curitiba, Curitiba, PR, Brasil.