O eczema das mãos (EM) é doença de alta prevalência, recorrente e multifatorial; engloba um grupo de doenças eczematosas que acomete as mãos, classificadas etiologicamente como dermatite de contato irritativa (DCI), dermatite de contato alérgica (DCA) e dermatite atópica (DA). Poucos são os estudos epidemiológicos na América Latina que investigaram as características dos pacientes com essa doença e sua origem.
ObjetivosAnalisar o perfil dos pacientes com diagnóstico de EM que foram submetidos a testes de contato a fim de determinar sua etiologia.
MétodosRealizado estudo retrospectivo descritivo dos dados epidemiológicos e de testes de contato dos pacientes com EM atendidos em hospital terciário da cidade de São Paulo no período de janeiro de 2013 a dezembro de 2020.
ResultadoForam analisados 173 pacientes cujo diagnóstico final de DCI foi de 61,8%, de DCA 23,1% e de DA 5,2%, havendo sobreposição de diagnóstico em 42,8% dos casos. As principais substâncias dos testes de contato positivos e relevantes foram: Kathon CG (42%), sulfato de níquel (33%) e tiuram‐mix (18%).
Limitações do estudoNúmero de casos atendidos e perfil socioeconômico limitado à faixa populacional vulnerável.
ConclusãoO EM é diagnóstico em que a sobreposição das etiologias é frequente; os principais sensibilizantes relacionados na DCA são Kathon CG, sulfato de níquel e tiuram‐mix.
O termo eczema tem origem grega (ekzein) e significa ebulição. É definido como distúrbio inflamatório da pele, clinicamente caracterizado pela presença de eritema, edema, infiltração, vesiculação, secreção, formação de crostas, escamas e liquenificação. Essas lesões podem se suceder ou associar resultado no quadro clínico polimorfo do eczema.1 Histologicamente, o eczema pode acometer a derme e a epiderme, levando a espogiose, edema intracelular, acantose e paraceratose na epiderme e infiltrado linfocitário perivascular dérmico. Os principais sintomas que o acompanham são prurido, queimação e dor.
O termo eczema de mãos (EM) engloba um grupo de doenças eczematosas que acomete predominantemente as mãos e que apresentam quadro clínico comum.
A classificação do EM ainda é tema controverso, podendo basear‐se na morfologia e etiologia das lesões clínicas, porém ainda não há classificação universalmente aceita.
Em relação à morfologia das lesões clínicas, o EM pode ser classificado como hiperceratósico, eritematoescamoso, pompholyx (vesicular) e numular. Essas apresentações podem variar de maneira dinâmica ao longo da evolução clínica do EM.
Quanto à etiologia, pode ser classificado como dermatite de contato irritativa (DCI), dermatite de contato alérgica (DCA), dermatite atópica (DA) e, menos comum, dermatite de contato a proteínas. No entanto, na maioria das vezes o que se observa é uma sobreposição dessas etiologias. Assim, o EM comumente ocorre em indivíduos com antecedente de atopia e que têm história de contato com substâncias potencialmente sensibilizantes ou irritativas ao longo da vida, muitas vezes relacionado à exposição ocupacional.
A prevalência estimada em um ano do EM na Suécia é de 9,7%.2 De acordo com alguns estudos, a taxa de incidência do EM é de 5,5 casos novos por 1.000 pessoas por ano, com taxa média de incidência maior entre o sexo feminino (9,6) do que entre o sexo masculino (4,0).3 Isso ocorre principalmente pela maior frequência de DA entre o sexo feminino e sua maior exposição a substâncias sensibilizantes e irritativas em atividades ocupacionais e domésticas, e não efetivamente por diferenças anatômicas das mãos entre os dois sexos.
Além do sexo feminino, os principais fatores de risco relacionados à maior incidência de EM são: antecedente de DA (o fator de risco mais relevante), presença de episódio prévio de EM, antecedente de DCA(principalmente relacionado à sensibilização a sulfato de níquel), trabalho úmido (definido como aquele em que se mantém a mão úmida ou em uso de luvas por mais de duas horas contínuas ou realiza a lavagem das mãos mais de 20 vezes em um dia) e idade menor que 20 anos no início do quadro.4 Não há associação clara entre o EM e hábitos como tabagismo e etilismo ou mesmo influência do clima.5
O EM é a dermatose ocupacional mais frequente. O principal grupo afetado pelo EM é o de mulheres em idade economicamente ativa, de 20 a 29 anos. EM afeta 30% das mulheres que ocupam cargos de alto risco ocupacional para EM, os chamados trabalhos úmidos, como profissionais da saúde, limpeza e cozinha, cabelereiros e trabalhadores da indústria de manufatura. A incidência de novos casos de EM de causa ocupacional é estimada em 0,7 por 1.000 trabalhadores por ano. No entanto, a subnotificação dos casos pode mascarar a real importância desse problema ocupacional, que pode ser 30 a 50 vezes maior.6 Estudos mostram que o EM está relacionado a afastamento do trabalho em 19,9% dos casos e demissões em 23% dos casos em período de um ano. Na Suécia, um estudo mostrou que 82% dos pacientes com EM tiveram mudança de sua função no trabalho por conta da doença e 48% deles tiveram, em algum momento, que se afastar do trabalho por pelo menos uma vez pelo período de sete dias por conta da doença, e em 15% dos casos culminou‐se em desemprego ou aposentadoria por invalidez.7 Por fim, o custo de um paciente com EM pode variar entre 1.712 a 9.792 euros ao ano, principalmente relacionado ao absenteísmo ao trabalho.8 Até o momento, não temos estudos semelhantes em nosso meio que quantifiquem o custo dessa doença.
Além do impacto econômico negativo da doença ao paciente, há ainda um estigma social importante relacionado ao quadro de dermatose visível, que pode causar grande fardo. As mãos são importantes para a expressão e a comunicação dos indivíduos. Assim, qualquer prejuízo de função ou apresentação das mãos pode resultar em dano psicossocial, como baixa autoestima, isolamento social e ansiedade. O EM está relacionado a impacto negativo na qualidade de vida de modo semelhante ao encontrado em pacientes com doenças crônicas, como asma e psoríase.9 Além disso, esses fatores psicológicos podem também impactar de maneira negativa a doença.
O termo eczema crônico de mãos (ECM) pode ser definido como a presença do EM por período maior que 12 semanas ou recorrência de episódios pelo menos duas vezes ao ano.4 Pode afetar até 9% da população adulta e ter prevalência estimada de 10% em um ano nos países escandinavos.2,3 São os casos de difícil controle e refratários a tratamentos convencionais.
O EM é doença de alta prevalência, comumente de caráter recorrente e que afeta a qualidade de vida dos indivíduos e também a economia da sociedade. Não há estudos recentes caracterizando o perfil da população em relação ao tema na América Latina. Assim, faz‐se necessário estudo para caracterizar o perfil da população, o que poderia contribuir para o entendimento do assunto em nosso meio e fornecer informações relevantes para, a partir dele, traçar estratégias de prevenção efetiva para o problema.
MétodosTrata‐se de estudo retrospectivo descritivo com análise de prontuários e questionários aplicados sistemática e rotineiramente aos pacientes com quadro de EM atendidos em clínica de dermatologia de hospital terciário da São Paulo, de janeiro de 2013 a dezembro de 2020. Foram incluídos na pesquisa todos os pacientes adultos de ambos os sexos atendidos com suspeita clínica de EM submetidos ao teste de contato. Foram excluídos do estudo os pacientes que apresentavam contraindicações para realização de teste de contato (uso de corticoide sistêmico há menos de duas semanas, exposição solar nos últimos 15 dias e vigência de eczema agudo); que apresentavam dados incompletos ou insuficientes no prontuário ou no questionário do ambulatório; que não compareceram à leitura do teste de contato nos retornos de 48 horas e 96 horas após sua aplicação; que não aceitaram ter seus dados incluídos na pesquisa; que não tenham assinando termo de consentimento livre e esclarecido; e que eram gestantes.
A metodologia dos testes de contato aplicados nesses pacientes se baseia na aplicação de substâncias alérgenas fixadas na pele no dorso do paciente com auxílio de contensores e fitas adesivas. Os contensores utilizados para fixação dos testes de contato foram AlergoChambers (Neoflex biotecnologia ‐ São Paulo, Brasil).
Todas as leituras de 48 e 96 horas foram realizadas pelo mesmo dermatologista que aplicou os testes, de acordo com critérios morfológicos adotados pela International Contact Dermatitis Research Group (ICDRG), a saber: (−) negativo, quando não se observa reação na pele, e positivo em três intensidades, (+) discreto eritema com algumas pápulas, (++) eritema, pápulas e vesículas, (+++) intenso eritema, pápulas e vesículas confluentes.10
As baterias usadas neste estudo foram: bateria padrão brasileira (30 substâncias – FDA Allergenic, Rio de Janeiro, Brasil), bateria de cosméticos (10 substâncias ‐ FDA Allergenic, Rio de Janeiro, Brasil), bateria capilar (15 substâncias ‐ IPI ASAC, São Paulo, Brasil), bateria de corticoides (sete substâncias ‐ FDA Allergenic, Rio de Janeiro, Brasil), bateria de úlceras (27 substâncias ‐ Chemotechnique, Suécia). Em alguns casos específicos, alguns medicamentos tópicos foram produzidos em padronização preestabelecidas na literatura18 para investigação de DCA a medicamentos.
Os dados obtidos foram inseridos em planilha de programa Microsoft Excel para Mac, versão 15.33, e a análise estatística realizada pelo do programa SPSS v25.0.
ResultadosNo período determinado neste estudo, 184 pessoas preencheram os critérios de inclusão e 11 pessoas apresentaram critérios de exclusão, resultando numa população de estudo de 173 pessoas.
Dos 173 pacientes estudados, 130 (75,1%) eram do sexo feminino e 43 (24,9%) do sexo masculino. A idade média do grupo estudado foi de 41 ± 15,46 anos (43 ± 17,47 anos para o sexo masculino e 40 ± 14,65 anos para o sexo feminino).
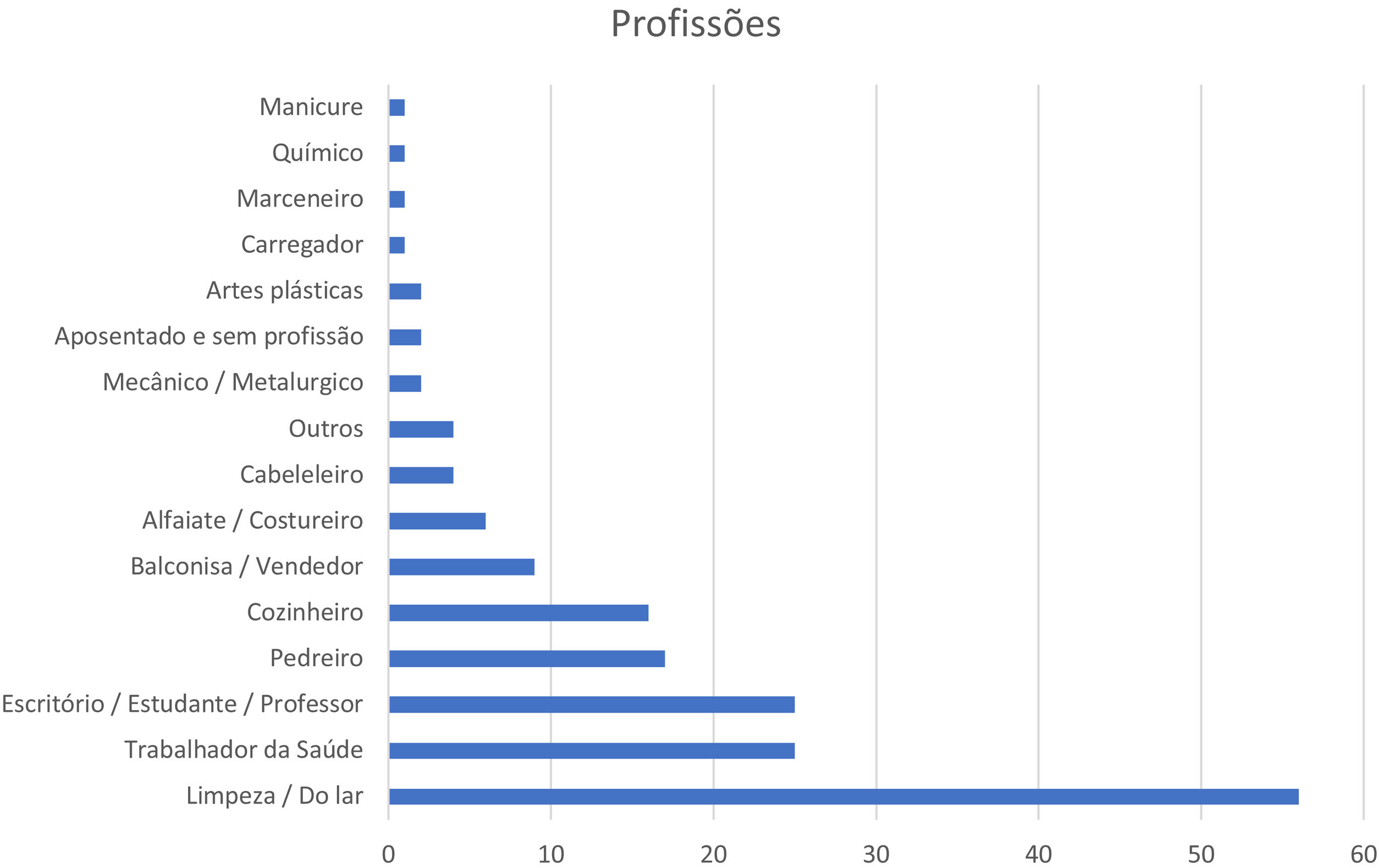
Quanto à profissão, 56 (32,4%) trabalhavam com limpeza/serviços domésticos, 25 (14,5%) eram trabalhadores de saúde, 25 (14,5%) trabalhavam em escritórios ou como professores ou estudantes, 17 (9,8%) eram pedreiros, 16 (9,2%) cozinheiros, nove (5,2%) balconistas ou vendedores, seis (3,5%) alfaiates, quatro (2,3%) cabelereiros, quatro (2,3%) outros, dois (1,2%) mecânicos ou metalúrgicos, dois (1,2%) trabalhavam com artes plásticas, dois (1,2%) eram aposentados ou sem profissão, um (0,6%) carregador, um (0,6%) marceneiro, um (0,6%) químico, um (0,6%) manicure e um (0,6%) não respondeu à pergunta (fig. 1).
Quanto a trabalhos domésticos, 146 (84,4%) informaram realizar algum tipo de trabalho doméstico, 20 (11,6%) negaram realizar trabalhos domésticos e sete indivíduos não responderam à pergunta. Quando questionados sobre contato com água por mais de duas horas por dia, 82 (47,4%) referiram que sim, 60 (34,7%) negaram e 31 (17,9%) não responderam à pergunta. Em relação ao ato de lavar as mãos mais de 20 vezes ao dia, 77 (44,5%) confirmaram esse hábito, 65 (37,6%) negaram e 31 (17,9%) não responderam à pergunta.
Quanto aos cuidados com as roupas, 94 (54,3%) dos indivíduos referiram lavar roupas em casa, 47 (27,2%) negaram e 32 (18,5%) não responderam à pergunta. Quando questionados sobre possuírem máquina de lavar roupas em casa, 109 (63%) confirmaram, 32 (18,5%) negaram e 32 (18,5%) não responderam à pergunta. Quanto a lavar louças, 131 (75,7%) referiram lavar louças em casa, 10 (5,8%) negaram e 32 (18,5%) não responderam à pergunta. Quando questionados sobre possuírem máquina de lavar louças em casa, 16 (9,2%) confirmaram, 125 (72,3%) negaram e 32 (18,5%) não responderam à pergunta.
Em relação a antecedentes, 79 (45,7%) referiram antecedentes pessoais de atopia, 71 (41%) antecedentes familiares de atopia e 79 (45,7%) antecedentes de alergia a metais.
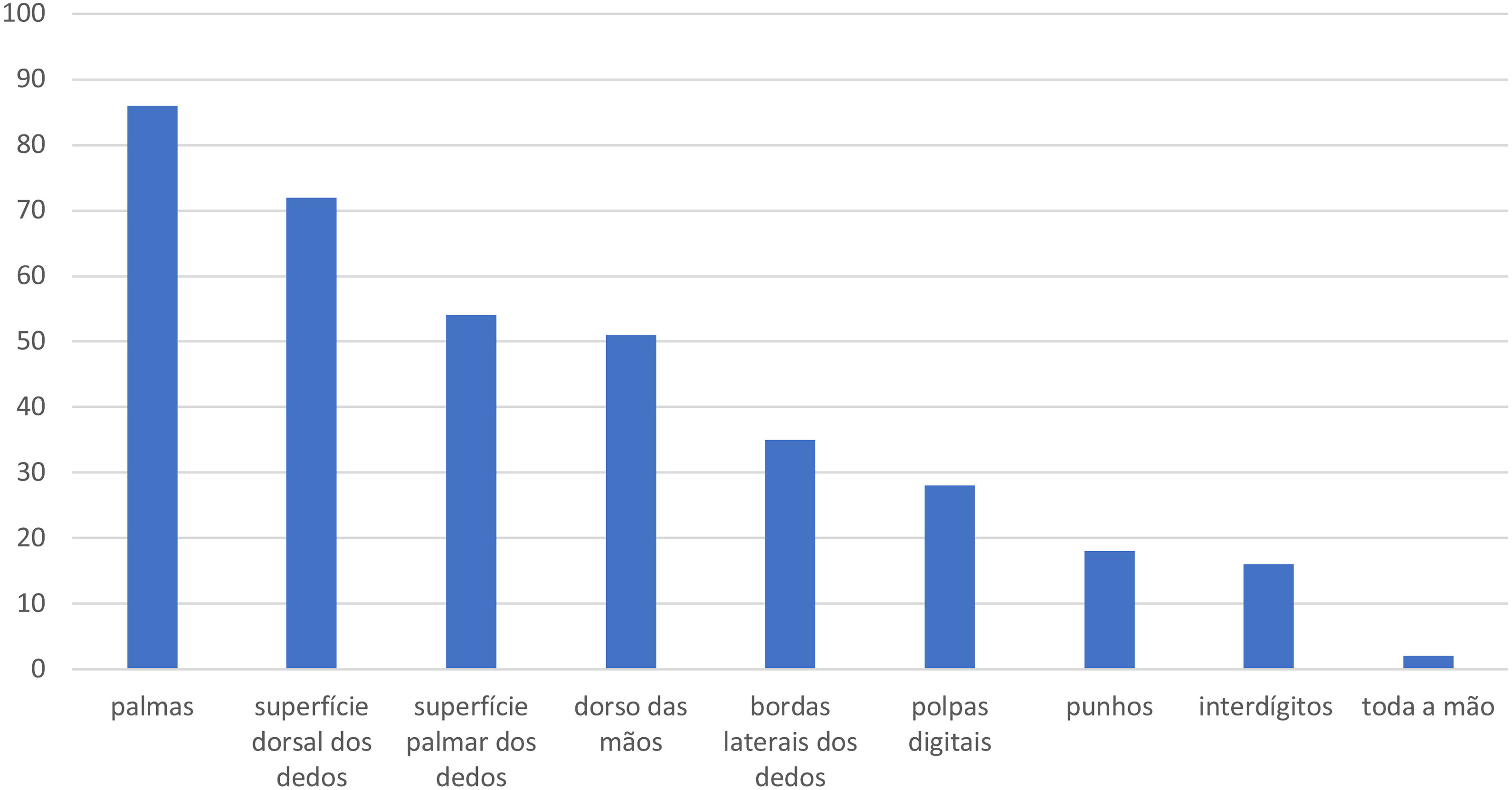
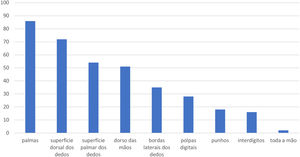
Quanto à localização do EM, 86 (49,7%) apresentavam lesões nas palmas, 72 (41,6%) na superfície dorsal dos dedos, 54 (31,2%) na superfície palmar dos dedos, 51 (29,5%) no dorso das mãos, 35 (20,2%) nas bordas laterais dos dedos, 28 (16,2%) nas polpas digitais, 18 (10,4%) nos punhos, 16 (9,2%) nos interdígitos e dois (1,2%) em toda a mão (fig. 2).
Quanto à apresentação clínica, 139 (80,3%) apresentavam descamação, 137 (79,2%) eritema, 127 (73,4%) fissuras, 43 (24,9%) vesículas e sete (4%) pústulas. Em 74 (42,8%) dos indivíduos havia lesões aglomeradas em placas.
Em relação a lesões em outras áreas além das mãos, 31 (17,9%) apresentavam lesões nos pés, 27 (15,6%) nos membros superiores, 14 (8,1%) nas pernas, 13 (7,5%) na face, sete (4%) no couro cabeludo, sete (4%) na região cervical, dois (1,2%) no tórax, cinco (2,9%) no dorso, três (1,7%) no abdome, três (1,7%) nos glúteos e três (1,7%) nas coxas.
Após realização dos testes de contato, 98 (56,6%) foram considerados relevantes e 75 (43,4%) considerados não relevantes para a dermatose atual, com relevância prévia ou desconhecida. O diagnóstico final após a realização do teste de contato estabeleceu que 107 (61,8%) dos indivíduos apresentavam diagnóstico de DCI, 98 (56,6%) diagnóstico de DCA, 40 (23,1%) diagnóstico de DA e nove (5,2%) tiveram outros diagnósticos. Nessa análise, houve sobreposição de diagnósticos em 74 (42,8%) dos pacientes. Ao analisar estes mesmos 173 diagnósticos de maneira isolada, ou seja, sem os casos com sobreposição de diagnósticos, obteve‐se DCI em 42 (24,3%) indivíduos, DCA em 41 (23,7%), DA em nove (5,2%) e outro diagnóstico em sete (4%) dos indivíduos (tabela 1). Dentre todos os indivíduos, 98 (56,6%) dos casos foram considerados dermatoses ocupacionais, sejam elas irritativas ou alérgicas.
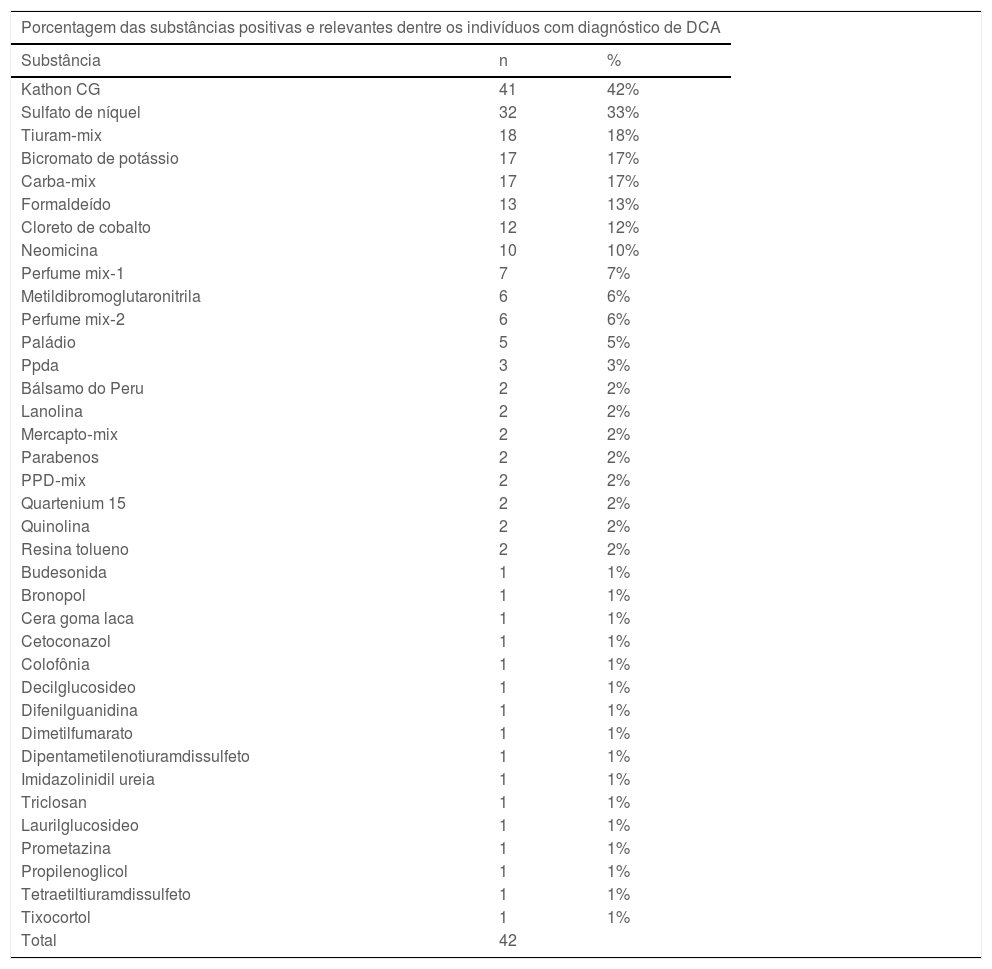
Dos pacientes com diagnóstico de DCA, observamos testes positivos e relevantes para as seguintes substâncias: Kathon CG 41 (42%), sulfato de níquel 32 (33%), tiuram‐mix 18 (18%), carba‐mix 17 (17%), bicromato de potássio 17 (17%), cloreto de cobalto 12 (12%), formaldeído 13 (13%), neomicina 10 (10%), metildibromoglutaronitrila 6 (6%), perfume mix‐1 7 (7%), perfume mix‐2 6 (6%), paládio 5 (5%), PPDA 3 (3%), 2 (2%) para as substâncias bálsamo do Peru, lanolina, mercapto‐mix, parabenos, PPD‐mix, quartenium 15, quinolina, resina tolueno e 1 (1%) para as substâncias budesonida, bronopol, cera goma laca, cetoconazol, colofônia, decilglucosideo, difenilguanidina, dimetilfumarato, dipentametilenotiuramdissulfeto, imidazolinidil ureia, triclosan, laurilglucosideo, prometazina, propilenoglicol, tetraetiltiuramdissulfeto e tixocortol (tabela 2).
Testes positivos e relevantes em pacientes com diagnóstico de DCA
| Porcentagem das substâncias positivas e relevantes dentre os indivíduos com diagnóstico de DCA | ||
|---|---|---|
| Substância | n | % |
| Kathon CG | 41 | 42% |
| Sulfato de níquel | 32 | 33% |
| Tiuram‐mix | 18 | 18% |
| Bicromato de potássio | 17 | 17% |
| Carba‐mix | 17 | 17% |
| Formaldeído | 13 | 13% |
| Cloreto de cobalto | 12 | 12% |
| Neomicina | 10 | 10% |
| Perfume mix‐1 | 7 | 7% |
| Metildibromoglutaronitrila | 6 | 6% |
| Perfume mix‐2 | 6 | 6% |
| Paládio | 5 | 5% |
| Ppda | 3 | 3% |
| Bálsamo do Peru | 2 | 2% |
| Lanolina | 2 | 2% |
| Mercapto‐mix | 2 | 2% |
| Parabenos | 2 | 2% |
| PPD‐mix | 2 | 2% |
| Quartenium 15 | 2 | 2% |
| Quinolina | 2 | 2% |
| Resina tolueno | 2 | 2% |
| Budesonida | 1 | 1% |
| Bronopol | 1 | 1% |
| Cera goma laca | 1 | 1% |
| Cetoconazol | 1 | 1% |
| Colofônia | 1 | 1% |
| Decilglucosideo | 1 | 1% |
| Difenilguanidina | 1 | 1% |
| Dimetilfumarato | 1 | 1% |
| Dipentametilenotiuramdissulfeto | 1 | 1% |
| Imidazolinidil ureia | 1 | 1% |
| Triclosan | 1 | 1% |
| Laurilglucosideo | 1 | 1% |
| Prometazina | 1 | 1% |
| Propilenoglicol | 1 | 1% |
| Tetraetiltiuramdissulfeto | 1 | 1% |
| Tixocortol | 1 | 1% |
| Total | 42 | |
Em análise geral de todos os pacientes com EM, observou‐se que 75,1% dos casos foram encontrados no sexo feminino, dado que coincide com a literatura.11 É sugerido que a diferença de prevalência entre os sexos ocorra essencialmente por diferença de exposição ambiental, tanto ocupacional como doméstica, e não por diferenças anatômicas entre a pele de homens e mulheres. Entre mulheres, o relato de lavagem das mãos, por exemplo, é mais frequente do que nos homens. Tal hábito tem associação estatisticamente significante com a presença de EM, de acordo com a literatura.12,13
Nosso estudo identificou entre mulheres idade média de 40 anos. Entretanto, a relação à idade média dos pacientes do sexo feminino com EM encontrada na literatura científica indica maior incidência em mulheres de 20 a 29 anos, com tendência a diminuir com o aumento da idade.14 Uma possibilidade para esse desencontro pode ser atribuída ao meio em que a pesquisa foi realizada: um serviço público terciário de país em desenvolvimento, em que o acesso à saúde é infelizmente ainda limitado, levando a maior tempo para diagnóstico e tratamento de doenças.
Quanto à ocupação, as principais profissões acometidas pelo EM neste estudo foram: indivíduos que trabalham com limpeza ou serviços domésticos (32,4%), trabalhadores de saúde (14,5) e trabalhadores de escritórios, professores ou estudantes (14,5%). Tais achados são coincidentes com os observados na literatura, em que a maior prevalência de EM dentro do período de um ano ocorre em trabalhadores da limpeza (21,3%), trabalhadores de saúde (15.9%) e trabalhadores de escritórios (15,4%).15 Dentre todos os casos de EM, 56,6% foram considerados dermatoses ocupacionais, porcentagem mais elevada do que as encontradas na literatura.16 Esses indivíduos foram encaminhados para avaliação da equipe de medicina ocupacional do hospital, visto que o trabalho em conjunto das especialidades é de suma importância para o melhor manejo desses pacientes.
Quanto aos pacientes de trabalho doméstico, que não se enquadram nas dermatoses ocupacionais mas apresentam diversas similaridades com essa situação, o EM é mais prevalente em população de renda familiar média quando comparado com a população de renda familiar alta.17 A população no presente estudo é oriunda de serviço público de saúde em um país em desenvolvimento, em sua maioria com baixa renda familiar. Essa característica fica bem ilustrada ao se observar que apenas 9,2% dos pacientes relataram possuir máquina de lavar louças, 63% referiram ter máquina de lavar roupas e a maioria dos entrevistados (84,4%) realizava algum tipo de atividades domésticas no cotidiano, como lavar louças, cozinhar e lavar roupas. Também foi relatada piora do EM com contactantes em 39,3% dos indivíduos, dentre eles produtos de limpeza, alimentos crus, água e luvas de borracha. É claro que a necessidade de realizar atividades domésticas cotidianas, sem ter a opção de delegar para outras pessoas, e a falta de equipamentos domésticos que reduziriam o tempo de contato das mãos com a água nessas atividades provavelmente contribuiu para a maior frequência de EM nessa população, conforme identificado em estudos prévios.18
Além de fatores desencadeantes do dia a dia, os antecedentes pessoais pareceram ter importante papel no desenvolvimento do EM. O histórico de atopia é descrito em diversos estudos realizados em populações gerais como o principal fator de risco e sinal de gravidade para EM,19 o que coincide com os achados aqui descritos, em que 45,7% referiram antecedentes pessoais de atopia e 41% referiram antecedentes familiares de atopia. A DA está relacionada ao EM principalmente em indivíduos de idade escolar, em que a frequência de antecedentes de atopia em indivíduos com EM pode chegar a até 90%.20 Essa relação parece tornar‐se menos relevante com o passar da idade, porém não há até o momento estudos que determinem a importância desse fator de risco ao longo de diferentes faixas etárias.
Outro dado interessante observado por alguns autores é que indivíduos com antecedentes de atopia com diagnóstico de sensibilização a metais apresentariam maior risco para EM quando comparados com indivíduos não sensibilizados a metais.21
Em nosso estudo, 45,7% dos indivíduos referiram algum antecedente de alergia a metais, frequência alta e compatível com a literatura. Essa relação entre sensibilização a metais e EM ainda é controversa, uma vez que até o momento não está claro se a sensibilização ao níquel favoreceria o aparecimento de EM ou se a presença de EM favoreceria a sensibilização ao níquel.22
Tampouco é bem estabelecida a falta de relação entre etiologia e achados clínicos do EM. Os principais achados clínicos encontrados neste estudo foram de descamação e eritema, aspectos comuns a todos os eczemas e coincidente com a literatura sobre o assunto.23 Acredita‐se que a apresentação clínica do EM tenha comportamento dinâmico, passando por apresentações clínicas de eczema agudo, subagudo e crônico, a depender do momento de sua evolução, que comumente é arrastada e muitas vezes redicivante. Assim, a apresentação clínica se modificaria ao longo do tempo em um mesmo indivíduo e não estaria relacionada especificamente com determinada etiologia do EM.
Já quanto ao acometimento de outras áreas do corpo, encontrou‐se uma relação frequente entre acometimento de mãos e pés; 17,9% dos casos de EM apresentavam também lesões semelhantes nos pés. De acordo com a literatura, essa associação pode atingir até 30% dos indivíduos.24 Nesses casos, na maioria das vezes a etiologia é endógena, e esse achado é sugerido até como indicador etiológico.25 Alguns autores acreditam também que a maior frequência de dermatoses localizadas nos pés, como tinha do pé associada a eczema vesicular nas mãos, poderia justificar alguma parcela desses casos.26
Quanto à etiologia, a DCI foi a mais frequente, seguida da DCA e DA, o que está de acordo com a literatura. A sobreposição de diagnósticos encontrada em nosso estudo em 42,8% dos indivíduos está relacionada com pior prognóstico e maior tempo de duração de doença.27
Por fim, vale discutir os resultados dos testes de contato neste estudo: 43,4% dos testes positivos foram considerados não relevantes, com relevância prévia ou desconhecida. Dados da literatura relatam 1/3 de testes positivos não relevantes, não contabilizando relevância prévia ou desconhecida.24 A interpretação da relevância do teste de contato é de suma importância para determinar corretamente a etiologia do EM. A aplicação, leitura e interpretação dos testes deve ser realizada por dermatologista treinado, para que não haja equívoco no diagnóstico. É importante também lembrar que além de contar com profissional treinado para realizar o teste, a gama de baterias a disposição para investigação é muito importante.
No presente estudo foram utilizadas 10 baterias complementares, além da bateria padrão brasileira, e, em casos específicos, substâncias manipuladas. Essa iniciativa provavelmente elevou a taxa de resultados positivos e relevantes em comparação à literatura,24 o que não pode ser confirmado neste estudo, já que não foi seu objetivo comparar tal percentual de relevância, sendo para isso necessários estudos posteriores.
Vale ressaltar que a escolha da bateria complementar a ser aplicada foi individualizada para cada paciente após realização de minuciosa anamnese e exame físico ao longo da primeira consulta. Por exemplo, casos com quadro clínico de localização na face, couro cabeludo e região cervical podem estar relacionados à DCA a componentes de xampus, como os surfactantes. Tais componentes encontram‐se apenas na bateria capilar, uma das baterias complementares aplicadas nesses casos.
Em relação aos pacientes com diagnóstico de DCA, ou seja, teste de contato positivos e relevantes, os principais sensibilizantes encontrados em nosso estudo estão de acordo com a literatura; sulfato de níquel e conservantes são os que ocupam as primeiras posições.28
A sensibilização a metais é muito frequente em nosso meio, com o níquel como principal representante desse grupo. Estudos prévios realizados nos últimos 25 anos no mesmo serviço do presente estudo indicam o mesmo resultado, demonstrando que as altas taxas de sensibilização aos metais se mantiveram estáveis ao longo desses anos.29,30 Uma das principais localizações do eczema em pacientes com DCA a níquel são as mãos, observadas em 20,2% de sensibilização em nosso estudo e chegando até a 45% dos casos na literatura.31 Esse contato pode ocorrer por diversas formas, ocupacionais ou não. Um estudo evidenciou que uma fonte frequente de contato ao níquel no Brasil são as chaves, que liberam tanto níquel como cobalto.32 Regulamentações quanto à liberação de níquel em produtos existem na Europa desde 1994, após a instituição da Diretiva Níquel, porém essas regras não existem em nosso país, o que mantém alta a exposição a esse alérgeno para a população brasileira.
O Kathon CG, nome comercial dado ao conservante composto pela combinação de metilcloroisotiazolinona e metilisotiazolinona em partes de 3:1,33 ocupa o segundo lugar de sensibilizantes neste estudo, e é o conservante que mais causou DCA dentre os pacientes de EM. Esse conservante é amplamente encontrado em produtos de uso pessoal e limpeza com veículos líquidos, como xampus, soluções e géis. Historicamente, observa‐se aumento de sua sensibilização principalmente nos anos 2010 em diante, o que levou a medidas restritivas primeiramente estabelecidas na Europa para limitar a concentração dessa substância em até 15 ppm para cosméticos que se enxaguam e em bani‐lo de cosméticos que não se enxaguam.34 Isso acarretou redução da frequência de sensibilização, porém ainda ocupa uma das primeiras posições dentre os sensibilizantes. Em tempos de pandemia por COVID‐19, em que o uso de sabonetes e álcool em gel aumentou, a sensibilização a esses conservantes também ficou mais evidente, já que ele é encontrado em muitas dessas formulações. Em agosto de 2021, foi liberado pela Agência Nacional de Vigilância Sanitária (ANVISA) uma nota que estipula a restrição de concentração do Kathon CG em até 15 ppm em produtos de higiene pessoal, cosméticos e perfumes que se enxaguam comercializados no Brasil, a ser cumprida até agosto de 2024.35 Espera‐se que isso propicie redução na alta sensibilização a esse conservante, ainda observada em nosso meio.
O bicromato de potássio, marcador do cromo nos testes de contato, vem em terceiro lugar em frequência no estudo (17%). A literatura mundial relata alta frequência de sensibilização ao cromo tanto nos casos de EM quanto dos pés, atribuída à vasta fonte de exposição a essa substância; o couro é a principal origem.36 Vale lembrar que legislações sobre o assunto estão em vigor na Europa desde 2015, quando a venda de artigos de couro que liberem mais de 3 ppm de cromo e que entrem em contato diretamente com a pele foi proibida no mercado europeu.37 Estudos que avaliam o impacto dessas leis ainda não estão disponíveis, mas espera‐se uma redução na sensibilização ao cromo em decorrência da legislação.
Quanto aos agentes vulcanizadores da borracha, grupo também com alta frequência de sensibilização na população estudada, observamos que os grupos carba‐mix e tiuram‐mix apresentam maior taxa de sensibilização do que os demais grupos (18% e 17% respectivamente), comparado com 2% nos grupos PPD‐mix e mercapto‐mix. É descrito, em literatura, alta taxa de liberação de substâncias do grupo tiuram por luvas de borracha, o que justificaria sua maior sensibilização em pacientes com EM quando comparado a pacientes com eczema dos pés, em que o principal sensibilizante é o grupo mercapto, cujos ingredientes são mais encontrados em sapatos e botas.38 Atualmente, observa‐se tendência de substituição do tiuram por ditiocarbamato na manufatura das luvas de procedimentos médicos, mas, ainda assim, o tiuram‐mix segue como o principal marcador de DCA ao ditiocarbamato, fato justificado pela similaridade de suas estruturas químicas.39 Ainda em relação às luvas, observou‐se aumento do uso de difenilguanidina na fabricação de luvas de procedimentos médicos nos últimos anos, o que justificaria a maior sensibilização encontrada em nosso estudo ao grupo carba‐mix, ao qual a difenilguanidina pertence.40
ConclusãoAs principais morfologias clínicas do eczema encontradas foram descamação (80,3%), eritema (79,2%), fissuras (73,4%), vesículas (24,9%) e pústulas (4%). Em 42,8% dos indivíduos havia lesões aglomeradas em placas. A localização predominante foi em palmas (49,7%). Quanto aos fatores relacionados ao quadro, 45,7% referiram antecedente de atopia e 45,7% referiram antecedentes de alergias a metais.
Quanto aos diagnósticos finais etiológicos do EM, 61,8% dos indivíduos receberam diagnóstico de DCI, 56,6% receberam diagnóstico de DCA e 23,1% dos indivíduos receberam diagnóstico de DA; 42,8% dos pacientes tiveram concomitância de dois ou mais diagnósticos.
Nos casos alérgicos, os principais sensibilizantes foram Kathon CG 41 (42%), sulfato de níquel 32 (33%), bicromato de potássio 17 (17%), tiuram‐mix 18 (18%), carba‐mix 17 (17%),
Do universo de EM relacionados à ocupação profissional, as principais profissões acometidas foram profissionais da limpeza e que realizam serviços domésticos (32,4%), trabalhadores da saúde (14,5%) e trabalhadores de escritórios, professores e estudantes (14,5%).
Suporte financeiroNenhum.
Contribuição dos autoresNathalie Mie Suzuki: Obtenção, análise e interpretação dos dados; revisão crítica da literatura, elaboração e redação do manuscrito; revisão crítica do manuscrito.
Mariana de Figueiredo Silva Hafner: Concepção e planejamento do estudo, obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Rosana Lazzarini: Obtenção, análise e interpretação dos dados; revisão crítica da literatura, aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa.
Ida Alzira Gomes Duarte: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa.
John Verrinder Veasey: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa.
Conflito de interessesNenhum.