Desde o início do surto de COVID‐19, vários artigos destacaram uma possível ligação entre a vacinação ou infecção por COVID‐19 e a coinfecção ou reativação de vírus da família Herpesviridae. Foi realizada exaustiva revisão da literatura sobre o tema, cujos resultados são apresentados individualmente para cada membro da família Herpesviridae: herpesvírus simples tipos‐1 (HSV‐1) e 2 (HSV‐2); vírus varicela‐zóster (VZV); vírus Epstein‐Barr (EBV); citomegalovírus (CMV); herpesvírus humano tipos 6 (HHV‐6), 7 (HHV‐7) e 8 (HHV‐8). Esses herpesvírus humanos podem servir como marcadores prognósticos da infecção por COVID‐19 e podem até ser responsáveis por algumas das manifestações clínicas inicialmente atribuídas ao SARS‐CoV‐2. Além da infecção por SARS‐CoV‐2, todas as vacinas correspondentes aprovadas até o momento na Europa parecem ser capazes de induzir a reativação do herpesvírus. É importante considerar todos os vírus da família Herpesviridae ao lidar com pacientes infectados ou recentemente vacinados contra a COVID‐19.
Os herpesvírus humanos (HHVs), que incluem os herpesvírus simples (HSV) tipos 1 (HSV‐1) e 2 (HSV‐2), o vírus varicela‐zóster (VZV), o vírus Epstein‐Barr (EBV), o citomegalovírus (CMV), e HHV‐6, HHV‐7 e HHV‐8, fazem parte de uma família de vírus DNA que causam diversas doenças em seres humanos. Estudos da relação entre esses vírus e o novo coronavírus recém‐surgido (SARS‐CoV‐2) propuseram a possibilidade de que o SARS‐CoV‐2 ou as vacinas contra o vírus SARS‐CoV‐2 possam induzir a reativação de diferentes subtipos desses HHVs.
Nesta revisão, a literatura disponível é examinada e é fornecida uma visão geral dos casos relatados de reativação de diferentes HHVs após infecção com COVID‐19 ou vacinação contra esse vírus; considera‐se a possibilidade de que muitas manifestações originalmente atribuídas à COVID‐19 possam de fato ser decorrentes da reativação desses vírus.
MétodosFoi realizada pesquisa bibliográfica (dezembro de 2021) no banco de dados PubMed usando os seguintes termos, sem restrições: “COVID‐19”, “SARS‐CoV‐2”, “COVID‐19 Vaccines”, “human herpesviruses”, “human herpes virus”, “varicella zoster virus”, “Epstein‐Barr virus”, “cytomegalovirus”, “human herpes virus 1”, “human herpes virus 2”, “human herpes virus 6”, “human herpes virus 7”, e “human herpes virus 8”. Os títulos e resumos de todos os tipos de estudos, desde relatos de casos até revisões, foram revisados quanto à relevância. Foram aceitos artigos em inglês ou espanhol. Em casos de artigos de relevância incerta, todo o artigo foi revisado para determinar sua adequação para inclusão.
ResultadosHerpesvírus simples tipo 1Estima‐se que 66% da população mundial esteja infectada com o HSV‐1. O HSV‐1 é transmitido principalmente de pessoa para pessoa por meio de secreções orais infectadas durante contato próximo.1 Após a infecção inicial, a infecção crônica se estabelece nos gânglios sensoriais e é reativada na mucosa e na pele. Embora as infecções sejam frequentemente assintomáticas, elas podem produzir uma variedade de sinais e sintomas. Esses podem incluir lesões periorais ou orais recorrentes (“herpes labial”) e lesões cutâneas e mucosas.2
Durante as recorrências do HSV, o vírus reativado muda de replicação latente para lítica nos neurônios dos gânglios trigêmeos ou sacrais e viaja via transporte axonal anterógrado para células epiteliais, onde se replica e pode ser eliminado de maneira assintomática ou dar origem a ulceração clinicamente aparente.
A frequência de reativação é maior em hospedeiros imunocomprometidos, pois a contenção do HSV requer imunidade celular intacta. No entanto, mesmo em indivíduos com vigorosa resposta imune humoral e celular, o HSV‐1 evita a erradicação por meio de múltiplos mecanismos de evasão imune. Estudos em humanos demonstraram papel fundamental das células T na vigilância imunológica e na contenção inicial da reativação do HSV‐1 na mucosa e nos gânglios.3 O comprometimento imunológico pode ser desencadeado por qualquer um de uma ampla variedade de mecanismos, incluindo infecções por outros vírus, como SARS‐CoV‐2, que causa linfopenia.4
Vários artigos descreveram a reativação do HSV‐1 em pacientes com COVID‐19. Le Balc’h et al.5 publicaram a primeira série de 36 casos de reativação do HSV‐1 em pacientes graves com COVID e relataram taxas mais altas do que as descritas em estudos anteriores de pacientes gravemente doentes. Desde então, muitos casos semelhantes foram relatados, variando de leves (p. ex., lesões de HSV no lábio) a manifestações mais graves, incluindo dois casos fatais por insuficiência hepática aguda secundária a HSV‐1 e polineuropatia craniana, respectivamente.
O HSV‐1 foi detectado em muitos tecidos diferentes em pacientes com COVID‐19. Em maio de 2020, Hu et al.6 demonstraram a presença de HSV‐1 latente no segmento anterior ocular e no humor aquoso de pacientes infectados com SARS‐CoV‐2 e especularam que a infecção latente por HSV‐1 pode ter sido ativada em resposta ao comprometimento imunológico causado pela infecção por COVID‐19. Essa hipótese foi posteriormente confirmada em múltiplos casos de ceratite por HSV‐1.7
Embora várias manifestações cutâneas e mucosas tenham sido inicialmente atribuídas diretamente ao SARS‐CoV‐2, mais tarde foi sugerido que algumas, incluindo lesões orais, poderiam ser o resultado da reativação de outros vírus mais comuns. Kämmerer et al.8 detectaram anti‐HSV IgM em amostras de soro de um paciente que desenvolveu gengivoestomatite herpética, e Kano et al.9 relataram um caso de glossite herpética relacionado ao tratamento de COVID‐19.
A coexistência de HSV‐1 e SARS‐CoV‐2 também é considerada no manejo clínico de pacientes com COVID‐19: a reativação pulmonar de HSV‐1 em pacientes ventilados de modo invasivo é fenômeno conhecido, e secreções traqueais e amostras de lavagem brônquica são analisadas por reação em cadeia de polimerase (PCR, do inglês polymerase chain reaction) para HSV‐1. Essa reativação do HSV‐1 coincide com diminuição na expressão de genes estimulados por interferon e aumento nas células T CD38+HLADR+ CD8+ muito ativadas nos estágios avançados da infecção por SARS‐CoV‐2.10
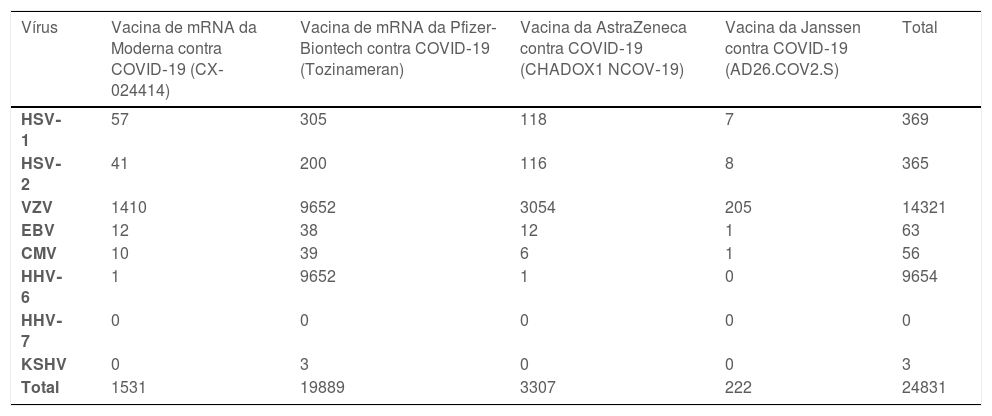
Com o desenvolvimento de novas vacinas para SARS‐CoV‐2, começaram a aparecer relatos de reativação do HSV‐1 em indivíduos recentemente inoculados. Essa correlação foi observada no esquema do cartão amarelo (yellow card) do Reino Unido para registro de incidentes adversos com medicamentos; um total de 369 casos de infecções por HSV associados a vacinas COVID‐19 estão registrados no banco de dados europeu de suspeitas de reações adversas a medicamentos (EudraVigilance): 57 após CX‐024414; 305 depois de Tozinameran; 118 após CHADOX1 NCOV‐19; e sete após AD26.COV2.S (tabela 1).11 O viés de relato é muito provável, uma vez que as reativações do HSV‐1 provavelmente são subdiagnosticadas em decorrência de sua natureza inócua.
Herpesvírus simples tipo 2O HSV‐2 é patógeno onipresente que causa principalmente infecções genitais. O herpes genital é uma das infecções sexualmente transmissíveis mais comuns em todo o mundo. Embora o HSV‐2 continue sendo a principal causa de infecções recorrentes por herpes genital (70 a 90% no geral), a proporção causada pelo HSV‐1 vem aumentando. Infecções primárias, iniciais não primárias e recorrentes podem ser sintomáticas ou assintomáticas. Particularmente, 81% daqueles com sorologia positiva não têm diagnóstico prévio de infecção genital por HSV. A infecção genital por HSV‐2 também aumenta o risco de adquirir e transmitir a infecção por HIV.12 PCR é cada vez mais utilizada como método mais rápido, sensível e específico para detectar o DNA do HSV em amostras de pele e de outros órgãos.
Até o momento, há apenas um caso relatado de infecção por SARS‐CoV‐2 e infecção concomitante pelo vírus da imunodeficiência humana, HSV‐2 e SARS‐CoV‐2, com curso clínico fulminante e resultado falso‐negativo da PCR em tempo real.
Um total de 365 casos de HSV‐2 após vacinação contra a COVID‐19 foram registrados no banco de dados EudraVigilance (tabela 1): 41 após CX‐024414; 200 depois de Tozinameran; 116 após CHADOX1 NCOV‐19; e oito após AD26.COV2.S.11
Casos de infecções por herpesvírus associados às vacinas contra a COVID‐19 registrados no banco de dados europeu de suspeitas de reações adversas a medicamentos (EudraVigilance)
| Vírus | Vacina de mRNA da Moderna contra COVID‐19 (CX‐024414) | Vacina de mRNA da Pfizer‐Biontech contra COVID‐19 (Tozinameran) | Vacina da AstraZeneca contra COVID‐19 (CHADOX1 NCOV‐19) | Vacina da Janssen contra COVID‐19 (AD26.COV2.S) | Total |
|---|---|---|---|---|---|
| HSV‐1 | 57 | 305 | 118 | 7 | 369 |
| HSV‐2 | 41 | 200 | 116 | 8 | 365 |
| VZV | 1410 | 9652 | 3054 | 205 | 14321 |
| EBV | 12 | 38 | 12 | 1 | 63 |
| CMV | 10 | 39 | 6 | 1 | 56 |
| HHV‐6 | 1 | 9652 | 1 | 0 | 9654 |
| HHV‐7 | 0 | 0 | 0 | 0 | 0 |
| KSHV | 0 | 3 | 0 | 0 | 3 |
| Total | 1531 | 19889 | 3307 | 222 | 24831 |
HSV‐1, herpesvírus simples tipo‐1; HSV‐2, herpesvírus simples tipo 2; VZV, vírus varicela‐zóster; EBV, vírus Epstein‐Barr; CMV, citomegalovírus; HHV‐6, herpesvírus humano tipo 6; HHV‐7, herpesvírus humano tipo 7; KSHV, herpesvírus associado ao sarcoma de Kaposi.
Herpes‐zóster (HZ) está associado a alta morbidade. É causado pela reativação do vírus varicela‐zóster (VZV) latente após declínio da imunidade mediada por células, resultando no aparecimento de pápulas agrupadas, metamericamente distribuídas sobre uma base eritematosa que evoluem rapidamente para vesículas, que por sua vez podem progredir para pústulas. O HZ tem sido associado a idade avançada, mas pode ocorrer em indivíduos doentes e naqueles tratados com imunossupressores e até mesmo em indivíduos imunocompetentes. Sabe‐se agora que a infecção por SARS‐CoV‐2 afeta linfócitos T, especialmente células T CD4+, CD8+ e natural killer (NK), resultando em estado imunocomprometido que pode desencadear a reativação de infecções virais latentes.13 Essa associação veio à tona pela primeira vez quando foram observados aumentos no número de casos de HZ durante o surto de COVID‐19 em relação ao período correspondente em 2019 em vários países diferentes, incluindo Turquia e Brasil.14
Relatos de casos e séries de casos descreveram pacientes com HZ após COVID‐19, mais frequentes dentro de uma a duas semanas após a infecção por COVID‐19, na maioria dos casos com apresentação típica afetando um único dermátomo. Apresentações atípicas de HZ foram relatadas, especialmente em pacientes com linfopenia, causando envolvimento multimetamérico e necrose cutânea e, nos casos mais graves, oclusão da veia central da retina, meningite e encefalomielite.15
Pacientes idosos imunocomprometidos são mais suscetíveis a HZ grave e fatal. O HZ foi proposto como biomarcador clínico de COVID‐19; postulou‐se que o envolvimento oftálmico pode constituir complicação ou indicador de infecção por COVID‐19, particularmente em pacientes jovens, imunocompetentes e em mulheres grávidas.16
Essa associação foi investigada por análises bioinformáticas que examinam o potencial crosstalk genético entre HZ e COVID‐19, e aumentos na diferenciação de células Th17 e, consequentemente, sinalização de IL‐17 foram descritos em COVID‐19 e HZ, sugerindo que a sinalização de IL‐17 pode ser um mecanismo pelo qual a COVID‐19 pode aumentar o risco de HZ.17
É muito provável que a prevalência de coinfecção seja subestimada, já que muitos casos foram diagnosticados por telemedicina e os exames laboratoriais necessários para HZ estavam disponíveis apenas em um número limitado de casos.18
Há mais debate sobre a coinfecção de COVID‐19 com a varicela (mais comumente conhecida como catapora). Recalcati et al.19 relataram pela primeira vez que vesículas semelhantes à varicela poderiam constituir manifestação cutânea do COVID‐19. Posteriormente, Marzano et al.20 relataram que 22 pacientes com teste nasofaríngeo positivo para COVID‐19 desenvolveram exantema papulovesicular semelhante à varicela. Esse tipo de exantema foi relacionado a lesões clínicas típicas e sintomas de herpes simples/zóster. Llamas‐Velasco et al.4 realizaram PCR de microarray de herpesvírus em três pacientes com SARS‐CoV‐2 e erupção vesicular e detectaram o VZV e outras sequências de DNA de herpesvírus no conteúdo das vesículas.
Existem poucos casos de varicela no contexto de uma infecção por COVID‐19 em que foram detectados anticorpos IgM positivos contra VZV ou onde foi realizada análise molecular do conteúdo da vesícula.21
Em geral, foram descritos casos em jovens com sinais clínicos típicos de varicela e infecção por SARS‐CoV‐2, incluindo febre alta, mialgia, secreção nasal e erupção cutânea composta por vesículas, erosões e crostas associadas a enantema petequial da mucosa palatal.21 Entretanto, também foram relatados casos de envolvimento mais grave, com o desenvolvimento de pneumonia por varicela.22 Esse diagnóstico presuntivo deve ser estabelecido precocemente para iniciar o tratamento com aciclovir, que previne a progressão do acometimento pulmonar, diminuindo a probabilidade de desfecho fatal.
Além dos testes laboratoriais para distinguir o exantema semelhante à varicela daquele causado pela varicela, diferentes padrões histopatológicos foram descritos. No exantema semelhante à varicela, a histopatologia mostra acantólise e disceratose com vesícula intraepidérmica unilocular suprabasal, sem as grandes células multinucleadas e a balonização típica da varicela.23 Por outo lado, a incidência de varicela e outras infecções virais diminuiu drasticamente desde a implementação das medidas de controle da COVID‐19.
Casos de HZ após administração de vacinas contra o SARS‐CoV‐2 foram relatados em todo o mundo. A maior série e revisão descritiva inclui 399 casos, e outra revisão sistemática descreve 91 casos de reativação de VZV após a vacinação contra COVID‐1924 – números menores do que os registrados no EudraVigilance (tabela 1). O número de casos de HZ associados às vacinas COVID‐19 registrados no banco de dados EudraVigilance é 1.410 para CX‐024414, 9.652 para Tozinameran, 3.054 para CHADOX1 NCOV‐19 e 205 para AD26.COV2.S.11
Uma revisão sistemática de Katsikas Triantafyllidis et al.24 relatou que a distribuição dermatomal das lesões cutâneas foi variável nos pacientes com reativação de HZ após a vacinação contra COVID‐19, embora a região mamária tenha sido o local anatômico mais frequentemente afetado. A maioria das lesões e sintomas apareceram após a administração da primeira dose da vacina. Houve tendência de maior suscetibilidade nos pacientes com idade> 60 anos. A maioria dos pacientes foi tratada com valaciclovir oral em monoterapia. Além disso, a maioria dos pacientes afetados apresentava doença autoimune concomitante e/ou estava recebendo terapia imunossupressora.24
Embora a causalidade ainda não tenha sido estabelecida, o aumento da conscientização e a identificação precoce do HZ são cruciais para garantir o manejo ideal desses pacientes. Um dos estudos mais recentes sobre as correlações clínicas e patológicas das reações cutâneas à vacina contra a COVID‐19 reporta quatro casos de HZ pós‐vacinal em que a histopatologia revelou alterações citopáticas virais, levando os autores a propor que a resposta imune induzida pela vacinação pode desencadear a reativação de outros vírus.
Vírus de Epstein BarrO EBV, gammaherpesvírus humano 4, infecta linfócitos B e células epiteliais. Após a infecção primária, o EBV persiste em estado latente em células B individuais. O EBV latente é encontrado em aproximadamente 95% da população humana. A presença de EBV em linfócitos B tem sido associada ao aparecimento de doenças linfoproliferativas e doenças autoimunes, como esclerose múltipla, lúpus eritematoso sistêmico, artrite reumatoide e dermatomiosite.
Múltiplos fatores têm sido implicados na reativação do EBV, em particular estresse psicológico, incluindo estresse associado a hospitalização por vários dias. A reativação ocorre mais provavelmente em pacientes imunossuprimidos (p. ex., receptores de transplante).25 Vários estudos descreveram o aumento da reativação do EBV em pacientes com COVID‐19, especialmente aqueles gravemente doentes.26,27 Paolucci et al.26 detectaram DNA do EBV em 95,2% dos pacientes com COVID‐19 internados em unidade de terapia intensiva (UTI), além de reduções significantes nas contagens de células CD8+ e NK. Essa reativação ocorreu mais precocemente após a hospitalização em UTI e foi associada à internação de longo prazo. O curso da COVID‐19 pode ser agravado em pacientes que sofrem reativação de EBV: esses pacientes tiveram taxa de mortalidade mais alta e receberam mais suporte imunológico do que pacientes com SARV‐CoV‐2 sem coinfecção por EBV.28 De fato, Solomay TV et al.29 relataram que doença grave e pneumonite foram mais comuns em pacientes com coinfecção por EBV. Esses pacientes apresentam febre mais frequente, marcadores de inflamação elevados (proteína C‐reativa) e níveis aumentados de enzimas hepáticas.30 Embora alterações leves nos testes de função hepática sejam comuns em pacientes com infecção por COVID‐19, a elevação acentuada das enzimas hepáticas deve levantar a suspeita de coinfecção por EBV. Essas observações destacam a importância de diferenciar entre as manifestações do EBV e as complicações associadas à COVID‐19.
Um estudo relatou reativações de EBV em 60% dos pacientes com sintomas prolongados de COVID‐19 após a resolução da doença aguda, em comparação com 10% em um grupo controle, sugerindo que alguns sintomas de COVID‐19 de longo prazo podem ser decorrentes da reativação do EBV.
Além disso, Verma et al.31 relataram que a reativação do EBV em células epiteliais nasofaríngeas e orofaríngeas aumenta a expressão da enzima conversora de angiotensina 2 (ECA2), o receptor celular para SARS‐CoV‐2, favorecendo assim a infecção pelo vírus.32
A base de dados EudraVigilance contém 63 casos de reativação de EBV após vacinação contra COVID‐19 (tabela 1): 12 para CX‐024414; 38 para Tozinameran; 12 para CHADOX1 NCOV‐19; e um para AD26.COV2.S.11 Um único caso de linfoma difuso de grandes células B positivo para EBV após a vacina contra COVID‐19 foi relatado em um receptor de transplante de coração. Um estudo não relatou aumento na reativação do herpesvírus, incluindo o EBV, uma semana após versus uma semana antes da vacinação contra COVID‐19 (Tozinameran).33
CitomegalovírusO citomegalovírus (CMV) é um membro da família Herpesviridae, e sua prevalência aumenta com a idade. Tipicamente, causa infecção primária em indivíduos jovens e, subsequentemente, persiste em estado latente durante toda a vida do hospedeiro.
O CMV permanece assintomático em indivíduos imunocompetentes. Entretanto, o aumento da taxa de reativação do CMV em pacientes imunossuprimidos, incluindo receptores de transplante de órgãos sólidos e pacientes com AIDS ou câncer, é uma grande preocupação e pode exigir profilaxia antiviral. Esse fenômeno também foi descrito em pacientes previamente saudáveis internados em UTI, que também apresentam maior risco de reativação de outros herpesvírus.34 De fato, essas taxas parecem ser ainda mais altas em pacientes gravemente doentes com COVID‐19, com reativação viral relatada em quase 50% dos pacientes na série de Le Balc’h et al.5 e outros autores.27 Tanto a linfopenia grave quanto a ventilação mecânica são fatores de risco conhecidos para infecções virais secundárias, o que explicaria, pelo menos em parte, esse efeito.
Muitos casos de reativação de CMV em pacientes com COVID‐19 foram relatados, alguns com consequências fatais.35 A reativação do CMV pode se manifestar com ampla variedade de sintomas, incluindo sangramento gastrintestinal e colite, febre persistente e pneumonia secundária, todos associados a pior prognóstico.36 A linfopenia acentuada e persistente é característica da infecção grave por COVID‐19. Além disso, agentes imunossupressores potentes, incluindo corticosteroides em altas doses e antagonistas de IL‐6, como tocilizumabe, são mais frequentemente utilizados nesses pacientes. Esses dois fatores podem contribuir para risco aumentado de reativação do CMV em pacientes gravemente doentes com COVID‐19.37
Estudos têm investigado o papel do CMV na regulação da resposta imune. O CMV parece contribuir para a senescência imunológica acelerada e para exacerbar a tempestade de citocinas associada à infecção grave por COVID‐19, alterando assim negativamente a resposta do hospedeiro à infecção por COVID‐19.38 Consequentemente, pacientes coinfectados com COVID‐19 e CMV parecem ter pior prognóstico,39 e essa desregulação da resposta imune também pode explicar por que pacientes idosos, geralmente soropositivos para CMV, desenvolvem doença mais grave. Em concordância com esses achados, as áreas com maior prevalência de soropositividade para CMV também apresentam taxas de mortalidade mais altas por COVID‐19. Um total de 56 casos de reativação de CMV após a vacinação com COVID‐19 (tabela 1) foi relatado na Europa: dez após CX‐024414; 39 depois de Tozinameran; seis após CHADOX1 NCOV‐19; e um caso após AD26.COV2.S.11
Herpesvírus humano 6 e 7O HHV‐6 é um beta‐herpesvírus generalizado, geneticamente relacionado ao CMV humano. O HHV‐6 exibe amplo tropismo celular in vivo e, como outros herpesvírus, induz infecção latente ao longo da vida em seres humanos. Muitas infecções ativas por HHV‐6, correspondendo a infecções primárias, reativações ou reinfecções exógenas, são assintomáticas. No entanto, o vírus pode causar doenças graves, principalmente em indivíduos imunocomprometidos.
Doenças cutâneas associadas à infecção por HHV‐6 incluem roséola infantil, pitiríase rósea (PR), síndrome de Gianotti‐Crosti, reação medicamentosa com eosinofilia e sintomas sistêmicos e púrpura trombocitopênica, entre outras.40 No caso da PR, vários estudos estabeleceram papel causal da reativação ativa sistêmica do HHV‐6 e/ou HHV‐7, com base na detecção de DNA viral no plasma de pacientes com PR, na expressão de mRNA e antígenos virais específicos e detecção por microscopia eletrônica de vírions de HHV em lesões de PR.41 Contudo, é difícil estabelecer uma associação etiológica entre a infecção por HHV‐6 e doença cutânea devido à onipresença e prevalência quase universal do vírus e às limitações das ferramentas de pesquisa atuais.40
A associação entre SARS‐CoV‐2 e HHV‐6 é apoiada por vários relatos durante a pandemia de COVID‐19, descrevendo aumento da incidência de PR; em um caso, a reativação do HHV‐6 foi confirmada por PCR sérico. O presente grupo detectou sorologia positiva de IgM e/ou soroconversão de IgG para HHV‐6 em 12 pacientes que preenchiam critérios clínicos e/ou microbiológicos de COVID‐19 e que apresentavam diferentes manifestações cutâneas, incluindo erupção semelhante à PR.42 Também foi relatado um caso de erupção semelhante à PR em um paciente com COVID‐19 com positividade da proteína spike do SARS‐CoV‐2 na histopatologia de pele, sugerindo relação patogênica direta com esse vírus, embora o status de HHV‐6 desse paciente não tenha sido investigado.
Essa reativação não foi descrita apenas em associação com PR, mas também em pacientes gravemente doentes com COVID‐19. Em sua série de 34 pacientes com COVID‐19, Simonnet et al.27 detectaram viremia do HHV‐6 em sete (22%) pacientes, embora o status do HHV‐6 não tenha sido associado à morbidade e mortalidade. Essa porcentagem está próxima da frequência relatada em grandes estudos de pacientes com choque séptico. Uma limitação do estudo de Simonnet et al.27 foi a ausência de um grupo controle para comparação, o que impediu os autores de determinar se a infecção por SARS‐CoV‐2 ou a “imunossupressão adquirida na UTI” foram os principais fatores de reativação.
Um relato descreveu a reativação do HHV‐6 no sistema nervoso central de um paciente com COVID‐19 e concomitância de mielite por HHV‐6 e mielite parainfecciosa de oligodendrócitos mediada por anticorpo glicoproteína. Outro estudo relatou a detecção positiva de ácido nucleico de SARS‐CoV‐2, HSV‐1 e HHV‐6 em secreções lacrimais e conjuntivais de um paciente com COVID‐19 sem conjuntivite, com obstrução dos ductos lacrimais comuns.6 Em ambos os casos, especula‐se que a infecção latente por HHV‐6 pode ter sido reativada no contexto da disfunção imune induzida por COVID‐19.6
Recentemente, Biswas et al.42 relataram o caso de uma criança com síndrome inflamatória multissistêmica (SIM) como complicação tardia da COVID‐19. Inicialmente, detectou‐se alta carga viral de HHV‐6. Posteriormente, descobriu‐se que o paciente havia herdado o HHV‐6 cromossomicamente integrado (iciHHV‐6). O iciHHV‐6 é o HHV‐6 que foi integrado nas regiões teloméricas cromossômicas e é transmitido por linha germinativa. Isso ocorre em cerca de 1% dos indivíduos. A presença do iciHHV‐6 foi associada a respostas alteradas de anticorpos e, em alguns casos, respostas aumentadas a certos vírus e podem ser reativadas a partir da latência.43 Curiosamente, os pacientes com SIM podem apresentar respostas de anticorpos aumentadas ao SARS‐CoV‐2. Biswas et al.42 concluíram que pesquisas adicionais podem ser necessárias para determinar se o iciHHV‐6 é comumente observado em pacientes com SIM e, em caso afirmativo, se pode desempenhar um papel em sua patogênese.
Finalmente, desde a introdução das vacinas contra o SARS‐CoV‐2, foram relatados vários casos de lesões semelhantes a pitiríase rósea (PR‐símile).13,44 Català et al.44 observaram PR‐símile em 4,9% de uma coorte de 405 pacientes, bem como reativação do VZV e HSV em 10,1% e 3,7%, respectivamente. A PR‐símile após a administração de outras vacinas já havia sido descrita anteriormente. Alguns autores diferenciam a PR induzida por vacina, possivelmente decorrente da reativação de HHV‐6 e/ou HHV‐7, da PR‐símile induzida por vacina, que pode ocorrer como resposta de hipersensibilidade tardia a uma vacina, na ausência de quaisquer sinais da reativação do HHV‐6/HHV‐7.45 A diferenciação entre PR “verdadeira” e uma erupção semelhante a PR é difícil, e estudos virológicos de reativação do HHV‐6/HHV‐7 são realizados apenas em poucos casos.45 O status do HHV‐6 não foi investigado na maioria dos casos de erupção semelhante a PR induzida pela vacina contra SARS‐CoV‐2 relatados até o momento, exceto em dois casos relacionados à vacina Pfizer BioNTech (BNT162b2), em que altos títulos de anticorpos HHV‐6 foram detectados.46
Dadas as preocupações sobre um aumento na reativação de VZV e HSV após a vacinação com Tozinameran, Brosh‐Nissimov et al.32 estudaram a excreção orofaríngea de herpesvírus, incluindo HHV‐6, antes e após a vacinação. Os autores não relataram diferenças significantes na positividade para qualquer herpesvírus entre as amostras pré‐vacinação e pós‐vacinação. A base de dados EudraVigilance (tabela 1) registra 9.654 casos de HHV‐6: um após CX‐024414; 9.652 depois de Tozinameran; e um caso após CHADOX1 NCOV‐19.11
Herpesvírus humano 8O herpesvírus associado ao sarcoma de Kaposi (KSHV, do inglês Kaposi sarcoma‐associated herpesvirus) é um vírus oncogênico da subfamília dos γ‐herpesvírus humanos e é o agente etiológico de vários cânceres humanos, incluindo o sarcoma de Kaposi (SK), o linfoma de efusão primário e a doença multicêntrica de Castleman multicêntrica. Também está associado a uma síndrome hiperinflamatória denominada síndrome da citocina inflamatória associada ao herpesvírus do SK, que pode ser fatal em alguns pacientes.47 A soroprevalência da infecção por KSHV na população geral da América do Norte é inferior a 10%, mas na maior parte da África Subsaariana a soroprevalência geral excede 50%. Nos Estados Unidos e na Europa, os anticorpos HHV‐8 estão presentes em aproximadamente 30% dos homens que fazem sexo com homens infectados pelo HIV‐1.48 O KSHV pode ser diagnosticado por vários métodos, incluindo quantificação do DNA viral no sangue, imunomarcação com HHV8‐LANA‐1 em amostras teciduais e testes sorológicos.
O ciclo de vida viral do KSHV consiste em uma fase latente quiescente e uma fase lítica replicativa. Embora o estabelecimento da latência permita a infecção persistente por KSHV e a evasão do sistema imunológico do hospedeiro, a replicação lítica é essencial para a disseminação do vírus entre hospedeiros e dentro do próprio hospedeiro. A transição entre essas fases, conhecida como reativação lítica, é controlada por um conjunto complexo de fatores ambientais relacionados ao hospedeiro e virais. Um desses fatores desencadeantes é a infecção por COVID‐19, e as proteínas codificadas pelo SARS‐CoV‐2 podem induzir a reativação lítica do KSHV por meio da manipulação das vias de sinalização intracelular.49 Isso foi demonstrado na prática clínica em um paciente que havia sido hospitalizado recentemente por infecção por COVID‐19 e desenvolveu lesões cutâneas maculopapulares vermelho‐azuladas, cuja histopatologia estabeleceu o diagnóstico de SK. A microscopia eletrônica de transmissão da amostra de pele revelou a presença de COVID‐19 e HHV‐8.50 É proposto que o SARS‐CoV‐2 contribua para o desenvolvimento de um estado hiperinflamatório, levando à proliferação do HHV‐8 e consequente recorrência do SK.
O banco de dados EudraVigilance (tabela 1) registra três casos de SK, todos após a vacinação com Tozinameran.11
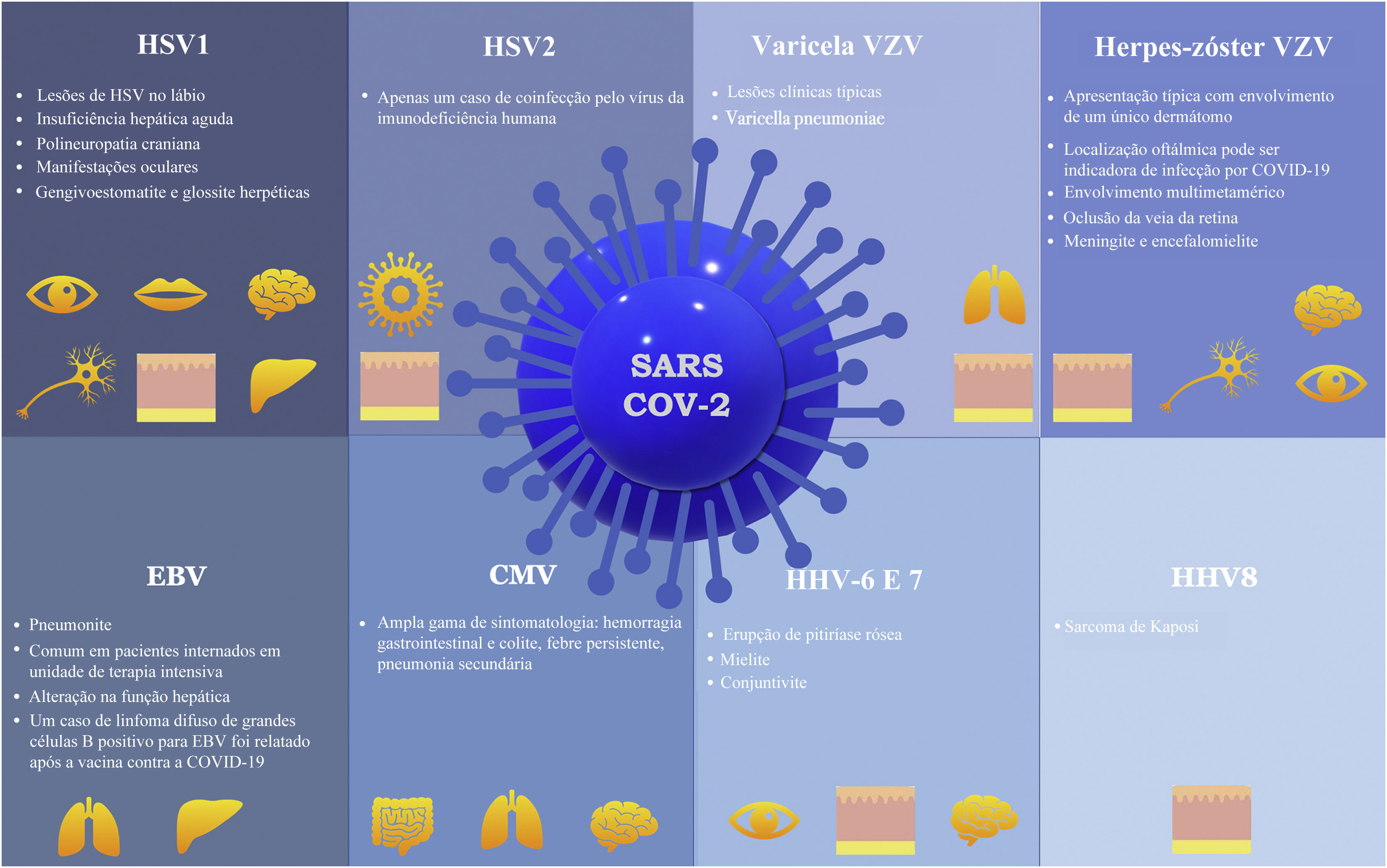
ConclusãoDiversos artigos relacionaram a infecção por COVID‐19 com coinfecção ou reativação de HHV. Além disso, evidências sugerem que a infecção por HHV pode constituir marcador prognóstico da infecção por COVID‐19 e até mesmo ser responsável por muitas das manifestações inicialmente atribuídas ao SARS‐CoV‐2. Relatos recentes indicam que, além do vírus SARS‐CoV‐2, todas as vacinas contra a COVID‐19 aprovadas até o momento na Europa são capazes de induzir a reativação do herpesvírus. A figura 1 mostra as principais manifestações das infecções por herpesvírus associadas à COVID‐19. É importante considerar essas informações e todos os vírus da família Herpesviridae ao lidar com pacientes com infecção por COVID‐19 ou recentemente vacinados contra COVID‐19.
Manifestações de infecções por herpesvírus associadas à COVID‐19. HSV‐1, herpesvírus simples tipo‐1; HSV‐2, herpesvírus simples tipo‐2; VZV, vírus varicela‐zóster; EBV, vírus Epstein‐Barr; CMV, citomegalovírus; HHV‐6, herpesvírus humano tipo 6; HHV‐7, herpesvírus humano tipo 7; HHV8, herpesvírus humano tipo 8.
Nenhum.
Contribuição dos autoresAlba Navarro‐Bielsa: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Tamara Gracia‐Cazaña: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Beatriz Aldea‐Manrique: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; preparação e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Isabel Abadías‐Granado: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Adrián Ballano: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Isabel Bernad: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Yolanda Gilaberte: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Conflito de interessesNenhum.
Como citar este artigo: Navarro‐Bielsa A, Gracia‐Cazaña T, Aldea‐Manrique B, Abadías‐Granado I, Ballano A, Bernad I, et al. COVID‐19 infection and vaccines: potential triggers of Herpesviridae reactivation. An Bras Dermatol. 2023;98:347–54.
Trabalho realizado no Hospital Universitario Miguel Servet, Zaragoza, Espanha.