A pustulose exantemática generalizada aguda (PEGA) é uma erupção cutânea infrequente secundária a medicamentos, com uma latência curta de 24 a 48 horas entre a exposição e o início das lesões.1,2 Os sintomas consistem em febre e pústulas pequenas, estéreis e não foliculares, com um fundo eritematoso.1,2 O comprometimento das mucosas e o envolvimento de órgãos internos são incomuns.1,2 As anormalidades laboratoriais mais comuns são leucocitose e neutrofilia > 7.000mL.2 Uma pontuação, desenvolvida pelo grupo EuroSCAR, que leva em consideração critérios clínicos e histopatológicos, é útil para o diagnóstico.1,2 A PEGA é usualmente uma doença autolimitada, que em geral se resolve com descamação cutânea em menos de 15 dias após a suspensão do medicamento causador e apresenta excelente prognóstico.2 Embora pouco frequentemente, os pacientes podem desenvolver lesões purpúricas, em alvo e bolhosas, áreas de pele desnuda, sinal de Nikolsky positivo, envolvimento mucoso e comprometimento de múltiplos órgãos, o que indica um desfecho mais sério.3 Os autores relatam o caso de uma paciente com PEGA induzida por um medicamento atípico com essa apresentação clínica grave.
Paciente do sexo feminino, 69 anos, com história de extrassístoles supraventriculares, apresentou febre, mal‐estar, pequenas pústulas não foliculares e histórico de eritema nas axilas e virilhas. Vinte e quatro horas antes, ela havia mudado seu tratamento antiarrítmico de bisoprolol para amiodarona. Na admissão, apresentava dispneia, taquicardia, taquipneia e saturação subótima de oxigênio. Suas mucosas não estavam comprometidas e o sinal de Nikolsky foi negativo. Os estudos laboratoriais revelaram leucocitose (26.689 células/mm3) com neutrofilia (88,25%). As hemoculturas não apresentaram crescimento e a radiografia do tórax não revelou doença.
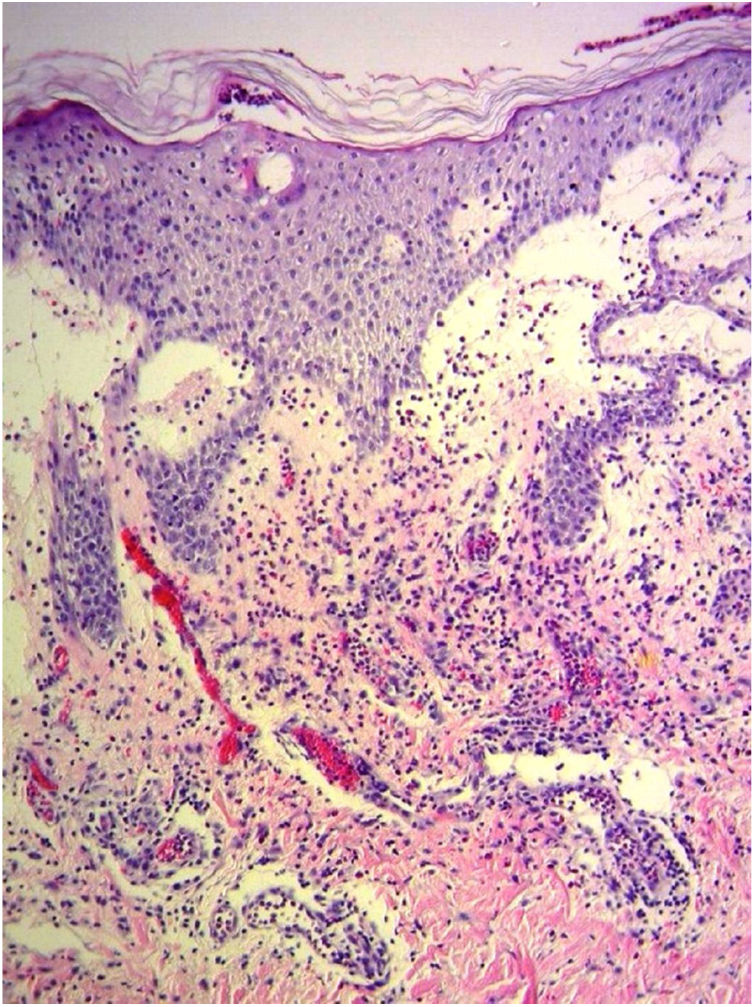
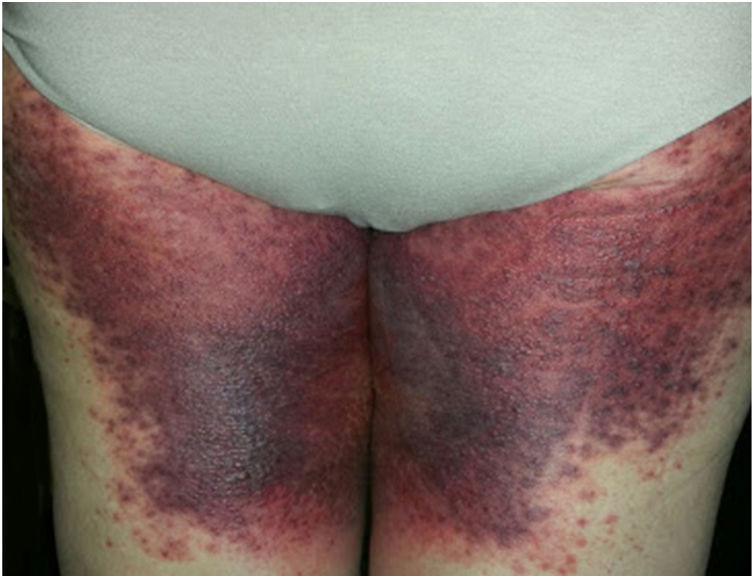
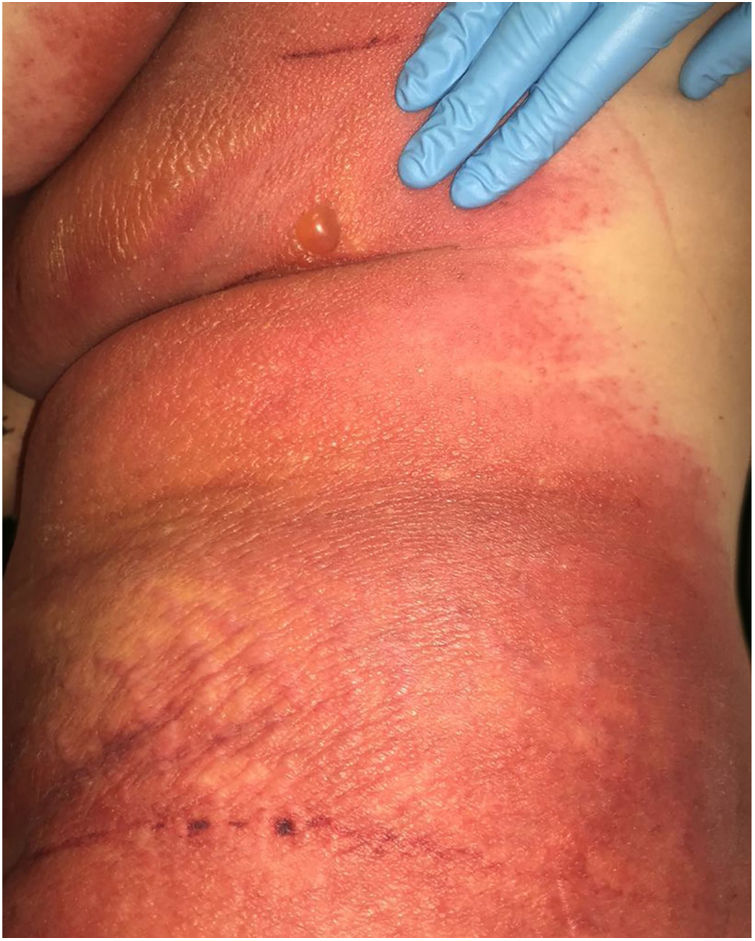
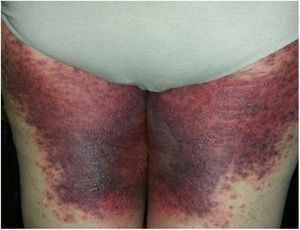
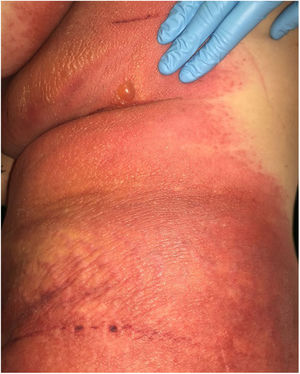
Devido à suspeita de PEGA, interrompeu‐se o uso de amiodarona. Foram solicitadas biópsias de pele e iniciou‐se o uso de meprednisona oral 0,5mg/kg/dia devido aos sintomas pulmonares. A histopatologia revelou pústulas subcórneas sem queratinócitos necróticos (fig. 1). O escore Euroscar foi 11, compatível com o diagnóstico definitivo de PEGA. Apesar do tratamento inicial, 24 horas depois as lesões da paciente evoluíram e se disseminaram. Ela apresentou diarreia e desenvolveu lesões purpúricas e em alvo nas coxas e na região glútea (fig. 2), bem como lesões bolhosas que evoluíram para pequenas erosões em seus flancos (fig. 3). O sinal de Nikolsky foi novamente negativo. Considerando essa progressão tórpida, os autores levantaram a hipótese de que a absorção intestinal do corticosteroide não seria suficiente, que a meia‐vida prolongada da amiodarona seria um fator importante e que a paciente poderia apresentar uma reação medicamentosa diferente, como necrólise epidérmica tóxica (NET), ou ainda sofrer de uma sobreposição de duas reações adversas a medicamentos. Naquele momento, novas biópsias de pele foram coletadas. A histopatologia foi novamente compatível com PEGA. A dose de meprednisona foi aumentada para 1mg/kg/dia e administrada por via intravenosa. Finalmente, as lesões cutâneas e os sintomas sistêmicos resolveram com descamação da pele 11 dias após seu início. No entanto, cinco meses após o princípio dos sintomas, a paciente continuou a desenvolver novas recorrências sempre que se tentava suspender o corticosteroide.
A relação entre o início do novo antiarrítmico e o desenvolvimento de sintomas sistêmicos e cutâneos, juntamente com os achados clínicos e histopatológicos, levou ao diagnóstico de PEGA induzida por amiodarona. Após extensa pesquisa da literatura em inglês e espanhol, tanto quanto é do conhecimento dos autores, este é o primeiro relato de PEGA desencadeado por esse medicamento. A amiodarona é um medicamento lipossolúvel com meia‐vida prolongada de 15 a 142 dias (média de 58), mesmo após a administração de dose única.4 Isso poderia explicar por que a paciente continuou a apresentar novas lesões após a suspensão do medicamento.
Este caso apresentou características incomuns para a PEGA clássica: lesões em alvo e bolhosas, juntamente com evolução tórpida e comprometimento de órgãos internos. Foi considerado o diagnóstico de NET, mas, na ausência de queratinócitos necróticos na biópsia, concluiu‐se que essa era uma apresentação de PEGA semelhante à NET.5
Embora o envolvimento de órgãos internos seja observado em menos de 17% a 20% dos pacientes, quando ocorre, insuficiência hepática e renal são as manifestações mais comuns.1,2 Também pode apresentar sintomas respiratórios,1,2 como nesta paciente, na qual, após serem descartadas causas infecciosas e NET, o comprometimento pulmonar foi atribuído à PEGA. Além disso, embora na PEGA clássica a interrupção do medicamento causador seja a única intervenção necessária, os corticosteroides sistêmicos são obrigatórios quando há comprometimento de outros órgãos ou lesões cutâneas graves, como no presente caso.1
Os autores admitem que este caso respalda a opinião de alguns autores de considerar a PEGA uma reação cutânea grave a medicamentos e a necessidade de acompanhar de perto esses pacientes, identificar casos críticos e intensificar o tratamento para reduzir a taxa de mortalidade.
Suporte financeiroNenhum.
Contribuição dos autoresCheryl Distel: Elaboração e redação do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
María Luz Bollea Garlatti: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Ana Clara Torre: Aprovação da versão final do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Julia Riganti: Aprovação da versão final do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Ao Dr. Luis Mazzuoccolo, chefe do Departamento de Dermatologia do Hospital Italiano de Buenos Aires, pela revisão crítica e aprovação da versão final do manuscrito.
Como citar este artigo: Distel C, Bollea Garlatti ML, Torre AC, Riganti J. Acute generalized exanthematous pustulosis with features mimicking toxic epidermal necrolysis secondary to amiodarone. An Bras Dermatol. 2020;95:540–2.
Trabalho realizado no Hospital Italiano de Buenos Aires, Buenos Aires, Argentina.