Os inibidores de checkpoint imunológico PD‐1 (do inglês programmed death‐1) proporcionaram benefícios significantes aos pacientes com neoplasias. No entanto, uma proporção considerável de pacientes desenvolve eventos adversos imuno‐relacionados (EAir), dos quais EAir cutâneos (EAirc, por exemplo, psoríase) ocorrem com relativa precocidade. Esta revisão fornece uma visão geral da evolução atual do conhecimento na psoríase de novo ou na exacerbação por inibidores de checkpoint PD‐1. Não apenas descreve os fatores de influência relevantes, mas também analisa teoricamente os mecanismos imunológicos que levam ao aparecimento ou exacerbação da psoríase. Por fim, apresenta diretrizes para o tratamento da psoríase de novo ou da exacerbação por inibidores de checkpoint PD‐1. A revisão tem como objetivo auxiliar os dermatologistas no reconhecimento precoce e no manejo individualizado eficaz de EAirc, e é útil para continuar ou ajustar a imunoterapia direcionada à neoplasia com base na garantia da qualidade de vida dos pacientes com neoplasias.
Os inibidores do checkpoint PD‐1 (do inglês programmed death‐1) são amplamente utilizados na imunoterapia oncológica e têm proporcionado benefícios clínicos significantes aos pacientes oncológicos. Entretanto, mais de 50% dos pacientes desenvolvem eventos adversos imuno‐relacionados (EAir), dos quais EAir cutâneos (EAirc) ocorrem com relativa precocidade. As lesões cutâneas psoriásicas, como um dos EAirc, não afetam apenas a qualidade de vida dos pacientes, mas também podem exigir ajuste dos regimes de tratamento com inibidores de PD‐1 em virtude da gravidade das lesões cutâneas. Esta revisão concentra‐se no conhecimento científico atual sobre psoríase de novo ou exacerbação por inibidores do checkpoint PD‐1, incluindo manifestações clínicas, previsão e diagnóstico, possíveis mecanismos e princípios de tratamento. O objetivo é melhorar o reconhecimento e o manejo individualizado eficaz desses EAirc pelos dermatologistas para garantir a qualidade de vida dos pacientes com câncer.
Checkpoint PD‐1 na manutenção da homeostase das células TAtualmente, sabe‐se que a ativação das células T é rigorosamente regulada por um “canal duplo” para evitar reação insuficiente ou excessiva. O primeiro sinal refere‐se à ligação específica do receptor de células T (RCT) ao complexo principal de histocompatibilidade (MHC, do inglês major histocompatibility complex) das células apresentadoras de antígeno (APCs, do inglês antigen‐presenting cells). O segundo sinal refere‐se às interações das moléculas do checkpoint imunológico (moléculas coestimuladoras e coinibitórias) na superfície das células T e APCs. Os checkpoints imunológicos coinibitórios são uma classe de moléculas imunossupressoras que incluem receptores de morte programada e seus ligantes. Eles podem prevenir respostas imunológicas sustentadas, evitando assim danos e destruição de tecidos normais. Checkpoints imunológicos cossupressores comuns incluem PD‐1, CTLA‐4 (do inglês cytotoxic T‐lymphocyte‐associated protein 4), VISTA (do inglês V‐domain Ig suppressor of T‐cell activation), TIM (CD366; HAVCR2) e LAG‐3 (do inglês lymphocyte activation gene 3).
O PD‐1 é um checkpoint imunológico coinibitório amplamente visado na terapia clínica. O gene PD‐1 humano está localizado no cromossomo 2q37.3. É uma molécula de proteína transmembrana que consiste em 288 resíduos de aminoácidos e pertence à superfamília das imunoglobulinas.1 Como receptor regulatório, é expresso principalmente em células T CD4+e CD8+ativadas. As células T não ativadas não expressam PD‐1 em níveis altos. PD‐1 também é expresso em células B, células NKT, células dendríticas e monócitos.2 A molécula PD‐1 se liga principalmente ao seu ligante PD‐L1 (B7‐H1) ou PD‐L2 (B7‐DC). PD‐L1 e PD‐L2 podem ser expressos em células neoplásicas, células dendríticas, macrófagos e células endoteliais vasculares.
A ligação do PD‐1 ao ligante inibe a via de sinalização do RCT mediada pela tirosina fosfatase SHP2. Ao fornecer sinais coestimulatórios negativos, inibe a ativação e proliferação de células T, levando à redução da função das células T, perda de atividade e/ou apoptose. Pode‐se observar que PD‐1 desempenha papel importante no estabelecimento da tolerância imunológica periférica.3,4
Inibidores do checkpoint PD‐1 e seus EAir na terapia direcionada a neoplasiasAs células tumorais expressam PD‐L1 e, assim, exploram os checkpoints fisiológicos normais para imunossupressão das células imunes. Isso pode levar a um desequilíbrio entre o crescimento do tumor e a vigilância do hospedeiro, e os medicamentos anti‐PD‐1 podem reverter o sinal inibitório das células tumorais para as células imunológicas, particularmente as células T CD8+. Em 2010, cientistas relataram o primeiro estudo de anticorpos anti‐PD‐1 em neoplasias sólidas, incluindo 39 pacientes com melanoma avançado, câncer de pulmão de células não pequenas, carcinoma de células renais, câncer de próstata e câncer colorretal tratados com MDX1106 (nivolumabe).5 Atualmente, o nivolumabe e o pembrolizumabe são os anticorpos anti‐PD‐1 mais utilizados na prática clínica. Eles demonstraram eficácia terapêutica significante em uma ampla gama de neoplasias, incluindo melanoma avançado, câncer de pulmão de células não pequenas, carcinoma de células renais, câncer de bexiga e linfoma de Hodgkin.6
Eventos adversos relacionados ao sistema imunológico podem ocorrer na terapia direcionada a neoplasias, conhecidos como EAir. Os EAir têm as seguintes características: (i) são órgão‐específicos: os EAir podem afetar quase todos os sistemas orgânicos do corpo, mas os tecidos mais comumente afetados são aqueles com função de barreira, como a pele, trato gastrintestinal, fígado e epitélio respiratório; (ii) tem início tardio e persistência a longo prazo: embora o tempo médio para o início dos EAir varie entre os indivíduos, todos eles têm a característica de início tardio, geralmente ocorrendo semanas ou até meses após a administração do medicamento;7 (iii) memória inflamatória anterior: pacientes com doença inflamatória concomitante ou anterior têm maior probabilidade de desenvolver EAir; (iv) reversibilidade: 70% dos EAir são de grau pequeno ou moderado e a maioria se resolve após a descontinuação do medicamento ou uso de corticosteroides;8–10 (v) heterogeneidade da neoplasia: os mesmos inibidores de checkpoint imunológico (ICI) podem produzir perfis de toxicidade diferentes quando utilizados para tratar tumores diferentes; (vi) incidência relacionada aos ICI: o anti‐CTLA‐4 resulta em uma incidência global mais elevada de EAir do que o anti‐PD‐1. A incidência de EAir aumentou quando essa combinação foi administrada.
EAir comuns incluem toxicidade dérmica, toxicidade endócrina, hepatotoxicidade e pneumonia imunomediada (os EAir mais comuns estão relacionados à pele); por outro lado, cardiotoxicidade e nefrotoxicidade são eventos raros de EAir.11–14 A incidência de toxicidade cutânea decorrente do anti‐CTLA‐4 e do anti‐PD‐1 é de 50% e 30%‐40%, respectivamente.15 Os EAir cutâneos podem se manifestar como erupção cutânea inespecífica, psoríase, vitiligo, dermatite liquenoide, pênfigo, aspergilose, dermatomiosite e erupção cutânea medicamentosa de grau acentuado.
Características da psoríase de novo ou exacerbação por inibidores de checkpoint PD‐1A psoríase induzida por PD‐1 pode ser de novo (55,0%) ou uma exacerbação da psoríase preexistente. O tipo clínico mais comum é a psoríase em placas (70,6%), seguida de psoríase gutata (21,4%) e raras manifestações de psoríase pustulosa e de psoríase invertida.16–18 Além disso, o envolvimento de áreas palmoplantares pode ser encontrado em 38,3% dos casos de psoríase induzida por PD‐1.19
A psoríase, como EAir causada pelo inibidor PD‐1, atualmente carece de ferramentas de predição eficazes, e é difícil alcançar um modelo de previsão para sua ocorrência em pacientes com neoplasias que usam ICI. Contudo, fatores integradores relacionados à doença podem ser úteis para seu diagnóstico: (i) psoríase concomitante ou história/história familiar de psoríase; (ii) aparecimento ou exacerbação de lesões psoriásicas em média cinco a 12 semanas ou mais após o início da terapia com ICI;20,21 (iii) correspondência com a distribuição e as características das lesões psoriásicas clássicas;22–24 (iv) as características histopatológicas da psoríase relacionada ao inibidor de PD‐1 não são significantemente diferentes daquelas da psoríase clássica; no entanto, a psoríase induzida por medicamentos geralmente não apresenta capilares significantemente dilatados nas papilas dérmicas nem diminuição da espessura da epiderme sobre as papilas dérmicas;25,26 (v) o protocolo de tratamento da psoríase é eficaz para as lesões.
Estudos demonstraram que pacientes com neoplasias que desenvolveram EAir apresentaram melhores resultados do que aqueles que não desenvolveram EAir.27,28 Em um estudo com 7.008 pacientes com neoplasias, aqueles com psoríase concomitante apresentaram melhor sobrevida do que pacientes sem psoríase (HR=0,703; intervalo de confiança de 95%: 0,497–0,994; p=0,045).29 O desenvolvimento de psoríase, uma complicação dos inibidores de PD‐1, pode ser reflexo de boa resposta ao tratamento com inibidores de PD‐1 tumoral. No entanto, essa conclusão precisa ser apoiada por estudos com amostras maiores.
Mecanismo teórico da psoríase de novo ou exacerbação por inibidores do checkpoint PD‐1Uma vez que os inibidores de PD‐1 podem reduzir ou libertar os “freios” da resposta imune, eles podem, em teoria, ativar os sistemas imunológicos inato e adaptativo. As células que podem ser afetadas pelos inibidores de PD‐1 incluem células dendríticas, células Th e células Treg. As citocinas que eles secretam, especialmente interferon‐gama, IL‐1, IL‐17 e IL‐22, podem desempenhar papel vital na patogênese da psoríase de novo ou exacerbação.30 Entretanto, os mecanismos exatos precisam ser verificados por estudos adicionais. Os autores apresentam aqui uma análise teórica passo a passo dos efeitos potenciais dos inibidores de PD‐1 nos sistemas imunológicos inato e adaptativo.
Efeitos dos inibidores de PD‐1 no sistema imunológico inatoEfeitos potenciais dos inibidores de PD‐1 nos neutrófilosComo principais impulsionadores da resposta imune inata, os neutrófilos desempenham papel importante na patogênese da psoríase. Os neutrófilos saem dos vasos sanguíneos e migram para a epiderme para formar o microabscesso de Munro ou Kogoj, a característica histopatológica típica da psoríase.31 Atualmente, acredita‐se que os neutrófilos secretam diversas citocinas e quimiocinas, como fatores da família TNF‐α, IL‐17 e IL‐36, bem como armadilhas extracelulares para neutrófilos (NET, do inglês neutrophil extracellular traps) e exossomos de neutrófilos, envolvidos direta ou indiretamente na patogênese de psoríase.
A via PD‐L1/PD‐1 está envolvida na regulação da apoptose de neutrófilos. PD‐L1 em neutrófilos contém uma estrutura semelhante à tirosina‐XX‐metionina (YXXM), que promove a ligação da fosfatidilinositol 3‐quinase (PI3K) e ativa a subunidade p85. Este último regula a apoptose dos próprios neutrófilos, prolongando assim sua atividade.32,33 Dessa maneira, os anticorpos anti‐PD‐1 podem prolongar a atividade dos neutrófilos e provavelmente participarão no início e na manutenção da psoríase por meio das vias mencionadas.
Efeitos potenciais dos inibidores de PD‐1 nas células dendríticasExistem três tipos de células dendríticas (CDs) nas lesões de psoríase: células de Langerhans (CLs), células dendríticas plasmocitoides (CDp) e células dendríticas mieloides (CDm). As primeiras são encontradas principalmente na epiderme das lesões psoriásicas, enquanto as duas últimas são encontradas principalmente na derme, e todas as três desempenham papel patogênico na psoríase.34
Atualmente, não há investigação que tenha elucidado o mecanismo das CDs na psoríase induzida por inibidores de PD‐1, mas podem‐se obter pistas de pesquisas na área de oncologia. Foi demonstrado que PD‐L1 pode ser expressa em células neoplásicas e células imunes infiltrantes tumorais (TIC, do inglês tumor‐infiltrating immune cells) particularmente macrófagos e CD mieloides. O sinal de PD‐1/PD‐L1 no microambiente neoplásico pode mediar a inibição de células T.35,36 Foi demonstrado que os inibidores de PD‐1 induzem diretamente a produção de IFN‐γ por células T ativadas, o que induz a produção de IL‐12 por subpopulações de CD intratumorais. A IL‐12 está envolvida na imunidade antitumoral das células T e estimula a proliferação maciça de células T enquanto secreta várias citocinas para formar uma alça inflamatória de feedback positivo. Além disso, a IL‐12 pode inibir Eomes, um regulador‐chave da exaustão de células T, resultando na redução da exaustão das mesmas.37 Da mesma maneira, sabemos que a IL‐12 também é um dos fatores que desempenha papel importante no início e no desenvolvimento da psoríase.38 Entretanto, são necessárias pesquisas para confirmar se esses mecanismos estão relacionados ao envolvimento das CDs na indução ou exacerbação da psoríase pelos inibidores de PD‐1.
Efeitos potenciais dos inibidores de PD‐1 em macrófagosOs macrófagos, como uma das células‐chave da imunidade inata, têm o papel de produzir mediadores inflamatórios, apresentando antígenos, fagocitose e destruindo microrganismos patogênicos. De acordo com sua função imunológica, eles podem ser divididos em macrófagos do tipo M1, isto é, macrófagos classicamente ativados, e macrófagos do tipo M2, ou seja, macrófagos ativados alternativamente.39 Em termos de função imunológica, os macrófagos do tipo M1 e os macrófagos do tipo M2 representam dois extremos. A ativação de M1 secreta principalmente alguns fatores pró‐inflamatórios que ajudam as células Th1 em sua função anti‐infecciosa. Em contraste, a ativação de M2 está envolvida principalmente na fibrose, reparo tecidual e imunidade humoral sendo considerado um macrófago “anti‐inflamatório”.40,41
Os macrófagos estão envolvidos no desenvolvimento da psoríase. Inicialmente, os macrófagos estão aumentados nas lesões psoriásicas.42 Eles podem induzir proliferação excessiva e diferenciação anormal de queratinócitos por meio da secreção de citocinas como TNF‐α, MIF e IL‐20.43–45 Em segundo lugar, os macrófagos promovem a angiogênese psoriásica regulando positivamente a expressão do fator de crescimento endotelial vascular (VEGF, do inglês vascular endothelial growth factor), TGF‐β, fator de crescimento derivado de plaquetas (PDGF, do inglês platelet‐derived growth factor) e TNF‐α.46 Além disso, os macrófagos também desempenham papel no feedback positivo de fatores inflamatórios (p. ex., IL‐1 e procineticina 2) na psoríase.47
Descobriu‐se que PD‐1 é expresso em macrófagos e faz a mediação da apoptose de macrófagos.48–50 No tratamento de neoplasias, o uso de inibidores de PD‐1 pode atenuar esse efeito e aumentar o número de macrófagos. Além disso, os macrófagos associados a neoplasias (TAMs, do inglês tumor‐associated macrophages) têm plasticidade e podem se diferenciar no tipo inflamatório M1 ou no tipo M2.51–53 TAMs PD‐1+têm padrões de expressão molecular de superfície e funções semelhantes aos macrófagos do tipo M2, como expressão persistentemente aumentada de CD206 e IL‐10, expressão reduzida de HLA‐DR, CD64 e IL‐12 e capacidade significantemente aumentada de suprimir células T CD8+.54 Em contraste, o perfil de expressão de TAMs PD‐1−foi semelhante ao dos macrófagos do tipo M1. Seu número e a função anti‐inflamatória dos TAMs PD‐1+foram suprimidos após o uso de inibidores de PD‐1. No entanto, se o acima exposto está envolvido no desenvolvimento ou exacerbação da psoríase precisa ser verificado por meio de experimentos relevantes.
Efeitos dos inibidores de PD‐1 no sistema imunológico adaptativoEfeitos potenciais dos inibidores de PD‐1 nas células Th1 e Th17A psoríase clássica é geralmente considerada uma doença Th1 e Th17. Foi demonstrado que na psoríase em placas, as citocinas da via Th1 (IL‐2, IL‐12, IF‐γ) e da via Th17A (IL‐17A, IL‐17F, IL‐21, IL‐22) desempenham papel importante no recrutamento de mais células imunes, levando à infiltração inflamatória persistente e à proliferação de queratinócitos.55,56 As células T comumente expressam PD‐1 e PD‐L1, e o tratamento com anticorpos anti‐PD‐1 tem efeito dramático na imunogênese adaptativa mediada por células T. Essa é frequentemente considerada a principal causa do início ou exacerbação da psoríase induzida por anticorpos anti‐PD‐1. A seguir, os autores analisam aspectos da proliferação, diferenciação e função das células T.
Em termos de proliferação, Lebwohl et al. sugeriram que a expressão reduzida de PD‐L1 na epiderme psoriásica pode permitir a ativação contínua de células T. Isso foi confirmado na avaliação imuno‐histoquímica, na qual os níveis de expressão de PD‐L1 estavam reduzidos em média na epiderme psoriásica tanto para mRNA quanto para proteína.57–61 Entretanto, há relatos de “enxugamento clonal” após tratamento anti‐PD‐1, isto é, os clones de ativação de células T não aparecem ou até mesmo desaparecem, e esses mecanismos precisam ser melhor investigados.62 Sabe‐se atualmente que em um sistema de cultura em que a PHA (fito‐hemaglutinina) estimula a proliferação de células T, o PD‐L1 bloqueia a proliferação de células T na fase G0/G1, regula negativamente a ativação de células T, inibe a capacidade de resposta dos linfócitos T à proliferação de PHA e, portanto, reduz a proliferação de células T.
Em termos de diferenciação, sabemos que as células Th1 e Th17 são as células pró‐imunes, enquanto as células Th2 são as células supressoras da inflamação psoriásica. O bloqueio da via PD‐1/PD‐L não apenas promove a proliferação de células T, mas também induz a diferenciação de células T CD4+em células Th1 e Th17.63,64 Após o bloqueio de PD‐1, as células T demonstraram múltiplas trajetórias de diferenciação. Entre elas, há uma importante trajetória de diferenciação, que é a trajetória de células T virgens → células Th1, ou células Tfh.65 Isso pode ter implicações importantes na exploração do mecanismo da psoríase de novo ou exacerbação pelos inibidores do checkpoint PD‐1.
Em termos de função, as propriedades efetoras das células T CD4+e CD8+são melhoradas após o tratamento com bloqueio de PD‐L1. A pesquisa descobriu que após o tratamento anti‐PD‐L1, as células T quimiotáticas para CXCL13 exibem citotoxicidade aumentada, bem como aumento das vias de sinalização de IFN‐γ.66
Efeito potencial dos inibidores de PD‐1 nas células T regulatóriasO efeito do PD1/PD‐L1 na regulação das células T regulatórias (Treg) reflete‐se principalmente nos seguintes aspectos. Primeiro, foi demonstrado que microesferas revestidas com PD‐L1 podem induzir Treg in vitro, e PD‐L1 pode aumentar a expressão de Foxp 3 e aumentar a capacidade imunossupressora de Treg.3 Além disso, PD‐Ll pode promover a conversão de células T CD4+virgens em Treg, regulando negativamente Akt, mTOR e ERK 2, bem como regulando positivamente PTEN ao mesmo tempo.67 Em segundo lugar, a regulação da PD‐1 é afetada pela via Notch, e a diferenciação e função de Treg também requerem a participação da via Notch.68–70 A superexpressão de Jagl, um ligante da via Notch, nas CD aumenta a expressão de PD‐L1 e a co‐cultura de células T CD4+com as Jag1‐CD promove a geração de Treg, enquanto o bloqueio de PD‐Ll reduz parcialmente a amplificação de Treg.71 Os resultados acima confirmam o importante papel de PD‐1 na indução da amplificação de Treg.
Além disso, a capacidade imunomoduladora de Treg é reduzida na pneumonia induzida por ICI, e especula‐se que a imunossupressão diminuída de Treg pode induzir uma resposta imune Th1 mais intensa na pneumonia induzida por ICI, e especula‐se que essa resposta também pode desempenhar um papel na formação de placas psoriásicas.72
Em uma palavra, antagonizar PD1/PD‐L1 pode enfraquecer a quantidade e a função de Treg, possivelmente levando a um desequilíbrio entre as células Treg e Th1/Th17.73–76 Portanto, isso pode teoricamente levar à ocorrência ou exacerbação da psoríase.
Efeito potencial do inibidor de PD‐1 nas células T de memória residentes em tecidosAs células T de memória, com base em seu comportamento migratório, são divididas em células T de memória circulantes e células T de memória residentes em tecidos (TRM, do inglês tissue‐resident memory).77 As TRM geralmente não entram novamente na corrente sanguínea e ficam em tecidos periféricos, que constituem barreiras epiteliais (pele, pulmão, trato gastrintestinal e trato reprodutivo) e órgãos internos (rim, cérebro) onde podem fornecer proteção imune a longo prazo contra infecções, neoplasia e outros danos teciduais. As TRM são caracterizadas pela molécula de adesão CD103 (subunidade aE da integrina) e/ou marcador de ativação CD69.78–80 As TRM têm características proeminentes de longa vida útil e baixa mobilidade, bem como perfil transcricional único. Em geral, acredita‐se que estejam envolvidos na recorrência da psoríase.81–83
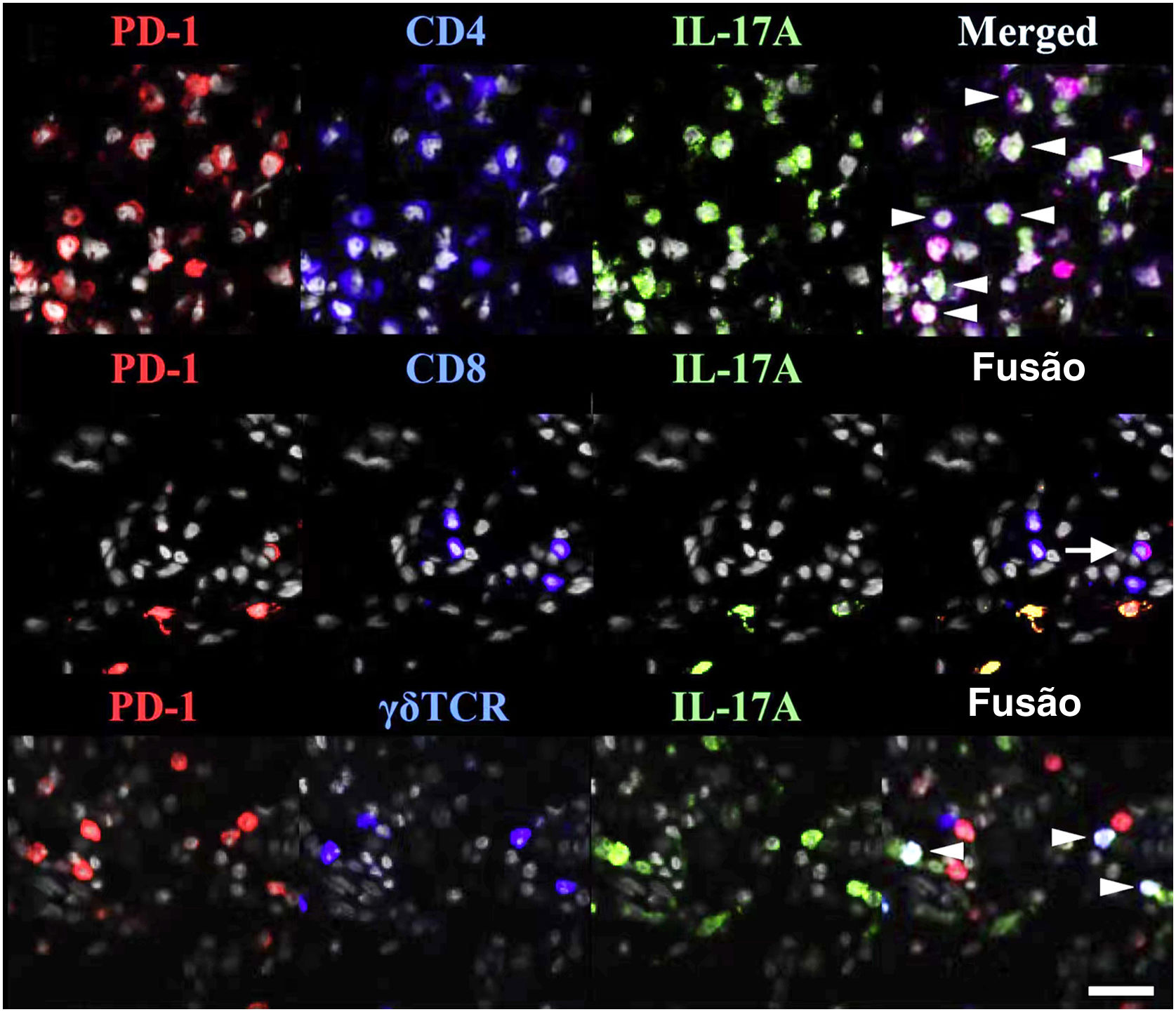
As TRM expressam PD‐1 e PD‐L1 (fig. 1), sugerindo que os medicamentos anti‐PD‐1/PD‐L1 possam atuar nas TRM.77 O envolvimento de anticorpos anti‐PD‐1 na ocorrência/exacerbação da psoríase pode estar relacionado aos seguintes mecanismos: (i) a terapia anti‐PD‐1 aumenta o efeito citotóxico das TRM CD103+;84 (ii) os anticorpos anti‐PD‐1 permitem a amplificação de clones TRM e aumentam a expressão de IFN‐γ e IL‐17, que podem iniciar/exacerbar a psoríase;47 (iii) o bloqueio do anticorpo PD‐1 aumenta a interação e coativação de TRM com células de memória circulantes.85
TRM (do inglês tissue‐resident memory) expressam PD‐1 na psoríase. PD‐1 e IL‐17A foram marcados conjuntamente com CD4, CD8 ou TCRγδ. Pontas de seta brancas indicam células triplamente marcadas e uma seta branca inteira indica células T CD8 IL‐17A‐PD‐1+. Reproduzido com a permissão de ©Clearance Center. O ligante de morte celular programada‐1 atenua a inflamação psoriásica suprimindo a produção de IL‐17A a partir de células T com morte celular programada‐1 alta.
Em 2022, o grupo de trabalho da European Academy of Dermatology and Venereology (EADV) apresentou requisitos de manejo e princípios básicos indicando que as intervenções médicas devem variar de pessoa para pessoa; com a premissa de aliviar os EAir e melhorar a qualidade de vida, a terapia direcionada aos pacientes deve ser continuada ou ajustada. Um novo equilíbrio deve ser estabelecido entre o tratamento do EAir e a terapia alvo.86 Uma vez diagnosticada a psoríase induzida ou agravada por inibidores de PD‐1, os dermatologistas devem ser convidados a participar do tratamento e manejo precoces de acordo com princípios interdisciplinares.87,88
A psoríase devido a ICI (inibidores de checkpoint imunológico) pode ser classificada como Grau I, Grau II e Grau III de acordo com os critérios comuns para avaliação de eventos adversos (CTCAE, do inglês common terminology criteria for adverse events, v5.0). A maioria desses pacientes está no Grau I ou II, e apenas alguns atingem o Grau III, o que está de acordo com o padrão de “pirâmide”. De acordo com os mais recentes padrões de manejo do grupo de trabalho da EADV: pacientes Grau 1 devem receber modalidades de tratamento tópico, como corticosteroides potentes e análogos da vitamina D, mantendo a dose de ICI; os pacientes Grau II devem ser tratados com terapias sistêmicas tradicionais, como fototerapia e retinoides, com base no manejo do Grau I, com continuação ou ajuste da dose de ICI, e sua classificação precisa ser reavaliada duas semanas depois; os pacientes Grau III devem ser tratados com doses maiores de terapia sistêmica tradicional com base no tratamento do Grau II. Se essa terapia for ineficaz ou houver piora, medicamentos biológicos (p. ex., antagonistas de TNF‐α) podem ser considerados, e o regime de ICI deve ser ajustado ao mesmo tempo.86 Isso difere acentuadamente dos princípios de tratamento da psoríase tradicional induzida por medicamentos.
No decorrer do tratamento, deve‐se também prestar atenção a outras questões. No passado, os oncologistas frequentemente recomendavam corticosteroides sistêmicos para EAir graves; entretanto, a American Academy of Dermatology‐National Psoriasis Foundation não os recomenda para psoríase de novo ou exacerbação por inibidores de checkpoint PD‐1. Isso ocorre porque os corticosteroides sistêmicos não têm eficácia duradoura e podem causar recidiva da psoríase durante sua redução gradual.89 Além disso, em virtude da presença de neoplasia maligna, os pacientes são aconselhados a evitar a ciclosporina e alguns agentes biológicos e inibidores de moléculas pequenas (p. ex., inibidores de Jak), que podem induzir/exacerbar a progressão da neoplasia.90 Durante o tratamento, os pacientes também devem evitar fatores que possam induzir ou agravar a psoríase, como estresse, obesidade, alcoolismo, tabagismo e infecções.
É necessário levar em consideração os seguintes aspectos em conjunto: (1) o aparecimento de EAir na pele pode ser um indicador de boa eficácia antineoplásicas dos ICI; e (2) a possibilidade de recorrência da psoriáse ou mesmo piora pela continuação da imunoterapia.91–93 Além disso, é preciso levar em consideração que o regime de tratamento adotado deve ser eficaz contra EAir cutâneos, mas também que o regime não deve afetar negativamente a imunidade antineoplásica. Portanto, os médicos precisam tomar decisões individualizadas e avaliar globalmente os riscos e benefícios.
ConclusãoCom a ampla aplicação da imunoterapia para neoplasias, a ocorrência de reações adversas cutâneas torna‐se cada vez mais frequente. Tem sido um desafio para oncologistas e dermatologistas padronizarem o manejo das reações cutâneas adversas e, ao mesmo tempo, minimizarem o impacto na imunoterapia. O que é apresentado aqui é uma visão geral do conhecimento atual sobre psoríase de novo ou exacerbação induzida por inibidores de checkpoint PD‐1. Pode‐se observar que existem alguns aspectos que precisam de maiores elucidações: quais são os mecanismos moleculares exatos por meio dos quais os inibidores de PD‐1 desencadeiam/exacerbam a psoríase? Esses mecanismos diferem e se cruzam com os da psoríase clássica? Existem diferenças nos fenótipos clínicos e mecanismos moleculares pelos quais diferentes inibidores de PD‐1 desencadeiam/exacerbam a psoríase? É apropriado que o metotrexato seja proposto para uso no tratamento da psoríase associada a inibidores de PD‐1, uma vez que o metotrexato pode causar doença linfoproliferativa associada ao metotrexato (MTX‐LPD, do inglês methotrexate‐associated lymphoproliferative disorder) em indivíduos com microambiente imunológico instável? A resolução das questões acima irá facilitar o tratamento eficaz e seguro de numerosos EAir cutâneos por inibidores de PD‐1, incluindo a psoríase.
Suporte financeiroNational Natural Science Foundation of China (n° 82273537).
Contribuição dos autoresZhu Shen: Concepção e planejamento do estudo, revisão crítica do manuscrito e aprovação da versão final do manuscrito e publicação.
Zi Wan: Pesquisa na literatura, elaboração e redação do manuscrito e aprovação da versão final do manuscrito e publicação; aprovação da versão final do manuscrito; Concepção e planejamento do estudo; elaboração e redação do manuscrito; Revisão crítica do manuscrito.
Jiangyuan Huang: Pesquisa na literatura, elaboração e redação do manuscrito, aprovação da versão final do manuscrito e publicação; Aprovação da versão final do manuscrito; Concepção e planejamento do estudo; elaboração e redação do manuscrito; Revisão crítica do manuscrito.
Xiaojie Ou: Pesquisa na literatura e elaboração e redação do manuscrito e aprovação da versão final do manuscrito e publicação; Aprovação da versão final do manuscrito; Concepção e planejamento do estudo; elaboração e redação do manuscrito; Revisão crítica do manuscrito.
Shuang Lou: Pesquisa na literatura, elaboração e redação do manuscrito e aprovação da versão final do manuscrito e publicação.
Jianji Wan: Pesquisa na literatura, revisão crítica do manuscrito e aprovação da versão final do manuscrito e publicação.
Conflito de interessesNenhum.
Esses autores contribuíram igualmente para este trabalho e compartilham a primeira autoria.
Como citar este artigo: Wan Z, Huang J, Ou X, Lou S, Wan J, Shen Z. Psoriasis de novo or exacerbation by PD‐1 checkpoint inhibitors. An Bras Dermatol. 2024;99:425–32.
Trabalho realizado no The Second School of Clinical Medicine at Southern Medical University and Guangdong Provincial People's Hospital, Guangzhou, Guangdong, China.