Prurigo é condição reativa hiperplásica da pele caracterizada por pápulas, placas e/ou nódulos pruriginosos. Temporalmente, são classificados como agudo/subagudo e crônico (≥ 6 semanas), com diferentes variantes clínicas, sinonímias, e fatores etiológicos subjacentes. A imunologia do prurigo crônico mostra semelhanças com a dermatite atópica em virtude do envolvimento de IL‐4 e IL‐13, IL‐22 e IL‐31. O tratamento varia desde anti‐histamínicos, esteroides tópicos, dupilumabe e inibidores de Janus Quinases (JAK). Diversas entidades se manifestam clinicamente como lesões prurigoides, e o correto diagnóstico clínico deve preceder o tratamento intempestivo. Além disso, prurigos crônicos representam dermatose recalcitrante e angustiante, e pelo menos 50% desses pacientes apresentam diátese atópica, cujo tratamento pode induzir efeitos adversos, especialmente em idosos. Há importante comprometimento da qualidade de vida, e, muitas vezes, os tratamentos tópicos não são capazes de controlar os sintomas e as lesões cutâneas. Imunossupressores sistêmicos, imunobiológicos e inibidores de JAK, apesar do custo e de potenciais efeitos adversos, podem ser necessários para obter melhoria clínica e na qualidade de vida. Este manuscrito revisa os principais tipos de prurigo, doenças associadas, suas bases imunológicas, diagnóstico e tratamento.
Prurigo é condição cutânea hiperplásica reativa caracterizada por pápulas, placas e/ou nódulos, isolados ou múltiplos, com prurido intenso. Alguns autores classificam o prurigo de acordo com o tipo (agudo, subagudo ou crônico) ou forma clínica ou agente causador/doença associada. Há vasta sinonímia e descrição de quadros superponíveis, sob a mesma denominação, o que dificulta a revisão da informação disponível.1–3O termo “prurigo” foi originado do latim pruire, que significa coceira, nominado por Ferdinand von Hebra ao caracterizar pápulas e nódulos com prurido intenso, em Viena, em 1850.3,4 Outros autores, porém, atribuem a Robert Willan, há mais de 200 anos, a descrição de pápulas pruriginosas sob o termo prurigo.4,5
Este manuscrito revisa os principais tipos de prurigo, doenças associadas, suas bases imunológicas, diagnóstico e tratamento.
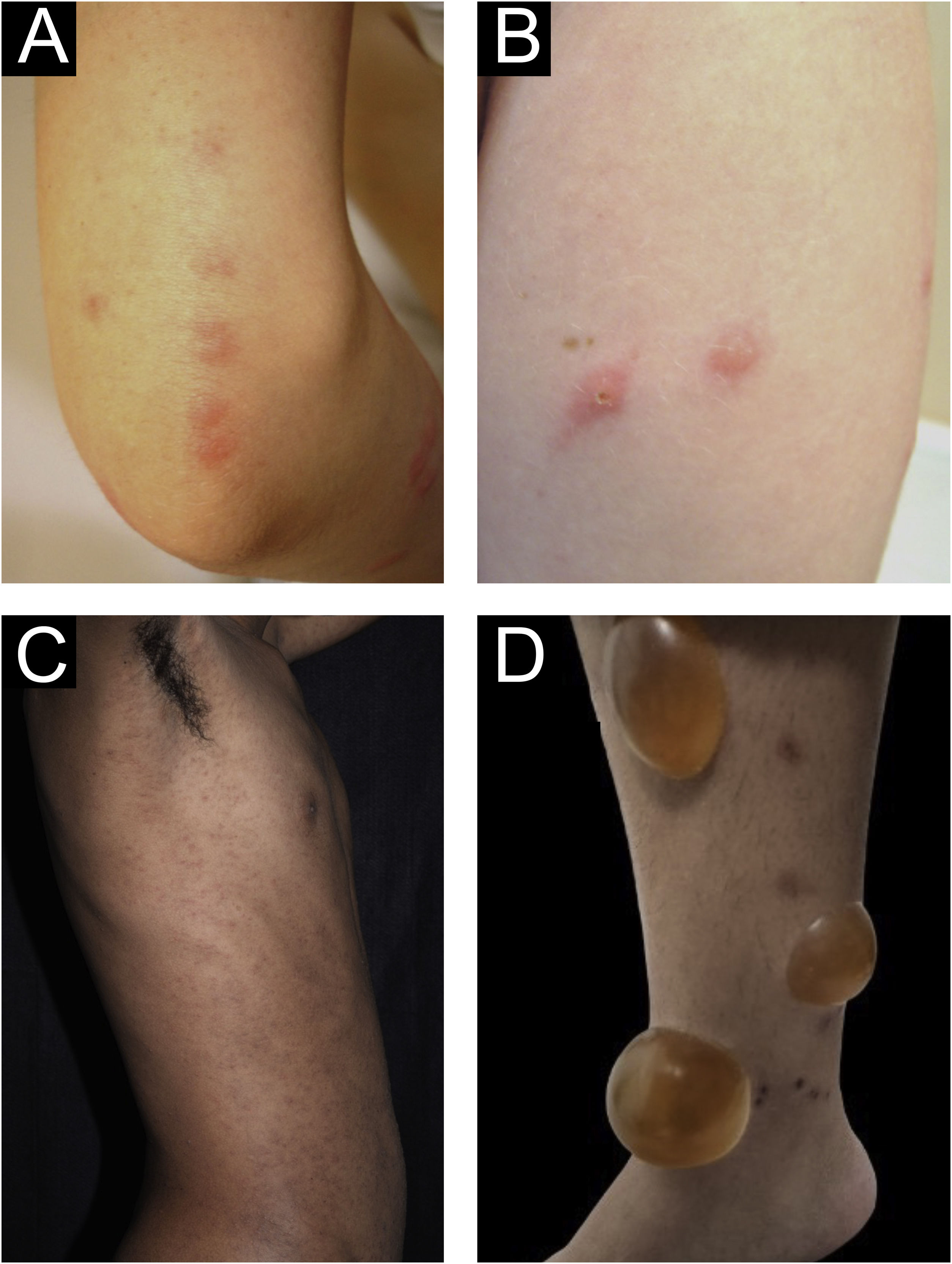
Formas clínicas de prurigoPrurigo agudo/subagudoO prurigo agudo compreende lesões com duração efêmera (≤ 6 semanas), podendo haver surtos de reagudização. Compreende uma variedade de manifestações clínicas como pápulas eritematosas intensamente pruriginosas, frequentemente exibindo vesícula central, em áreas cobertas por roupas (tórax, abdome), ou principalmente não cobertas, como antebraços, braços, pernas, mãos e pés (fig. 1), dependendo do agente indutor. Lesões atípicas podem estar associadas, como vesículas, bolhas, crostas e lesões urticariformes, em que a superinfecção estafilocócica é comum. O prurigo agudo geralmente ocorre em virtude de picada de artrópodes; é comumente referido na literatura pediátrica como prurigo estrófulo, que privilegia crianças de 2 a 7 anos, em áreas tropicais, com fundo imunológico atópico e baixo nível socioeconômico.2,6
(A) Prurigo agudo no antebraço em virtude de picadas de percevejos em morfologia de padrão linear típico semelhante ao café da manhã, almoço e jantar. (B) Prurigo agudo decorrente de picada de inseto (prurigo estrófulo). (C) Prurigo agudo extenso por escabiose. (D) Bolha após prurigo agudo em virtude de picadas de insetos.
A reativação de lesões antigas após novas picadas de insetos em outras topografias é descrita, assim como a formação de bolhas e vesículas nos locais das novas picadas (fig. 1). Lesões mais exuberantes aparecem em indivíduos predispostos, principalmente em atópicos. O conteúdo das lesões geralmente é citrino, refletindo o plasma exsudado das lesões.7
Em geral, o prurigo agudo não requer exames complementares extensos. Seu tratamento deve ser orientado de acordo com o agente causador. O tratamento é sintomático: anti‐histamínicos (anti‐H1) não sedantes de dia e sedantes à noite, cuidados antissépticos diários, corte de unhas para evitar superinfecção bacteriana e corticosteroides tópicos.2
No entanto, a exposição a picadas intermitentes de artrópodes pode conduzir a uma forma de prurido agudo referido como urticária papular (UP), que é induzida principalmente por picada de pulga.8
A UP é condição alérgica crônica em que a melhora clínica pode ocorrer em torno dos 7 anos, representando um modelo natural de tolerância imunológica adquirida. Em pacientes com UP, estudos imunológicos demonstraram mais células‐T CLA4+ específicas da pele para antígenos de pulgas secretando IFN‐γ, IL‐4, IL‐10 e IL‐17, quando comparadas a controles saudáveis.8,9 Curiosamente, após mais de cinco anos de duração da doença, as células T CLA4+ da pele perdem sua capacidade de produzir IL‐4, enquanto mantêm em grande parte sua capacidade de secreção de IL‐10 e IL‐17.8,9 Alinhado com essa hipótese, a frequência de células T positivas para IFN‐γ é reduzida tanto em linfócitos residentes ou não, na pele nesses pacientes.8,9
Celiksoy et al.10 estudaram 130 pacientes com UP (idade mediana: 60 meses). A prevalência de sibilos recorrentes e dermatite atópica (DA) foi maior no grupo <5 anos com UP do que no grupo controle da mesma idade.10 A prevalência de asma, rinite alérgica e DA foi maior no grupo >5 anos com UP do que o grupo controle da mesma idade.10 Esses pacientes devem ser avaliados não apenas em termos de UP, mas também em termos de doenças atópicas comórbidas.8,10
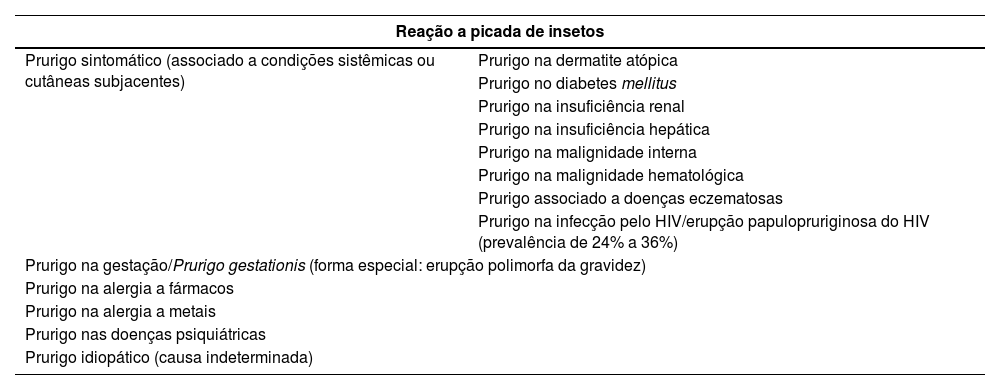
Prurigo crônicoO prurigo crônico (PGC) tem sua duração definida por mais de 6 semanas, e pode ser classificado em três subtipos, se associado/causado por outras dermatoses ou não: a) PGC com lesões cutâneas associadas; b) PGC sem lesões cutâneas associadas; ou c) PGC de origem indeterminada. Um consenso japonês classificou os tipos de prurigo de acordo com sua causa relacionada, conforme demonstrado na tabela 1.1
Classificação do prurigo de acordo com sua causa subjacente. Frequentemente, a maioria dessas formas evolui para prurigo crônico16
| Reação a picada de insetos | |
|---|---|
| Prurigo sintomático (associado a condições sistêmicas ou cutâneas subjacentes) | Prurigo na dermatite atópica |
| Prurigo no diabetes mellitus | |
| Prurigo na insuficiência renal | |
| Prurigo na insuficiência hepática | |
| Prurigo na malignidade interna | |
| Prurigo na malignidade hematológica | |
| Prurigo associado a doenças eczematosas | |
| Prurigo na infecção pelo HIV/erupção papulopruriginosa do HIV (prevalência de 24% a 36%) | |
| Prurigo na gestação/Prurigo gestationis (forma especial: erupção polimorfa da gravidez) | |
| Prurigo na alergia a fármacos | |
| Prurigo na alergia a metais | |
| Prurigo nas doenças psiquiátricas | |
| Prurigo idiopático (causa indeterminada) | |
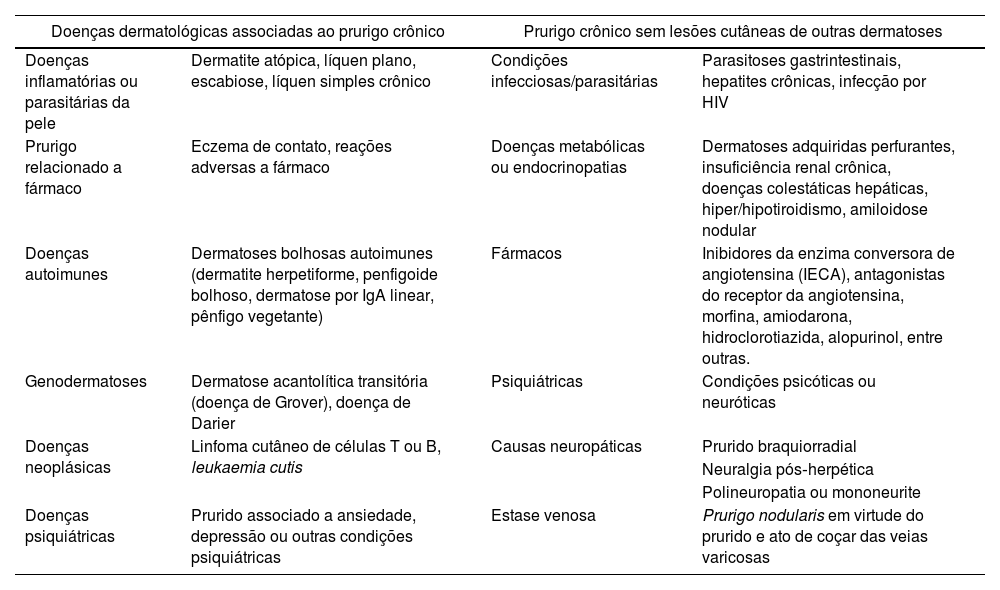
O PGC sem associação com outras lesões cutâneas pode estar relacionado a doenças internas ou sistêmicas.2,11,12 Na tabela 2, demonstramos doenças dermatológicas associadas ao PGC com ou sem lesões cutâneas de outras dermatoses.
Doenças dermatológicas associadas a prurido e prurigo crônico, e prurido/prurigo crônico sem lesões cutâneas de outras dermatoses1,21
| Doenças dermatológicas associadas ao prurigo crônico | Prurigo crônico sem lesões cutâneas de outras dermatoses | ||
|---|---|---|---|
| Doenças inflamatórias ou parasitárias da pele | Dermatite atópica, líquen plano, escabiose, líquen simples crônico | Condições infecciosas/parasitárias | Parasitoses gastrintestinais, hepatites crônicas, infecção por HIV |
| Prurigo relacionado a fármaco | Eczema de contato, reações adversas a fármaco | Doenças metabólicas ou endocrinopatias | Dermatoses adquiridas perfurantes, insuficiência renal crônica, doenças colestáticas hepáticas, hiper/hipotiroidismo, amiloidose nodular |
| Doenças autoimunes | Dermatoses bolhosas autoimunes (dermatite herpetiforme, penfigoide bolhoso, dermatose por IgA linear, pênfigo vegetante) | Fármacos | Inibidores da enzima conversora de angiotensina (IECA), antagonistas do receptor da angiotensina, morfina, amiodarona, hidroclorotiazida, alopurinol, entre outras. |
| Genodermatoses | Dermatose acantolítica transitória (doença de Grover), doença de Darier | Psiquiátricas | Condições psicóticas ou neuróticas |
| Doenças neoplásicas | Linfoma cutâneo de células T ou B, leukaemia cutis | Causas neuropáticas | Prurido braquiorradial |
| Neuralgia pós‐herpética | |||
| Polineuropatia ou mononeurite | |||
| Doenças psiquiátricas | Prurido associado a ansiedade, depressão ou outras condições psiquiátricas | Estase venosa | Prurigo nodularis em virtude do prurido e ato de coçar das veias varicosas |
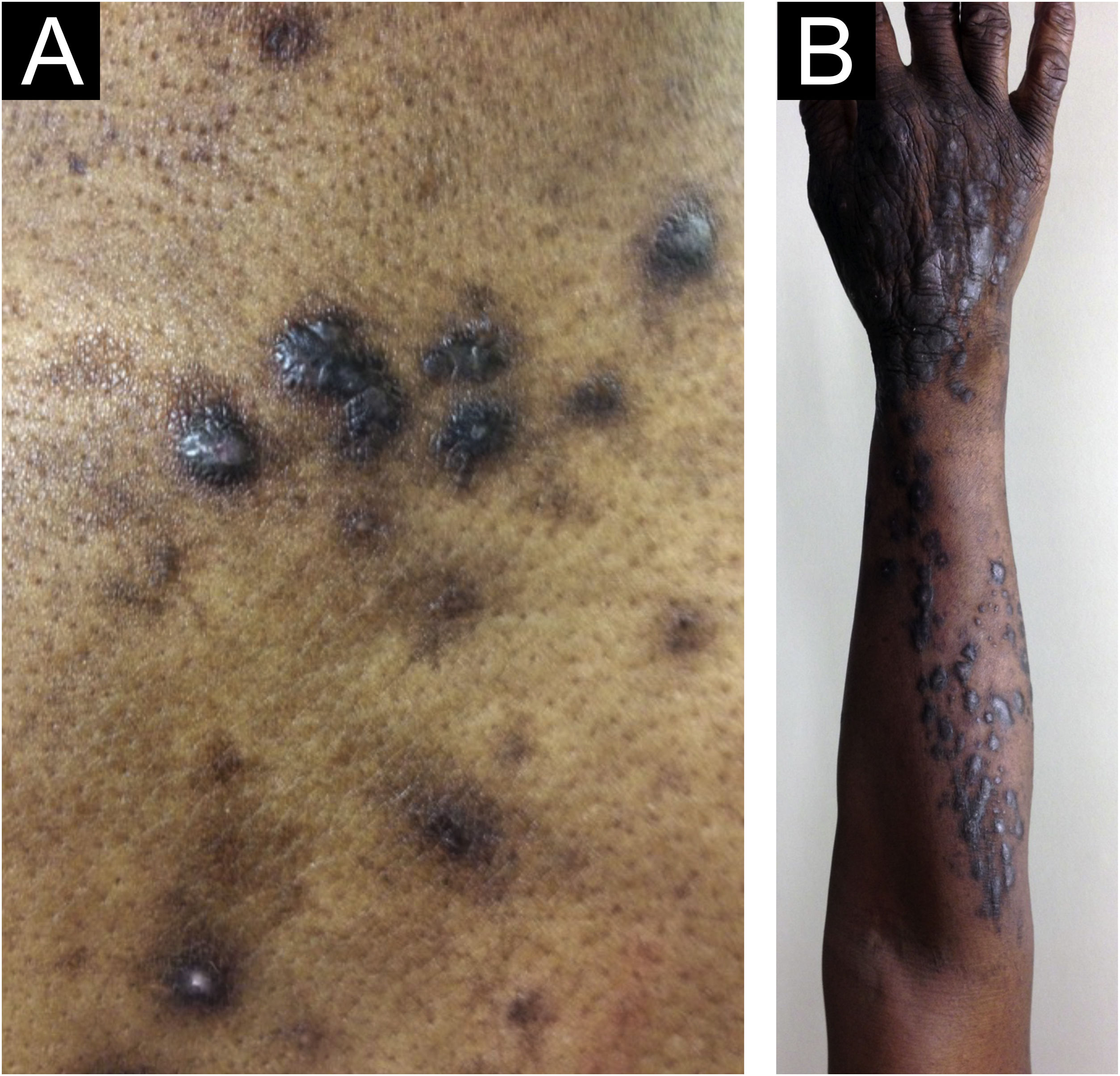
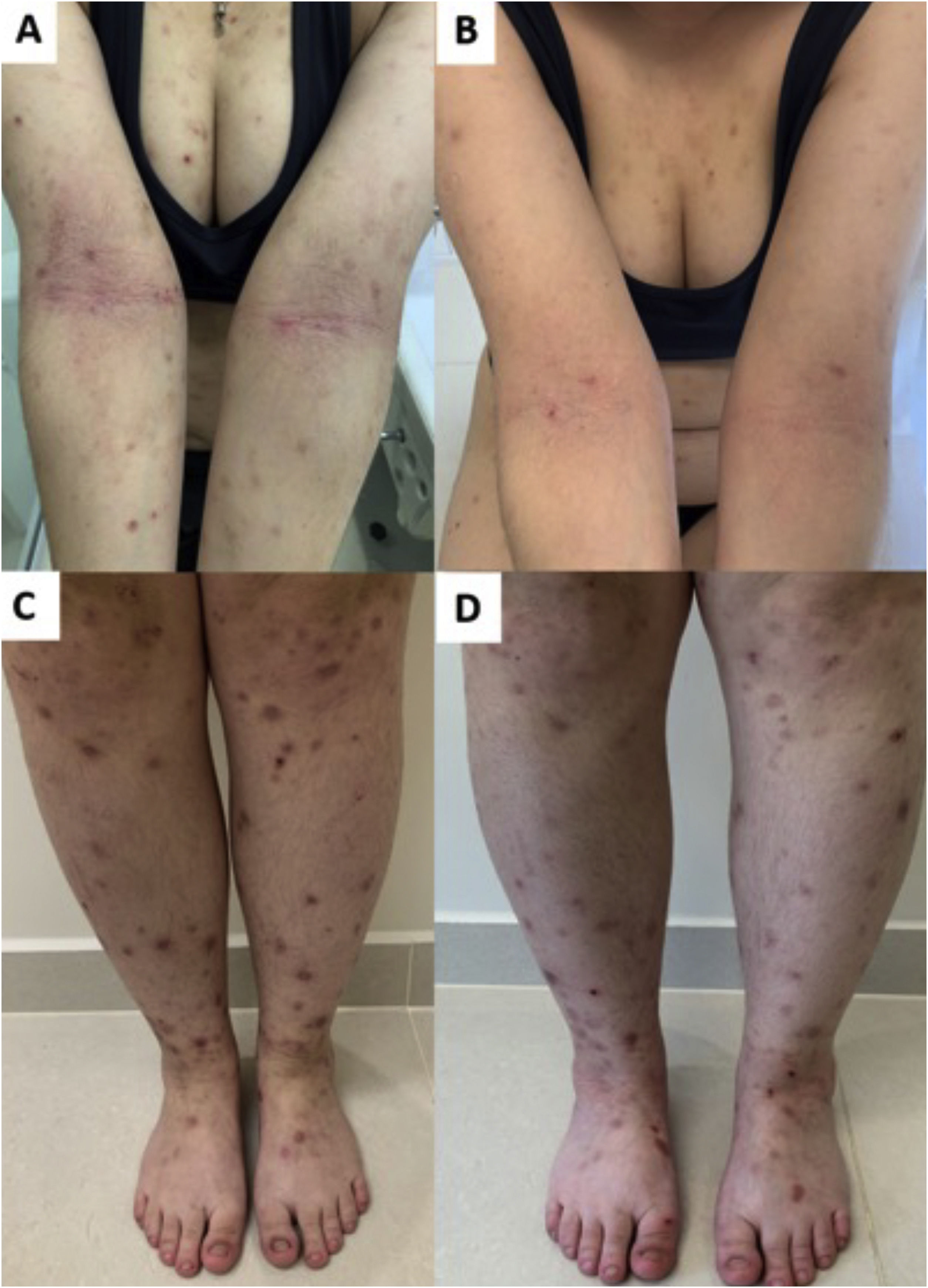
Morfologicamente, o PGC pode ser designado como prurigo nodular crônico (predominam os nódulos), prurigo papular crônico (predominam as pápulas), PGC em placas (predominam as placas), PGC umbilicado (predominam as lesões pruriginosas ulceradas) ou linear (fig. 2). Entretanto, como morfologias distintas podem estar presentes no mesmo paciente simultaneamente e suas características podem evoluir e mudar ao longo do tempo, todos esses fenótipos serão tratados como PGC, nesse texto.4,13,14
Dados epidemiológicos sobre o PGC são escassos na literatura. Alguns autores estimam 72 casos por 100.000 pessoas, o que provavelmente sejam subestimados por subnotificação.4,14 Docampo‐Simón et al.13 relataram que, em sua prática clínica, o PGC é mais frequente em pacientes com idade entre 50 e 60 anos e entre afro‐americanos.14
Zeidler et al. estudaram 1.128 pacientes de PGC na Alemanha entre 2004 e 2018, dos quais 61,4% eram do sexo feminino; a prevalência aumenta com a idade, e a duração mediana do PGC foi de 2,9 anos antes do diagnóstico pelo estudo.15
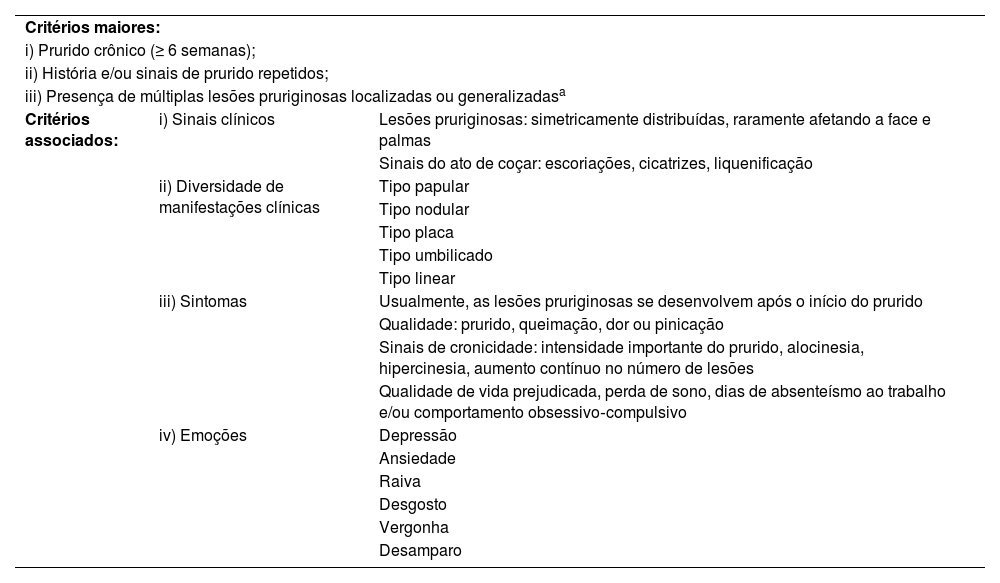
Especialistas europeus e americanos em prurido desenvolveram a diretriz do Fórum Internacional sobre o Estudo do Prurido (IFSI) sobre PGC, incluindo prurigo nodular como seu sinônimo; foram estabelecidos critérios diagnósticos para PGC (tabela 3).16 As definições japonesas são alinhadas, embora ligeiramente diferentes.1 De acordo com a classificação etiológica do IFSI, o PGC pode ainda ser de origem dermatológica, sistêmica, neurológica, psiquiátrica/psicossomática, multifatorial ou desconhecida, atentando para a relevância da investigação etiológica em seu tratamento.16
Diretriz do Fórum Internacional sobre o Estudo do Prurido (IFSI) sobre critérios diagnósticos de prurigo crônico. Os três critérios maiores são necessários para estabelecer o diagnóstico de prurigo crônico. Os critérios menores estão frequentemente presentes, mas não são obrigatórios16
| Critérios maiores: | ||
| i) Prurido crônico (≥ 6 semanas); | ||
| ii) História e/ou sinais de prurido repetidos; | ||
| iii) Presença de múltiplas lesões pruriginosas localizadas ou generalizadasa | ||
| Critérios associados: | i) Sinais clínicos | Lesões pruriginosas: simetricamente distribuídas, raramente afetando a face e palmas |
| Sinais do ato de coçar: escoriações, cicatrizes, liquenificação | ||
| ii) Diversidade de manifestações clínicas | Tipo papular | |
| Tipo nodular | ||
| Tipo placa | ||
| Tipo umbilicado | ||
| Tipo linear | ||
| iii) Sintomas | Usualmente, as lesões pruriginosas se desenvolvem após o início do prurido | |
| Qualidade: prurido, queimação, dor ou pinicação | ||
| Sinais de cronicidade: intensidade importante do prurido, alocinesia, hipercinesia, aumento contínuo no número de lesões | ||
| Qualidade de vida prejudicada, perda de sono, dias de absenteísmo ao trabalho e/ou comportamento obsessivo‐compulsivo | ||
| iv) Emoções | Depressão | |
| Ansiedade | ||
| Raiva | ||
| Desgosto | ||
| Vergonha | ||
| Desamparo | ||
O PGC induz um ciclo prurido‐coçadura, bem como fenômenos de sensibilização neuronal, que contribuem para o desenvolvimento e perpetuação do PGC.16 Esses mecanismos são independentes da origem do prurido, uma vez que o desenvolvimento do PGC é observado em diferentes etiologias subjacentes do prurido – p. ex., na DA, prurido nefrogênico ou síndromes de compressão neurológica.16 Em idosos, muitas comorbidades independentes podem estar presentes, mas sem representar causa desencadeante do PGC.16 Portanto, a doença subjacente do PGC não é fácil de estabelecer, e alguns termos, como “dermatite atópica prurigoide”, devem ser evitados em favor de afirmar que existem duas entidades distintas.16
Patogênese do prurigo crônicoEm pacientes atópicos, estudos imunológicos e genéticos delinearam vias inflamatórias alérgicas comuns a diversas condições, como DA, asma, alergia alimentar, entre outras, das quais a patogênese central é a via do receptor da interleucina 4 (IL‐4R).17
O eixo IL‐4/IL‐13/IL‐4R promove a diferenciação das células T helper tipo 2 (TH2), que medeiam a resposta imune adaptativa pró‐alérgica.17 Uma vez que a IL‐4 ou IL‐13 se liga aos receptores, elas desencadeiam a transfosforilação e a ativação das proteínas quinases da família Janus (JAKs) associadas à subunidade do receptor, incluindo JAK1, JAK3 e JAK2.17 No entanto, várias outras condições estão relacionadas ao PGC, e sua patogênese é baseada na sensibilização do prurido e nas interações entre pruriceptores e células da pele.18
O prurido envolve estruturas e células com origem em tecidos neuroectodérmicos. Existem dois principais envolvidos na patogênese do PGC: o sistema nervoso central e as células imunes da pele.18
Ocorrem alterações funcionais encefálicas associadas à sensibilização ao prurido que mostram ativação aumentada de algumas áreas associadas a alterações estruturais, como diminuição da massa cinzenta em algumas regiões do cérebro.16
Na medula espinal, a regulação anormal das vias inibitórias do prurido pode explicar a sensibilização central.18 A sensibilização periférica tem sido atribuída ao aumento da excitabilidade do nervo sensorial em virtude da hiperinervação (na derme) e/ou à perda de inervação (fibras nervosas intraepidérmicas de pequeno diâmetro, FNIPD), bem como ao aumento da expressão, sensibilidade e/ou capacidade de resposta de pruriceptores, que contribuem para a hipersensibilidade dos neurônios sensoriais aos pruritogênicos.10
Na pele, os queratinócitos interagem com terminações nervosas sensoriais, especialmente pruriceptores das FNIPD, por meio de contatos sinápticos.18 A percepção da coceira e o aparecimento de lesões de prurigo estão relacionados a essas interações e com outras células do seu ambiente, como mastócitos, eosinófilos, células dendríticas ou linfócitos T.18
Em camundongos, foram identificados três tipos de terminações nervosas pruriceptivas: a) neurônios D+ MRGPR (receptor acoplado à proteína G relacionada a Mas); b) neurônios que expressam MRGPRA3, MMRGPRC11, receptores de histamina e o receptor de IL‐33; e c) terminações nervosas que expressam receptores de serotonina e o receptor de IL‐31. Muitos genes MRGPR são expressos exclusivamente em subconjuntos de neurônios do gânglio da raiz dorsal (GRD) de pequeno diâmetro e, em humanos, as proteínas derivadas desses genes são denominadas MRGPRX1 a MRGPRX4.19 Em humanos, o gene MRGPR‐X2 é altamente expresso em lesões de PGC, e os mastócitos são as principais células que expressam mRNA de MRGPRX2 na maioria dos pacientes (70%).20 Os receptores de IL‐4 e IL‐13 são detectados em todas as três categorias.18 Em camundongos, foi demonstrado que os comportamentos do ato de coçar variam de acordo com a ativação desses diferentes subtipos.18
No PGC, a expressão dérmica de IL‐31, IL‐31RA e oncostatina M (OSM) e periostina estão bem correlacionadas com a intensidade da coceira. Além disso, a expressão de OSMRβ na derme está aumentada, apesar de não estar correlacionada com a intensidade do prurido. A IL‐31 está envolvida na coceira em várias doenças, incluindo DA, psoríase, linfoma cutâneo de células T, dermatite de estase, penfigoide bolhoso, escabiose e amiloidose cutânea primária localizada. O PGC expressa 50 vezes mais o mRNA da IL‐31 na pele lesionada.21
A IL‐31 é produzida principalmente por células Th2 ativadas. Queratinócitos epidérmicos, glândulas sudoríparas écrinas, mastócitos, basófilos, eosinófilos e monócitos/macrófagos são capazes de liberar IL‐31, pois macrófagos CD68+, além de células T CD3+, são as principais fontes celulares de IL‐31 em lesões de PGC. Os macrófagos M2 expressam IL‐31 e podem ser responsáveis pelo prurido em diversas dermatoses, como a dermatite de estase e a escabiose. Portanto, os macrófagos, juntamente com as células T, podem ser potencial alvo terapêutico para o prurido associado ao PGC.21
A intensidade do prurido também está intimamente relacionada à expressão dérmica de IL‐31RA e OSMRβ (receptor beta da oncostatina M).21 A maior população de células dérmicas IL‐31RA+ são macrófagos e mastócitos. As células dérmicas OSMRβ+ são principalmente macrófagos, enquanto os mastócitos mal expressavam OSMRβ. Isso indica que os macrófagos podem responder à IL‐31, mas os mastócitos não. A maioria das células infiltradas nas lesões de PGC consiste em macrófagos, células T e mastócitos. Considera‐se que essas células causam inflamação e prurido na pele ao secretar citocinas/quimiocinas e pruritogênios (incluindo IL‐31) e, para macrófagos, parcialmente em resposta à sinalização de IL‐31 envolvendo IL‐31RA e OSMRβ.21
A OSM atua nos fibroblastos dérmicos para liberar a proteína quimioatrativa de monócitos 1 (MCP‐1), o que pode levar à infiltração de monócitos/macrófagos com capacidade de liberar IL‐31. Essas funções da OSM podem estar envolvidas na patogênese do PGC e contribuir para sua associação com o prurido. Relata‐se que os queratinócitos epidérmicos medeiam o prurido induzido pela IL‐31 pela secreção de estimuladores pruritogênicos quando estimulados pela IL‐31 por meio de seu complexo receptor. A menor expressão de OSMRβ epidérmico pode estar relacionada à redução de FNIPD, pois a insuficiência de OSMRβ poderia levar à apoptose das fibras nervosas epidérmicas.21
O meio dérmico complexo de células imunes/citocinas/rede receptora incluindo IL‐31, OSM, IL‐31RA e OSMRβ pode desempenhar papel importante na patogênese do prurido no PGC.21,22 No entanto, em contraste com a DA, a ativação de macrófagos M1/M2, produção de fator de necrose tumoral, fibrose dérmica, revascularização e desregulação neural são características únicas do PGC atópico.23
Uma imunopolarização sistêmica e cutânea Th22 do PGC leva a outros participantes a interagirem em sua patogênese, bem como a hiperplasia neuronal dérmica proeminente, na qual a neurite expressa CGRP e substância P.21 A IL‐4 induz a proliferação e migração de fibroblastos e estimula a produção de proteínas da matriz extracelular. A sinalização hiperativa de IL‐4 e IL‐13 tem sido implicada na patogênese de doenças fibróticas da pele. IL‐4 e IL‐13 regulam positivamente a atividade do promotor e a transcrição de genes pró‐fibróticos, como colágeno tipo I e TGF‐β. O aumento da periostina dérmica e a diminuição da periostina epidérmica também foram encontrados em pacientes com PGC em comparação com controles saudáveis.24
Além disso, há alguma relevância na participação do microbioma em pacientes com PGC, especialmente o papel de S. aureus.25,26 Além disso, a linfopoietina estromal tímica (TSLP) induz a hiperplasia da pele ativando células imunes, promovendo a proliferação de queratinócitos (diretamente), interrompendo a diferenciação de queratinócitos e aumentando a expressão de mediadores pró‐inflamatórios, contribuindo para o fenômeno da hiperplasia.27
A IL‐22 está envolvida em várias condições inflamatórias crônicas, como doença arterial coronariana e diabetes tipo II (DM2), ambas comorbidades altamente associadas em pacientes com PGC.23 Na epiderme, níveis elevados de IL‐22 promovem hiperplasia de queratinócitos e acantose, além de atuar sinergicamente com a IL‐17, que promove hiperplasia de queratinócitos e diferenciação epidérmica prejudicada no PGC.23
Observa‐se aumento da expressão de IL‐31 em europeus quando comparados a afro‐americanos; no entanto, a regulação positiva de citocinas relacionadas a Th22 no PGC pode ser independente da etnia.23 Em contraste, observou‐se aumento da expressão de citocinas Th2, incluindo IL‐4, IL‐5 e IL‐13, bem como maior ativação de Th2 entre os europeus, mas não entre os afro‐americanos.23 Esse perfil de citocinas pode ser a chave para respostas bem‐sucedidas ao tratamento com medicamentos específicos, como o dupilumabe, que pode ser mais eficaz em certos endotipos de pacientes com PGC com atopia associada, envolvendo IL‐4Rα, e/ou nemolizumabe em pacientes descendentes de europeus. Já o receptor de IL‐31 é composto de receptor alfa de IL‐31 (IL‐31RA) e receptor beta de oncostatina M (OSMRβ), que são dependentes de JAK1/2,24 e indicam uma janela de oportunidade para fármacos seletivos da JAK1, como o abrocitinibe e o upadacitinibe, no tratamento do PGC.28
Diagnóstico do prurigo crônico e sua avaliaçãoO diagnóstico do PGC é feito clinicamente com base na história clínica, exame clínico, histopatológico, laboratorial e radiológico, que auxiliam na confirmação do diagnóstico e determinam a gravidade do PGC, a doença subjacente e um plano de tratamento individual.16
A anamnese de pacientes com PGC deve envolver várias questões objetivas.16 O exame físico geral, dermatológico sugerido para o PGC, exames laboratoriais e de imagem complementares recomendados pela diretriz IFSI no PGC,16 com adaptações, com base na prática clínica, estão listados na tabela 4.
Proposta de exames dermatológico e laboratoriais para pacientes com prurigo crônico16
| I. EXAME FÍSICO: |
| 1. Exame dermatológico: |
| ‐ Distribuição clínica das lesões pruriginosas (p. ex., localizadas/generalizadas; simétricas/assimétricas) |
| ‐ Morfologia dermatológica das lesões pruriginosas; |
| ‐ Número de regiões do corpo afetadas; número de lesões pruriginosas/com escoriações no topo |
| ‐ Sinal da borboleta (área poupada de lesões ou escoriações no dorso, onde as mãos do paciente não alcançam) |
| 2. Métodos objetivos: |
| ‐ Medida das lesões pruriginosas (com régua ou outro equipamento); |
| ‐ Monitoramento de lesão alvo quando for possível (clinicamente ou por fotos); |
| ‐ Documentação fotográfica; |
| ‐ Escores: IGAa, para o estadiamento do prurigo crônico |
| 3. Exame físico geral: |
| ‐ Palpação abdominal, avaliação de linfadenopatias, avaliação da força muscular, ausculta (pulmão, coração, abdome) |
| ‐ Exame neurológico simples; |
| ‐ Exame dermatológico: presença de doenças de pele concomitantes, xerose, inspeção das mucosas; |
| ‐ Dermatoscopia das lesões pruriginosas (em busca de ectoparasitas como o Sarcoptes scabiei); |
| ‐ Pesquisa de dermografismo; pesquisa do sinal de Nikolsky; pesquisa do sinal de Darier. |
| II. BIOPSIAS DE PELE/FLUIDOS /SANGUE: |
| 1. Biopsias de pele |
| 2. Fluidos/cultura microbiológica se sinais de infecção |
| 3. Avaliação microscópica direta: pesquisa de Sarcoptes scabiei |
| ‐ Imunofluorescência direta e indireta (se há suspeição de condições autoimunes como penfigoide bolhoso, dermatite herpetiforme, dermatose por IgA linear, pênfigo paraneoplásico etc.) |
| ‐ Histopatologia (coloração com hematoxilina & eosina ou colorações histoquímicas para depósito de substância amiloide, mucina, e outras desordens cutâneas de depósito) |
| III. EXAMES DIAGNÓSTICOS COMPLEMENTARES |
| 1. Evitar procedimentos diagnósticos invasivos, se desnecessários, para: |
| ‐ PGC com prurido de leve intensidade ou pequena extensão; |
| ‐ PGC de origem não dermatológica; |
| ‐ Pacientes idosos ou pediátricos e frágeis. |
| 2. Grupos de pacientes nos quais estudos de imagem e laboratório são recomendados: |
| ‐ Dependendo da história familiar |
| ‐ Dependendo do histórico médico (p. ex., presença de escarro com sangue, mudança do perfil de tosse) |
| ‐ Em todos os pacientes com PGC, descartar doenças subjacentes |
| ‐ Em todos os pacientes com PGC cuja doença tem duração de, pelo menos, um ano |
| ‐ Em pacientes com PGC que relatam sudorese noturna ou perda ponderal |
| ‐ Em pacientes com PGC de origem indeterminada |
| ‐ Em pacientes com PGC com prurido desproporcional |
| ‐ Quando os pacientes demandam realizar exames laboratoriais |
| 3. Exames laboratoriais regularmente realizados: |
| ‐ Hemograma; eletrólitos, VHS, PCR, glicemia de jejum, hemoglobina glicada (HbA1c), ferro, ferritina, LDH, TSH |
| ‐ IgE sérica total, IgE específica (se alergia respiratória ou ocular forem suspeitas) |
| ‐ Parâmetros de retenção renal (p. ex., potássio, creatinina, ureia, taxa de filtração glomerular) |
| ‐ Enzimas hepáticas (p. ex., gama‐GT, TGO, TGP, fosfatase alcalina, bilirrubinas) |
| 4. Exames laboratoriais – com base nos achados patológicos ou história médica: |
| ‐ Eletroforese de proteínas séricas e urinárias, imunofixação (maior sensibilidade se gamopatia monoclonal for suspeita) |
| ‐ Imunofenotipagem por citometria de fluxo para neoplasias hematológicas no sangue periféricob |
| ‐ Triptase sérica (se houver suspeita de mastocitose sistêmica) |
| ‐ Diagnóstico de tiroidopatia em situações especiais (p. ex., paratormônio, fosfato, Ca2+, fT3, fT4). |
| ‐ Vitamina B12, ácido fólico (se anemia estiver presente). |
| 5. Exames de imagem, se a anamnese e o exame físico forem sugestivos de neoplasia ou doenças sistêmicas: |
| ‐ Tomografia computadorizada (TC) de crânio, tórax e abdome; endoscopia digestiva, conoloscopia |
A imunofenotipagem por citometria de fluxo está indicada nas seguintes situações clínicas: citopenia, especialmente bicitopenia e pancitopenia; contagem elevada de leucócitos, incluindo linfocitose, monocitose e eosinofilia; presença de células atípicas ou blastos na periferia sangue, medula óssea ou fluidos corporais; plasmocitose ou gamopatia monoclonal; e organomegalia e massas teciduais.21
Em pacientes japoneses, além do PGC/prurigo nodular (Hyde), é referido o prurigo crônico multiforme (PCM), descrito pela primeira vez por Lutz em 1957, como uma desordem cutânea crônica, intensamente pruriginosa, que acomete principalmente indivíduos idosos.29
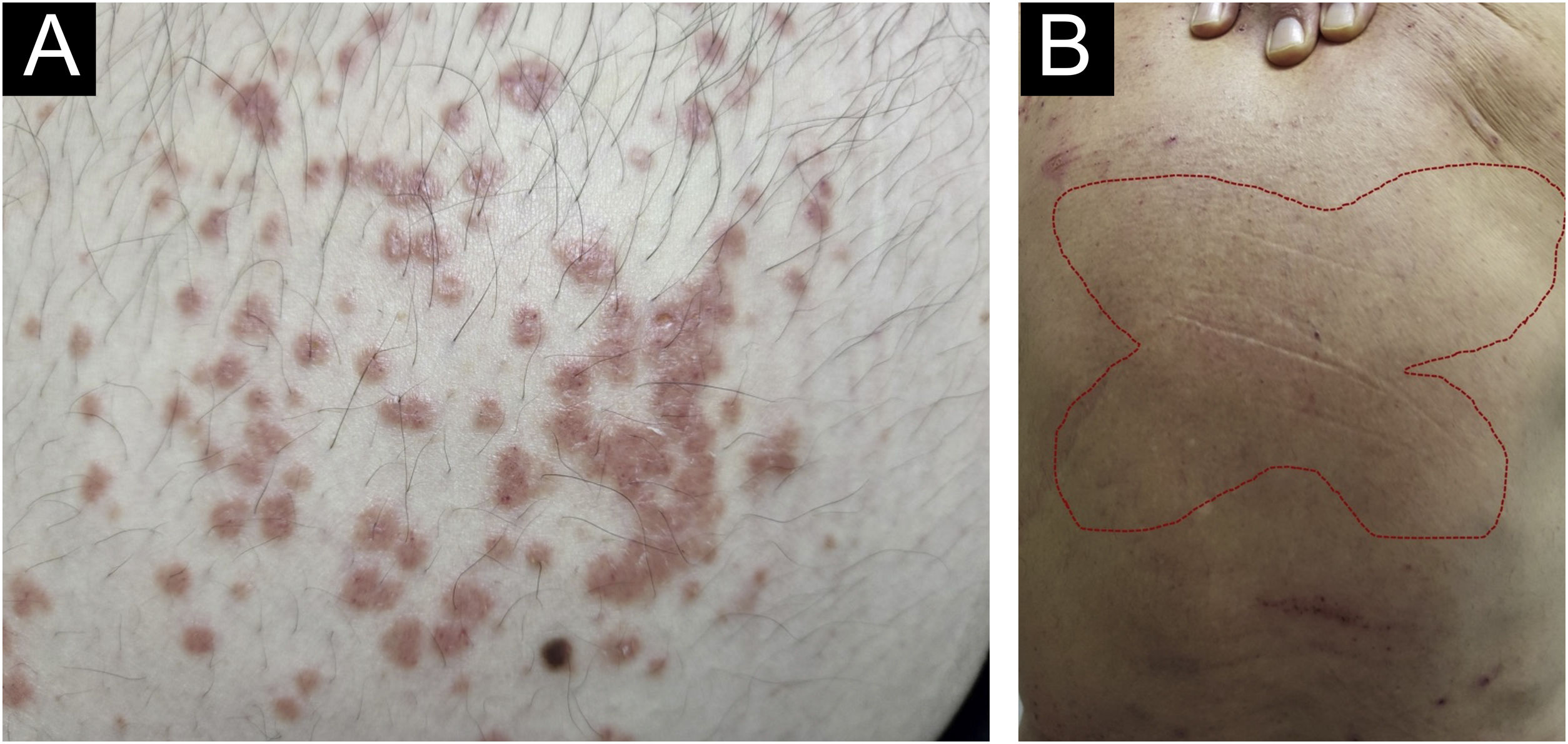
Sempre houve confusão na sinonímia e classificação das lesões pruriginosas, e Greither incluiu o PCM como variante do prurigo subagudo apresentando um traço de neurodermatite.20,30 A morfologia característica, o local de predileção, a idade e os achados histopatológicos do PCM indicam que se trata de dermatose distinta e não de variante do prurigo simples subagudo ou crônico (fig. 3).29 O “sinal da borboleta” é um exemplo de “fenômeno poupador” que denota uma área de pele normal ou relativamente hipopigmentada toracolombar que é poupada da coçadura em virtude de sua inacessibilidade (fig. 3), em pacientes com prurido generalizado decorrente de muitos distúrbios, como doença hepatobiliar, dermatite atópica e PGC.31
Fujii et al.29 coletaram mais de 30 casos de PCM de 1997 a 2000, seguindo os seguintes critérios: i) a lesão primária começa como lesão intensamente pruriginosa, papular solitária ou pruriginosa que se desenvolve na lateral do tórax, região lombar, nádegas e superfícies extensoras das coxas; ii) a parte superior das costas, ombros, superfícies extensoras das extremidades superiores, abdome inferior, tórax anterior e panturrilhas também podem ser afetadas; iii) as lesões papulares pruriginosas primárias frequentemente se expandem ou coalescem para formar uma placa eritematosa infiltrada; iv) a natureza coalescente da erupção primária diferencia o PCM do PGC usual ou do prurigo subagudo; v) o prurido intenso muitas vezes causa áreas focais de eczema agudo sobre e ao redor das lesões em placa, mas componentes seropapulares e/ou descamativos nunca dominam as manifestações cutâneas; vi) uma lesão tipo placa infiltrada se estende além do confinamento da área cutânea, que é clinicamente diferente da liquenificação do eczema crônico ou da neurodermatite; vii) no exame histopatológico, tanto as lesões papulares pruriginosas primárias quanto as lesões em placa mostram graus moderados de infiltração perivascular de células mononucleares contendo populações variadas de eosinófilos na derme reticular e papilar superior; viii) ao contrário das lesões primárias de prurigo simples subagudo, a epiderme nem sempre apresenta espongiose com exocitose, sugerindo que a espongiose epidérmica não deva ser a principal alteração patológica da doença.29
Então, essa variante singular de PGC é caracterizada por pápulas pruriginosas urticariformes ou sólidas, que às vezes se juntam para formar placas liquenificadas; as lesões estão espalhadas pelo tronco e extremidades, e cada erupção dura várias semanas (fig. 3).32 O PCM ocorre mais frequentemente em homens e em pacientes com idade mais avançada, ao contrário do PGC, que ocorre mais em mulheres e pacientes de meia‐idade, no Japão.32
Inui et al.32 estudaram 168 casos de prurigo crônico no Japão (103 com PGC e 65 com PCM) e demonstraram que tanto no PGC quanto no PCM, os níveis séricos de IgE tendiam a ser elevados (> 256 UI/mL), sugerindo o envolvimento das respostas imunes Th2 no prurigo crônico. Esses autores descobriram que os níveis séricos de TARC/CCL17 e o número de eosinófilos no sangue eram maiores no PCM do que no PGC. Além disso, a distribuição de eosinófilos também era distinta no PGC e no PCM, mas sua densidade foi comparável em ambos os grupos. Esses achados sugerem que o aumento dos níveis de eosinófilos no sangue periférico e o recrutamento dessas células para áreas com colágeno na derme podem ser importantes para a patogênese do PCM.32
O PCM é frequentemente resistente ao tratamento com uma combinação de esteroides tópicos e anti‐histamínicos, particularmente quando a lesão cutânea está se expandindo ativamente.32
Todas as formas de PGC apresentam a marca registrada de prurido intenso e lesões secundárias ao ato de coçar.10 Embora o PGC seja entidade clínica específica, também pode ser secundário a várias condições subjacentes.33 O PGC tem impacto significante na qualidade de vida,11 maior do que outras condições de pele em que o prurido é uma característica marcante, como psoríase ou DA.14 A ansiedade ocorre em 37% dos pacientes, a depressão em 29% e a ideação suicida em 19%.13,14
Especialistas do European Prurigo Project publicaram um consenso em 2018 para propor definições, classificações e terminologia.4,13 O artigo afirma que o PGC é “uma doença distinta definida pela presença de prurido crônico e múltiplas lesões pruriginosas localizadas ou generalizadas”. A sensibilização à coceira e o desenvolvimento de um ciclo prurido‐coçadura podem ser de origem dermatológica, sistêmica, neurológica e psiquiátrica/psicossomática, multifatorial ou indeterminada”.4,13
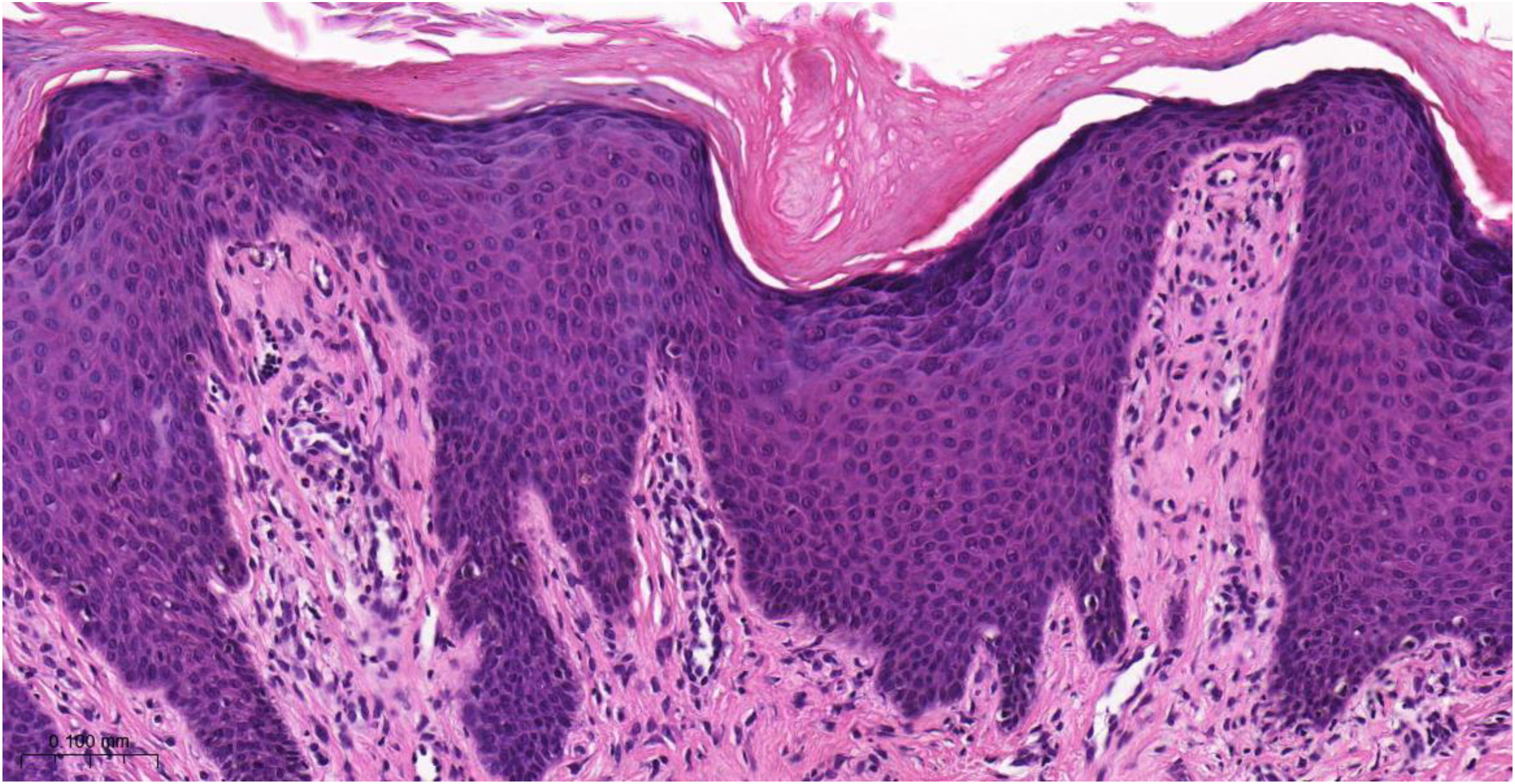
Histopatologia do prurigo crônicoO exame histopatológico das lesões cutâneas nodulares do PGC sob microscopia óptica pode variar dependendo do estágio e gravidade da lesão e da resposta individual do paciente ao ato de coçar e à irritação crônica. Hiperceratose, escoriação, acantose (às vezes psoriasiforme), espongiose leve, fibrose dérmica e infiltrado perivascular leve (linfócitos e eosinófilos escassos) são a base da doença (fig. 4).
Exame histopatológico de paciente portador de prurigo crônico mostrando hiperceratose com paraceratose esparsa, acantose irregular, espongiose discreta, proeminência vascular nas papilas dérmicas, fibroplasia da derme superficial e infiltrado inflamatório linfocitário preferencialmente perivascular (Hematoxilina & eosina, 400×).
Um aumento da densidade de fibras nervosas dérmicas e alterações em muitos tipos de células da pele, incluindo mastócitos, células de Merkel, queratinócitos epidérmicos, células dendríticas, células endoteliais e fibras de colágeno também são relatados.34 Essas células causam inflamação e prurido por meio da liberação de triptase, IL‐31, prostaglandinas, proteína catiônica eosinófila, histamina e outros mediadores como neuropeptídeos, incluindo substância P, peptídeo relacionado ao gene da calcitonina (CGRP) e fator de crescimento.34,35
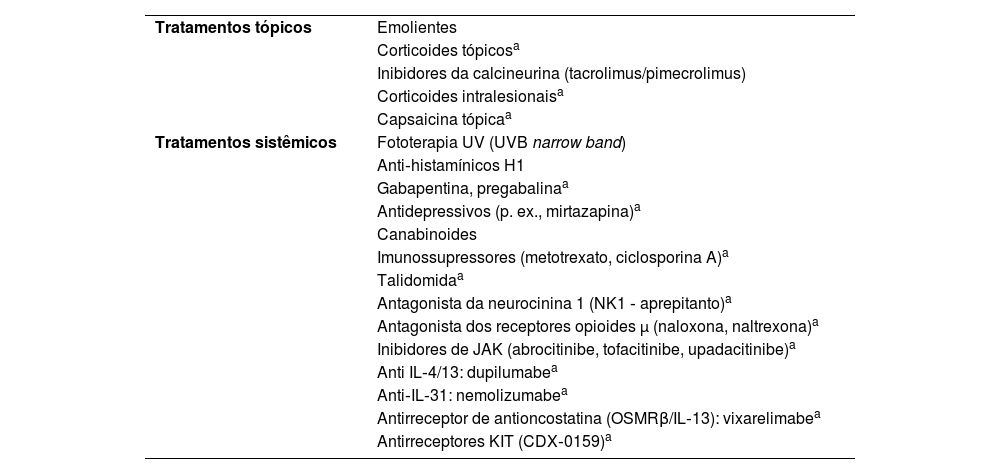
Tratamento do prurigo crônicoO tratamento dos prurigos pode ser desafiador pela história recorrente das lesões, em virtude de doenças subjacentes (p. ex., DA, uremia) ou por limitação do uso de medicamentos sistêmicos em pacientes suscetíveis a efeitos adversos (p. ex., idosos). A tabela 5 lista uma série de abordagens, farmacológicas ou não, referidas na literatura para o tratamento de lesões prurigoides; entretanto, somente a correta classificação diagnóstica, identificação de condições subjacentes, investigada criteriosamente (tabela 4) pode levar ao maior sucesso terapêutico dos casos.
Tratamentos indicados no prurigo
| Tratamentos tópicos | Emolientes |
| Corticoides tópicosa | |
| Inibidores da calcineurina (tacrolimus/pimecrolimus) | |
| Corticoides intralesionaisa | |
| Capsaicina tópicaa | |
| Tratamentos sistêmicos | Fototerapia UV (UVB narrow band) |
| Anti‐histamínicos H1 | |
| Gabapentina, pregabalinaa | |
| Antidepressivos (p. ex., mirtazapina)a | |
| Canabinoides | |
| Imunossupressores (metotrexato, ciclosporina A)a | |
| Talidomidaa | |
| Antagonista da neurocinina 1 (NK1 ‐ aprepitanto)a | |
| Antagonista dos receptores opioides μ (naloxona, naltrexona)a | |
| Inibidores de JAK (abrocitinibe, tofacitinibe, upadacitinibe)a | |
| Anti IL‐4/13: dupilumabea | |
| Anti‐IL‐31: nemolizumabea | |
| Antirreceptor de antioncostatina (OSMRβ/IL‐13): vixarelimabea | |
| Antirreceptores KIT (CDX‐0159)a |
De modo geral, a prescrição de emolientes, antipruriginosos tópicos, corticosteroides tópicos, inibidores de calcineurina e anti‐histamínicos não sedantes são pouco eficientes no PGC, enquanto anti‐histamínicos sedantes podem levar a efeitos adversos, especialmente em pacientes que demandem atenção profissional (p. ex., motoristas) ou idosos, que acumulam efeitos anticolinérgicos. Ademais, a patogênese do PGC é complexa, e a histamina não está entre as principais mediadoras envolvidas.
Usualmente, o tratamento do PGC depende de medicamentos sistêmicos como os corticosteroides, ciclosporina, micofenolato de mofetila, azatioprina, talidomida e neuromoduladores (p. ex., gabapentina ou pregabalina), além de fototerapia (especialmente narrow‐band UVB). Mas a demanda pelo uso prolongado dessas opções maximiza efeitos adversos.
O dupilumabe é um anticorpo monoclonal humano IgG4 (mAb) que se liga a IL‐4Ra e inibe a sinalização de IL‐4R induzida por IL‐4 e IL‐13, e regula negativamente a inflamação TH2 na DA e em outras doenças inflamatórias e atópicas.17 O dupiluma apresenta efeito antipruriginoso em pacientes com PGC. Dois estudos recentes de fase 3 também demonstraram que o tratamento com dupilumabe reduziu o prurido e as lesões cutâneas em pacientes com PGC; no Brasil, a indicação “prurigo nodular” foi incorporada à bula do medicamento.36
A terapia com dupilumabe reduziu a assinatura de mais de 800 genes afetados na DA.37 Dupilumabe diminui a expressão de mRNA de genes relacionados à hiperplasia epidérmica (K16 e MKI67), células T e células dendríticas (CD1b e CD1c), e uma inibição potente de quimiocinas associadas à via TH2 (CCL17, CCL18, CCL22 e CCL26) foi observada sem modulação significante de genes associados à via TH1 (IFNG).37 Essas ações podem explicar a boa resposta do dupilumabe no tratamento do PGC (fig. 5).
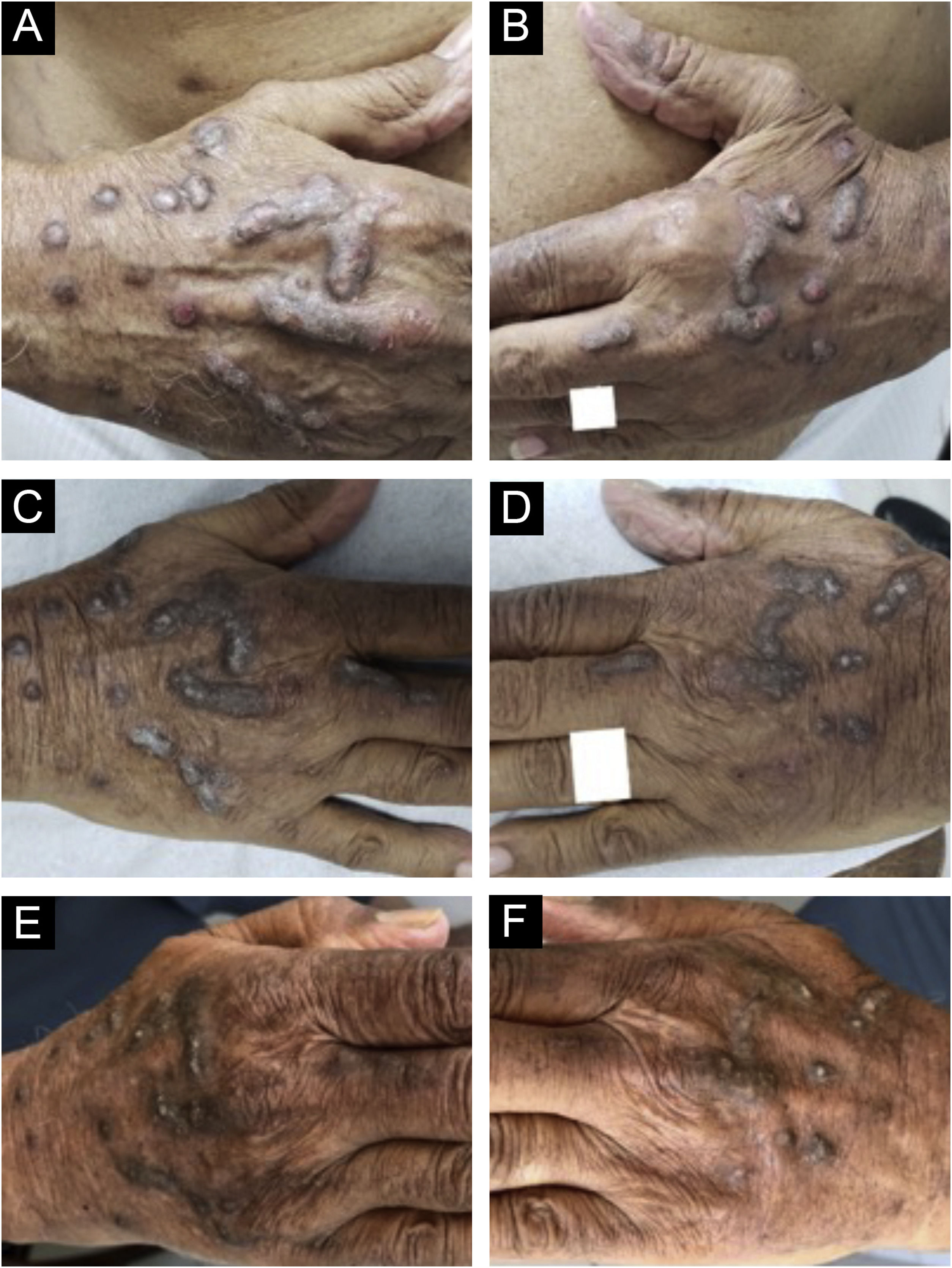
Evolução das lesões prurigo nodular crônico em homem de 87 anos antes (2019) e após tratamento com dupilumabe. A evolução sequencial dos nódulos hiperceratóticos infiltrados e escoriados isolados ou confluentes nas mãos do paciente. Aspecto direito (A) e aspecto esquerdo (B) na consulta inicial (observar erosões e escoriações sobre nódulos). (C e D) Menos lesões escoriadas ao final do primeiro mês de tratamento com dupilumabe. (E e F) Após quatro meses de monoterapia com dupilumabe, quando os nódulos infiltrados e hiperceratóticos apresentaram regressão expressiva e não foram observadas erosões ou escoriações. Após três anos de acompanhamento do tratamento com dupilumabe (2019‐2022), o paciente completou 91 anos, em uso de 300mg uma vez ao mês, e negou prurido; sua Escala Visual Analógica de prurido foi constantemente 0 nos últimos dois anos.
As lesões cutâneas da DA crônica incluem aumento da infiltração por células T, células dendríticas (DCs) e eosinófilos,17 semelhante ao encontrado nas lesões de PGC. Embora a DA tenha sido classificada como doença dominada por TH2, outros subconjuntos de células T (células TH22, TH17 e TH1) também podem contribuir para a patogênese. Como mencionado, alguns autores encontraram no PGC um upregulation de mRNA da IL‐31.35 A ligação da IL‐31 aos seus receptores ativa vias de sinalização poderosas (ou seja, a ativação de JAK1 e JAK2 e o início da via JAK‐STAT). Assim, a IL‐31 foi considerada um novo participante na inflamação do tipo 2.
Essa teoria foi corroborada pela descoberta de que as células Th2 são uma das principais produtoras de IL‐31, havendo uma correlação positiva entre IL‐31 e a gravidade da DA. Além disso, níveis elevados de IL‐31 contribuem para sintomas específicos como prurido, lesões cutâneas e irritação/inflamação localizada da DA17 e eixos de endotelina na pele lesional e perilesional no PGC. Zhong et al. observaram maior expressão do mRNA da IL‐31 nas lesões de cinco pacientes atópicos do que em seis pacientes não atópicos. Esses resultados sugerem papel muito mais importante da IL‐31 em pacientes com PGC atópico versus não atópico.38
O PGC é doença órfã, com altas taxas associadas a ansiedade, depressão e alto impacto na qualidade de vida. O prurido crônico também prejudica negativamente o sono e a qualidade de vida.39 Zhai et al., em um estudo retrospectivo envolvendo 20 pacientes com prurido recalcitrante crônico (nove com PGC; cinco com prurido urêmico; quatro com prurido idiopático crônico; um com líquen plano e um com dermatose eosinofílica relacionada a malignidade hematológica), demonstraram o uso off‐label do dupilumabe e desfecho bem‐sucedido, reduzindo o prurido em todos os pacientes, levando à resolução completa em 12/20 pacientes e média geral da intensidade de prurido na escala de classificação numérica (NRSi) de 7,55.40 Em idosos, o dupilumabe foi bem tolerado sem grandes efeitos adversos.41
Entre 90 pacientes adultos com DA tratados com dupilumabe41 em dois hospitais universitários italianos, 10,0% apresentavam PGC generalizado e eram afetados por uma ou mais comorbidades atópicas (rinite alérgica, asma e conjuntivite alérgica). O nível sérico de IgE estava acima do normal em todos os pacientes. Os nove pacientes de PGC foram tratados com dupilumabe com o regime de dosagem padrão. Após 16 semanas de tratamento, todos os pacientes apresentaram melhora clínica acentuada. Nenhum paciente abandonou o tratamento.41
A abordagem terapêutica para o PGC também é baseada em casuística e experiência clínica: corticosteroides, fototerapia, imunomoduladores tópicos (inibidores tópicos de calcineurina) e imunossupressores (ciclosporina, azatioprina, micofenolato de mofetila e metotrexato),42 neuromoduladores, talidomida que, no entanto, têm efeitos colaterais indesejáveis potenciais significantes, especialmente em pacientes idosos. Agentes sistêmicos são frequentemente necessários, incluindo corticoides intralesionais, agentes antipruriginosos como anti‐histamínicos orais, neuromoduladores como gabapentina e pregabalina, além de fototerapia.43–45Em casos mais graves, os agentes imunossupressores têm sido usados com sucesso variável e apresentam diversos efeitos colaterais indesejáveis.43,44 Outro aspecto do uso de imunossupressores sistêmicos em países tropicais são as doenças infecciosas endêmicas, como as parasitoses gastrintestinais (a profilaxia da estrongiloidíase é obrigatória), e o risco de pacientes idosos desenvolverem doenças infecciosas endêmicas graves comodengue, Zika e Chikungunya46 ou novos vírus epidêmicos, como o COVID‐19.47
De modo geral, uma abordagem racional para o tratamento do PGC pode ser feita levando em consideração cinco passos. O primeiro é utilizar corticoides tópicos, inibidores de calcineurina (tacrolimus e pimecrolimus) e fototerapia ultravioleta (narrowband 311nm, Excimer laser e PUVA terapia). O segundo passo compreende o uso da capsaicina tópica na concentração que varia de 0,025% a 0,3% de 4 a 6×/dia, além do uso oral de gabapentina 300‐900mg/dia até 3×/dia ou pregabalina 150‐600mg/dia dividida em 2‐3 doses. O terceiro passo consiste no uso de antidepressivos, como a paroxetina 20‐50mg/dia ou a mirtazapina 15mg/dia. O quarto passo, para casos em que o controle tópico e com antidepressivos e/ou gabapentinoides não obtiveram melhora, é o uso de imunossupressores como a ciclosporina e o metotrexato. Para casos mais refratários, o quinto passo incluiria também o uso de antagonistas dos receptores opioides μ, como a naltrexona; antagonistas dos receptores da neuroquinina 1.48 Como em metade dos casos de PGC, a DA está associada, há uma concordância dos tratamentos entre essas duas entidades, inclusive com o uso de biológicos como o dupilumabe e o nemolizumabe, e pequenas moléculas, como os inibidores de JAK, como upadacitinibe, baricitinibe, tofacitinibe abrocitinibe.49
O dupilumabe é bem tolerado em crianças, adultos e idosos, com poucos eventos adversos graves, que incluem nasofaringite, cefaleia, conjuntivite e reações no local da injeção, rubor alcoólico em um caso, eritema cutâneo transitório e descamação, reações locais no local, infecções por herpes simples e alopecia.50 Atenção especial deve ser dada à prescrição de dupilumabe em pacientes com linfoma cutâneo de células T (micose fungoide), em virtude do risco de evolução desfavorável da doença de base.51
Novos fármacos emergentes surgem como opções promissoras, como o nemolizumabe, um anticorpo humanizado contra o receptor IL‐31 α (IL‐31Rα). A IL‐31 é uma citocina pró‐inflamatória elevada em várias dermatoses pruriginosas crônicas, e o bloqueio de seu receptor recentemente mostrou redução do escore de prurido em pacientes com PGC, melhora na qualidade de vida e do sono, em comparação com o placebo em um estudo duplo‐cego randomizado de 12 semanas.52 Os eventos adversos relatados nesse estudo foram leves e incomuns, principalmente diarreia, dor abdominal e sintomas musculoesqueléticos. Outro estudo avaliou o transcriptoma de pacientes com PGC após a terapia com nemolizumabe, mostrando fatores inflamatórios a jusante, após 12 semanas de tratamento, bem como alterações no transcriptoma.53 Em decorrência dessas evidências, o FDA considerou recentemente o nemolizumabe uma “terapia inovadora” para pacientes com PGC. Mais estudos são necessários para garantir a eficácia e segurança do inibidor de IL‐31Rα em pacientes com PGC e, nesse momento, existem quatro ensaios clínicos em andamento.54–57Outros biológicos e pequenas moléculas estão atualmente sendo investigados, como os inibidores de IL‐4 e IL‐13, antirreceptores OSMβ, inibidores do receptor de tirosina quinase KIT e inibidores da JAK.58–61 O traloquinumabe, um inibidor de IL‐13, mostrou melhora, em um estudo aberto, em pacientes atópicos com PGC.61
Os inibidores de JAK surgiram mais recentemente como opção para o PGC recalcitrante, inibindo a via JAK‐STAT, bloqueando a transcrição de IL‐4 e IL‐31, aumentando a densidade das fibras nervosas epidérmicas e reduzindo o prurido (fig. 6). A via JAK‐STAT regula positivamente numerosas citocinas e células CD4 e já foi reconhecida pela patogênese em outras condições cutâneas inflamatórias, como DA.62,63 Relatos de casos da eficácia do tofacitinibe, um inibidor não seletivo de JAK1 e JAK3, foram descritos.64 O tofacitinibe tópico a 2% também demonstrou redução substancial no prurido em dois pacientes com PGC.65 O abrocitinibe, um inibidor de JAK1 estudado pela primeira vez na DA, está atualmente sendo estudado para PGC em ensaios clínicos.66 Um estudo recente comparou 36 e 13 pacientes (com ou sem DA) em uso de dupilumabe e inibidores orais de JAK (baricitinibe e upadacitinibe), respectivamente. Ambos os grupos obtiveram respostas semelhantes em relação ao prurido (WI‐NRS), enquanto os escores IGA PN‐S de 0 ou 1 foram alcançados por 40,0% dos pacientes com dupilumabe e 25,0% dos inibidores de JAK.67
Resposta do prurigo nodular ao upadacitinibe. (A) Mulher com lesões eczematosas da dermatite atópica clássica nas dobras antecubitais e nódulos do prurigo nodular nos braços e membros inferiores (C). (B e D) Após 12 semanas de tratamento com upadacitinibe 30mg/dia, houve melhora importante das lesões eczematosas, do prurido e, consequentemente, do prurigo.
O melhor conhecimento da patogênese, associado à disponibilidade de uma gama de novos tratamentos, deve modificar a história da doença e o panorama dos pacientes com PGC.
ConclusõesDiversas entidades se manifestam clinicamente como lesões prurigoides, e o correto diagnóstico clínico deve preceder o tratamento intempestivo. Além disso, os PGC representam dermatose recalcitrante e angustiante, e pelo menos 50% desses pacientes apresentam diátese atópica, cujos tratamentos podem induzir efeitos adversos, especialmente em idosos. Há importante comprometimento da qualidade de vida, e, muitas vezes, tratamentos tópicos não são capazes de controlar os sintomas e as lesões cutâneas. Imunossupressores sistêmicos, imunobiológicos e inibidores de JAK, apesar do custo e potenciais efeitos adversos, podem ser necessários para o controle do PGC e oferecer melhoria clínica e na qualidade de vida para esses pacientes.
Suporte financeiroNenhum.
Contribuição dos autoresPaulo Ricardo Criado: Idealização do estudo, escrita e aprovação do texto final.
Roberta Fachini Jardim Criado: Idealização do estudo, escrita e aprovação do texto final.
Mayra Ianhez: Idealização do estudo, escrita e aprovação do texto final.
Juliana Nakano: Idealização do estudo, escrita e aprovação do texto final.
Daniel Lorenzini: Idealização do estudo, escrita e aprovação do texto final.
Hélio Amante Miot: Idealização do estudo, escrita e aprovação do texto final.
Conflito de interessesPaulo Criado: Advisory board – Pfizer, Galderma, Takeda, Hypera, Novartis, Sanofi; Pesquisa clínica – Pfizer, Novartis, Sanofi, Amgen e Lilly; Palestrantre – Pfizer, Abbvie, Sanofi‐Genzyme, Hypera, Takeda, Novartis.
Roberta Fachini Jardim Criado: Advisory board – Pfizer, Takeda, Hypera, Novartis, Sanofi; Pesquisa clínica – Pfizer, Novartis, Sanofi e Lilly; Palestrantre – Pfizer, Abbvie, Sanofi‐Genzyme, Hypera, Takeda, Novartis.
Mayra Ianhez: Advisory Board – Galderma, Sanofi, Pfizer, Novartis, Abbvie, Janssen, UCB‐Biopharma, Boehringer‐Ingelheim; Palestrante – Galderma, Sanofi, Pfizer, Theraskin, Novartis, Abbvie, Janssen, Leopharma, FQM.
Juliana Nakano: Advisory Board – Novartis, Abbvie, Janssen, Boehringer‐Ingelheim; Palestrante – Sanofi, LeoPharma, Lilly, Novartis, Abbvie, Janssen, Boehringer‐Ingelheim.
Daniel Lorenzini: Advisory Board – Abbvie, Sanofi, Galderma; Palestrante – Sanofi, Abbvie, Pfizer, Lilly, Leopharma.
Hélio Miot: Advisory Board – Johnson & Johnson, L’Oréal, Theraskin, Sanofi e Pfizer; Pesquisa clínica – Abbvie, Galderma e Merz.
Como citar este artigo: Criado PR, Ianhez M, Criado RFJ, Nakano J, Lorenzini D, Miot HA. Prurigo: review of its pathogenesis, diagnosis, and treatment. An Bras Dermatol. 2024;99:706–20.
Trabalho realizado no Centro Universitário Faculdade de Medicina do ABC, Santo André, SP, Brasil.