A dermatite atópica (DA) é doença inflamatória crônica cutânea comum, que requer tratamentos seguros e eficazes em longo prazo. Os tratamentos clássicos tinham eficácia limitada e efeitos adversos significantes, mas o crescente conhecimento da fisiopatologia permitiu o desenvolvimento de novas terapias‐alvo que mudaram o paradigma.1 Surgiram duas classes principais: os produtos biológicos, que incluem anticorpos monoclonais anti‐IL‐4Ra (dupilumabe) e anti‐IL‐13 (traloquinumabe) e inibidores de JAK (iJAK).2 Ambos os grupos demonstraram eficácia e segurança sustentadas na DA moderada a grave, mas não há estudos comparativos, e os dados sobre pacientes que receberam terapias‐alvo anteriores são limitados.2–4 Os autores relatam três casos de DA grave, com EASI basal médio de 35,9 (25,8‐42,9), com idade entre 24 e 32 anos, refratários a múltiplas terapias clássicas, dupilumabe e, em um caso, também baricitinibe, tratados com sucesso com traloquinumabe. Os Casos 1 e 3 não conseguiram atingir EASI‐75 após seis meses sob dupilumabe (300mg, quinzenalmente). A mudança para baricitinibe, única alternativa aprovada na época, foi feita no Caso 3, sem resposta satisfatória. No Caso 1, fatores de risco cardiovascular e tuberculose latente contraindicaram o baricitinibe, e então uma dosagem semanal de dupilumabe foi tentada, sem sucesso. No Caso 2, foi alcançada resposta rápida após apenas três meses (EASI‐85), mas houve falha secundária aos nove meses. Em seguida, mudou‐se para traloquinumabe (300mg, quinzenalmente) em todos os pacientes, no âmbito de um programa nacional de acesso precoce. Foi observada melhora global nos sintomas e na qualidade de vida em todos os pacientes e EASI‐90 foi alcançado em seis meses. O Caso 2 apresentou resposta precoce, atingindo EASI‐95 em 12 semanas (figs. 1‐3). Todos os pacientes ainda estão em tratamento, com seguimento médio de 57 semanas. Nenhum efeito adverso, incluindo conjuntivite, foi relatado.
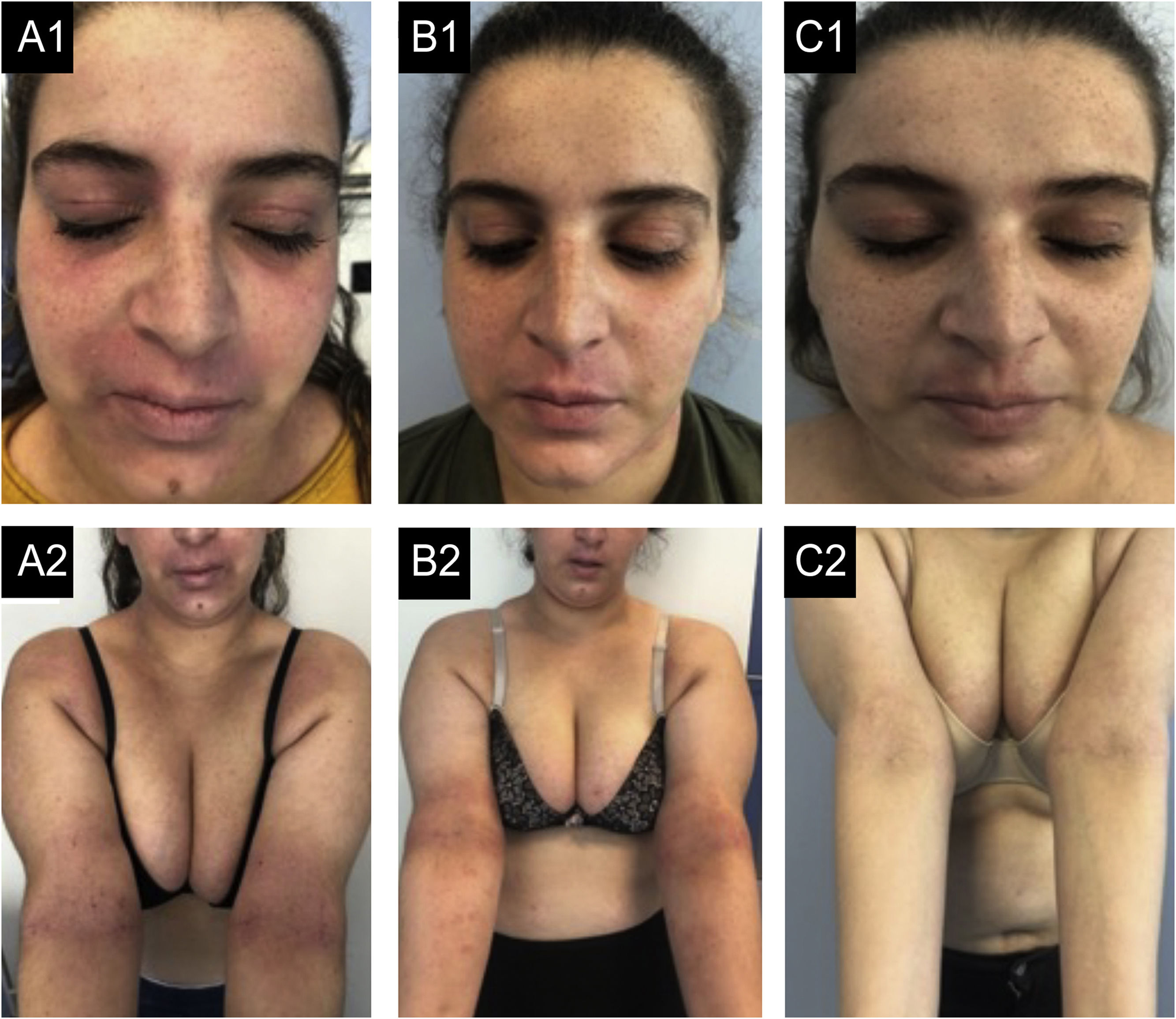
Caso 1. (A1‐A2) Estado basal: eczema grave, afetando principalmente face, região cervical e dobras cutâneas. Há eritema acentuado, formação de pápulas com algum exsudato e crostas e liquenificação no lábio superior e nas dobras cutâneas. (B1‐B2) Após 12 meses de dupilumabe: pequena melhora, mesmo após seis meses de tratamentos semanais. (C1‐C2) Após seis meses de traloquinumabe: pele quase limpa, permanecendo apenas pequena placa no lábio superior, com pouco eritema e liquenificação e alguma hiperpigmentação residual.
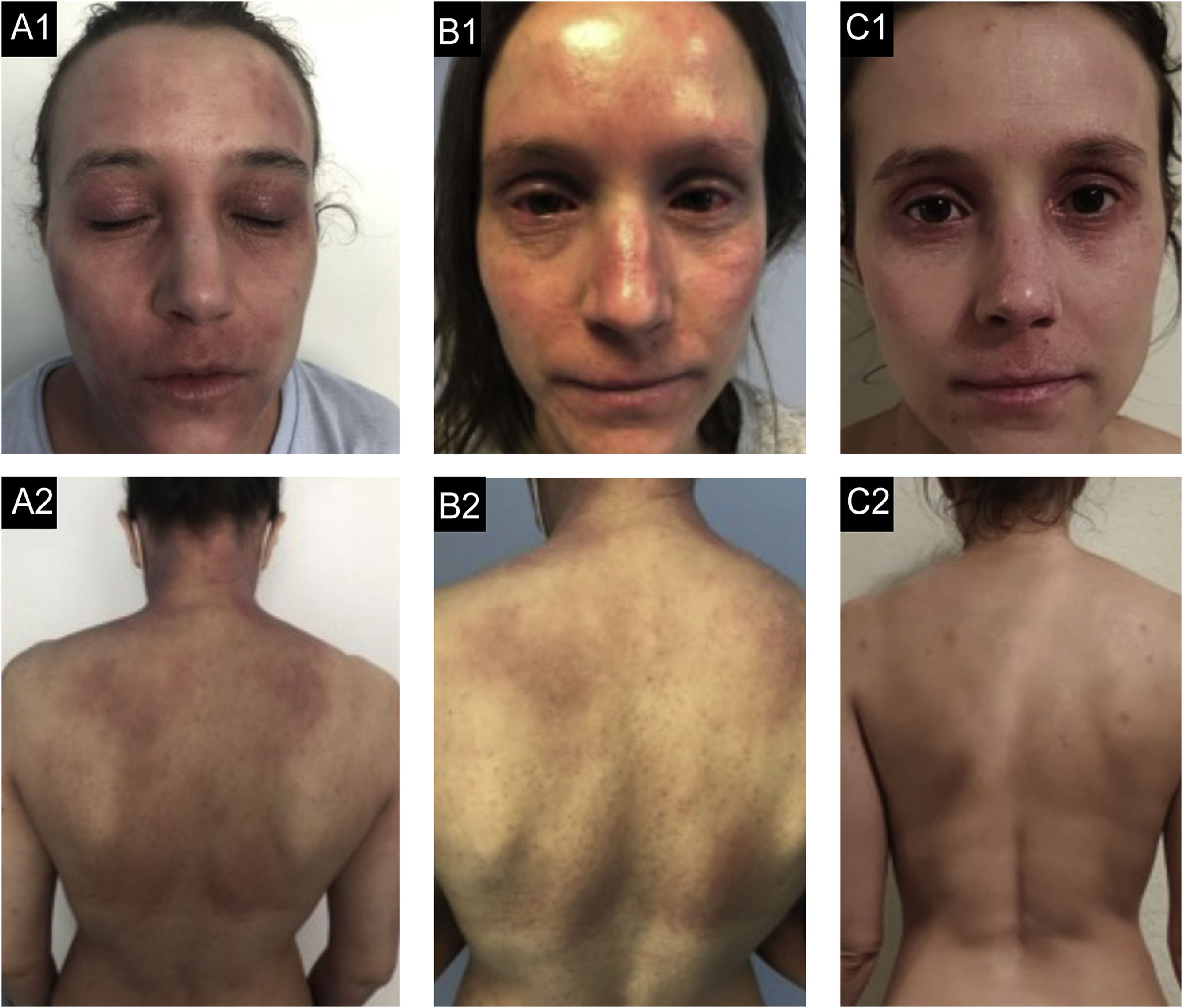
Caso 2. (A1‐A2) Estado basal: eczema grave, generalizado, com eritema acentuado, formação de algumas pápulas com exsudato e crostas, e liquenificação palpebral acentuada. (B1‐B2) Após nove meses de dupilumabe: falência secundária após melhora inicial com resposta parcial aos seis meses, com desenvolvimento de conjuntivite bilateral grave. (C1‐C2) Após três meses de traloquinumabe: melhora global, com pele quase limpa, apenas liquenificação residual em ambas as pálpebras e lábio superior.
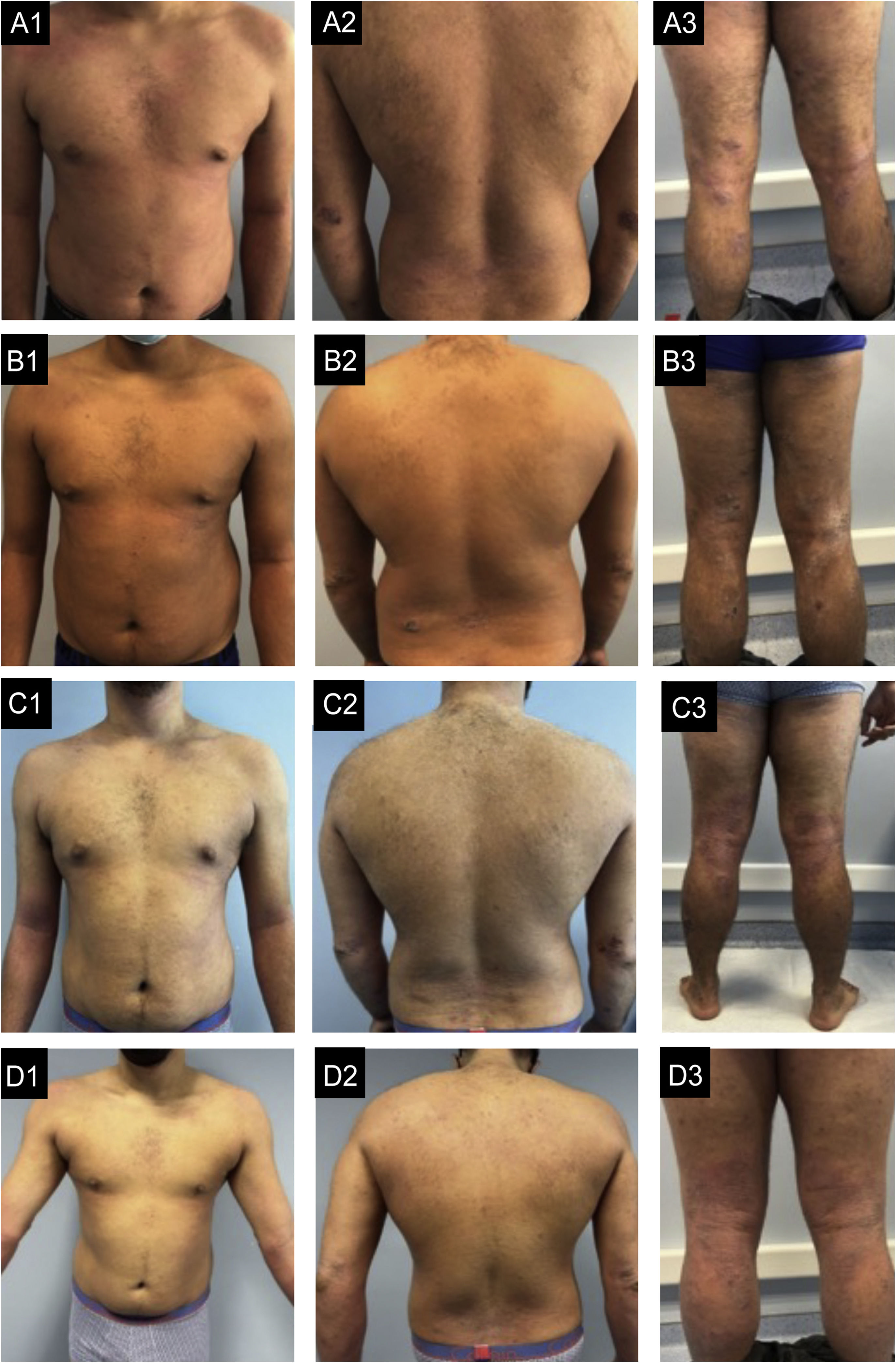
Caso 3. (A1‐A3) Estado basal: eczema grave, generalizado, com áreas de extenso eritema moderado e edema no tronco e áreas de configuração numular com acentuado exsudato e formação de crostas e escoriação nos cotovelos, regiões glúteas, coxas e pernas. (B1‐B3) Após seis meses de dupilumabe: melhora muito pequena. (C1‐C3) Após seis meses de baricitinibe: sem melhora, com novas lesões nos pés. (D1‐D3) Após quatro meses de traloquinumabe: melhora global, mais evidente no tronco, com pele quase limpa. Nos membros, o edema e a liquenificação são menos graves e não há escoriações, o que reflete melhora importante do prurido.
A DA é doença mediada por Th2, envolvendo IL‐4 e IL‐13.1,3,5,6 A IL‐4 foi considerada a citocina principal, mas estudos recentes mostraram superexpressão de IL‐13 em lesões cutâneas, particularmente na fase crônica, havendo correlação entre seus níveis teciduais e a gravidade da doença, sugerindo papel preponderante na inflamação subjacente.1,5,6 Em contraste, os níveis de IL‐4 eram quase indetectáveis. Além disso, a IL‐13 tem implicações importantes na biologia e no microbioma da pele, na barreira epidérmica e no recrutamento de células inflamatórias.5
Tanto o dupilumabe quanto o traloquinumabe demonstraram ser seguros e eficazes em ensaios clínicos, mas não há estudos comparativos diretos.1,6 Revisões sistemáticas com metanálise apontam para a superioridade do iJAK, seguido por dupilumabe e traloquinumabe. No entanto, a maioria dos ensaios é realizada em monoterapia, com tempo máximo de seguimento de 20 semanas, o que não reflete a prática diária.7 Além disso, casos refratários, como o presente caso, geralmente são excluídos.8 Independentemente disso, as conclusões da metanálise devem ser consideradas com cautela, uma vez que as disparidades entre as metodologias dos ensaios limitam sua comparabilidade.1,3,6,7 De fato, recente ensaio aberto de extensão mostrou que, em longo prazo, os resultados do traloquinumabe coincidem com os do dupilumabe e do iJAK, o que é significante, considerando a cronicidade da DA.9 Duas séries de casos da prática clínica com traloquinumabe relataram resultados consistentes com os dos ensaios clínicos, mas os pacientes que receberam terapias‐alvo anteriores apresentaram respostas significantemente piores.8,10
Nos presentes casos, houve excelente resposta ao traloquinumabe, apesar da falha anterior do dupilumabe e, em um caso, também do baricitinibe. Em parte, isso pode ser decorrente de tempo de seguimento mais longo, já que a maioria dos pacientes na série da prática clínica teve menos de 20 semanas de seguimento.10
Assim, apesar da inibição adicional da IL‐4 pelo dupilumabe, parece haver um subconjunto de pacientes que responde melhor ao traloquinumabe. As diferenças farmacocinéticas e farmacodinâmicas podem explicar parcialmente esse quadro, mas há fatores do paciente que devem ser desvendados para que decisões terapêuticas individualizadas possam ser tomadas.8
Assim, o traloquinumabe pode ser eficaz em pacientes que não respondem a outros tratamentos sistêmicos, incluindo o dupilumabe, com bom perfil de tolerabilidade; no entanto, ainda são necessários estudos comparativos para orientar a tomada de decisão do médico.
Suporte financeiroNenhum.
Contribuição dos autoresPatrícia Amoedo: Redação e edição (principal).
Gilberto Rosa: Revisão (suporte).
Teresa Baudrier: Revisão (suporte).
Ana Filipa Pedrosa: Revisão e aprovação final.
Maria João Cruz: Revisão e aprovação final.
Conflito de interessesNenhum.
Como citar este artigo: Amoedo P, Rosa G, Baudrier T, Pedrosa A, Cruz MJ. Atopic dermatitis: real‐life experience with tralokinumab after dupilumab failure: a case series. An Bras Dermatol. 2024;99:721–4.
Trabalho realizado no Centro Hospitalar e Universitário de São João (CHUSJ), Porto, Portugal.