Piedra branca é afecção causada por algumas espécies do gênero Trichosporon. Investigamos um caso de piedra branca cujo exame molecular identificou Cutaneotrichosporon (Trichosporon) debeurmannianum como causador da afecção.
MétodosExaminamos com microscopia eletrônica de varredura (MEV) os cabelos afetados, bem como a colônia fúngica do C. debeurmannianum obtida a partir dos cabelos. Para fins comparativos, foi examinada também uma colônia de Trichosporon mucoides, obtida de micoteca.
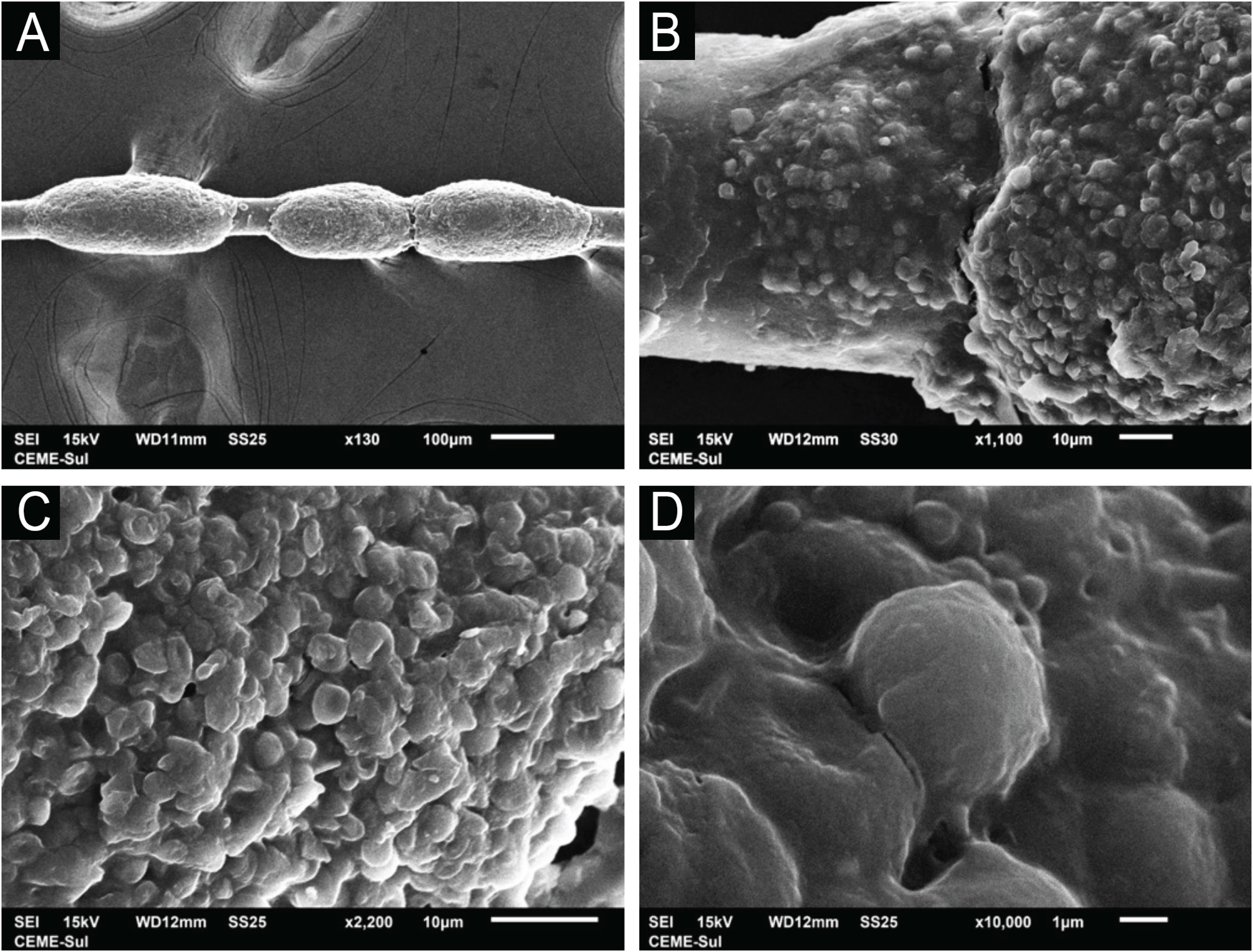
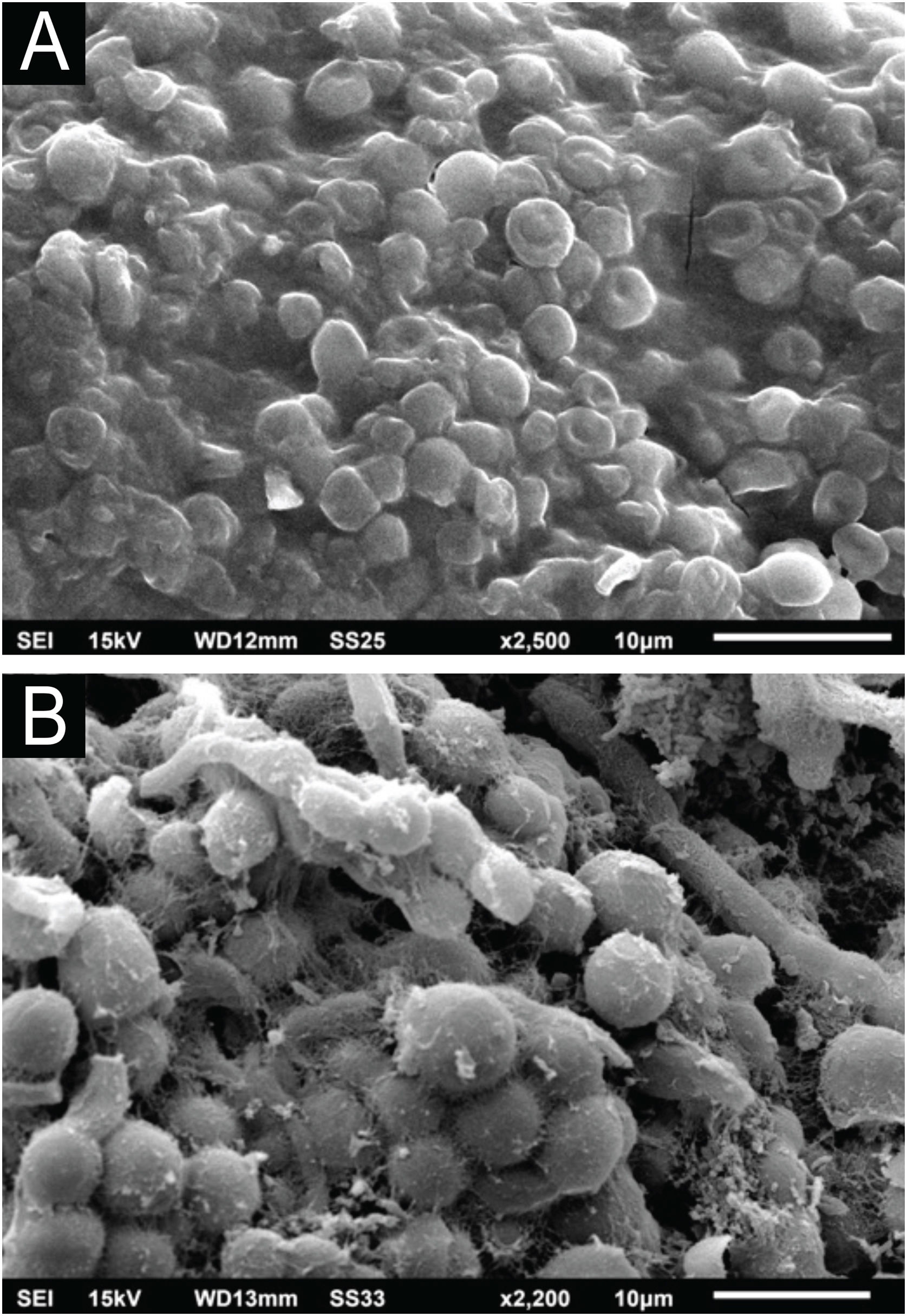
ResultadosO exame dos cabelos afetados com a MEV demonstra facilmente os nódulos na haste pilar com predomínio das estruturas arredondadas leveduriformes, aderidas entre si por substância cimentante. O exame da colônia de C. debeurmannianum demonstra importante aderência entre as células fúngicas por matriz extracelular reticular. O exame da colônia de T. mucoides obtida de micoteca demonstra pequena produção de substância fibrilar entre os blastoconídios.
DiscussãoO exame da colônia obtida a partir da piedra apresenta relevante formação de matriz extracelular, aderindo e recobrindo as estruturas fúngicas, formando um biofilme. Essa matriz deve corresponder à substância cimentante descrita na afecção.
ConclusãoA síntese de matriz extracelular deve ser crucial na formação dos nódulos da piedra branca.
O gênero Trichosporon é formado por fungos basidiomicetos leveduriformes (formadores de blastoconídios e hifas),1–3 havendo mais de 50 espécies descritas; eles são causadores de dermatoses e infecções oportunísticas.
O gênero recebeu essa denominação (Trichos‐cabelo e sporon‐esporos) pois foi descrito pela primeira vez a partir de nódulos de piedra branca, por Beigel, em 1865, e foi posteriormente denominado Trichosporon beigelii.1,2 Atualmente, os principais causadores de doença em humanos, seguindo a nova taxonomia, são: T. asahii, T. asteroides, T. cutaneum, T. mucoides, T. inkin e T. ovoides.1
Os fungos desse gênero causam micoses superficiais como a piedra branca e onicomicose – essa última geralmente por T. cutaneum –, mas também causam infecção sistêmica, sendo a segunda causa de septicemia fúngica em pacientes oncológicos hematológicos, frequência inferior apenas àquela do gênero Candida spp.1
A piedra branca é afecção causada geralmente por algumas espécies do gênero Trichosporon, como T. cutaneum, T. inkin, T. ovoides e T. loubieri. Caracteriza‐se por pequenos nódulos que se formam na haste do pelo, podendo afetar várias regiões do corpo, como barba, couro cabeludo, pelos pubianos, axilas e sobrancelhas. Cabelos longos poderiam facilitar sua ocorrência e são mais comuns em crianças.3–5
Esse gênero tem sofrido inúmeras reclassificações nos últimos anos.6,7 O fungo Cutaneotrichosporon (Trichosporon) debeurmannianum, também denominado Trichosporon debeurmannianum por alguns autores, foi identificado em 2001,8 e já foi descrito causando infecção cutânea.9,10 Examinamos um caso de piedra branca e a respectiva cultura fúngica, cujo exame molecular identificou C. debeurmannianum como causador da afecção.
MétodosExaminamos com microscopia eletrônica de varredura (MEV), com microscópio Jeol, JSM‐6610LV no Centro de Microscopia do Sul – CEMESUL – FURG, cabelos afetados de um caso de piedra branca, bem como a colônia fúngica obtida a partir do cultivo dos cabelos em ágar Sauboraud dextrose. Para fins comparativos, foi examinada também colônia de Trichosporon mucoides, obtida da micoteca do Instituto de Medicina Tropical de São Paulo.
Os cabelos foram examinados após metalização com ouro. Para exame das colônias foi retirado pequeno alçado do cultivo obtido, fixado em glutaraldeído, desidratado e posteriormente metalizado também com ouro, nas distintas amostras de cultura.
ResultadosA colônia obtida a partir dos cabelos afetados demonstrou o típico aspecto amarelado‐cremoso (fig. 1A). O exame da cultura com microscopia óptica demonstrou as estruturas leveduriformes (blastoconídios) e alguns filamentos (fig. 1B).
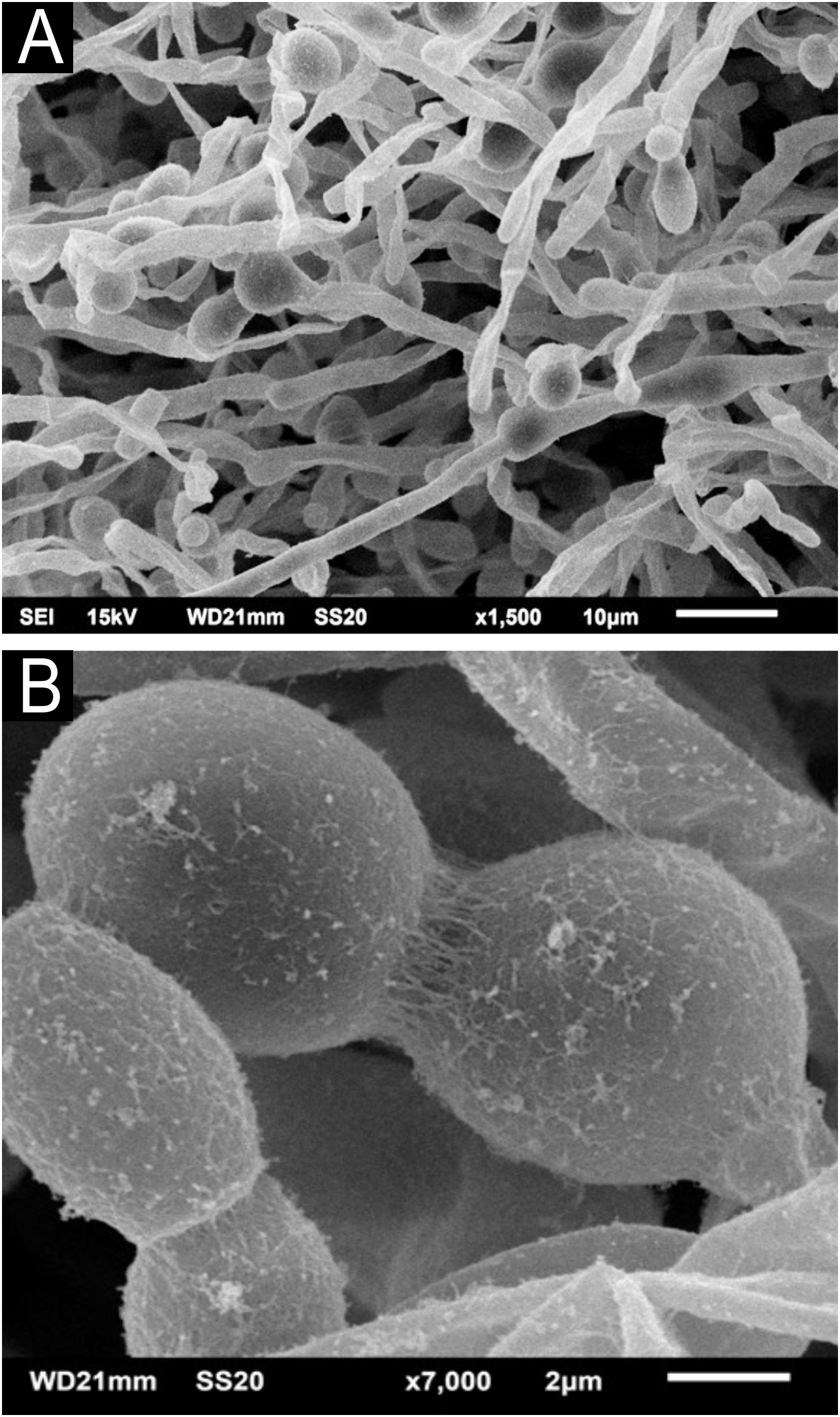
O exame dos cabelos afetados com a MEV demonstra facilmente os nódulos em pequeno aumento (fig. 2A). Em grandes aumentos se observam nódulos bem‐formados e lesões incipientes (fig. 2B). O exame detalhado dos nódulos mostra a formação dos mesmos com predomínio das estruturas arredondadas leveduriformes, semelhante aos achados da microscopia óptica, aderidas entre si por substância cimentante (fig. 2 C‐D).
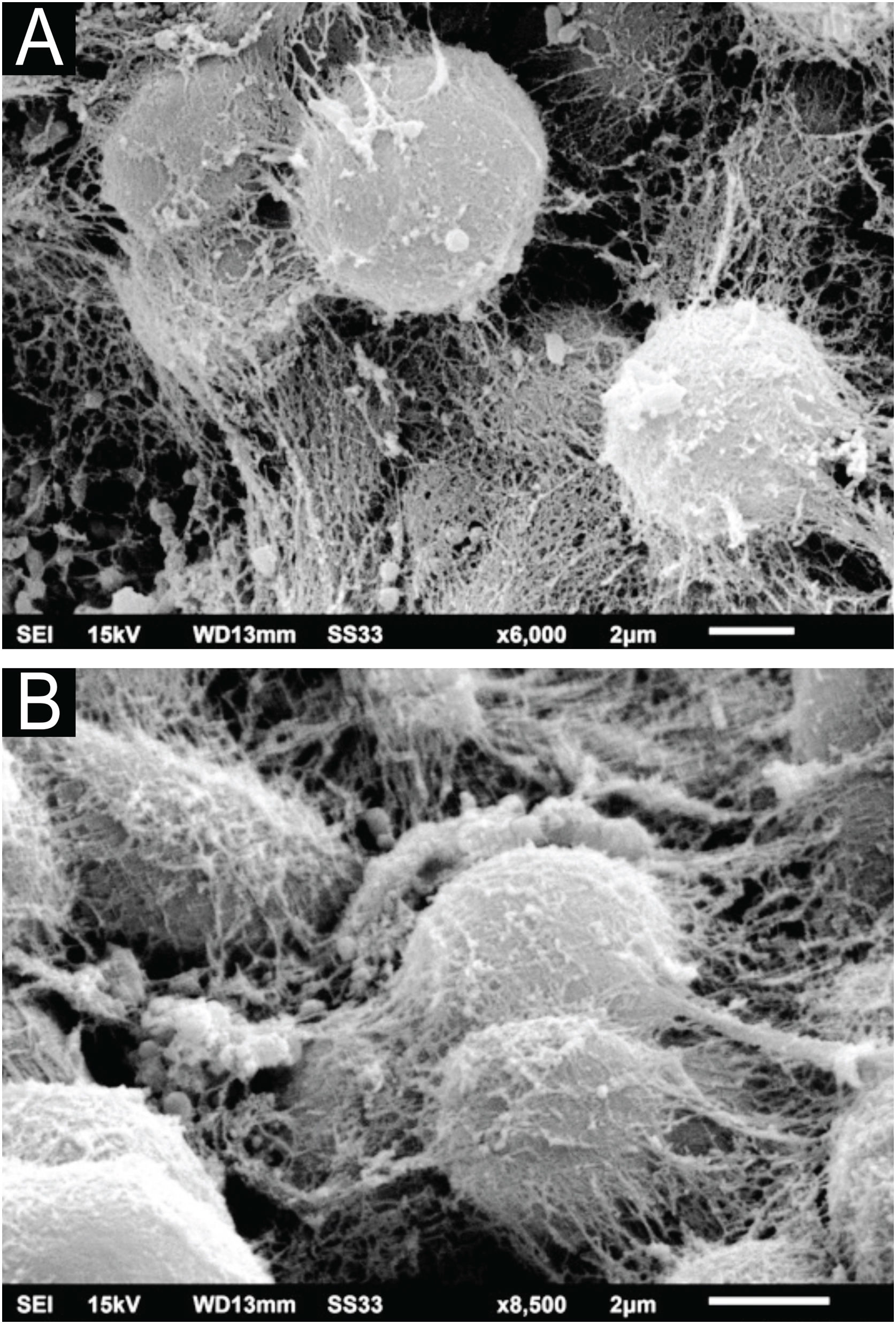
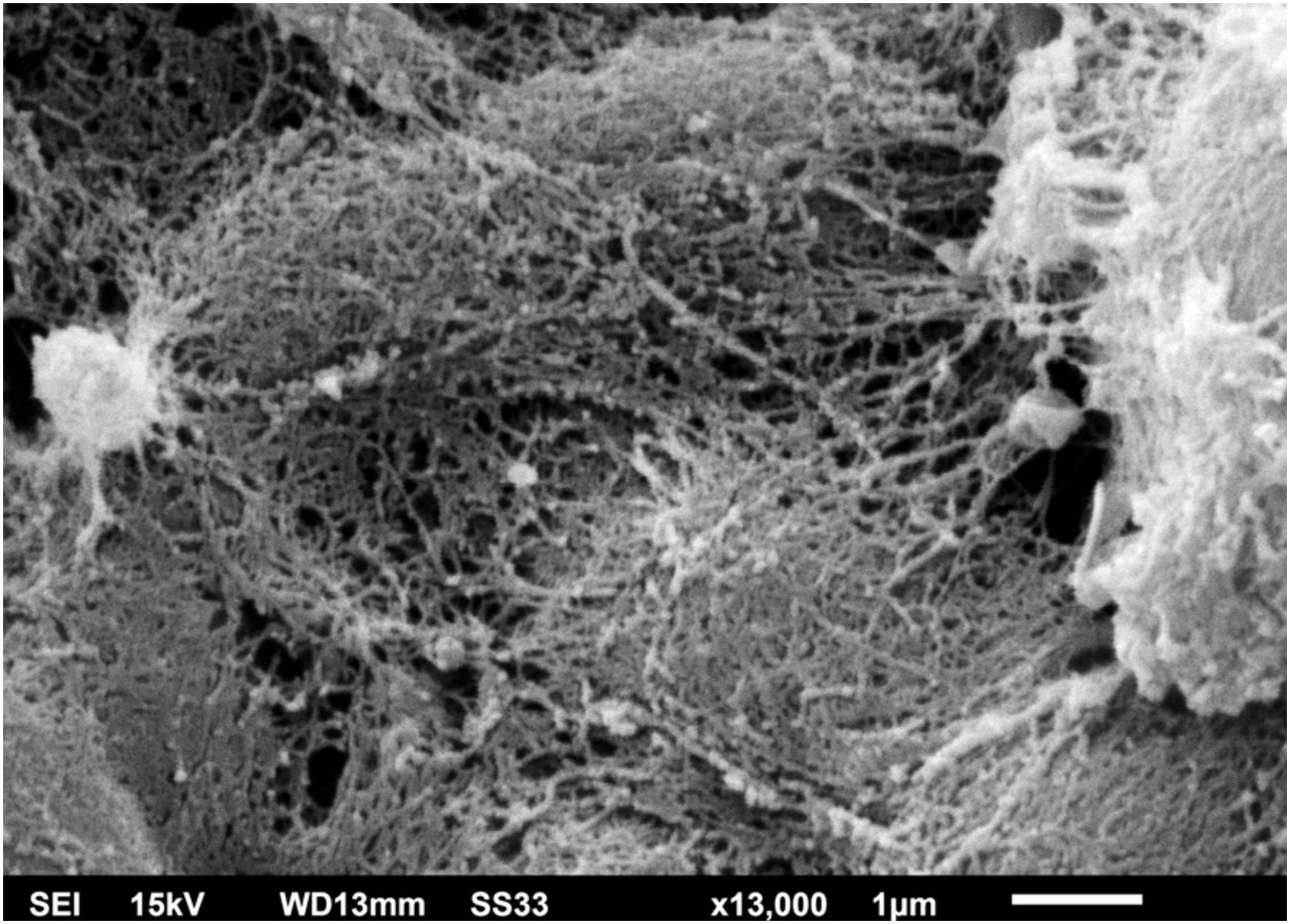
O exame da colônia de C. debeurmannianum com a MEV também demonstra predomínio de estruturas arredondadas, como vistas na microscopia óptica; já em pequeno aumento observa‐se aderência entre essas estruturas por uma rede extracelular; as hifas apresentam menor produção dessa rede (fig. 3). O exame detalhado demostra importante aderência entre as células arredondadas, formando por vezes agrupamentos que lembram “ácinos” (fig. 4), os blastoconídios aparecem bem envoltos pela matriz extracelular (fig. 5). Em alguns campos essa rede extracelular oculta as estruturas leveduriformes, compactando‐as nessa matriz (fig. 6). Algumas hifas foram vistas também com essa matriz extracelular (fig. 7).
Na comparação em aumentos similares pode‐se ver a semelhança entre o nódulo da piedra branca e no cultivo do C. debeurmannianum (fig. 8).
O exame com a MEV da colônia de T. mucoides obtida de micoteca demonstra filamentos e blastoconídios, sem a formação da evidente matriz extracelular aderindo às células fúngicas entre si (fig. 9A), como visto na colônia obtida do presente caso de piedra branca. Com grandes aumentos pode‐se observar pequena produção, mas evidente, de substância fibrilar entre os blastoconídios (fig. 9B).
DiscussãoNossos achados com o exame do nódulo da piedra são semelhantes a achados já publicados sobre sua ultraestrutura; são encontradas hifas (em cortes na análise com microscopia eletrônica de transmissão) e esporos envoltos por substância cimentante na superfície, na análise por MEV.11
Com relação ao exame da colônia obtida a partir do caso índice aqui apresentado, nota‐se relevante formação de matriz extracelular, aderindo e recobrindo as estruturas fúngicas, formando um biofilme – matriz essa que deve corresponder à substância cimentante descrita na afecção.
Formação de biofilme foi demonstrada primeiramente na década de 1970, e caracteriza‐se por matriz extracelular com os agentes etiológicos embebidos.12,13 Deve ter função de proteção dos agentes etiológicos contra radiação ultravioleta, temperaturas e pH extremos, salinidade e pressão, bem como podem estar envolvidos na resistência a antibióticos e antifúngicos.12 Podem ser formados por polissacarídeos, proteínas ou gorduras.12
Inúmeros fungos de interesse dermatológico já foram escritos como formadores de biofilme, como T. rubrum e T. mentagrophytes, e nos gêneros Aspergillus, Candida e Cryptococcus.14–16
Com relação ao gênero Trichosporon, a formação de biofilme também já foi relatada,17–20 e variação interespécies foi encontrada, podendo ser classificadas em produtoras fracas, medias ou fortes de biofilmes.17 Em uma publicação com casuística de 53 cepas de Trichosporon obtidos de amostras urinárias, cerca de 10% eram produtores medianos de biofilme e a maioria produtores fracos.19 Com T. asahii obtido de hemocultura, demonstrou‐se experimentalmente que o fungo se adere às placas de cultura e em poucas horas começa a produzir biofilme.20
Em trabalho experimental já foi demonstrado que várias espécies de Trichosporon podem se aderir aos cabelos, formando a piedra.21
Possivelmente, cepas com baixa produção de matriz extracelular podem não formar o nódulo da piedra, pois seria necessária para formar a concreção no pelo, de maneira semelhante ao que demonstramos, com a intensa produção de matriz extracelular pela colônia obtida a partir de cabelos afetados, em contraposição à diminuta produção de matriz extracelular por T. mucoides obtido de micoteca, havendo a possibilidade de essa cepa mantida congelada em micoteca ter modificado a possibilidade de produzir a matriz extracelular.
A formação da substância cimentante firmemente aderida ao cabelo e do biofilme poderia ser responsável pela lentidão da resposta terapêutica antifúngica tópica ou sistêmica na piedra branca.
A síntese de matriz extracelular sugere exercer papel crucial na firme adesão das células fúngicas entre si, resultando na formação dos nódulos das piedras, pois já foi também demonstrada com o agente etiológico da piedranigra.22 Esses achados com MEV deveriam ser expandidos para mais espécies de Trichosporon formadoras ou não de piedra.
Suporte financeiroNenhum.
Contribuição dos autoresHiram Larangeira de Almeida Jr: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados, revisão crítica da literatura; revisão crítica do manuscrito.
Thales de Moura Assis: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Eduardo Camargo Faria: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Viviane Mazo Fávero Gimenes: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Almeida Jr HL, Assis TM, Faria EC, Gimenes VMF. White piedra: fungal extracellular matrix formation and its importance in pathogenesis. Ultrastructural study. An Bras Dermatol. 2025;100:501140.
Trabalho realizado na Pós‐Graduação em Saúde e Comportamento, Universidade Católica de Pelotas, Pelotas, RS, Brasil.