Psoríase e periodontite são doenças inflamatórias crônicas mediadas imunologicamente. Evidências epidemiológicas estabeleceram uma relação entre ambas as doenças; entretanto, a alteração de marcadores no fluido crevicular gengival tem sido pouco avaliada.
ObjetivoAvaliar os níveis de IL‐17A, IL‐22, IL‐23, S100A7, S100A8 e S100A9 no fluido crevicular gengival de indivíduos psoriásicos e saudáveis com e sem periodontite e suas relações com a gravidade da psoríase.
MétodosEstudo transversal. A amostra foi composta pelos seguintes grupos: controles saudáveis sem periodontite ou com doença leve (n=21), controles saudáveis com periodontite moderada ou grave (n=18), indivíduos com psoríase sem periodontite ou com doença leve (n=11), indivíduos com psoríase e periodontite moderada ou grave (n=32). Os níveis de IL‐17A, IL‐22, IL‐23, S100A8 e S100A9 foram determinados por ensaio multiplex, e S100A7 foi medida por ELISA.
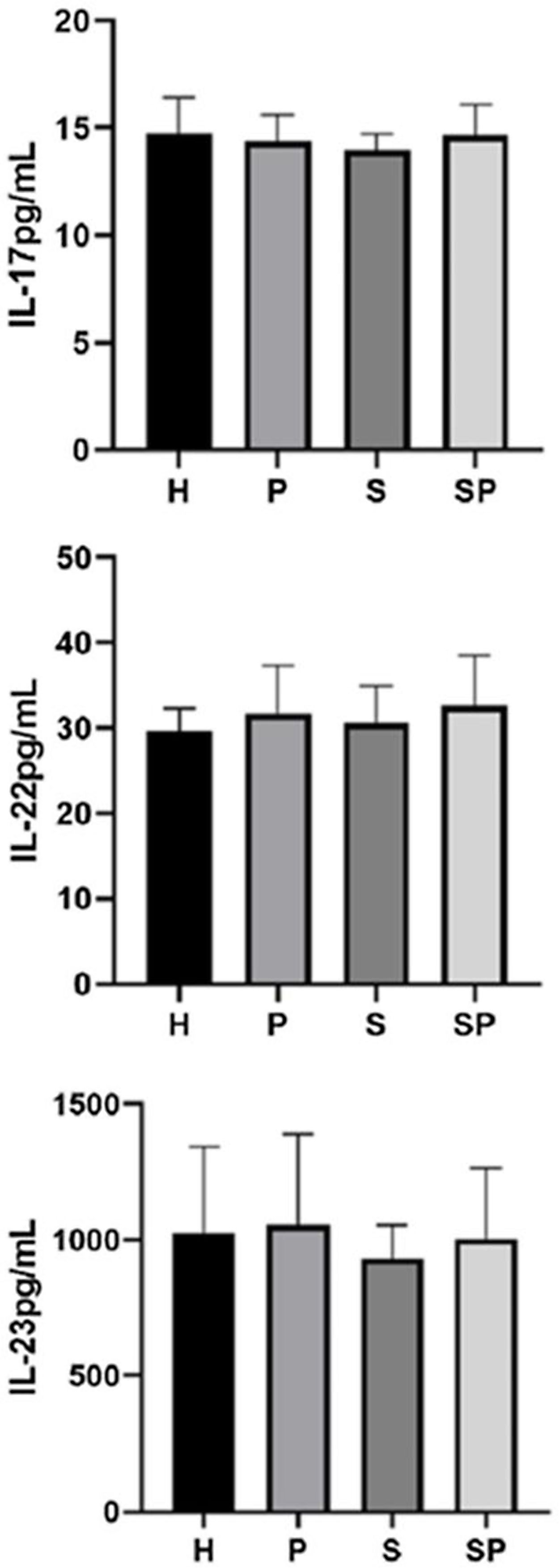
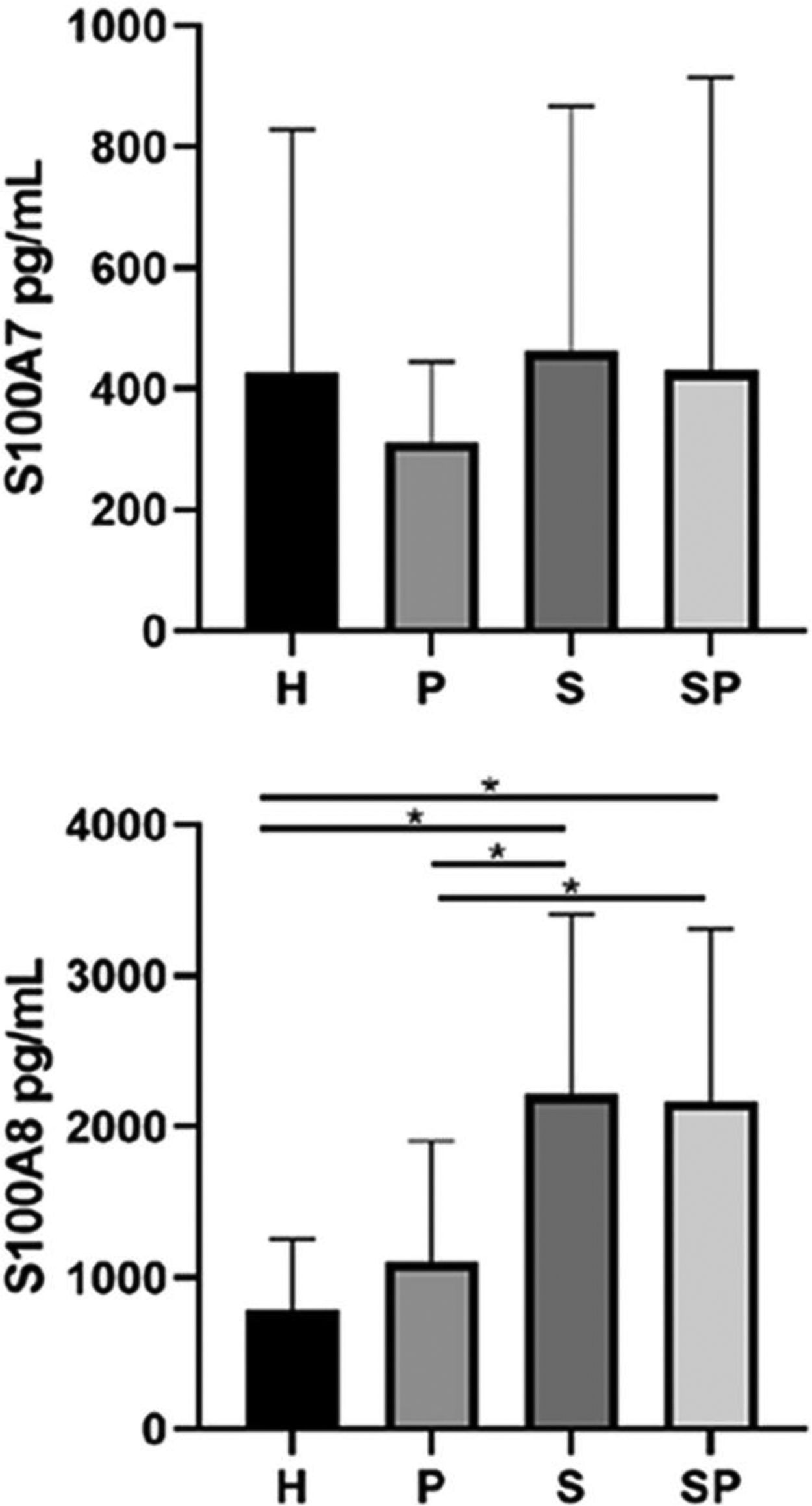
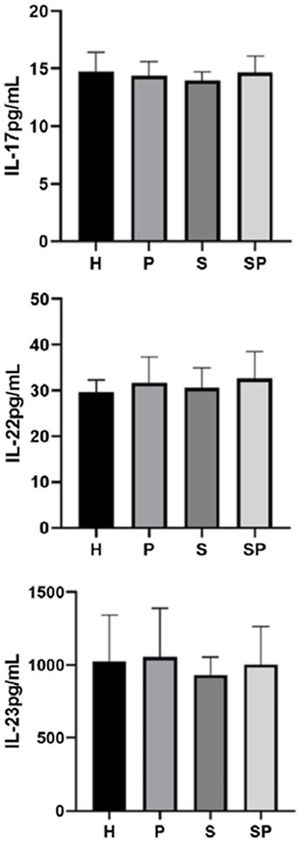
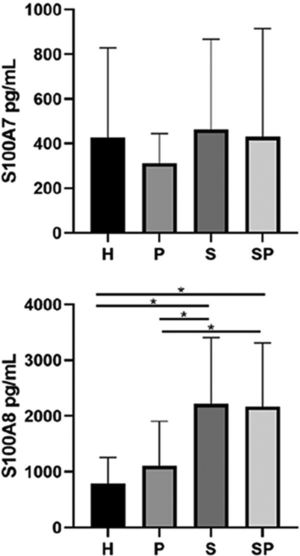
ResultadosNão foram encontradas diferenças entre os grupos em relação aos níveis de IL‐17A, IL‐22, IL‐23 e S100A7. Os níveis de S100A8 foram maiores em pacientes com psoríase em relação aos controles (p<0,05). A proteína S100A8 foi positivamente correlacionada com a gravidade da psoríase no grupo com psoríase (p <0,05). A S100A9 excedeu os limites de detecção.
Limitações do estudoEste estudo piloto apresenta um pequeno tamanho de amostra.
ConclusõesA concentração de S100A8 foi mais alta em pacientes com psoríase, independentemente da saúde/estado periodontal. A S100A8 foi associada à gravidade da psoríase. As concentrações de interleucinas e S100A7 foram semelhantes em pacientes psoriásicos com ou sem periodontite versus controles saudáveis.
A psoríase é uma dermatose inflamatória crônica mediada imunologicamente e uma doença autoimune recorrente que ocorre em indivíduos geneticamente suscetíveis. A psoríase é uma doença comum, e sua prevalência é de cerca de 2% na Europa e na América do Norte. As principais manifestações clínicas da pele incluem prurido, sensação de queimação e dor, acompanhadas pelo desenvolvimento de placas escamosas e eritematosas bem definidas, resultantes de proliferação e diferenciação anormais de ceratinócitos.1
A patogênese da psoríase permanece incerta; entretanto, as interações entre os ceratinócitos e as células T residentes da pele na via da interleucina (IL) 23/Th17 parecem participar no início e na progressão da doença.2 As evidências que sustentam essa hipótese incluem o isolamento de mRNA de IL‐23 e IL‐17 de lesões cutâneas psoriásicas e o relato de concentrações séricas aumentadas de IL‐17A, IL‐22 e IL‐23 em pacientes com psoríase versus controles saudáveis.3–5
Nos últimos anos, atenção especial tem sido dada ao papel prospectivo das proteínas S100 no desenvolvimento da psoríase. A família de proteínas S100 é composta por proteínas ligantes de cálcio, nas quais a psoriasina (S100A7) e a calgranulina A (S100A8) são reguladas pela IL‐17, amplificando a resposta inflamatória. Foi relatado que S100A7, S100A8 e calgranulina B (S100A9) apresentam expressão em lesões cutâneas psoriásicas, revelando que essas proteínas S100 podem desempenhar um papel importante na proliferação e diferenciação desreguladas de ceratinócitos na pele de pacientes com psoríase.6–9 Além disso, foi apontado que as proteínas S100 atuam como fatores quimiotáticos para células imunes, induzindo um ambiente pró‐inflamatório no qual o início e a recorrência da psoríase podem ocorrer facilmente.9
Recentemente, estudos epidemiológicos associaram a psoríase à periodontite, sugerindo uma imunopatogênese comum subjacente.10,11 Embora os estudos sobre o assunto sejam escassos, os resultados são particularmente interessantes, uma vez que uma relação potencialmente bidirecional entre as duas doenças foi sugerida. Nesses estudos, os pacientes com psoríase não apenas apresentaram uma frequência maior de periodontite e piores parâmetros periodontais, mas também um risco mais elevado de desenvolver periodontite em comparação com controles saudáveis não psoriásicos.12–14 Além disso, uma potencial relação de dose‐resposta entre a psoríase e a periodontite foi relatada por Egeberg et al.,10 pois a frequência da periodontite aumentou quando a gravidade da psoríase aumentou. Por outro lado, algumas evidências indicam que pacientes com doença periodontal podem ter frequência e risco aumentados de psoríase; entretanto, mais evidências ainda são necessárias.
De maneira similar à psoríase, a patogênese da periodontite inclui um envolvimento especial da via IL‐23/Th17. A expressão de IL‐17, IL‐22 e IL‐23 foi avaliada no fluido gengival crevicular (FGC) de pacientes com periodontite crônica, e essas citocinas têm sido associadas à patogênese e gravidade da doença e reabsorção óssea alveolar.15–17 Na periodontite, estudos detectaram um heterocomplexo S100A8/S100A9 no FGC, saliva e soro de pacientes com periodontite, enquanto um estudo recente associou a periodontite a níveis elevados de S100A8 salivar.18–21
Até o momento, não há evidências para avaliar a expressão de citocinas relacionadas a IL‐23/Th17 e proteínas da família S100 no FGC de pacientes com psoríase. Devido ao fato de o FGC abranger biomarcadores de diagnóstico de doenças orais e sistêmicas, bem como expor com precisão os constituintes do soro e as reações celulares do periodonto, hipotetizamos que os níveis de citocinas envolvidas na regulação das células T e moléculas da família de proteínas S100 no FGC mostrariam diferenças relevantes em indivíduos psoriásicos e saudáveis com ou sem periodontite, refletindo a relação entre psoríase e periodontite.22 Assim, o objetivo deste estudo foi avaliar os níveis de IL‐17A, IL‐22, IL‐23, S100A7, S100A8 e S100A9 no FGC de indivíduos psoriásicos e saudáveis com e sem periodontite e sua relação com a gravidade da psoríase.
MétodosO presente estudo transversal foi aprovado pelo comitê de bioética do North Metropolitan Health Service, Santiago, Chile (N52/2017). Todos os participantes forneceram consentimento informado por escrito antes da inclusão no estudo, de acordo com a Declaração de Helsinque.
Seleção de pacientesIndivíduos encaminhados para diagnóstico presumido de psoríase na Unidade de Dermatologia do San José Hospital (Santiago, Chile) foram incluídos ao longo de um período de 10 meses (2018). Indivíduos sem psoríase foram selecionados simultaneamente entre pacientes voluntários atendidos na clínica odontológica da Faculdade de Odontologia da Universidad Andrés Bello (Santiago, Chile).
Os critérios de elegibilidade globais incluíram: i) pacientes adultos (≥ 18 anos) com ii) onze ou mais dentes (excluindo terceiros molares). Os critérios de exclusão foram assim definidos: i) indivíduos com quaisquer doenças/condições sistêmicas conhecidas além da psoríase (especialmente aquelas envolvendo desregulação inflamatória/imunológica, como diabetes, lúpus sistêmico e artrite/osteoartrite, entre outras); ii) pacientes que tinham recebido antibióticos, medicamentos anti‐inflamatórios não esteroides e/ou terapia imunomoduladora nos últimos três meses; iii) pacientes que tinham sido submetidos à radioterapia e/ou quimioterapia no último ano; e iv) pacientes que tinham recebido tratamento periodontal e/ou de psoríase nos últimos seis meses.
Medidas clínicasTodos os pacientes foram avaliados pela mesma equipe de especialistas. Os dados dermatológicos foram coletados na consulta inicial por dermatologistas da equipe do hospital. As variáveis confundidoras avaliadas incluíram sexo e idade. As variáveis clínicas da psoríase incluíram presença ou ausência de psoríase, tipo clínico da psoríase e gravidade da doença, definida pelo (i) Índice de Área e Gravidade da Psoríase (PASI, do inglês Psoriasis Area and Severity Index), (ii) Área de Superfície Corporal (ASC) e (iii) Avaliação Global pelo Médico (PGA, do inglês Physician Global Assessment) e Índice de Qualidade de Vida em Dermatologia (DLQI, do inglês Dermatology Life Quality Index).
Avaliação e amostragem periodontais foram realizadas por um periodontista qualificado. A avaliação clínica periodontal incluiu mapeamento manual da doença periodontal na boca inteira (seis locais por dente, excluindo terceiros molares) e registro dos seguintes parâmetros: profundidade de sondagem (PS), nível clínico de inserção (NCI), sangramento à sondagem (SS) e perda de dentes. Informações adicionais sobre hábitos de higiene bucal e tabagismo foram coletadas. A condição periodontal foi definida de acordo com a definição de caso clínico de periodontite proposta pelo Centers for Disease Control and Prevention (EUA). Periodontite grave foi definida como dois ou mais locais interproximais com NCI ≥ 6mm (não no mesmo dente) e ≥ um local interproximal com PS ≥ 5mm. Periodontite moderada foi definida como dois ou mais locais interproximais com NCI ≥ 4mm (não no mesmo dente) e/ou dois ou mais locais interproximais com PS ≥ 5mm. Por fim, casos sem periodontite/com periodontite leve foram definidos como periodontite não grave, não moderada.23
De um total de 93 indivíduos avaliados, 82 atenderam aos critérios de inclusão. Os indivíduos foram divididos nos seguintes grupos: H, controles sistemicamente saudáveis sem periodontite/com periodontite leve; P, controles sistemicamente saudáveis com periodontite moderada/grave; S, indivíduos com psoríase sem periodontite/com periodontite leve; e SP, indivíduos com psoríase e periodontite moderada/grave.
Por fim, do ponto de vista ético, deve‐se observar que todos os pacientes examinados neste estudo com diagnóstico positivo para psoríase e/ou periodontite foram encaminhados para tratamento adequado no Hospital San José e/ou na clínica odontológica da Universidad Andrés Bello, respectivamente.
Coleta de fluido gengival crevicular (FGC)As amostras foram obtidas de quatro locais independentes com base na PS, local mais profundo por quadrante. Antes da amostragem, os locais foram isolados com rolos de algodão e então cuidadosamente secos com uma seringa de ar para evitar a contaminação com saliva. O FGC foi coletado com tiras de papel absorvente padrão estéreis (Periopaper®, Interstate Drug Exchange, Amityville, NY, EUA) cuidadosamente inseridas no sulco ou bolsa gengival até que uma leve resistência fosse observada. Após 30 segundos, as tiras foram coletadas em tubos estéreis e imediatamente transportadas para o laboratório para armazenamento (−20°C) e posterior análise.
Análise do FGCUma eluição de 40μL/tira foi preparada utilizando tampão de eluição de proteína em tubos estéreis. As amostras foram incubadas por 30 minutos a 4°C e depois centrifugadas a 12.000×g por 5 minutos a 4°C. O procedimento foi repetido duas vezes, e as amostras foram congeladas e mantidas a−20°C até a análise. Alíquotas de todas as amostras de FGC foram utilizadas para quantificação de proteínas usando um ensaio multiplex (Human Magnetic Luminex Assay®, R&D Systems, MN, EUA) para Il‐17A, Il‐22, IL‐23, S100A8 e S100A9 e um kit ELISA (Human Protein S100‐A7 Elisa Kit®, MyBioSource Inc, San Diego, CA, EUA) para S100A7, de acordo com as instruções dos fabricantes. Os dados do painel de análise multiplex foram lidos em uma plataforma (Magpix, Millipore, St. Charles, MO) e posteriormente analisados em um software (MILLIPLEX AnalystR software, Viagene Tech, Carlisle, MA, EUA).
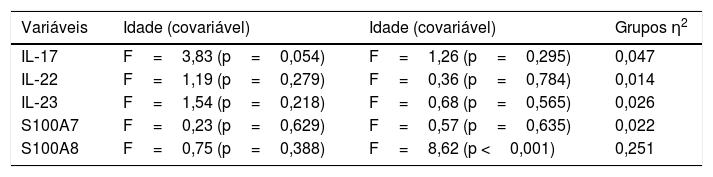
Análise estatísticaOs testes de Shapiro‐Wilk e de Levene foram utilizados para determinar a distribuição e a homocedasticidade dos dados, respectivamente. As análises inferenciais foram realizadas com o teste exato de Fisher, ANOVA e teste post hoc de Duncan. Uma análise de variância (ANOVA) univariada (modelo III) foi aplicada com a covariável idade dos indivíduos examinados. Os coeficientes de correlação foram obtidos utilizando a análise de correlação de Spearman. O nível de significância foi definido em p <0,05. O tamanho do efeito (η2) foi realizado, como mostrado na tabela 1. A análise estatística foi realizada pelo software estatístico STATA 12® (StataCorp, Collage Station, TX, EUA). Ressalta‐se que, em decorrência do caráter exploratório deste estudo, não foi realizado o cálculo amostral.
Resultados do tamanho do efeito para ANOVA: η2
| Variáveis | Idade (covariável) | Idade (covariável) | Grupos η2 |
|---|---|---|---|
| IL‐17 | F=3,83 (p=0,054) | F=1,26 (p=0,295) | 0,047 |
| IL‐22 | F=1,19 (p=0,279) | F=0,36 (p=0,784) | 0,014 |
| IL‐23 | F=1,54 (p=0,218) | F=0,68 (p=0,565) | 0,026 |
| S100A7 | F=0,23 (p=0,629) | F=0,57 (p=0,635) | 0,022 |
| S100A8 | F=0,75 (p=0,388) | F=8,62 (p <0,001) | 0,251 |
η2, eta‐quadrado.
No total, 82 indivíduos foram incluídos neste estudo: 21 controles sem periodontite/com periodontite leve (H), 18 controles com periodontite moderada/grave (P), 11 indivíduos com psoríase e sem periodontite/com periodontite leve (S) e 32 indivíduos com psoríase e periodontite moderada/grave (SP).
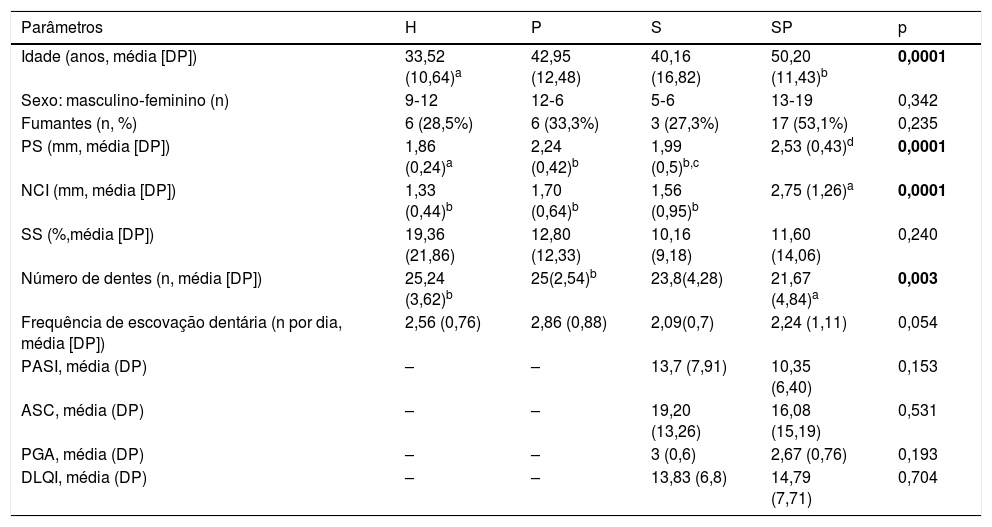
Os dados demográficos, hábitos e parâmetros clínicos de todos os indivíduos deste estudo estão resumidos na tabela 2. Não foram encontradas diferenças significativas entre os grupos em relação a sexo, tabagismo, SS e hábitos de higiene oral, PASI, ASC, PGA e DLQI. A maior média de idade foi encontrada no grupo SP, seguido pelos grupos P, S e H em ordem decrescente. Apenas o grupo SP apresentou diferenças significativas na média de idade com o grupo H (p <0,05).
Comparação de parâmetros demográficos, tabagismo e características clínicas dos indivíduos do estudo
| Parâmetros | H | P | S | SP | p |
|---|---|---|---|---|---|
| Idade (anos, média [DP]) | 33,52 (10,64)a | 42,95 (12,48) | 40,16 (16,82) | 50,20 (11,43)b | 0,0001 |
| Sexo: masculino‐feminino (n) | 9‐12 | 12‐6 | 5‐6 | 13‐19 | 0,342 |
| Fumantes (n, %) | 6 (28,5%) | 6 (33,3%) | 3 (27,3%) | 17 (53,1%) | 0,235 |
| PS (mm, média [DP]) | 1,86 (0,24)a | 2,24 (0,42)b | 1,99 (0,5)b,c | 2,53 (0,43)d | 0,0001 |
| NCI (mm, média [DP]) | 1,33 (0,44)b | 1,70 (0,64)b | 1,56 (0,95)b | 2,75 (1,26)a | 0,0001 |
| SS (%,média [DP]) | 19,36 (21,86) | 12,80 (12,33) | 10,16 (9,18) | 11,60 (14,06) | 0,240 |
| Número de dentes (n, média [DP]) | 25,24 (3,62)b | 25(2,54)b | 23,8(4,28) | 21,67 (4,84)a | 0,003 |
| Frequência de escovação dentária (n por dia, média [DP]) | 2,56 (0,76) | 2,86 (0,88) | 2,09(0,7) | 2,24 (1,11) | 0,054 |
| PASI, média (DP) | – | – | 13,7 (7,91) | 10,35 (6,40) | 0,153 |
| ASC, média (DP) | – | – | 19,20 (13,26) | 16,08 (15,19) | 0,531 |
| PGA, média (DP) | – | – | 3 (0,6) | 2,67 (0,76) | 0,193 |
| DLQI, média (DP) | – | – | 13,83 (6,8) | 14,79 (7,71) | 0,704 |
ASC, área de superfície corporal; DLQI, Índice de Qualidade de Vida em Dermatologia; DP, desvio padrão; Negrito, p <0,05; H, controle saudável; NCI, nível clínico de inserção; P, indivíduos com periodontite não tratada; PASI, Índice de Área e Gravidade da Psoríase; PGA, Avaliação Global pelo Médico; PS, profundidade de sondagem; S, indivíduos com psoríase não tratada; SS, sangramento à sondagem; SP, indivíduos com psoríase não tratada e periodontite não tratada.
Em relação aos parâmetros clínicos periodontais, a PS foi significativamente pior/mais profunda no grupo SP em comparação com os grupos S, P e H (p <0,05). O grupo P apresentou bolsas significativamente mais profundas do que o grupo H (p <0,05). O maior NCI foi observado no grupo SP em comparação aos grupos S, P e H (p <0,05). A maior perda dentária foi observada no grupo SP, seguido pelos grupos S, P e H em ordem decrescente. Em relação aos dados clínicos dermatológicos, não foram encontradas diferenças significativas em relação ao PASI, ASC e PGA entre os grupos S e SP.
Os níveis de IL‐17A, IL‐22 e IL‐23 no FGC são apresentados na figura 1. Não foram observadas diferenças intergrupos em relação aos níveis de IL‐17A, IL‐22 e IL‐23 no FGC. Os níveis de IL‐17A, IL‐22 e IL‐23 no FGC do grupo SP mostraram uma tendência a serem mais elevados em relação ao grupo S, respectivamente.
As concentrações de S100A7 e S100A8 no FGC dos diferentes grupos são apresentadas na figura 2. Não foram observadas diferenças significativas nos níveis de S100A7 no FGC dos diferentes grupos. O grupo H apresentou os menores níveis de S100A8 em comparação aos grupos S e SP (p <0,05). Além disso, o grupo P apresentou níveis mais baixos de S100A8 em comparação aos grupos S e SP (p <0,05). Entretanto, a idade não influenciou as concentrações de todas as interleucinas e da família de proteínas S100 (p >0,05). As concentrações de S100A9 no FGC de todos os grupos excederam os limites superiores de detecção do kit ELISA; portanto, a quantificação e a análise exatas não foram possíveis.
Os níveis de mediadores inflamatórios no FGC foram correlacionados com os parâmetros clínicos periodontais no grupo H e grupo P. No grupo H, os níveis de IL‐17A foram negativamente correlacionados com NCI (−0,499), (p <0,05). No grupo P, IL‐22 correlacionou‐se positivamente com PS (0,490) e NCI (0,589) (p <0,05). Nos grupos S e SP, as correlações entre mediadores inflamatórios e parâmetros clínicos periodontais e dermatológicos foram obtidas. No grupo S, a IL‐23 foi negativamente correlacionada com PGA, enquanto S100A8 foi positiva e fortemente correlacionada com PASI (0,878), ASC (0,851) e DLQI (0,622) (p <0,05). No grupo SP, as IL‐22 e IL‐23 foram negativamente correlacionados com ASC (−0,358 e−0,468, respectivamente), (p <0,05).
DiscussãoPsoríase e periodontite compartilham mecanismos semelhantes de desregulação imunológica caracterizada por uma resposta imune predominante do eixo Th17.24,25 A via Th17 regula a expressão das proteínas S100, que podem participar da patogênese de ambas as doenças.26–28 No presente estudo, encontramos níveis elevados de S100A8 no FGC de pacientes com psoríase em comparação com os níveis de controles sistemicamente saudáveis, independentemente de seu estado de saúde/periodontal, e uma forte correlação positiva entre S100A8 e ASC, PASI e DLQI no grupo com psoríase (grupo S), sugerindo que as concentrações de S100A8 no FGC podem ser um biomarcador não invasivo promissor para a presença e a gravidade da psoríase.
Que seja de nosso conhecimento, nenhum estudo anterior avaliou as concentrações de S100A7 e S100A8 no FGC de indivíduos psoriásicos com ou sem periodontite. Na periodontite isolada, S100A7 e S100A8 foram detectadas no FGC de indivíduos com periodontite utilizando técnicas de espectrometria de massa e western blotting, indicando que essas moléculas podem participar da resposta imune dos tecidos periodontais.29 Além disso, S100A7 e S100A8 podem estar envolvidas na reabsorção óssea periodontal, já que evidências mostram que a S100A8 induziu a reabsorção óssea osteoclástica na artrite experimental e a S100A7 estimulou a diferenciação de osteoclastos em monócitos humanos in vitro.30,31
Recentemente, Karna et al. relataram e associaram níveis elevados de S100A8 salivar com periodontite em adultos coreanos, sugerindo que as concentrações salivares de S100A8 podem ser um biomarcador prospectivo para periodontite.21 Na psoríase, foi relatado que S100A7 induz a diferenciação desregulada da epiderme.8 Acredita‐se que a S100A7 funcione como um agente quimiotático derivado de ceratinócitos para células imunes; como resultado, a molécula atrai fortemente linfócitos CD4+e neutrófilos sob estresse inflamatório. As moléculas de S100A8 e S100A9 são inicialmente liberadas dos ceratinócitos para iniciar/estimular a invasão das células imunes, que é posteriormente sustentada pela liberação posterior das mesmas moléculas dos neutrófilos que invadem o epitélio.28 A detecção de diferentes proteínas da família S100 no soro foi proposta como um biomarcador prospectivo para psoríase, uma vez que níveis aumentados de S100A7 e S100A8 foram detectados em amostras de sangue de pacientes psoriásicos não tratados em comparação com indivíduos saudáveis não psoriásicos. Além disso, foi relatado que a expressão gênica de S100A7 e S100A8 em lesões cutâneas psoriásicas é significativamente maior do que em amostras de pele saudável.28
Nossos resultados mostram que a S100A8 está presente em concentrações mais elevadas no FGC de pacientes com psoríase em comparação com controles saudáveis não psoriásicos, independentemente do estado de saúde/periodontal. No entanto, as concentrações de S100A7 entre os grupos não apresentaram diferenças. Portanto, em concordância com as evidências relatadas anteriormente, nossos resultados sugerem que a S100A8 pode ser uma proteína‐chave envolvida na patogênese da psoríase. Além disso, acreditamos que a S100A8 pode refletir a presença e a gravidade da psoríase, apresentando‐se como um biomarcador promissor, seguro e não invasivo para o diagnóstico precoce da doença, independentemente da saúde periodontal. Níveis aumentados de S100A8 nas amostras de FGC de indivíduos com psoríase podem ser explicados pela disseminação sistêmica das moléculas de lesões cutâneas psoriásicas ativas. É possível que as lesões cutâneas psoriásicas ativas possam funcionar como sítios locais para a produção maciça de S100A8, que então entra na corrente sanguínea em decorrência do aumento da permeabilidade vascular e viaja até locais distantes, como a gengiva.32
Em nosso estudo, observamos que as concentrações gerais de IL‐17A, IL‐22 e IL‐23 apresentaram tendência a estarem elevadas em pacientes com psoríase e periodontite moderada/grave (grupo SP) em comparação com pacientes com psoríase sem periodontite/com periodontite leve (grupo S). Esses achados podem ser atribuídos a um efeito local da periodontite. De acordo com a literatura, IL‐17, IL‐22 e IL‐23 estão associadas à osteoclastogênese na periodontite; entretanto, suas concentrações nos fluidos orais de pacientes periodontais permanecem controversas.17,33–35 Em um estudo, os níveis de IL‐17A no soro, saliva e FGC foram mais elevados em indivíduos com periodontite do que em controles saudáveis.36 Em contraste, outro estudo relatou níveis mais altos de IL‐17 no FGC de indivíduos saudáveis do que em indivíduos com periodontite crônica ou agressiva.37 Em relação à IL‐22, um estudo anterior não relatou diferenças nas concentrações salivares de IL‐22 em indivíduos com periodontite crônica em comparação a controles saudáveis.38 Entretanto, um estudo adicional relatou níveis mais elevados de IL‐22 no FGC de indivíduos com periodontite em comparação com o FGC de indivíduos com gengivite e indivíduos saudáveis.17 Em relação à IL‐23, um estudo relatou concentrações mais altas da molécula no FGC de pacientes com periodontite crônica versus controles saudáveis,39 enquanto R. Sadeghi et al. relataram concentrações mais altas de IL‐23 no FGC de indivíduos saudáveis em comparação com pacientes com periodontite crônica.37 Nossa teoria é que essas discrepâncias podem ser devidas às diferenças nos métodos utilizados para quantificar as concentrações das proteínas mencionadas, bem como resultado da ausência de consenso em relação a como definir os casos clínicos de periodontite.23
Anteriormente, foi relatada a detecção de IL‐17 no soro e na pele de pacientes com psoríase, embora não no FGC. As diferenças na concentração de IL‐17 em amostras de soro de pacientes com psoríase em relação às de controles saudáveis são controversas.5,40,41 Entretanto, as biópsias de pele psoriásica mostraram maior expressão de IL‐17A do que aquelas de indivíduos saudáveis.42 As diferenças entre nossos resultados e os relatados na literatura podem ser decorrentes de diferentes momentos na história da psoríase.5 Não há estudos anteriores relatando a presença de IL‐17 no FGC de indivíduos com psoríase com ou sem periodontite; entretanto, níveis mais altos de IL‐17A foram detectados no FGC de indivíduos com outras doenças autoimunes e periodontite. Esse é o caso de pacientes com artrite reumatoide e periodontite, que apresentaram níveis mais elevados de IL‐17A em comparação a indivíduos sistemicamente saudáveis com doença periodontal.43 Além disso, um estudo experimental em animais mostrou um aumento na produção de IL‐17 pelas células T dos linfonodos em camundongos artríticos com periodontite em comparação com camundongos artríticos sem periodontite.44 Outro estudo mostrou que a periodontite parece alterar os níveis de IL‐17 em amostras de tecido gengival de ratos artríticos.45
Em relação à psoríase, foi relatado que IL‐22 e IL‐23 são necessárias para induzir lesões semelhantes à psoríase em modelos animais.46,47 De modo análogo a nossos resultados, alguns estudos não relataram diferenças nos níveis de IL‐22 e IL‐23 no soro de pacientes com psoríase versus aqueles de controles saudáveis.48,49 Por outro lado, apenas um estudo relatou concentrações aumentadas de IL‐22 e IL‐23 no soro de pacientes com psoríase versus aqueles de controles saudáveis não psoriásicos.5 Esses achados sugerem que a IL‐22 e a IL‐23 podem atuar preferencialmente a nível local na psoríase. Todos esses antecedentes apoiam o papel potencial da periodontite na tendência a níveis elevados de IL‐17, IL‐22 e IL‐23 no grupo SP em comparação com o grupo S mostrado em nosso estudo. Os casos sem periodontite/com periodontite leve nos grupos H e S podem ter parcialmente mascarado as diferenças líquidas entre controles saudáveis sem periodontite e pacientes com periodontite neste estudo.
Em relação às correlações entre os mediadores inflamatórios de FGC e doença periodontal, verificamos que o grupo H apresentou correlação negativa entre os níveis de IL‐17A e NCI, enquanto o grupo P apresentou uma correlação positiva entre IL‐22 e PS e NCI. Nossos achados indicam que esses mediadores inflamatórios participam da patogênese da doença periodontal, o que foi sugerido anteriormente na literatura, uma vez que ambas as IL foram associadas à osteoclastogênese na doença periodontal.17,35
Embora a via IL‐23/Th17 faça parte da inflamação cutânea na psoríase, detectamos uma correlação negativa entre IL‐23 e PGA no grupo S. Além disso, também detectamos uma correlação negativa entre IL‐22 e IL‐23 no grupo SP. Esse resultado pode ser explicado pelo fenótipo divergente na psoríase.24 Que seja de nosso conhecimento, este estudo é o primeiro a relatar que os níveis de S100A8 no FGC se correlacionam positivamente com ASC, PASI e DLQI em indivíduos com psoríase, sugerindo que S100A8 no FGC pode servir como um potencial biomarcador de presença e gravidade da psoríase. Isso pode ser justificado pela alta expressão de S100A8 na epiderme da pele psoriásica.50
Este estudo piloto apresenta um pequeno tamanho amostral, que reconhecemos ser uma limitação. No entanto, o número de indivíduos incluídos tornou possível a identificação de alterações no FGC de indivíduos com e sem psoríase. Portanto, mais estudos são essenciais para elucidar a relação potencial entre periodontite e psoríase.
ConclusõesConcluímos que a concentração de S100A8 foi mais alta no FGC de pacientes com psoríase, independentemente de seu estado de saúde/periodontal. Além disso, a S100A8 no FGC foi associada à gravidade da psoríase. As concentrações de IL e S100A7 foram semelhantes no FGC de pacientes psoriásicos com ou sem periodontite, em comparação a controles saudáveis. Portanto, as moléculas imunes avaliadas no FGC no presente estudo não parecem refletir uma relação entre a periodontite e a psoríase.
Suporte financeiroEsta pesquisa recebeu apoio financeiro por meio de uma concessão da Dirección General de Investigación de la Universidad Andrés Bello (DGI‐UNAB), número DI‐36‐18/CBC e Fondecyt 1160741.
Contribuição dos autoresConstanza Jiménez: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; preparação e redação do manuscrito; coleta, análise e interpretação de dados; participação intelectual na conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Daniela Carvajal: Aprovação da versão final do manuscrito; preparação e redação do manuscrito; coleta, análise e interpretação de dados; participação intelectual na conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Marcela Hernández: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; preparação e redação do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual na conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Fernando Valenzuela: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; participação intelectual na conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Jessica Astorga: Aprovação da versão final do manuscrito; coleta, análise e interpretação dos dados; revisão crítica do manuscrito.
Alejandra Fernández: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; preparação e redação do manuscrito; coleta, análise e interpretação de dados; participação efetiva na orientação da pesquisa; participação intelectual na conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Jiménez C, Carvajal D, Hernández M, Valenzuela F, Astorga J, Fernández A. Levels of the interleukins 17A, 22, and 23 and the S100 protein family in the gingival crevicular fluid of psoriatic patients with or without periodontitis. An Bras Dermatol. 2021;96:163–70.
Trabalho realizado na Universidad Andrés Bello e Universidad de Chile, Hospital San José, Santiago, Chile.