Os nevos de Spitz são geralmente proliferações benignas e solitárias de melanócitos epitelioides. Vários subtipos clínicos e histopatológicos de nevos de Spitz foram relatados na literatura ao longo do tempo. A variante eruptiva do nevo de Spitz foi relatada em 34 casos até agora. A análise genética foi realizada em sete deles. No presente relato, os autores apresentam uma paciente com centenas de nevos de Spitz em seu corpo com surgimento em apenas dois meses e revisam a literatura atual incluindo estudos genéticos.
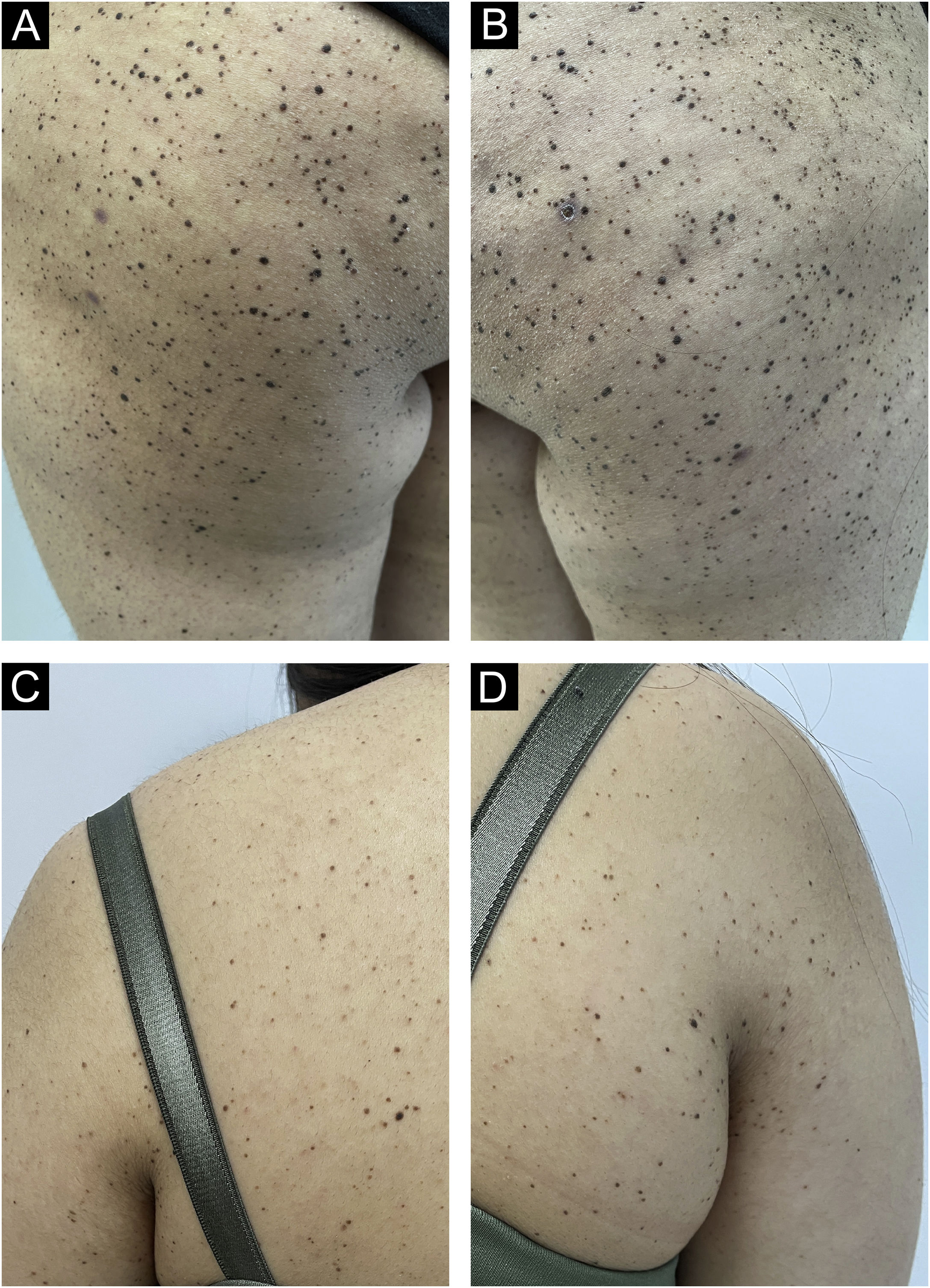
Uma jovem de 17 anos apresentou múltiplos nevos começando na região glútea e espalhando‐se pela região dorsal e pernas nos últimos dois meses. Ela era saudável e não tinha histórico de uso de drogas. Não apresentava queixas de prurido ou sangramento nas lesões. Não havia sardas em seu rosto, e a paciente não descreveu fotossensibilidade. Não foram identificadas síndromes caracterizadas por múltiplos lentigos, nenhuma doença genética conhecida na família, nenhuma exposição solar intermitente ou contínua nas regiões anatômicas comprometidas. No exame dermatológico, foram observados centenas de nevos papulosos, de coloração marrom‐avermelhada, com diâmetro <0,5cm, nas pernas e na parte superior do tronco, principalmente nas regiões glúteas (fig. 1). Algumas lesões compatíveis com nevo de Spitz foram observadas na região cervical, com relato de aparecimento recente.
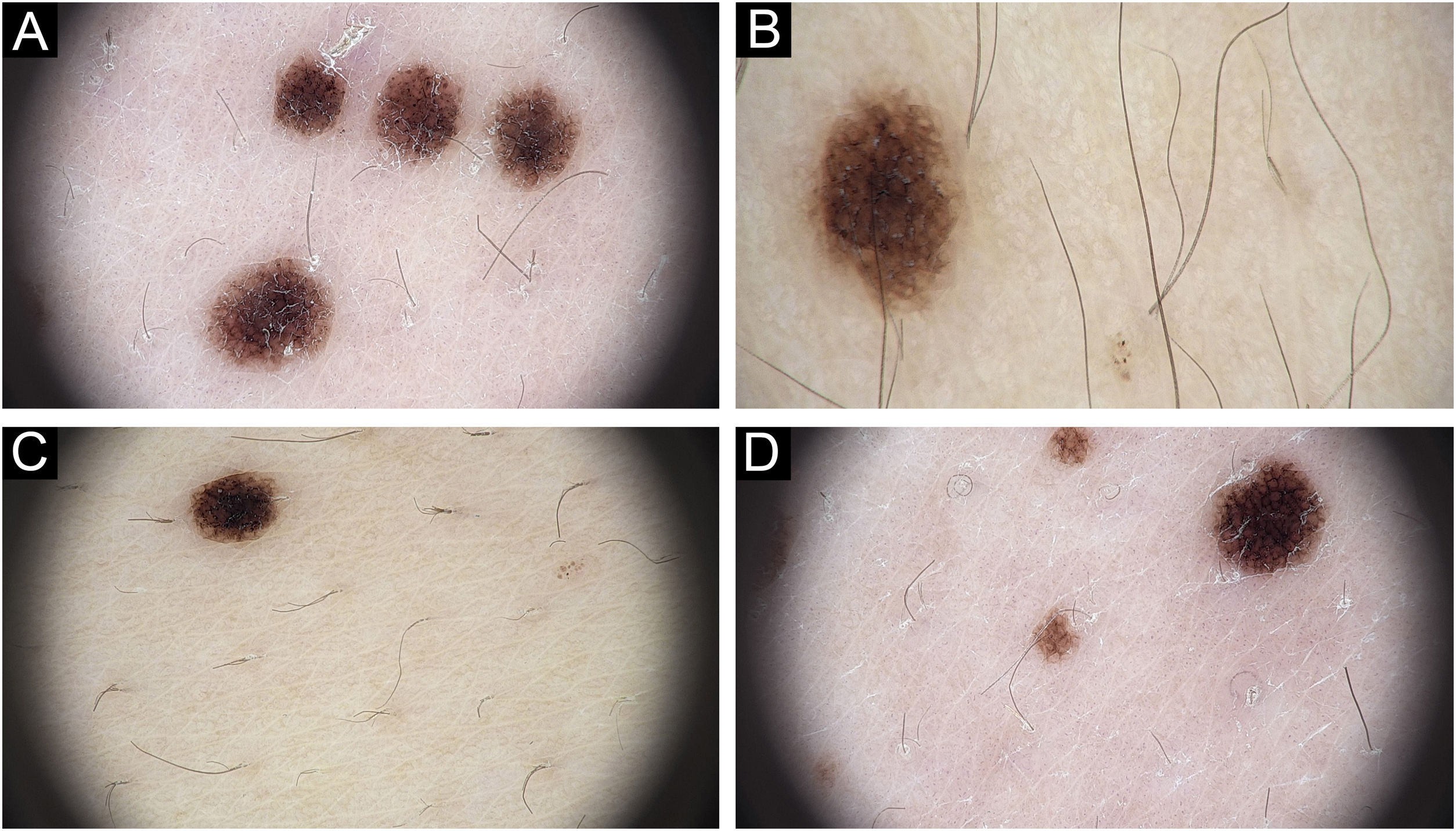
Ao exame dermatoscópico, observava‐se padrão reticular, mais escuro no centro e mais claro na periferia, além de glóbulos na periferia das lesões (fig. 2).
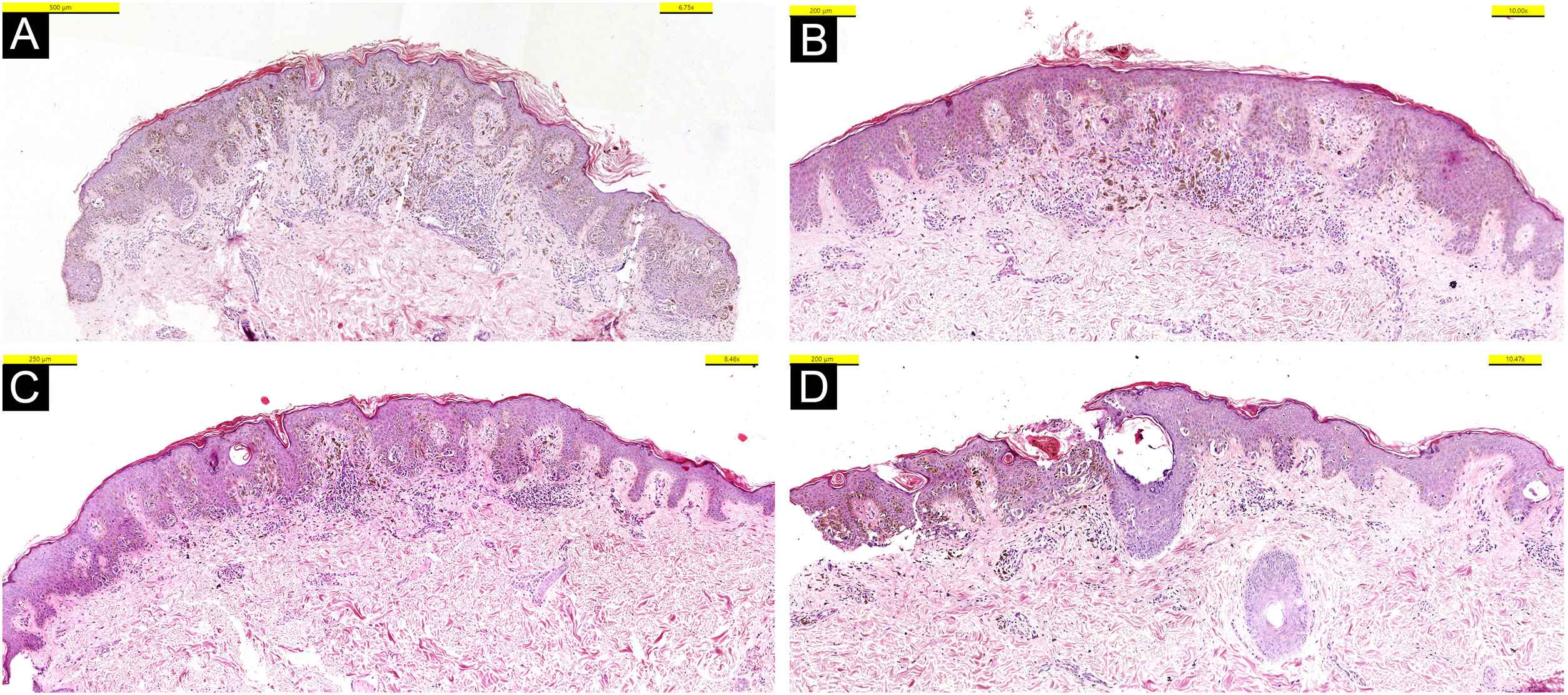
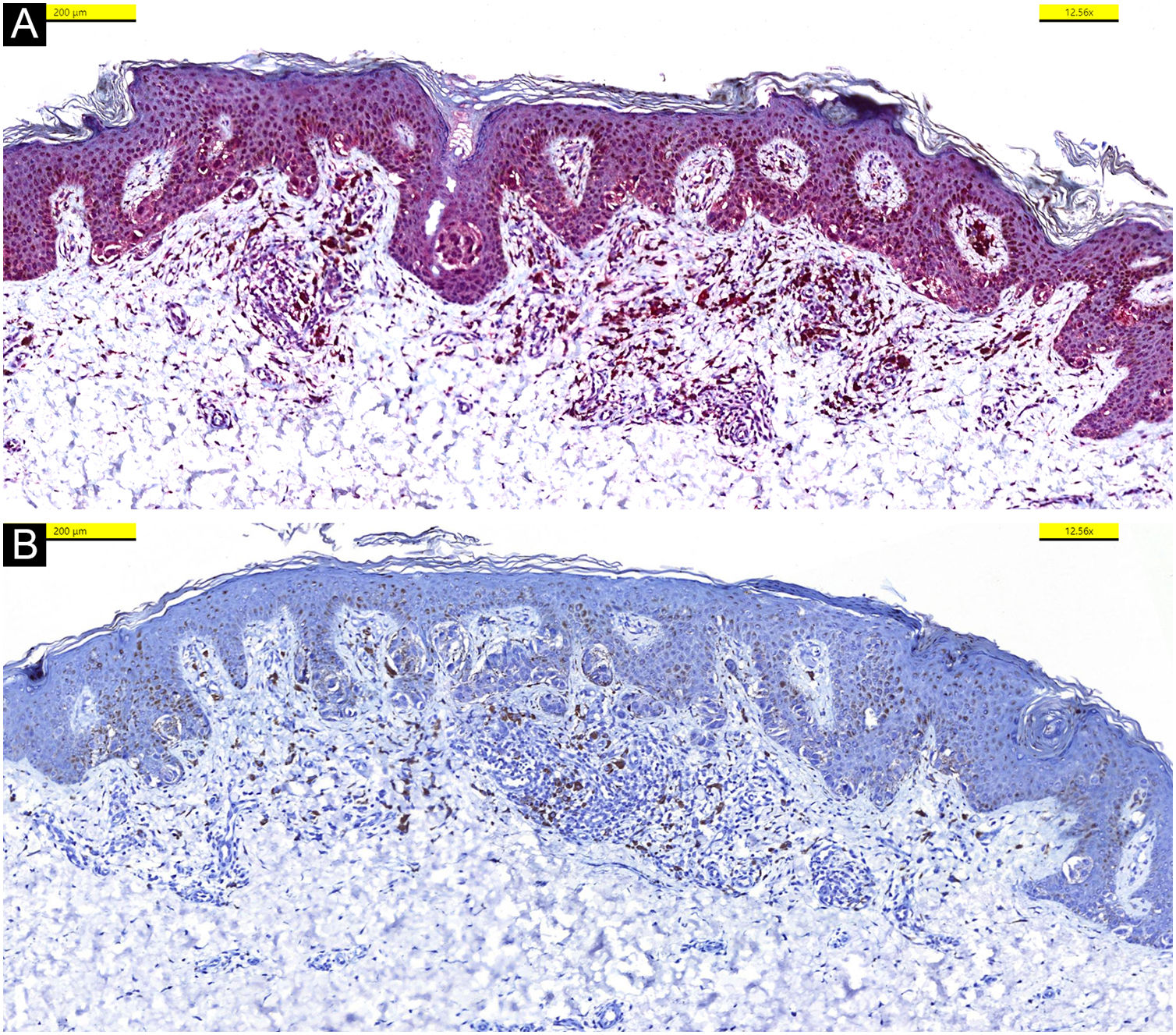
Na histopatologia em cortes de quatro lesões corados com hematoxilina & eosina (HE) foram observados ninhos melanocíticos discoesivos simétricos, juncionais, localizados e pigmentados, com células fusiformes e áreas de disseminação pagetoide (fig. 3). Atipia de pequeno grau foi observada em alguns melanócitos. Foi observada imunorreatividade difusa e forte com S100, MelanA, e HMB45. Além disso, foi observado PRAME negativo, sem perda de expressão do BAP‐1. Assim, foram excluídos os diagnósticos de melanoma metastático e de nevos de Spitz com perda de expressão de BAP‐1, que são considerados no diagnóstico diferencial (fig. 4).
Uma lesão maior que as outras foi excisada para análise genética. Nenhuma mutação foi detectada na sequência do gene HRAS no sequenciamento de próxima geração (NextGENe e Geneticist Assistant) e no gene ROS1 em análises FISH (CytoCell ROS1 Breakapart FISH Probe).
À luz dos dados clínicos e patológicos, a paciente foi diagnosticada com nevo de Spitz eruptivo disseminado. Foi recomendada forte proteção contra a luz solar e seguimento em intervalos de seis meses.
Os nevos de Spitz são lesões melanocíticas papulosas geralmente observadas na cor vermelho‐rosada, mas também podem apresentar tons marrons. As formas solitárias são a variante mais comum dos nevos de Spitz. A forma eruptiva é extremamente rara e tem sido relatada principalmente na adolescência mas também posteriormente. Nos casos relatados, as lesões geralmente se formaram e se espalharam ao longo de meses a anos. Curiosamente, neste caso, as lesões espalharam‐se muito rapidamente num curto período de dois meses.
Embora a etiopatogenia exata não seja conhecida, existem algumas teorias. Alguns fatores como medicamentos, uso de citocinas, imunossupressão, condições inflamatórias, gravidez, dermatite atópica e radioterapia são considerados responsáveis pela formação de lesões, que também foram relatadas em pessoas completamente saudáveis, como no presente caso.1–6
Até o momento, algumas teorias sobre a etiopatogenia foram propostas. Uma delas é que os nevos provavelmente se espalham ao longo das redes neurovasculares e linfáticas. Biopsias de linfonodo sentinela positivas são consideradas como evidência favorável a essa teoria.7 Mosaicismo embrionário foi sugerido em virtude do padrão de disseminação cutânea.7 De acordo com outra teoria, foi sugerido tropismo das células dos nevos para os locais onde ocorrem as lesões, e afirmou‐se que essas permanecem latentes na pele até que ocorra um fator desencadeante.8
Mutações nos genes HRAS, ROS1, NTRK1, ALK, BRAF e RET foram demonstradas em muitos casos de nevo de Spitz. Como essas mutações genéticas não são encontradas em todas as formas eruptivas evoca a ideia de que possa haver outras vias genéticas.7,9–11 Nenhuma mutação foi detectada nos genes HRAS e ROS1 neste caso de nevo de Spitz eruptivo.
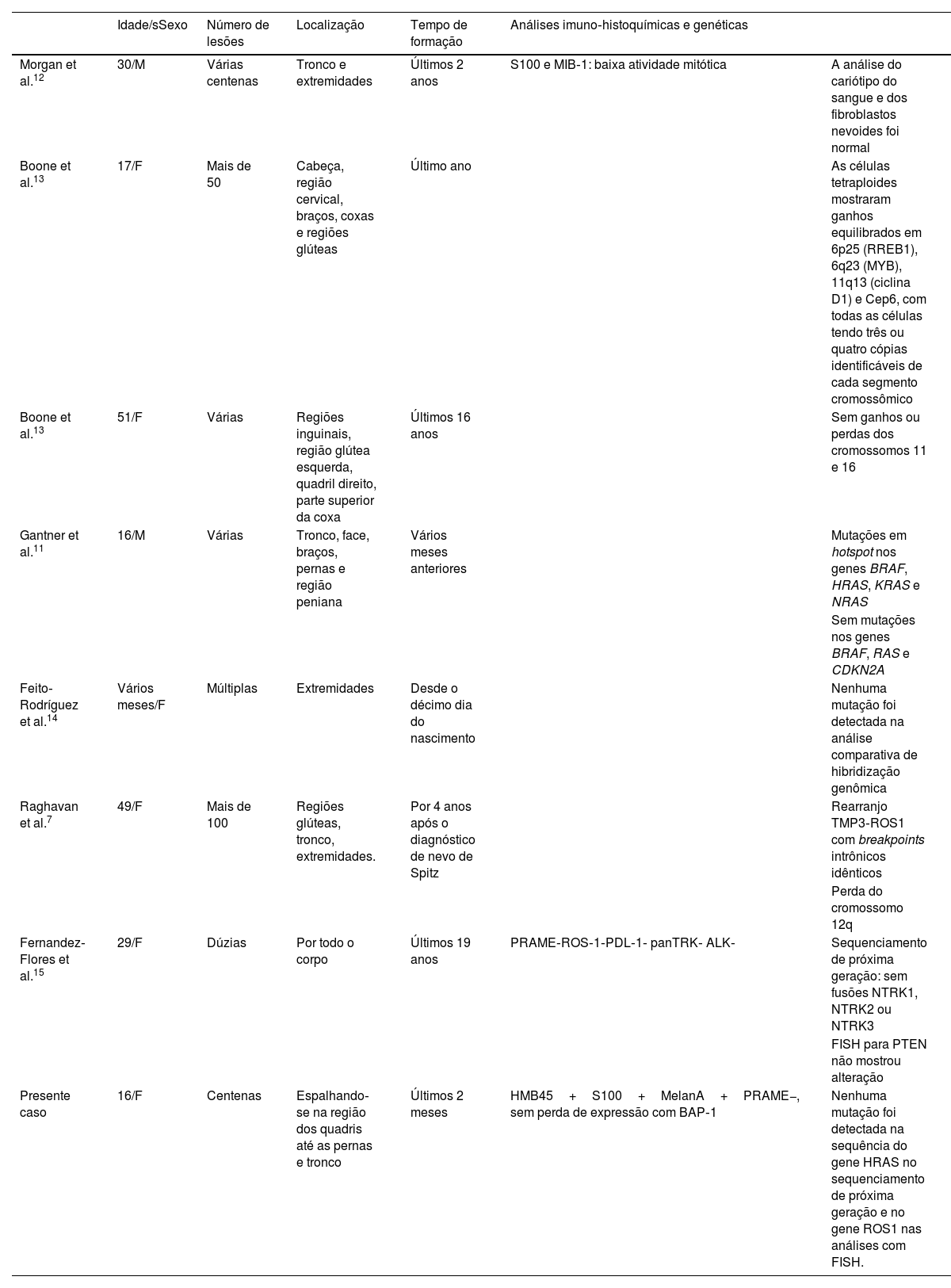
A tabela 1 apresenta o resumo dos resultados das análises demográficas, clínicas e genéticas dos casos de nevo de Spitz eruptivo que foram submetidos à análise genética.
Características gerais e resultados de análises genéticas dos casos de nevos de Spitz eruptivos analisados geneticamente até o momento
| Idade/sSexo | Número de lesões | Localização | Tempo de formação | Análises imuno‐histoquímicas e genéticas | ||
|---|---|---|---|---|---|---|
| Morgan et al.12 | 30/M | Várias centenas | Tronco e extremidades | Últimos 2 anos | S100 e MIB‐1: baixa atividade mitótica | A análise do cariótipo do sangue e dos fibroblastos nevoides foi normal |
| Boone et al.13 | 17/F | Mais de 50 | Cabeça, região cervical, braços, coxas e regiões glúteas | Último ano | As células tetraploides mostraram ganhos equilibrados em 6p25 (RREB1), 6q23 (MYB), 11q13 (ciclina D1) e Cep6, com todas as células tendo três ou quatro cópias identificáveis de cada segmento cromossômico | |
| Boone et al.13 | 51/F | Várias | Regiões inguinais, região glútea esquerda, quadril direito, parte superior da coxa | Últimos 16 anos | Sem ganhos ou perdas dos cromossomos 11 e 16 | |
| Gantner et al.11 | 16/M | Várias | Tronco, face, braços, pernas e região peniana | Vários meses anteriores | Mutações em hotspot nos genes BRAF, HRAS, KRAS e NRAS | |
| Sem mutações nos genes BRAF, RAS e CDKN2A | ||||||
| Feito‐Rodríguez et al.14 | Vários meses/F | Múltiplas | Extremidades | Desde o décimo dia do nascimento | Nenhuma mutação foi detectada na análise comparativa de hibridização genômica | |
| Raghavan et al.7 | 49/F | Mais de 100 | Regiões glúteas, tronco, extremidades. | Por 4 anos após o diagnóstico de nevo de Spitz | Rearranjo TMP3‐ROS1 com breakpoints intrônicos idênticos | |
| Perda do cromossomo 12q | ||||||
| Fernandez‐Flores et al.15 | 29/F | Dúzias | Por todo o corpo | Últimos 19 anos | PRAME‐ROS‐1‐PDL‐1‐ panTRK‐ ALK‐ | Sequenciamento de próxima geração: sem fusões NTRK1, NTRK2 ou NTRK3 |
| FISH para PTEN não mostrou alteração | ||||||
| Presente caso | 16/F | Centenas | Espalhando‐se na região dos quadris até as pernas e tronco | Últimos 2 meses | HMB45+S100+MelanA+PRAME−, sem perda de expressão com BAP‐1 | Nenhuma mutação foi detectada na sequência do gene HRAS no sequenciamento de próxima geração e no gene ROS1 nas análises com FISH. |
Adaptada e ampliada de Fernandez‐Flores et al.15
A etiopatogênese do nevo eruptivo de Spitz ainda não foi totalmente elucidada. Considerando a faixa etária das pessoas afetadas, a ideia de que os melanócitos spitzoides proliferam como resultado de um gatilho ainda desconhecido no contexto genético apropriado parece plausível. O fato de haver grande diferença na velocidade de formação dos nevos nos casos relatados pode indicar processos diferentes em pessoas diferentes, ao invés de um único processo fisiopatológico. Já existe grande variedade de análises genéticas porém mais estudos são necessários para entender completamente esse fenômeno.
Suporte financeiroNenhum.
Contribuição dos autoresEmre Zekey: Pesquisa de literatura, concepção do estudo e redação do manuscrito.
Seher Darakcı: Exame histopatológico.
Conflito de interessesNenhum.
Os autores gostariam de agradecer ao Prof. Dr. Cuyan Demirkesen, pela ajuda durante o exame histopatológico e com a documentação fotográfica.
Como citar este artigo: Zekey E, Darakcı S. Eruptive disseminated spitz nevus: a case report and review of the genetic aspect of the disease. An Bras Dermatol. 2024;99:307–11.
Trabalho realizado no Departamento de Patologia, Sivas Numune Hospital, Sivas, Turquia.