O líquen plano pilar e a alopecia fibrosante frontal são alopecias cicatriciais primárias cujo diagnóstico pode ser sugerido pela clínica e tricoscopia, principalmente em estágios iniciais, mas a biópsia de couro cabeludo é o exame padrão para o diagnóstico definitivo. A alopecia fibrosante frontal é considerada variante do líquen plano pilar, pois os achados histopatológicos são semelhantes, com infiltrado linfo‐histiocitário perifolicular, por vezes de padrão liquenoide. O exame clínico minucioso, a tricoscopia e a documentação fotográfica são essenciais para avaliar evolução e resposta terapêutica. Até o momento, não existem tratamentos validados ou diretrizes para essas doenças, mas há recomendações que variam com as características individuais de cada paciente. Neste artigo, apresentamos revisão ampla da literatura, incluindo atualização de tópicos relacionados ao diagnóstico, seguimento, aspectos histopatológicos e tratamentos disponíveis para o líquen plano pilar e a alopecia fibrosante frontal, ressaltando suas semelhanças, diferenças e peculiaridades.
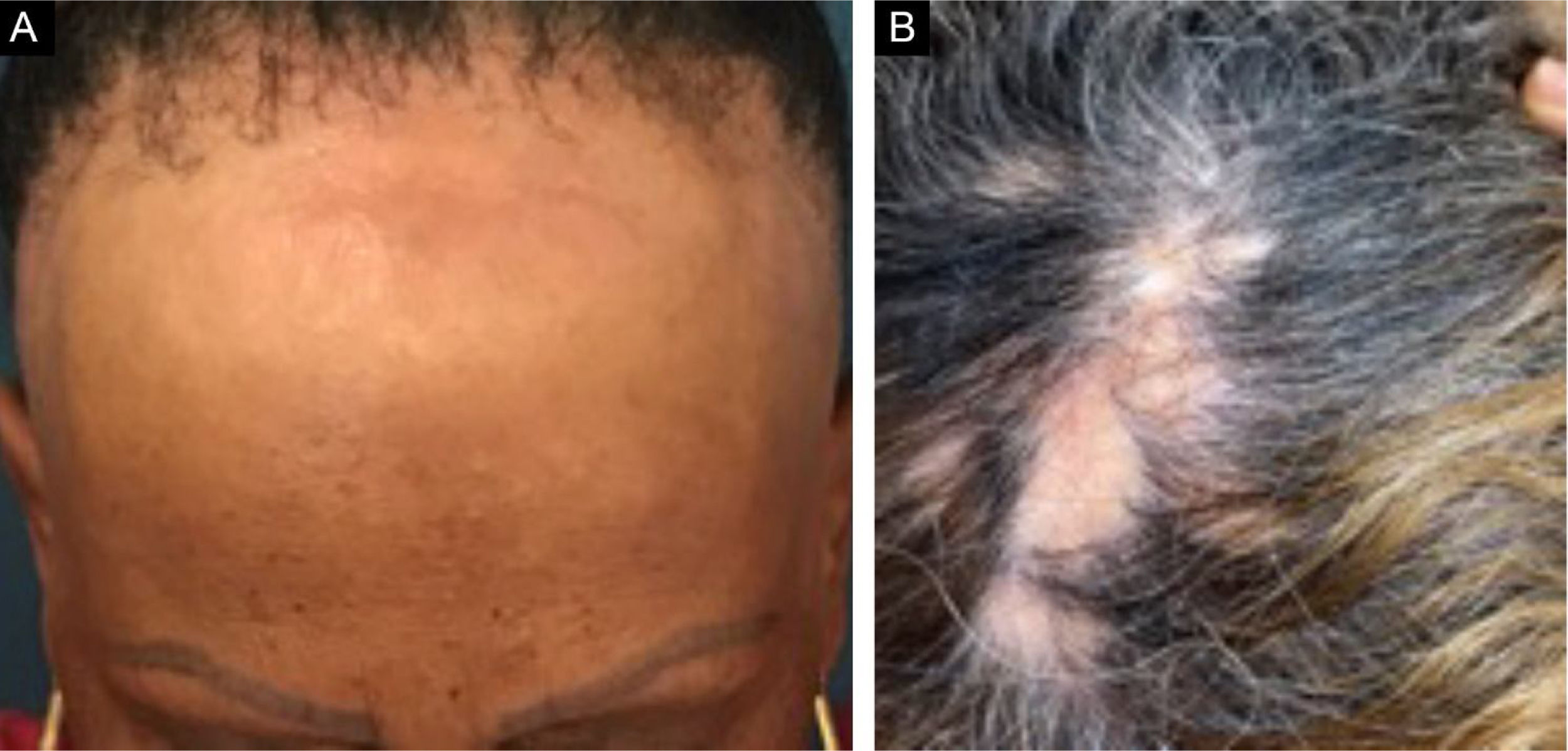
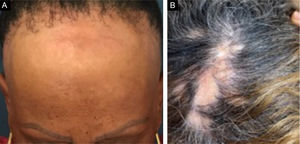
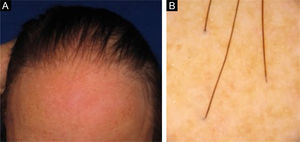
A alopecia fibrosante frontal (AFF) é alopecia cicatricial linfocítica primária, considerada variante do líquen plano pilar (LPP) pelos aspectos histológicos. Clinicamente, a AFF causa perda capilar de forma lenta na linha de implantação frontotemporal associada comumente à alopecia nos supercílios. Além do couro cabeludo, outras manifestações podem surgir, como líquen plano pigmentoso, pápulas da face, perda de pelos do corpo, lesões hipocrômicas, eritema difuso em face e pescoço e evidência de veias frontais. Já o LPP clássico manifesta área de alopecia irregular mais comum em região de vértice, única ou multifocal, podendo ocorrer em outros locais do couro cabeludo, mas sem distribuição característica em faixa (fig. 1). A síndrome de Graham‐Little‐Piccardi‐Lassueur (SGL) é um subtipo mais raro de LPP, caracterizado por alopecia cicatricial no couro cabeludo, perda de pelos não cicatricial em regiões axilares e pubianas e surgimento de pápulas foliculares liquenoides no tronco e extremidades.
Neste artigo, procuramos revisar aspectos diagnósticos, atividade inflamatória, seguimento e tratamentos das duas doenças, destacando suas semelhanças, diferenças e peculiaridades.
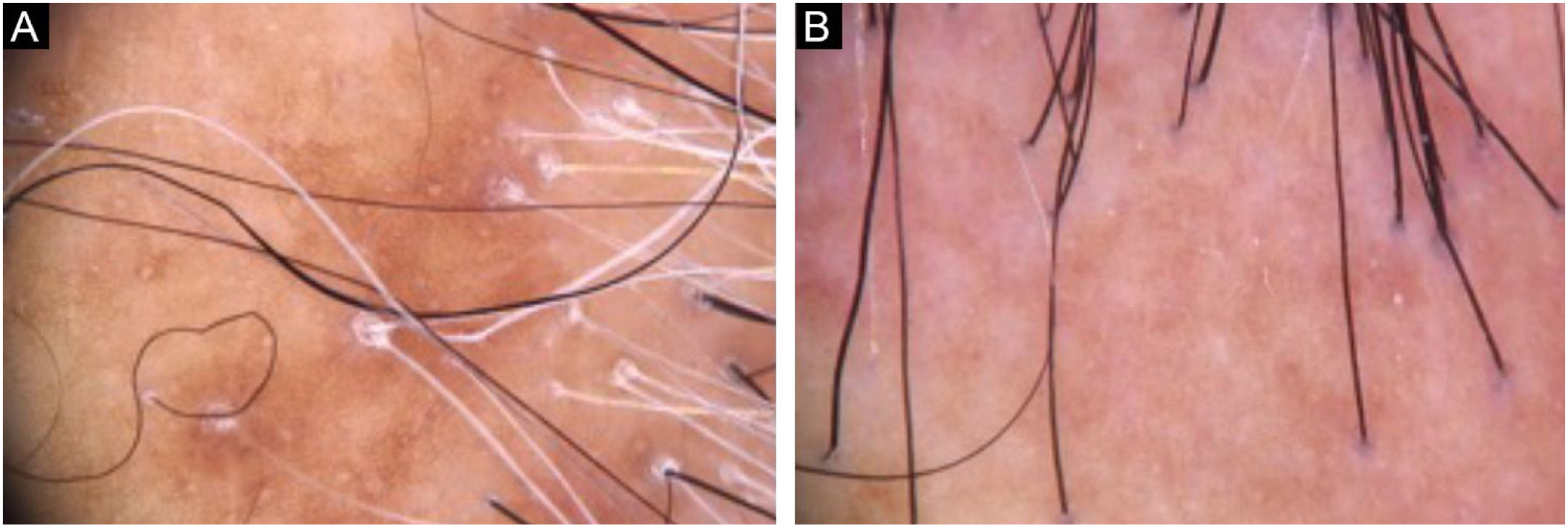
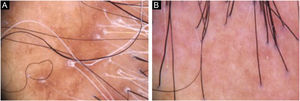
Diagnóstico e seguimentoA presença de achados clínicos e tricoscópicos característicos de LPP ou de AFF poderia substituir a realização de biópsia de couro cabeludo na opinião de alguns autores.1 Nas alopecias cicatriciais, as características individuais de cada doença nos quadros clínicos iniciais podem direcionar para a definição diagnóstica. No entanto, observa‐se superposição de muitos achados clínicos em entidades distintas (fig. 2). É unânime a necessidade de biópsia de couro cabeludo para casos duvidosos. O local deve ser escolhido com auxílio da tricoscopia.2 Além disso, apenas o exame histopatológico é suficiente para documentação incontestável de fibrose e avaliação do processo inflamatório com quantificação do infiltrado perifolicular envolvido em cada doença, impactando na escolha terapêutica, acompanhamento e prognóstico.
Uma lista de critérios diagnósticos para AFF foi proposto por Vañó‐Galván et al. em publicação de 2018.3 Os critérios maiores são: alopecia cicatricial do couro cabeludo em região frontotemporal (na ausência de pápulas foliculares queratóticas no corpo) e alopecia difusa bilateral de supercílios. Os critérios menores incluem: tricoscopia com características típicas (eritema peripilar, descamação peripilar ou ambas), características histopatológicas de alopecia cicatricial com padrão de AFF ou LPP, envolvimento de outras áreas sugestivas de AFF (região occipital, face, costeletas, pelos do corpo) e presença de pápulas faciais não inflamatórias. O diagnóstico requer dois critérios maiores ou um critério maior e dois menores.
Não há exames laboratoriais específicos para o LPP ou para AFF. Estudos anteriores demonstraram ocorrência de LPP em doenças inflamatórias crônicas e autoimunes, além de prevalência significativa de doenças autoimunes e anormalidades da tireoide em pacientes de AFF, quando comparados com a população normal.1 Estudo caso‐controle apontou associação de hipotireoidismo, rosácea e LPP em mulheres com AFF, sugerindo a realização de testes para excluir comorbidades nesse grupo.4 Não é consenso a realização de triagem em todos os pacientes de LPP ou AFF.5
Algumas classificações de atividade de doença e de gravidade foram propostas para essas enfermidades nos últimos anos.
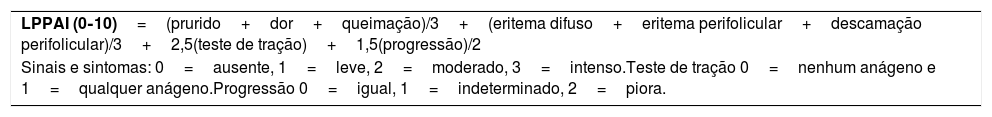
Em 2010, foi introduzido por Chiang et al. um índice de atividade do líquen plano pilar (LPPAI) para uma abordagem mais objetiva da evolução clínica e resposta terapêutica.6 O estudo incluiu 40 pacientes com LPP e AFF, dos quais 29 com LPP, sete com AFF e quatro com ambas as doenças. Até o momento, não existiam estudos com dados sistemáticos e objetivos de avaliação. O índice é composto por sintomas (prurido, dor e queimação), sinais (eritema difuso, eritema peripilar, descamação peripilar), teste de tração (presença de fio anágeno) e progressão (percepção de piora clínica pelo paciente) – tabela 1. A avaliação é realizada pelo exame físico, sem tricoscopia. O teste de tração é considerado positivo para alopecia cicatricial quando há saída de algum fio anágeno. Os autores atribuíram valores numéricos a esses marcadores subjetivos e objetivos, para um resumo quantitativo da atividade da doença, o LPPAI.6
Índice de enfermidades do líquen plano pilar (LPPAI)6
| LPPAI (0‐10)=(prurido+dor+queimação)/3+(eritema difuso+eritema perifolicular+descamação perifolicular)/3+2,5(teste de tração)+1,5(progressão)/2 |
| Sinais e sintomas: 0=ausente, 1=leve, 2=moderado, 3=intenso.Teste de tração 0=nenhum anágeno e 1=qualquer anágeno.Progressão 0=igual, 1=indeterminado, 2=piora. |
Fonte adaptada: Chiang C et al., 2010.6
Em 2016, Holmes et al. propuseram o índice de gravidade da AFF (FFASI) como método de avaliação para prática clínica e publicações científicas (tabela 2). O FFASI é compilado de duas formas: A e B. O FFASI‐A utiliza imagens clínicas da linha de implantação capilar divididas em quatro seções. A gravidade da alopecia é classificada de 1 a 5 com base no avanço da linha de implantação capilar. Além da extensão da área acometida, também são avaliados perda de supercílios, alterações extrafaciais como perda de pelos corporais, alterações em mucosas, presença de líquen plano pigmentoso, dentre outras medidas, que são pontuados como sem perda, perda parcial e perda total, e presente ou ausente, respectivamente. Todas as pontuações podem ser combinadas para obter uma pontuação máxima de 100. O FFASI‐B avalia as mesmas características, mas inclui pontuações para avaliar a inflamação e a densidade, bem como o envolvimento de outras áreas do corpo.7 Sugeriu‐se no estudo o registro em formulário para seguimento global da doença e comparação de resposta terapêutica. O critério de maior relevância, considerado pela experiência dos autores, foi a extensão e evolução clínica da área de alopecia.
Índice de gravidade da alopecia fibrosante frontal (FFASI)
| Extensão | Grau 1: ≤1cm; |
| Grau 2: 1 a 2,9cm; | |
| Grau 3: 3 a 4,9cm; | |
| Grau 4: 5 a 7,9cm; | |
| Grau 5: ≥ 8cm | |
| Margem do couro cabeludo | Grau 1 a 5 |
| (Sem perda=escore 0; Grau 1=escore 4; | |
| Grau 2=escore 8; Grau 3=escore 12; | |
| Grau 4=escore 16; Grau 5=escore 20) | |
| Frontal | |
| Lateral Direita | |
| Lateral Esquerda | |
| Posterior | |
| Banda Frontal | escore 0=sem inflamação e densidade normal; |
| escore 2=inflamação ou redução de densidade; | |
| escore 4=inflamação e redução de densidade | |
| Total | /84 |
| Alopecia em outros pelos | Ausente=escore 0 |
| Perda parcial=escore 1 | |
| Perda total=escore 2 | |
| Supercílios | |
| Cílios | |
| Flexurais (axilas, pubianos) | |
| Membros superiores | |
| Membros inferiores | |
| Outros achados | Ausente=escore 0 |
| Presente=escore 1 | |
| LPP clássico | |
| Pápulas da face | |
| LP cutâneo e variantes | |
| LP de mucosa oral | |
| LP de mucosa genital | |
| LP ungueal | |
| Total | /16 |
| Total combinado | /100 |
LPP, líquen plano pilar; LP, líquen plano.
Fonte adaptada: Holmes S et al., 2016.7
Alguns autores criticam o sistema de pontuação FFASI por considerarem complexo para a prática clínica, com critérios que não representam bem o prognóstico da AFF e não tem validação. Em função disso, em 2018 foi proposto um novo índice de gravidade da AFF (FFASS), que incluiu características clínicas como extensão de alopecia frontotemporal, perda de supercílio, eritema peripilar, descamação peripilar, prurido e dor (tabela 3). O escore de gravidade variou de 0 a 25 (o valor mais alto corresponde ao de maior gravidade).8 Embora o FFASS seja mais simples para aplicação prática, quando comparado com o FFASI, também apresenta limitações. Não há dados de tricoscopia e todos os pacientes avaliados eram do sexo feminino.
Pontuação de gravidade da alopecia fibrosante frontal (FFASS)8
| Sinais clínicos | |
| 1. Alopecia do couro cabeludo (medição da cicatriz em forma de faixa) | |
| Regiões: | __/10 |
| Frontal | __/5 |
| Temporal esquerda | __/5 |
| Temporal direita | |
| <1cm (1) 1‐2,99cm (2) 3‐4,99cm (3) 5‐6,99cm (4)> 7cm (5) | |
| 2. Perda de supercílios | |
| Não (0) Parcial (0,5) Total (1) | __/1 |
| Extensão | __/21 |
| 3. Inflamação peripilar | |
| A. Intensidade | |
| Eritema peripilar: Ausente (0), leve (0,1), intensa (0,2) | __/0,2 |
| Descamação peripilar: Ausente (0), leve (0,5), intensa (1) | __/1 |
| B. Extensão na linha frontotemporal | |
| Eritema peripilar:<25% (0); 25%‐75% (0,1);> 75% (0,2) | |
| Descamação peripilar: <25% (0); 25%‐75% (0,5);> 75% (1) | |
| Sintomas associados | |
| 1. Prurido | __/0,2 |
| Intensidade e frequência: ausente (0); leve ou ocasional (0,1), intenso | |
| 2. Dor | __/0,6 |
| Intensidade e frequência: ausente (0); leve ou ocasional (0,3), intenso ou diário (0,6) | |
| Grau de inflamação | __/4 |
| Total FFASS score | __/25 |
Fonte adaptada: Saceda‐Corralo D et al., 2018.8
Na prática clínica, observamos que muitos pacientes em seguimento para LPP e AFF, sem sintomas ou sinais inflamatórios, continuam com progressão da área de alopecia. Por outro lado, estudo com 62 mulheres com AFF documentou que uma em cada quatro pacientes em tratamento, mesmo com estabilidade da doença, apresentou persistência dos sintomas e sinais inflamatórios. Além disso, algumas pacientes tiveram piora e progressão da alopecia, sem sinais inflamatórios, sugerindo que infiltrados inflamatórios restritos ao istmo não sejam visíveis na superfície da pele.9
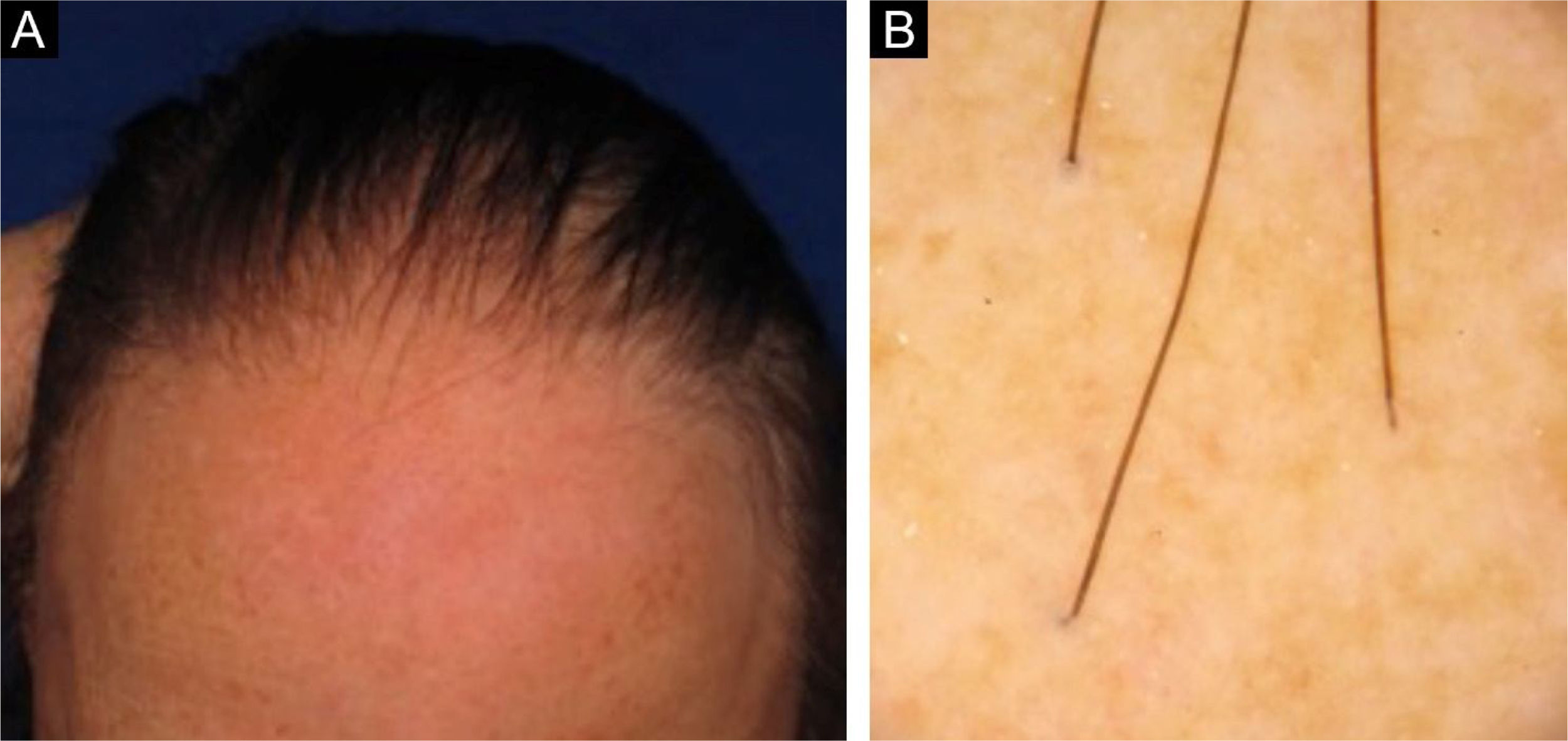
Nas figuras 3 e 4, demonstramos imagem clínica de região frontotemporal, tricoscopia e histopatológico de paciente com AFF de nosso centro de atendimento especializado, sem sintomas ou sinais ao exame físico, com descamação peripilar discreta na tricoscopia, mas com infiltrado inflamatório liquenoide importante em istmo e segmento inferior na histologia.
O grau de progressão da AFF é difícil de prever, mas alguns estudos citam fatores relacionados ao prognóstico. Padrão clínico de acometimento difuso do recesso frontotemporal, perda de cílios, perda de pelos corporais e presença de pápulas faciais foram indicadores de mau prognóstico.1,10 Já padrão clínico de pseudofranja, acometimento inicial de supercílios e idade mais jovem de início foram associados ao curso menos grave.10,11
Aspectos histopatológicosA biópsia do couro cabeludo permite a confirmação diagnóstica de alopecia cicatricial. Deve ser realizada com punch de 4mm; uma amostra deve ser submetida à secção vertical e a outra, transversal. O corte transversal ou horizontal garante a visualização de todos os folículos da amostra em diferentes níveis de profundidade. O corte vertical ou longitudinal é apropriado para avaliação de alopecias com alterações patológicas na epiderme e interface dermo‐epidérmica (p. ex., lúpus eritematoso).12
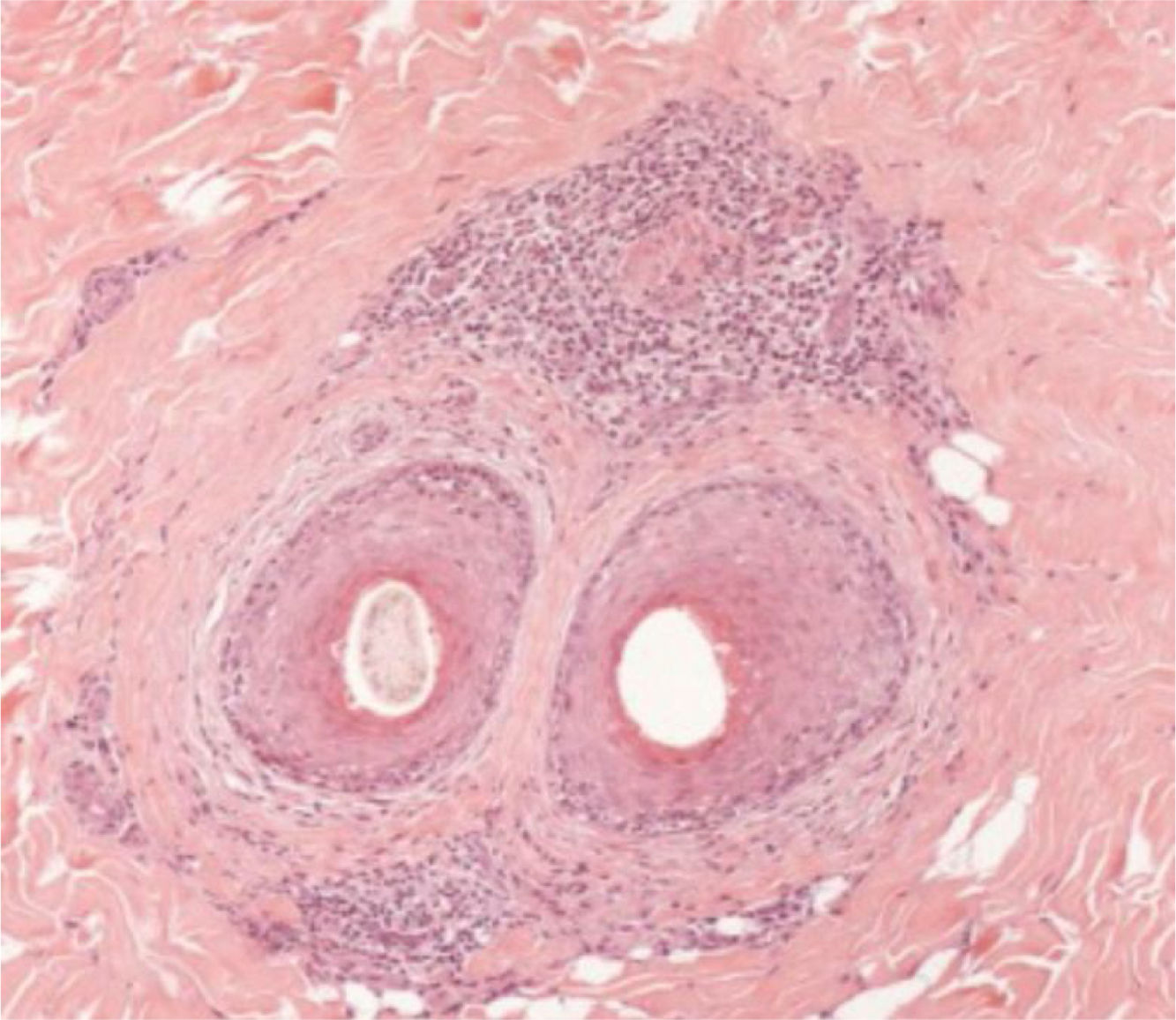
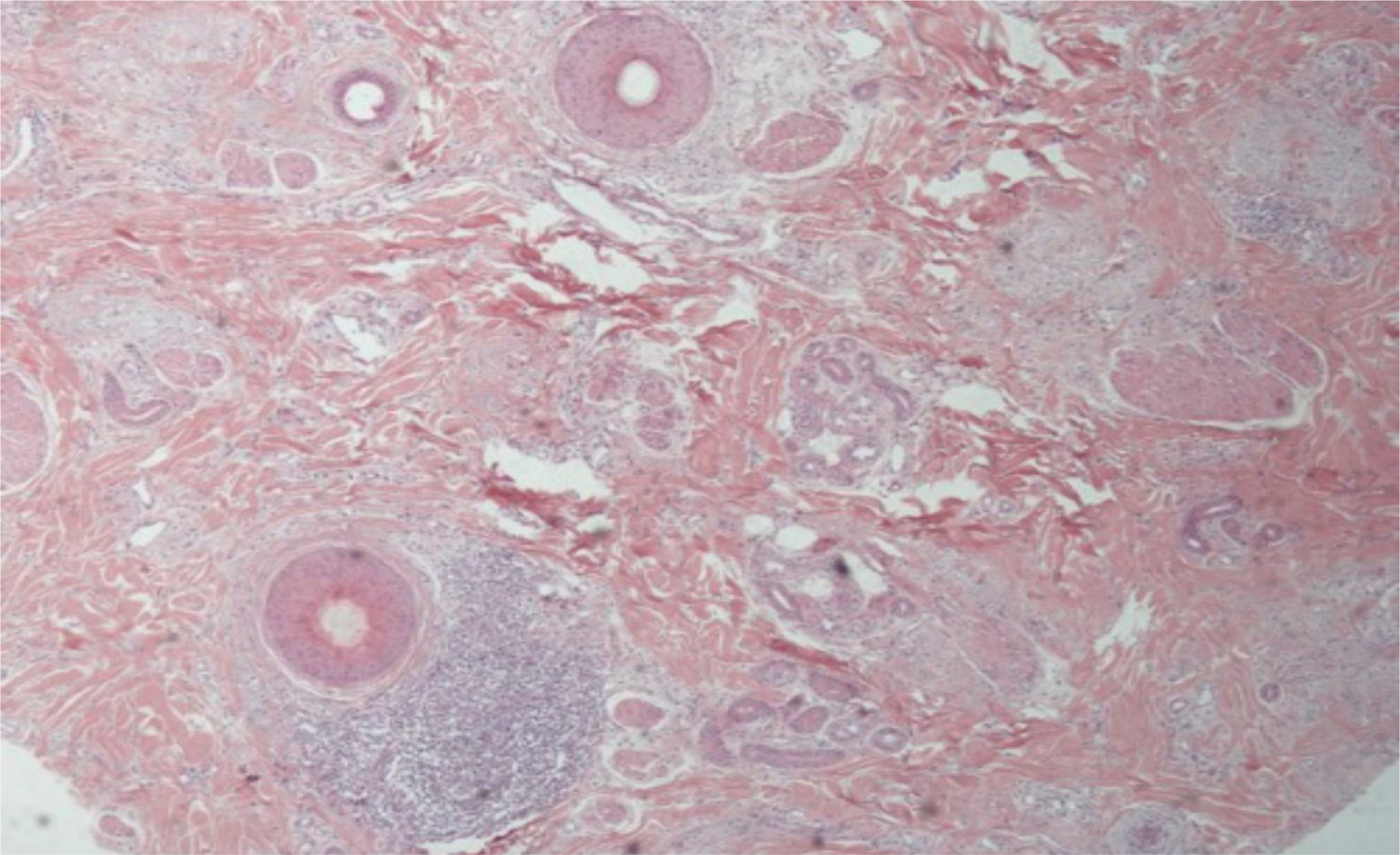
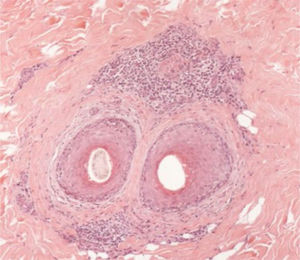
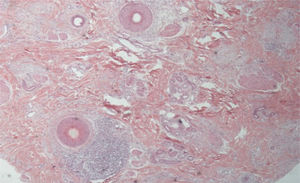
As alterações histológicas encontradas no LPP são: infiltrado linfo‐histiocitário perifolicular, por vezes de padrão liquenoide, mais proeminente na porção superior (região de istmo e infundíbulo); degeneração vacuolar de células basais, queratinócitos necróticos e fenda artefactual entre o folículo e o manto fibroso perifolicular; fibrose perifolicular pode ser observada separando o infiltrado inflamatório do folículo (fig. 5). Com o tempo, há redução e perda das glândulas sebáceas e destruição de todo folículo piloso, que é substituído por tecido conjuntivo.13
A imunofluorescência direta (IFD) é usada para detectar depósitos de anticorpos nos tecidos lesional e perilesional. Demonstrou‐se útil no diagnóstico diferencial de algumas alopecias cicatriciais como LPP e lúpus eritematoso. A IFD no LPP, quando positiva, evidencia um padrão de depósitos globulares, corpos citoides (geralmente IgM) agrupados adjacente ao epitélio folicular, deposição irregular de fibrinogênio e depósito de C3 na derme papilar. Depósitos lineares de imunorreativos em banda (IgG, IgM e C3) são típicos do lúpus eritematoso (LE).13
A AFF é considerada variante do LPP por apresentar achados histológicos indistinguíveis (fig. 5). Na literatura científica, alguns poucos estudos compararam as características de cada doença.
Poblet et al. (2006) descreveram oito casos de cada, utilizando também IFD em dois casos de AFF e em quatro casos de LPP. Encontraram infiltrado inflamatório mais proeminente e menos células apoptóticas no LPP do que na AFF, mas isso não foi suficiente para considerar essas doenças como entidades distintas na histopatologia. Com relação a IFD, o resultado foi negativo para AFF e positivo para dois casos de LPP.14
Cerqueira et al. (2016) compararam 10 casos de LPP e de AFF, usando também marcadores de IFD e imuno‐histoquímica (CD1a, CD3, CD4, CD8, CD68 e indolamina‐2,3‐dioxigenase). Não foram observadas diferenças significativas entre as doenças.15
Donati et. al (2017) avaliaram o resultado de IFD em pacientes com AFF e encontraram 29,5% de resultados positivos, dois quais 9% tinham padrão semelhante ao LPP, 7% padrão de LE e 13,5% padrões inespecíficos. O estudo concluiu que a IFD da AFF não tem o mesmo valor diagnóstico que no LPP e no LE, sendo, na maioria das vezes, negativa e sem um padrão específico.16
Wong e Goldberg (2017) compararam 32 casos de LPP e 37 casos de AFF. Encontraram diferenças estatisticamente significantes entre a extensão do infiltrado inflamatório abaixo do istmo em AFF em comparação com LPP (92% versus 63%; p=0,02), mas não encontraram diferenças entre a intensidade do infiltrado inflamatório nas duas doenças.17
Gálvez‐Canseco et al. (2018) analisaram 20 parâmetros histológicos em 34 pacientes com LPP e 44 com AFF; no entanto, só observaram três parâmetros histológicos estatisticamente significativos. A presença de pelos telógenos catágenos terminais (23,5% LPP versus 50% AFF; p=0,020); infiltrado inflamatório periférico perifolicular intenso (29,4% LPP versus 4,6% FFA; p=0,010) e zona de fibroplasia lamelar concêntrica (85,3% LPP versus 63,6% FFA; p=0,041).18 Os autores não fizeram imunofluorescência, nem imuno‐histoquímica, pois afirmaram que a maior parte dos diagnósticos histológicos das alopecias são baseadas na rotina de coloração com hematoxilina e eosina.
Pindado‐Ortega et al. (2020) realizaram estudo para analisar achados histológicos, imuno‐histoquímicos (CD4, CD8, FOXP3) e perfil de receptores hormonais (beta de estrogênio ER‐b e receptor de andrógeno) em áreas afetadas e não afetadas do couro cabeludo de pacientes com AFF. Foi observado infiltrado inflamatório perifolicular em ambas as áreas, mas com maior intensidade no local afetado. Células regulatórias T FOXP3+estavam paradoxalmente aumentadas nas áreas afetadas em comparação com o couro cabeludo saudável. Não houve diferenças no perfil dos receptores hormonais.19
No entanto, estudo posterior de análise imunohistoquímica indicou diferença significativa entre LPP e AFF com maior número de células CD68+nas amostras de LPP. Também houve diminuição na expressão de CD86 e aumento na expressão de CD163 e IL‐4 em LPP lesional em comparação com amostras de AFF. Os dados sugeriram que macrófagos existem em diferentes fenótipos funcionais nas duas doenças (aumento do fenótipo M2 no LPP lesional), com destaque para CD86 e CD163 como marcadores potenciais para distinguir cada condição.20 O estudo corroborou o aumento de células CD8 citotóxicas na região de bulge e infundíbulo de pacientes com LPP e AFF, mas sem diferenças entre as doenças.
Até o momento, embora algumas características histológicas tenham sido diferentes entre AFF e LPP, as diferenças são consideradas sutis ou inespecíficas para distingui‐las com confiança. Portanto, assim como em estudos anteriores, a correlação clínica é essencial para o diagnóstico diferencial entre as doenças.
TratamentoO objetivo do tratamento do LPP e da AFF é evitar a progressão da área de alopecia cicatricial e melhorar sintomas. A escolha terapêutica vai depender de diversos fatores, como idade do paciente, localização da lesão clínica, estágio da doença, presença de sintomas, comorbidades e inflamação histopatológica.
O manejo dessas doenças é desafiador. O nível de evidência das terapias atuais é fraco com relatos de casos, séries de casos, opinião de experts e poucos estudos controlados. Existem algumas recomendações, mas, até o momento, não há diretrizes de tratamento específicas para o LPP e a AFF.
Abordagem terapêutica no LPPCorticoides intralesionais e tópicos são considerados tratamentos de primeira linha para o LPP.21 Podem ser utilizados em monoterapia ou associados a outros medicamentos com graus variáveis de sucesso. São indicados em lesões localizadas e de extensão limitada. A triancinolona acetonida na concentração de 10mg/ml, no total de 2ml, a cada 4 a 6 semanas é preconizada para o tratamento do LPP na Universidade de British Columbia.22 O efeito observado é a melhora dos sinais e sintomas inflamatórios, com atenção ao risco de atrofia do couro cabeludo. A recomendação é manter o uso até estabilização da doença. Se não houver melhora após três meses, outras opções terapêuticas devem ser avaliadas.
Corticoides tópicos de alta potência podem ser usados em conjunto com a terapia intralesional para resposta clínica mais rápida. O propionato de clobetasol loção ou creme, até duas vezes ao dia, é uma alternativa terapêutica. Lyakhovitsky et al. relataram baixa taxa de sucesso em pacientes tratados com corticoides tópicos (oito respondedores em 42 pacientes em monoterapia), enquanto observaram resultados melhores com corticoide intralesional (11 respondedores em 15 pacientes em monoterapia).23 Por sua vez, Mehregan et al. tiveram taxa maior de sucesso em pacientes tratados com esteroides tópicos e via oral do que naqueles tratados com esteroides intralesionais.24
Corticoides via oral são reservados para manifestações mais extensas, muito sintomáticas e com progressão rápida. A prednisona na dose de 1mg/kg/dia pode ser administrada com reajuste de dose após 1 mês. Há também a alternativa de uso temporário, pelo rápido mecanismo de ação, atuando como ponte para o efeito de medicamentos mais demorados como o metotrexato.25 Apesar de boa resposta terapêutica, a taxa de recidiva é alta e os efeitos adversos podem ser importantes.
A hidroxicloroquina é utilizada no tratamento do LPP, em especial nos casos mais extensos. Embora o exato mecanismo de ação sobre a doença seja incerto, acredita‐se que esteja relacionado à apresentação de antígeno, produção de citocinas e estímulo dos receptores toll‐like 9.26 O início de ação ocorre após 2 a 3 semanas, com pico após 6 meses. A revisão da American Academy of Ophthalmology recomenda que a dose diária máxima deve ser de 5mg/kg.27 É necessário avaliação oftalmológica prévia com realização do exame de fundo de olho; avaliação bioquímica com hemograma completo, função hepática, rastreio de deficiência de glicose 6‐fosfato desidrogenase (G6PD), especialmente para pacientes do sexo masculino. As reações adversas são raras, mas podem incluir hiperpigmentação cutânea, retinopatia, dor abdominal, anorexia, náusea, mialgia e alterações hematológicas. É necessário cautela em mulheres com potencial para engravidar, pois os riscos para o feto incluem distúrbios neurológicos e interferência na audição, equilíbrio e visão.
Há ensaio clínico randomizado avaliando o uso de hidroxicloroquina (400mg/dia) versus metotrexato (15mg/semana) administrados por seis meses em casos refratários de LPP.28 Observou‐se diminuição significativa do LPPAI no segundo e quarto mês de uso da hidroxicloroquina, porém o metotrexato teve maior eficácia na redução média do LPPAI no período total.
Outros estudos relataram taxas de sucesso com uso de hidroxicloroquina variando entre 40,1 a 76%.6,23,29 No entanto, há dados de pequenas séries ou relatos de casos com resultados desapontadores com o mesmo medicamento.24
Os imunomoduladores são alternativas terapêuticas em pacientes com doença de difícil controle. Algumas opções apontadas na literatura são: ciclosporina 3 a 5mg/kg/dia, micofenolato mofetil 500mg, 2 vezes/dia e metotrexato 15mg/semana via oral.25,28
Várias modalidades diferentes de tratamento são relatadas para LPP refratário, com resultados pouco consistentes. Algumas delas são: retinoides sistêmicos, tetraciclinas, talidomida, dapsona, pioglitazona, inibidores da calcineurina tópico, griseofulvina.21,25,30
Isotretinoína e acitretina via oral demonstraram efeitos benéficos no líquen plano generalizado e erosivo, o que levou alguns autores a expandirem o uso para o LPP. No entanto, observaram‐se resultados discretos e altas taxas de recidiva após descontinuação. Os efeitos colaterais comuns são xerose, queilite, conjuntivite.22,25
Os estudos com uso de tetraciclinas para LPP são desanimadores. Spencer et al. relataram que apenas 27% dos pacientes tratados com doxiciclina oral (200mg/dia por três a seis meses em monoterapia) apresentaram respostas positivas.29 Resultados semelhantes foram encontrados por outros autores.23,24
Os inibidores tópicos da calcineurina demonstraram efeito benéfico na indução da fase anágena em modelos animais.31 Entretanto, o maior estudo com inibidores tópicos da calcineurina, em dez pacientes com LPP, relatou melhora da inflamação em apenas dois pacientes (um em monoterapia e outro associado à hidroxicloroquina).23
Nos últimos anos, os inibidores da Janus quinase (JAK) têm sido estudados especialmente no tratamento da alopecia areata, por serem pequenas moléculas envolvidas nas vias de sinalização inflamatória, reduzindo a inflamação. A atuação do tofacitinibe, um inibidor pan Janus quinase (preferencial da JAK1/JAK3), foi avaliada retrospectivamente por Yang et al. em 10 pacientes com LPP recalcitrante (8 LPP clássico e 2 AFF). A dose utilizada foi de 5mg via oral, 2 a 3 vezes/dia por 2 a 19 meses como monoterapia ou como terapia adjuvante. Houve melhora em oito de dez pacientes (quatro em monoterapia e quatro como terapia adjuvante). A redução no índice de atividade LPPAI variou de 30 a 94%. Como efeito adverso, apenas um paciente queixou‐se de ganho ponderal.32
Outro medicamento recentemente estudado foi o minoxidil via oral. Estudo retrospectivo avaliou o impacto de seu uso em 51 pacientes com LPP clássico, com dose variando de 0,25 a 1mg/dia. Houve aumento na espessura dos fios nas áreas não afetadas adjacentes à alopecia, levando a uma melhor cobertura.33
O desafio no tratamento do LPP foi evidenciado em estudo retrospectivo, demonstrando que 42,9% de um total de 261 pacientes com LPP clássico tiveram a necessidade do uso de medicamentos de três classes diferentes, dos quais 11,3% não atingiram resposta completa. Todos os pacientes receberam corticoide tópico como monoterapia ou combinado a agentes sistêmicos. Os medicamentos relativamente eficazes com resposta total ou parcial foram ciclosporina 100% (em um total de 16 pacientes), metotrexato 85% (em 26 pacientes), micofenolatomofetil 76% (em 66 pacientes), prednisolona 68% (em 22 pacientes), corticoide intralesional 43% (em 7 pacientes), hidroxicloroquina 59% (em 68 pacientes). O tempo médio para atingir remissão completa e parcial foi de 6,1 ±6,5 e 2,7 ±3,9 meses, respectivamente.34
Abordagem terapêutica na AFFA AFF é uma doença crônica com curso variável e possibilidade de estabilização espontânea, o que muitas vezes dificulta a avaliação de eficácia das modalidades de tratamento.
As recomendações de terapias tópicas da literatura incluem corticoides de alta potência, corticoides intralesionais e inibidores da calcineurina. Os principais tratamentos sistêmicos são inibidores da 5 alfa‐redutase, hidroxicloroquina e retinoides. Alguns estudos relatam o uso de tetraciclinas, metotrexato, pioglitazona, naltrexona e inibidores da JAK (tofacitinibe).
O corticoide intralesional (triancinolona acetonida) é uma das opções terapêuticas mais empregadas na AFF, especialmente para lesões em áreas bem delimitadas, linha de implantação capilar e supercílios.35 Em estudo retrospectivo, Banka et al. demonstraram estabilização da doença com injeção mensal de triancinolona acetonida 2,5mg/mL em região frontal, após 4 a 5 sessões.36 O primeiro estudo publicado com infiltração nos supercílios foi realizado na concentração de 10mg/mL com 0,125mL por supercílio, mostrando resultados positivos.37 No entanto, a recomendação atual é o uso de concentrações menores (2,5mg/mL), tanto no couro cabeludo como no supercílio, devido ao risco de atrofia cutânea e resultado inestético.5 A abordagem terapêutica da alopecia de supercílios na AFF obedece ao tratamento da doença, devendo ser considerada entre as opções tópicas e sistêmicas de acordo com o acometimento da doença, se sintomática, localizada ou extensa.
Corticoides tópicos de alta potência e inibidores da calcineurina tópicos apresentaram efeitos benéficos na melhora dos sintomas, mas pouco efeito no controle da progressão da doença.5,35,38 Estudo retrospectivo demonstrou melhora do prurido em 44%, da tricodinia em 33% e estabilização em 64,6% dos pacientes com uso combinado de corticoide tópico de alta potência e inibidor de calcineurina tópico.39 Na prática, esses agentes são combinados com outras terapias sistêmicas. Alguns autores criticam o uso dos corticoides tópicos, alegando risco de piora da atrofia cutânea, característica da AFF, e aumento de telangiectasias.40
O minoxidil tópico 5% pode ser utilizado para melhorar a cobertura de fios no couro cabeludo, especialmente em pacientes com associação de alopecia androgenética. Além disso, estudo in vitro demonstrou que o minoxidil reduziu significativamente a quantidade total de colágeno (inibição de 30%) em cultura de células da papila dérmica de ratos, com possível efeito antifibrótico.41 São necessários estudos controlados em humanos, para a avaliação desse efeito em alopecias cicatriciais.
A AFF é entendida hoje como uma doença generalizada com acometimento de todos os pelos do corpo e com associação de diversas alterações cutâneas como pápulas da face e líquen plano pigmentoso. Logo, as terapias sistêmicas são frequentemente necessárias.
Os inibidores da 5 alfa‐redutase (finasterida e dutasterida) são medicamentos sistêmicos que demostram resultados positivos no tratamento da AFF, mesmo em pacientes sem associação de alopecia androgenética.42 Alguns autores afirmam ser a modalidade terapêutica mais benéfica para a AFF.35 Acredita‐se que essas substâncias atuem na etiologia da doença, com provável mecanismo hormonal.
Há relato de caso evidenciando melhora dos sinais inflamatórios, da atrofia cutânea e repilação em região frontotemporal de paciente com AFF após introdução de finasterida 2,5mg/dia.43 No primeiro estudo multicêntrico de AFF com 355 pacientes, o uso de finasterida 2,5 a 5mg/dia ou dutasterida 0,5mg/semana demonstrou estabilização ou melhora da doença em todos os pacientes; mas o desenho do estudo foi retrospectivo e muitos pacientes estavam em uso de terapias combinadas.1
Em estudo de revisão sobre eficácia e segurança dos inibidores da 5 alfa‐redutase para AFF foi relatado: apenas duas publicações com nível moderado de evidência; a falta de padronização de doses (finasterida 2,5 a 5mg/dia, dutasterida 0,5mg, 1 a 3 vezes na semana ou uso diário com média de tempo de 1 ano); uso combinado com outros agentes terapêuticos; resultados positivos em doença recalcitrante. Concluiu‐se positivamente ao uso dos inibidores da 5 alfa‐redutase em função dos bons resultados, reduzindo a progressão da doença. Há evidência limitada sobre o perfil de segurança. O uso em mulheres com idade reprodutiva desse ser cauteloso devido a teratogenicidade. Embora alguns autores relatem efeito protetor no câncer de mama,44 é melhor evitar em mulheres com histórico pessoal ou familiar de neoplasia mamária até que mais dados estejam disponíveis.
Estudo recente observacional e retrospectivo sobre o uso de dutasterida via oral na AFF em 224 pacientes com acompanhamento médio de dois anos mostrou que a medicação foi a terapia mais eficaz em comparação com outras terapias sistêmicas ou nenhum tratamento sistêmico. A taxa de estabilização para as regiões temporais frontal, direita e esquerda após 12 meses foi de 62%, 64% e 62% no grupo da dutasterida (n=148), 60%, 35% e 35% com outras terapias sistêmicas (n=20) e 30%, 41% e 38% sem tratamento sistêmico (n=56; p=0,000, 0,006 e 0,006, respectivamente). A estabilização mostrou uma associação estatisticamente significativa com o aumento da dose de dutasterida via oral com tratamento semanal de 5 a 7 doses de 0,5mg. A medicação foi bem tolerada em todos os pacientes.45 Mas existem limitações no estudo como o desenho retrospectivo e número pequeno de pacientes tratados com outras drogas.
As principais terapias direcionadas contra a inflamação linfocítica da AFF são a hidroxicloroquina e a doxiciclina. Esses medicamentos exibem propriedades anti‐inflamatórias e perfil aceitável de efeitos adversos.35 Chiang et al. avaliaram a eficácia da hidroxicloroquina 400mg/dia em LPP e AFF, usando o índice de atividade LPPAI. Houve efeito positivo em ambas as doenças, com melhora dos sinais e sintomas em 69% dos pacientes após seis meses (71% nos pacientes com AFF) e 83% após um ano (50% nos pacientes com AFF).
Os estudos com uso de doxiciclina 100 a 200mg/dia demonstraram resultados inconsistentes. Estudo retrospectivo relatou 50% de melhora em sinais e sintomas da AFF versus 50% com ausência de resposta após um ano.46 O efeito adverso mais comum são alterações gastrointestinais (náuseas, vômitos e refluxo gastroesofágico).
Acredita‐se que os retinoides sistêmicos também tenham efeito anti‐inflamatório na AFF e possam levar a normalização na expressão antigênica de queratinócitos foliculares, mas o mecanismo de ação exato permanece desconhecido. O estudo de coorte retrospectivo de Rakowska et al. avaliou grupos tratados com isotretinoína via oral 20mg/dia; acitretina via oral 20mg/dia e comparou com grupo tratado com finasterida via oral 5mg/dia. Houve estabilização da doença em 79% no grupo tratado com isotretinoína, 73% no grupo com acitretina versus 43% no grupo com finasterida. E a resposta foi sustentada após um ano sem medicamento (72% grupo isotretinoína, 73% grupo acitretina e 43% controle com finasterida).47
Os retinoides também demonstraram efeitos benéficos no tratamento das pápulas da face e líquen plano pigmentoso em estudos com uso de isotretinoína 20mg/dia via oral.48,49 É importante avaliar com cautela a administração em mulheres em idade fértil e realizar os exames de avaliação bioquímica antes e durante o tratamento.
Os agonistas do PPAR‐gama (pioglitazona) foram utilizados para AFF, mas com resultados variáveis e muitos efeitos adversos. Um estudo retrospectivo de coorte relatou estabilização da doença em três de quatro pacientes, mas com avaliação realizada por curto período, um a três meses e em amostra pequena. Principais efeitos adversos foram edema de extremidades, ganho ponderal e tontura.50 Outros efeitos associados a medicação são: insuficiência cardíaca, aumento do risco de câncer de bexiga, próstata e pâncreas.5
A naltrexona é um antagonista opioide com propriedades anti‐inflamatórias e uma alternativa de tratamento, em baixas doses, para alopecias cicatriciais. Parece ser capaz de reduzir sintomas, sinais inflamatórios e progressão da doença.51 É importante investigar a presença de distúrbios de humor, função hepática e uso de outros medicamentos antes do início. Efeitos adversos relatados são: dor abdominal, náusea, cefaleia e ansiedade.
Os agentes imunossupressores podem ser utilizados em casos refratários de AFF, mas com dados escassos na literatura e resultados pouco consistentes.
Gerkowicz et. al. avaliaram a eficácia de dispositivos de laser de diodo (LED) como tratamento adjuvante em alopecia cicatricial.52 O índice de atividade LPPAI e o índice de gravidade FFASS foram significativamente reduzidos após o tratamento (p=0,012, p=0,017, respectivamente). Dentro da área tratada, houve melhora na espessura dos fios com aumento do número de fios terminais (p=0,009), enquanto o número de fios intermediários e finos não mudou significativamente (p=0,836, p=0,675, respectivamente). O tratamento com LED foi considerado seguro e bem tolerado com redução dos sintomas tanto na AFF como no LPP.52
A cirurgia de transplante capilar tem sido considerada uma opção de abordagem para casos com alto impacto na qualidade de vida dos pacientes. Alguns pontos que devem ser considerados são: a estabilização clínica não implica necessariamente em remissão da doença; a reativação pode levar a perda do enxerto; o procedimento cirúrgico pode ser responsável pela reativação da doença (fenômeno de Koebner).
Estudo multicêntrico retrospectivo avaliou 51 pacientes com AFF submetidos à transplante capilar, realizado após média de 15 meses de estabilização (segundo critérios clínicos e tricoscopia). A técnica de extração de unidade folicular foi realizada em 14% dos casos e a técnica em faixa em 86% dos casos. As localizações mais frequentes foram: região temporal (59%), frontal (44%) e supercílios (29%). Todos os pacientes continuaram com tratamento medicamentoso para AFF após o transplante. A sobrevida média do enxerto após 1, 2, 3 e 5 anos de acompanhamento foi de 87%, 71%, 60% e 41%, sendo notável a queda importante após cinco anos. No entanto, a taxa de satisfação dos pacientes foi de 82%.53
ConclusãoA AFF é considerada variante do LPP pelas semelhanças histológicas, mas com diversas peculiaridades que vão desde aspectos clínicos até variações na resposta terapêutica. A literatura científica sugere que, até o momento, não há achados histológicos ou imunológicos que nos permitam separar com precisão essas duas formas de alopecias cicatriciais primárias.
O melhor método para avaliação do processo inflamatório e que permite a comprovação incontestável de fibrose é o exame histopatológico. Além disso, a inflamação ao nível do istmo não é traduzida inteiramente pelos sintomas e sinais clínicos descritos para essas patologias o que pode impactar na decisão terapêutica.
A ausência de ensaios clínicos randomizados não permite conclusões definitivas sobre o mais eficaz dos tratamentos disponíveis. E a maioria dos estudos avalia pacientes com tratamentos combinados, logo a melhor escolha será realizada caso a caso. A abordagem terapêutica do LPP e da AFF também pode variar com a evolução e o seguimento. Diante disso, a documentação fotográfica e a tricoscopia são fundamentais para avaliar avanço ou estabilização da doença.
Suporte financeiroNenhum.
Contribuição dos autoresCarolina Oliveira Costa Fechine: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Neusa Yurico Sakai Valente: Aprovação da versão final do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Ricardo Romiti: Aprovação da versão final do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Fechine COC, Valente NYS, Romiti R. Lichen planopilaris and frontal fibrosing alopecia: review and update of diagnostic and therapeutic features. An Bras Dermatol. 2022;97:348–57.
Trabalho realizado no Departamento de Dermatologia, Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil.