A hanseníase que é doença causada pelo Mycobacterium leprae, apresenta manifestações neurocutâneas polimorfas fortemente correlacionadas com a resposta imune do hospedeiro. Os danos neurais periféricos podem levar a perdas sensoriais e motoras, bem como a deformidades das mãos e pés. Ambas as respostas imunes inata e adquirida estão envolvidas, mas a doença tem sido classicamente descrita ao longo de um espectro Th1/Th2, em que o polo Th1 corresponde às apresentações mais limitadas, e o Th2, às multibacilares. O objetivo desta revisão é discutir essa dicotomia à luz do conhecimento atual das citocinas, subpopulações T helper e células T regulatórias envolvidas em cada apresentação da hanseníase. Também abordamos as reações hansênicas relacionadas a aumento da atividade inflamatória tanto nas apresentações limitadas quanto nas multibacilares, levando à exacerbação dos sinais e sintomas crônicos e/ou ao desenvolvimento de novos. Apesar dos esforços de muitos grupos de pesquisa em todo o mundo, ainda não há um teste sorológico/marcador biológico padronizado como rotina para o diagnóstico, mesmo em áreas endêmicas, que poderia colaborar para a erradicação da hanseníase.
A hanseníase é micobacteriose crônica com alta infectividade e baixa patogenicidade. É causada por Mycobacterium leprae, cujo principal hospedeiro é o ser humano.1 Tatus da espécie Dasypus novemcintus também podem ser infectados naturalmente por M. leprae, e há evidências de que possam transmitir a doença aos seres humanos.2 Uma outra bactéria, M. lepromatosis, descoberta no México em 2008, também tem sido apontada como agente etiológico da hanseníase, inicialmente associada a formas multibacilares, mas posteriormente também encontrada em formas paucibacilíferas.3
A disponibilidade de tratamento medicamentoso gratuito há cerca de 40 anos, uma poliquimioterapia (PQT) recomendada e distribuída gratuitamente pela Organização Mundial de Saúde (OMS), contribuiu para a mudança na história natural da doença, com aumento significativo nas taxas de cura e queda substancial no número de novos casos, levando ao controle da endemia em muitos países. No entanto, a hanseníase persiste como importante causa de morbidade em áreas com alta vulnerabilidade social. Em 2019, foram registrados 202.185 novos casos no mundo, dos quais 27.863 detectados no Brasil.1 Apesar do tratamento poliquimioterápico, a doença ainda tem alto potencial incapacitante, em especial quando diagnosticada nas fases avançadas; é a principal causa de neuropatia infecciosa em países tropicais e subtropicais.
A fisiopatologia da hanseníase é multifatorial, com aspectos genéticos, imunológicos e ambientais determinando a suscetibilidade do indivíduo ao bacilo.1 Indivíduos com fraca resposta imune celular apresentam intensa resposta imune humoral, com altos títulos de anticorpos séricos específicos contra o bacilo, incapazes de conter a proliferação de M. leprae. Esses indivíduos apresentam alta carga bacilífera, e são denominados multibacilíferos. A suscetibilidade é também influenciada por traços hereditários, com expressividade variável em diversos genes relacionados à resposta imune, o que demonstra correlação entre a expressão de certos genes e determinadas apresentações.4 De particular relevância, na hanseníase virchowiana e na reação tipo 2, os genes envolvidos na resposta imune humoral são expressos em níveis elevados, em particular os genes para receptores de imunoglobulina ou para proteínas da via clássica do complemento; em contraste, genes ligados à resposta imune celular são intensamente expressos nas formas paucibacilares e na reação reversa.5,6
O sequenciamento do genoma de M. leprae de diferentes partes do mundo revela baixa variabilidade genética inter‐regional, com 99,995% do material genético idêntico entre diferentes cepas.7 Isso acontece, principalmente, pelo fato de que o genoma de M. leprae contém baixa porcentagem de genes funcionais (menos de 50%), com alta porcentagem de pseudogenes.8 Entretanto, o achado também sugere que a variabilidade na apresentação clínica da doença entre os indivíduos se deva principalmente a fatores idiossincráticos do hospedeiro, e não a variações genéticas do microrganismo, o que também tem sido demonstrado por estudos que correlacionam certas variações imunogênicas a determinadas apresentações clínicas.5
ImunopatologiaO período de incubação da hanseníase é longo, de meses a décadas, com tempo médio estimado em dez anos para a forma virchowiana e de quatro anos para a forma tuberculoide. O tempo de duplicação extremamente lento da micobactéria (uma vez a cada duas semanas) torna mais difícil que o nexo epidemiológico se estabeleça entre uma determinada exposição e o desenvolvimento da doença. O mecanismo exato da transmissão da hanseníase não é conhecido, mas a rota respiratória é a mais amplamente aceita. Há também outras possibilidades, como a transmissão por insetos e a inoculação através de tatuagens, que não podem ser completamente descartadas.9–11
Estima‐se que mais de 95% dos indivíduos infectados sejam naturalmente resistentes a M. leprae, nunca desenvolvendo qualquer sinal ou sintoma da doença. Entre os indivíduos sintomáticos, após a fase indeterminada, a doença se manifesta ao longo de um espectro horizontal proposto por Ridley e Jopling,12 com base nas características clínicas, baciloscópicas e histológicas, contendo dois polos (tuberculoide e virchowiano) e três formas intermediárias (dimorfa‐tuberculoide, dimorfa‐dimorfa e dimorfa‐virchowiana). À medida que a apresentação clínica caminha do polo tuberculoide para o polo virchowiano, uma transição gradual ocorre da resposta imune Th1 para Th2, conforme modelo proposto por Modlin.13
Resposta inata a M. lepraeMycobacterium leprae é bacilo gram‐positivo, álcool‐ácido‐resistente e parasita intracelular obrigatório, que exibe tropismo pronunciado para células fagocíticas como células de Schwann nos nervos e macrófagos na pele.14 O bacilo é distinguido de outras bactérias gram‐positivas e gram‐negativas por sua parede celular rica em lipídios, em particular ácidos micólicos e o glicolipídio fenólico‐1 (PGL‐1). O PGL‐1 medeia a penetração do bacilo em macrófagos via fração C3 do complemento, por meio dos receptores CR1, CR3 e CR4, induzindo sua fagocitose. É um componente central para a patogênese da doença e está envolvido no mecanismo de escape lisossomal,9 desemprenhando papel imunossupressor que facilita a sobrevivência de M.leprae no interior da célula hospedeira, o macrófago.
Com efeito, análises de citocinas secretadas por macrófagos naïve expostos a PGL‐1 e ao lipopolissacarídeo (LPS) da membrana externa das bactérias gram‐negativas mostram que o PGL‐1 sozinho induz fraca produção de citocinas inflamatórias, como o fator de necrose tumoral alfa (TNF‐α), IL‐1β e IL‐10, ao mesmo tempo que induz altos níveis de moléculas regulatórias negativas, como a proteína quimioatrativa de monócitos‐1 (MCP‐1) e o antagonista do receptor de interleucina‐1 (IL‐1RA). A atividade microbicida dos macrófagos envolve a produção de espécies reativas de oxigênio e nitrogênio, por meio do complexo NADPH‐oxidase e óxido nítrico, respectivamente.10 Maior expressão do óxido nítrico sintase induzida (iNOS) tem sido descrita em lesões tuberculoides da pele, em comparação com lesões virchowianas, que podem ser atribuídas à maior resposta imune tipo Th1 na hanseníase paucibacilares.10,11
Importante papel na resposta imune a M. leprae tem sido atribuído aos receptores Toll‐Like (TLRs) – um tipo de receptor de reconhecimento de padrão molecular (PRR) encontrado em monócitos e células dendríticas. Os TLR 2 e 4 reconhecem o bacilo da hanseníase, levando à secreção de IL‐12 – interleucina que induz a produção de outras citocinas pró‐inflamatórias e a eliminação do bacilo.12 Uma variação genética, mais fortemente associada à apresentação virchowiana, foi descrita no gene que codifica para TLR2. Estudo genético funcional mostrou que mutação de perda de função nesse receptor causa menor produção de IL‐12 por macrófagos em resposta a M. leprae, sugerindo que eventuais polimorfismos genéticos nesse receptor também possam afetar a história natural da doença.15
O papel do inflamassoma na hanseníase também foi estudado. Componente da resposta imune inata, o inflamassoma é um complexo de proteínas citosólicas que medeiam a resposta inflamatória por meio de padrões moleculares associados a patógenos (PAMPs) e padrões moleculares associados a danos (DAMPs) – este último é responsável pela maturação da caspase‐1, secreção de IL‐1β e IL‐18, além de um tipo de morte celular denominado piroptose. Tem sido relatada maior expressão de marcadores de inflamassoma em lesões virchowianas, em comparação às formas indeterminada e tuberculoide, revelando a ineficiência do inflamassoma no controle da infecção por M. leprae.16,17
Importantes na resposta imune a M. leprae, as células de Schwann são capazes de processar e apresentar antígenos para células T CD4+, desencadeando um processo inflamatório danoso a essas células, levando à desmielinização de nervos periféricos e lesões neurais. Mycobacterium leprae também estimula a resposta inflamatória, aumentando a sensibilidade da célula de Schwann à citocina pró‐inflamatória TNF‐α, por indução da expressão transmembrana de TNF‐α e do receptor TNF‐α nessas células.18,19
Resposta adquirida a M. lepraeConsiderando‐se o paradigma Th1/Th2da hanseníase, o perfil de citocinas encontrado na pele difere em cada polo, com maior expressão de citocinas Th1 (como IL‐7 e IL‐15) em pessoas com hanseníase tuberculoide, e maior expressão de citocinas Th2 (como IL‐ 4, IL‐5, IL‐10 e o fator de crescimento transformador [TGF‐β]) em pacientes com hanseníase virchowiana. Análises de sangue periférico de pacientes com hanseníase também mostraram que, após a estimulação com antígenos recombinantes de M. leprae, há indução predominante da secreção de citocinas Th1 (IFN‐γ, IL‐2 e IL‐12) em apresentações paucibacilares, e citocinas Th2 (IL‐4, IL‐5 e IL‐6) em apresentações multibacilares.6,20
Além do paradigma clássico Th1/Th2, estudos têm mostrado diferenças ao longo do espectro também em relação aos linfócitos Th9, Th17, Th25 e Treg. Os línfócitos Th9 formam uma subpopulação de células T helper CD4+, caracterizados pela indução das interleucinas pró‐inflamatórias IL‐9 e IL‐10, amplificando potencialmente a resposta imune específica contra M. leprae. De fato, o papel dos linfócitos Th9 na hanseníase foi avaliado em um estudo que demonstrou níveis mais elevados de IL‐9 no polo tuberculoide, explicado pela função antagônica de IL‐9 em relação a IL‐4 e IL‐10, mudando a resposta imune do polo Th2 para o polo Th1.21
Semelhante aos linfócitos Th1, os linfócitos Th17 produzem citocinas pró‐inflamatórias, mais proeminentemente IL‐17, já tendo sido associados ao desenvolvimento de reações reversas de hanseníase. Os níveis de IL‐17 também estão elevados na hanseníase tuberculoide, na qual contribuem para o recrutamento de células inflamatórias, a ativação de células endoteliais e a manutenção do processo inflamatório crônico. Acredita‐se que a resposta Th17 possa desempenhar papel crítico na modulação da atividade do macrófago, uma vez que o IL‐17 pode induzir a produção de TNF‐α, IL‐6 e iNOS, levando à geração de espécies reativas de oxigênio (ROS) que destroem o bacilo.22
Os linfócitos Th25 são caracterizadas pela expressão de IL‐4, IL‐13 e IL‐25 (também denominado IL‐17E), conhecidas por amplificar a resposta de células Th2 e de macrófagos imunomoduladores M2. Ademais, IL‐4 e IL‐13 são conhecidos por inibir respostas antimicrobianas e ativar linfócitos B, enquanto a IL‐25 inibe a produção de citocinas das respostas Th1 e Th17. O papel dos linfócitos Th25 na hanseníase foi estudado, tendo‐se observado que sua presença ocorre em concentrações significativamente maiores em pacientes com formas clínicas multibacilares, em consonância com seu papel estimulador da reposta Th2.23
As células T regulatórias (Tregs), fenotipicamente caracterizadas pela expressão de CD4, CD25 (receptor interleucina‐2 [IL‐2R]) e o fator de transcrição FOXP3, também têm recebido atenção especial. Elas compreendem 10% da população de células T CD4+ no sangue periférico humano e são associadas a supressão de respostas celulares por meio da produção de citocinas regulatórias/anti‐inflamatórias, como TGF‐β e IL‐10.24 Na hanseníase, as células Treg são mais abundantemente encontradas em pacientes com hanseníase virchowiana, sugerindo assim que essas células podem ter papel patogênico nas apresentações multibacilares. Também foi demonstrado que os Tregs nas formas paucibacilaress produzem mais IL‐17 (citocina proinflamatória) e menos IL‐10 (citocina regulatória), resultando em microambiente que favorece inflamação e aumenta os danos teciduais. Os Tregs também são conhecidos por secretar IL‐35, citocina imunossupressora, que inibe a produção de IFN‐γ, TNF‐α e IL‐2. O aumento de IL‐35 na hanseníase guarda correlação direta com o índice baciloscópico do paciente, apresentando níveis mais elevados nas formas multibacilares.24
Finalmente, as células B também são encontradas na resposta inflamatória de lesões da hanseníase, embora seu papel seja mal compreendido. Estudo comparando o perfil de expressão genética em lesões tuberculoides e virchowianas mostrou que a doença multibacilar esteve associada a aumento da frequência de plasmócitos (CD138+) e aumento da expressão de IL‐5 e IgM nas lesões, consistente com o fato de que a hanseníase virchowiana está mais próxima do polo Th2.25 Ao contrário do que se poderia imaginar, entretanto, estudos têm mostrado maior presença de linfócitos CD20+ nas formas paucibacilíferas, fato atribuído à participação desse tipo celular na gênese do granuloma.26
Imunologia das reações hansênicasReações hansênicas são episódios de hipersensibilidade aguda representados por agravamento das lesões anteriores ou aparecimento de lesões novas, ocorrendo antes, durante ou após o tratamento. Mais comumente, as reações hansênicas ocorrem em apresentações multibacilares durante os três primeiros meses do tratamento específico da hanseníase, e atualmente representam a principal complicação da doença, necessitando de tratamento imediato para prevenir sequelas neurais. As reações hansênicas podem ser de dois tipos: reação reversa (RR) e eritema nodoso hansênico (ENH). A RR ocorre em aproximadamente 1/3 dos pacientes com apresentação dimorfa, enquanto o ENH ocorre em cerca de 50% dos pacientes com hanseníase virchowiana e 10% dos pacientes com hanseníase dimorfa, especialmente naqueles dimorfos virchowianos.27
A RR é reação de hipersensibilidade tipo IV, caracterizada por exacerbação da resposta imune celular contra M. leprae. Se, por um lado, a reação leva à eliminação ampliada de bacilos, por outro causa exacerbação do processo inflamatório e dos sintomas da doença, incluindo danos neurais. Essas lesões são caracterizadas pela presença de infiltrado celular composto predominantemente de linfócitos T CD4+, bem como macrófagos CD163+, com secreção importante de TNF‐α, IFN‐γ, IL‐2, IL1‐beta, IL‐6, IL‐17 e CXCL‐10. A liberação de TNF‐α e IFN‐γ, que estimulam diretamente as fibras neurais tipo Aδ (A delta) e tipo C, está associada a dor e edema que são frequentemente observados na RR.28
O ENH caracteriza‐se por processo inflamatório sistêmico relacionado à deposição extravascular de imunocomplexos (IC) e exsudato neutrofílico. Ainda não está claro se os IC medeiam reação de hipersensibilidade tipo III ou se sua presença é apenas um epifenômeno. Essa reação ocorre em pacientes com apresentações dimorfas e virchowianas. É possível que o grande número de antígenos e a elevada produção de anticorpos, característicos das respostas Th2, contribuam para a formação desses imunocomplexos.29 O ENH também se caracteriza pela presença de altos níveis de TNF‐α, tanto nas lesões quanto no sangue periférico, além das citocinas IL‐2, IL‐4, IL‐5, IL‐6 e IL‐10, típicas das respostas Th2. O uso bem‐sucedido da terapia anti‐TNF‐α com infliximabe e etanercepte foi relatado em três pacientes com ENH, fornecendo evidências adicionais sobre o papel inflamatório do TNF‐α no processo. De modo semelhante, o uso de talidomida no tratamento do ENH se baseia em sua capacidade de inibir a produção de TNF‐α e IL‐12 por macrófagos.30 Além disso, a talidomida também afeta a função de linfócitos T, suprimindo sua proliferação e estimulando sua diferenciação em linfócitos Tregs, com ação anti‐inflamatória, inibindo ainda o fator de transcrição nuclear Kappa B, envolvido na síntese de diversas citocinas inflamatórias.31
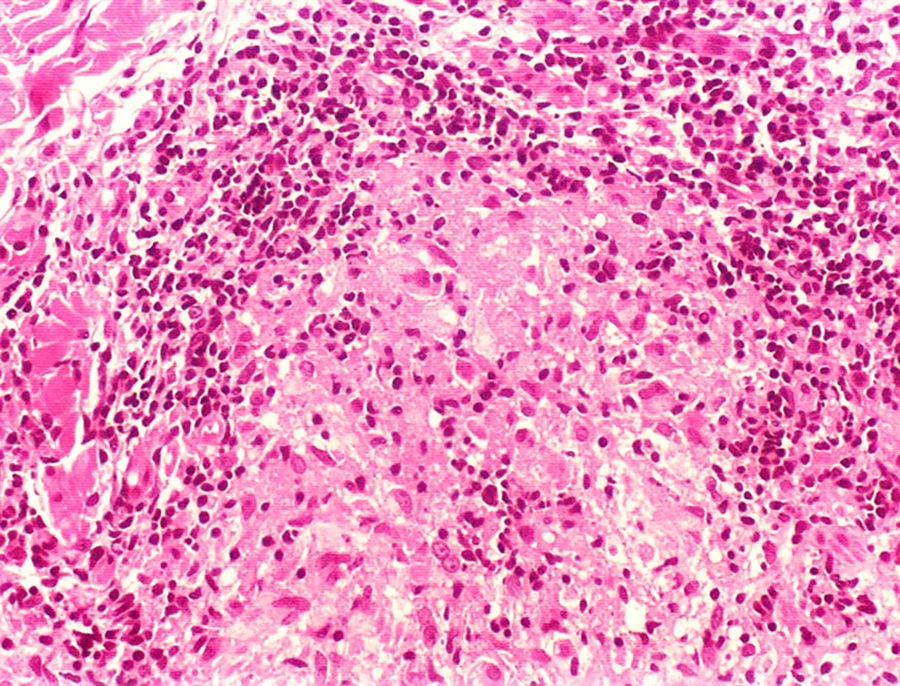
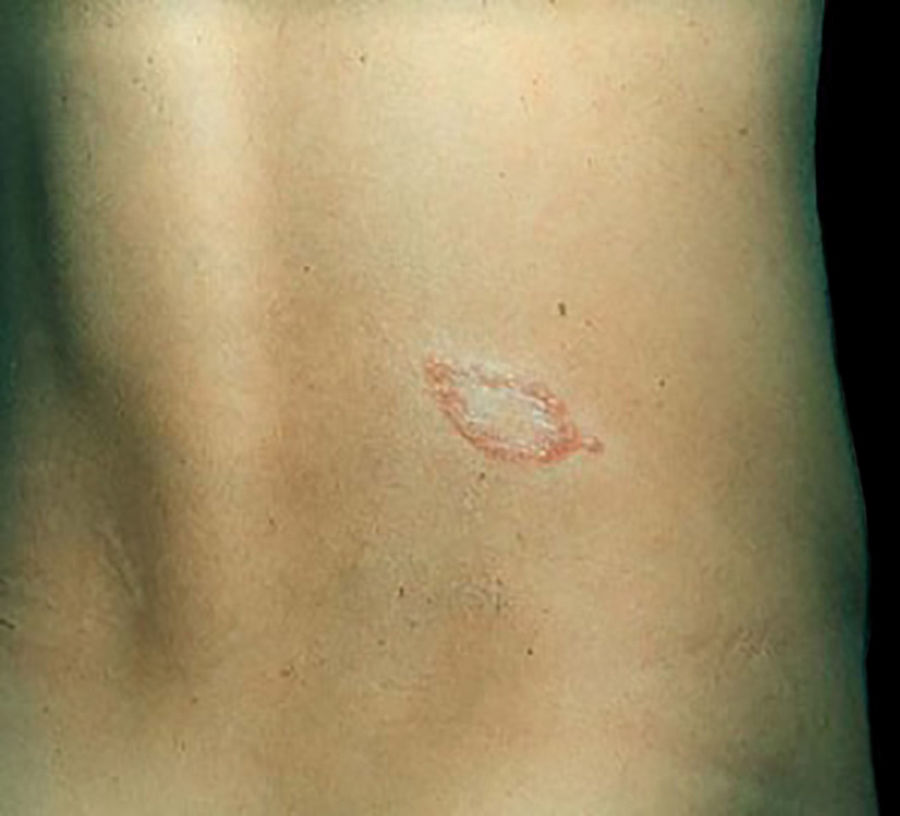
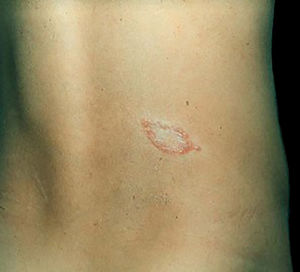
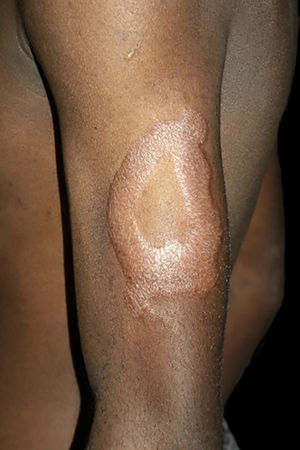
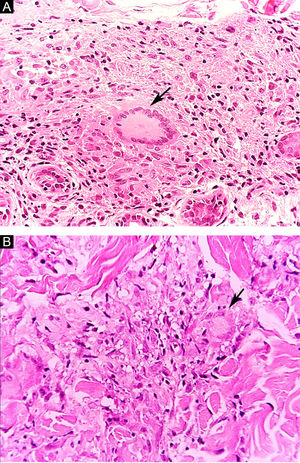
Manifestações clínicas e histológicasA resposta imune a M. leprae determina as alterações histopatológicas na hanseníase, que, por sua vez, determinam as características clínicas. A hanseníase tuberculoide apresenta granulomas bem definidos, que atingem a epiderme e são compostos por células epitelioides, células gigantes multinucleadas e macrófagos, cercados por um anel de linfócitos T CD4+, com achado de poucos ou nenhum bacilo (fig. 1). Clinicamente, esses pacientes apresentam placas eritematosas anulares bem definidas (fig. 2) e perda de sensibilidade, variando de uma a cinco lesões, podendo apresentar alopecia e/ou anidrose.32,33
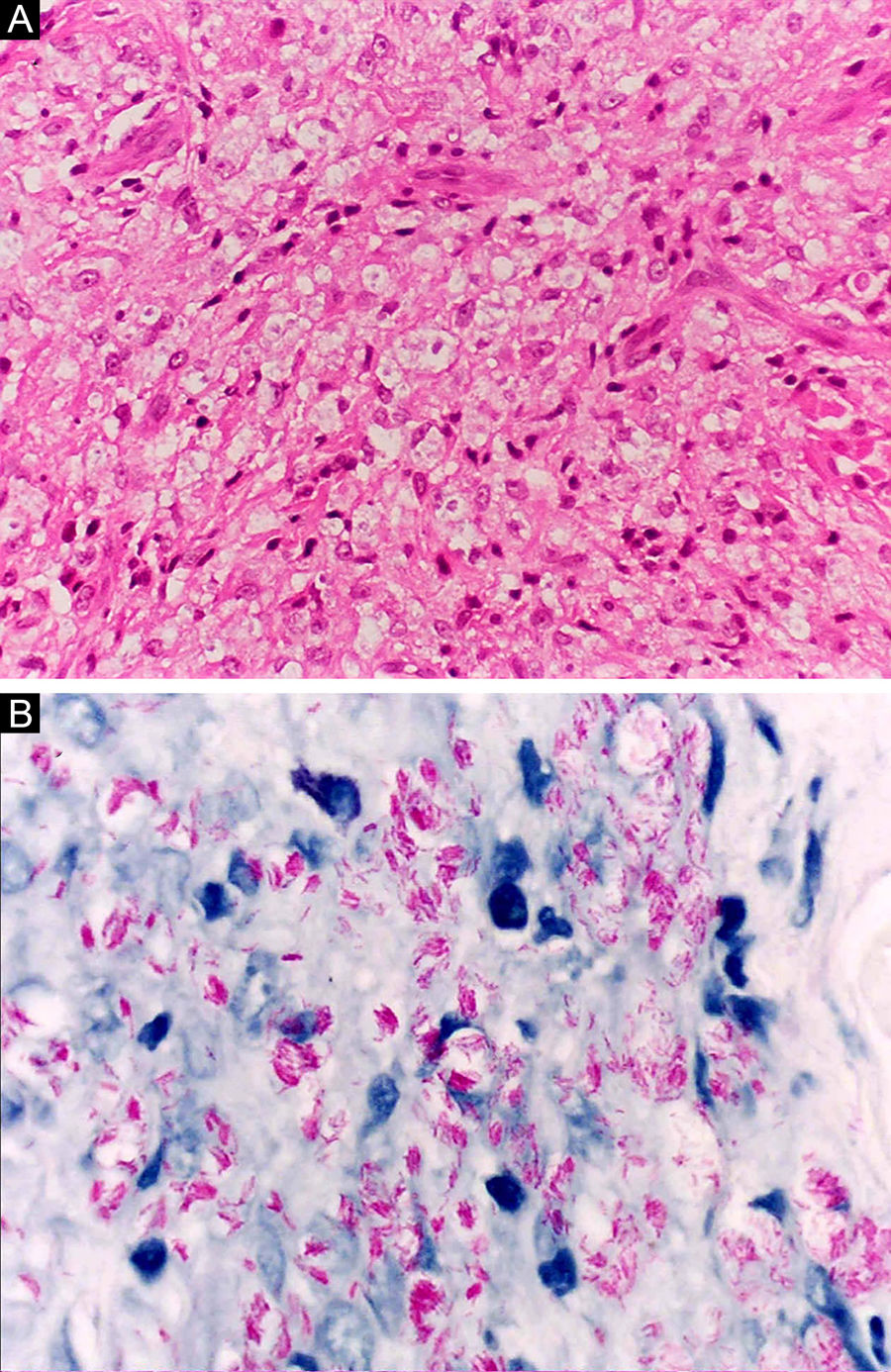
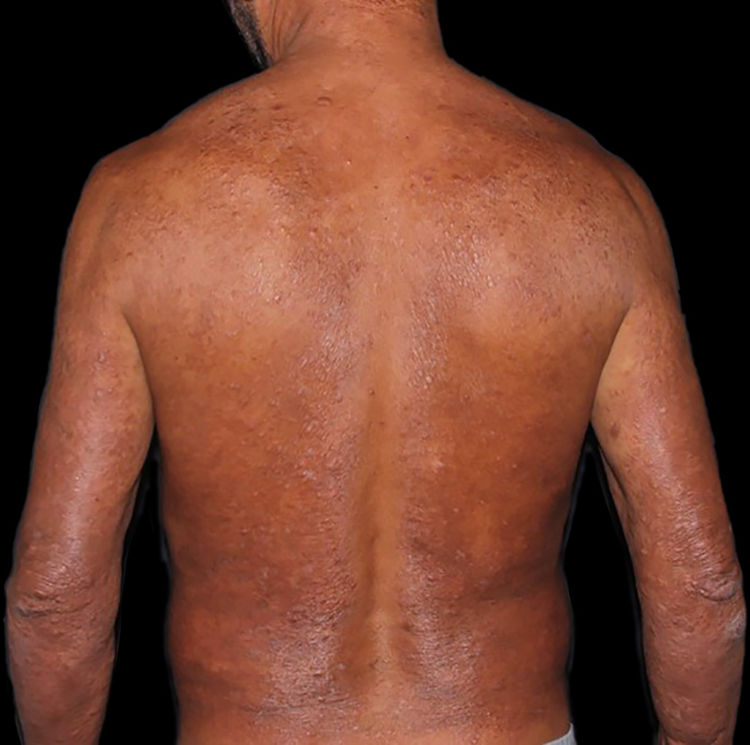
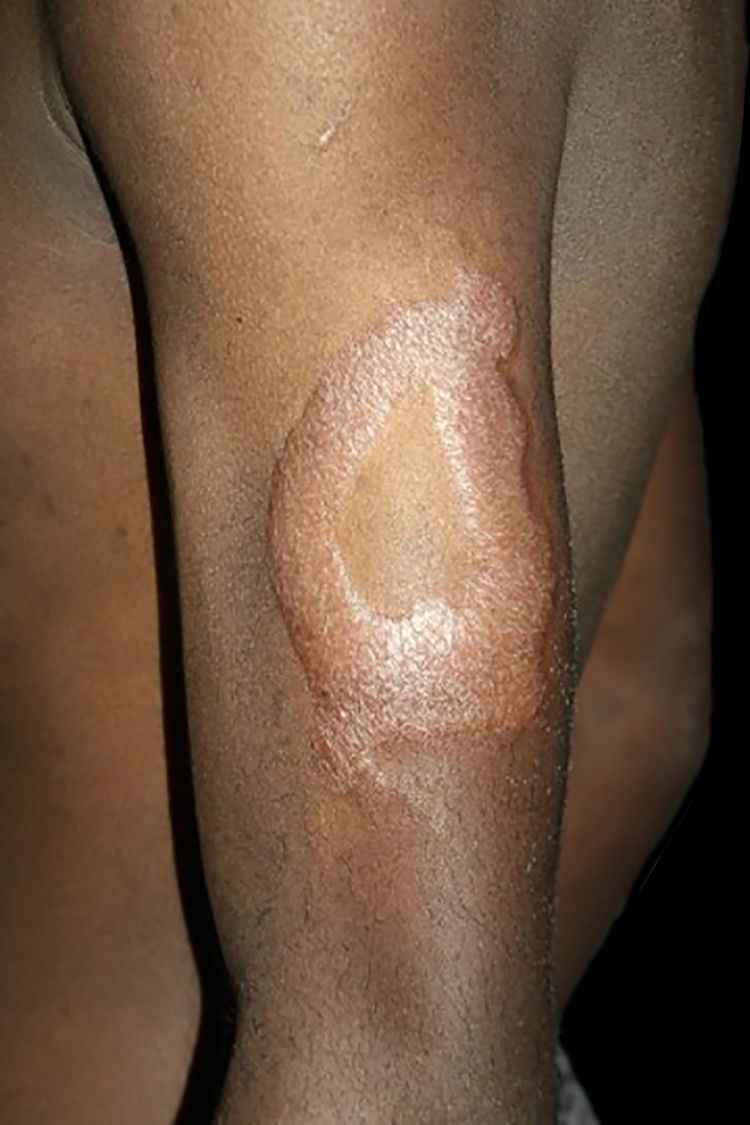
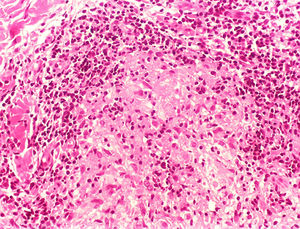
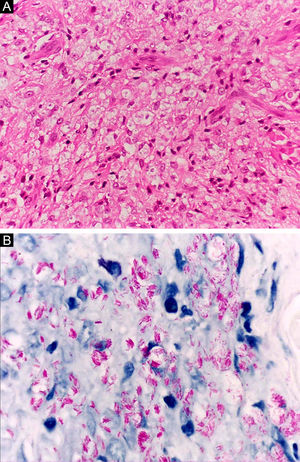
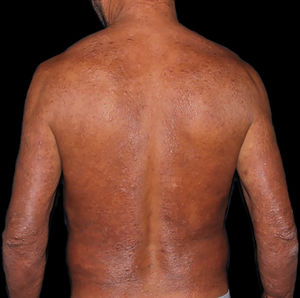
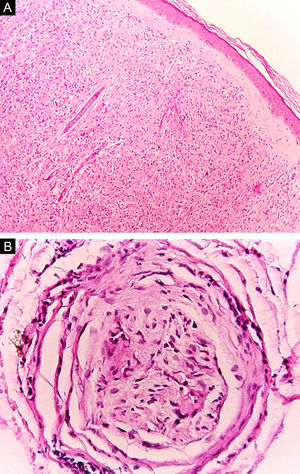
Na outra extremidade do espectro, indivíduos com hanseníase virchowiana apresentam grande número de lesões, que no exame histológico revelam granulomas macrofágicos com macrófagos vacuolizados (células de Virchow) (fig. 3 A). O parasitismo macrofágico é abundante, com formação de globias (fig. 3 B). Clinicamente, essa forma é caracterizada por extensas e múltiplas lesões bilaterais, que podem incluir máculas, pápulas, nódulos e placas (fig. 4). Nas lesões virchowianas, a predileção do M. leprae por regiões mais frias do corpo é mais nítida, percebidas ao exame minucioso pela induração difusa da face, das orelhas e/ou dos membros (cotovelos e joelhos). O comprometimento neural na hanseníase virchowiana tende a ser lento e múltiplo, agudizando‐se nos episódios reacionais, enquanto na hanseníase tuberculoide, tende a ser unilateral e mais agudo – portanto, evoluindo mais precocemente para incapacidades.32,33
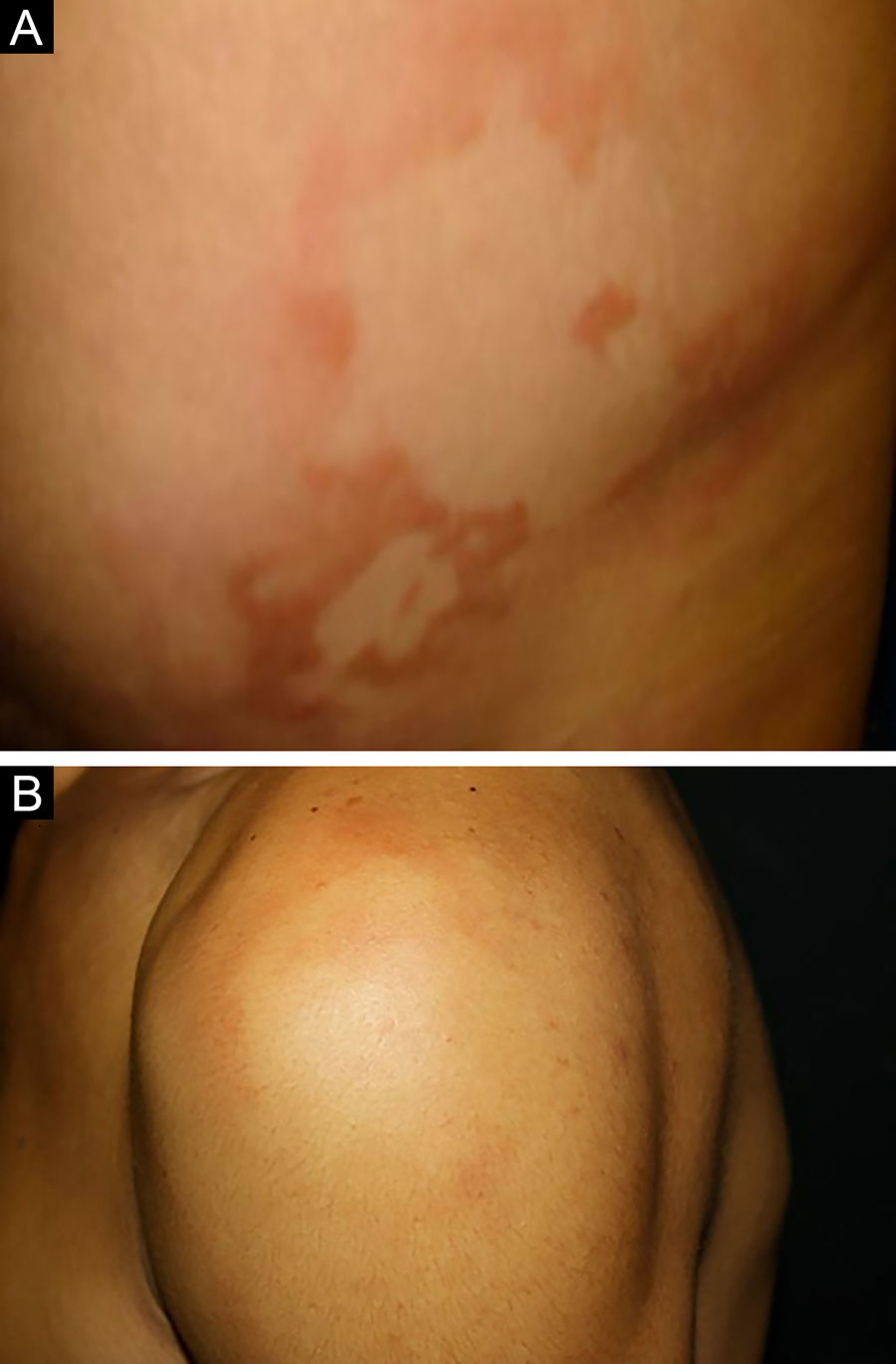
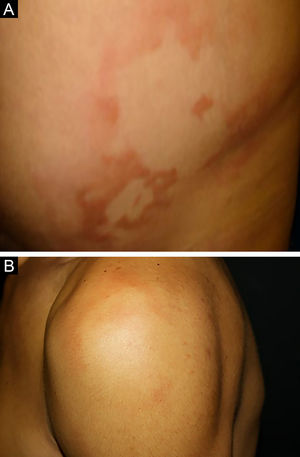
Entre os polos tuberculoide (de resposta imune celular competente) e virchowiano (de ausência de resposta imune celular específica) estão as formas dimorfas. Na apresentação histológica, como na clínica, a hanseníase dimorfa mostra aspectos tanto do polo tuberculoide quanto da hanseníase virchowiana (VV). Em indivíduos com clínica dimorfo‐tuberculoide (DT), as lesões variam em número de cinco a dez, com contornos maiores e menos bem‐definidos (fig. 5). Os troncos neurais estão assimetricamente aumentados, provocando neuropatia mais grave, com infiltração neural no exame histológico. A reação inflamatória presente na derme geralmente não toca a epiderme, nem é tão bem‐definida como na forma tuberculoide (TT). Indivíduos dimorfo‐dimorfos (DD) apresentam dezenas de placas anulares assimétricas. O achado clássico é a lesão dimórfica, tipicamente anular com bordas externas mal demarcadas e bordas internas bem‐definidas (fig. 6 A). Os pacientes podem apresentar espessamento dos nervos periféricos e neurites crônicas. Indivíduos dimorfo‐virchowianos (DV) também podem exibir as lesões clássicas dimórficas descritas, podendo vir associadas a pequenas máculas, pápulas e nódulos de diferentes formas e tamanhos (polimorfos) (fig. 6 B). Há comprometimento clínico assimétrico generalizado de nervos periféricos. A resposta inflamatória tecidual dessas lesões se assemelha à da hanseníase virchowiana, porém com aumento da circunscrição da resposta granulomatosa macrofágica, maior número de linfócitos e infiltrado mononuclear mais intenso em filetes nervosos e anexos cutâneos (folículos pilosos, glândulas sudoríparas).32,33
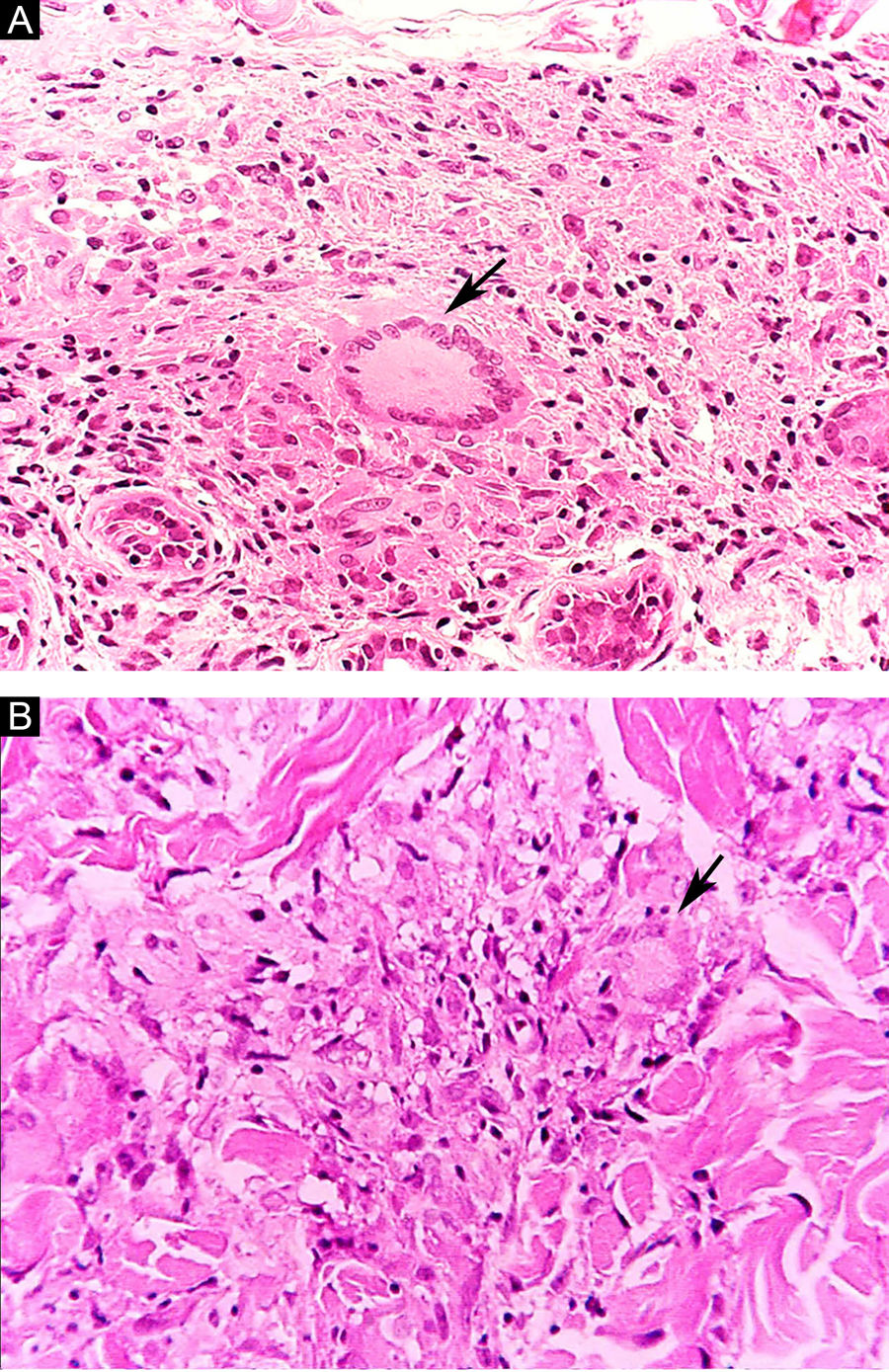
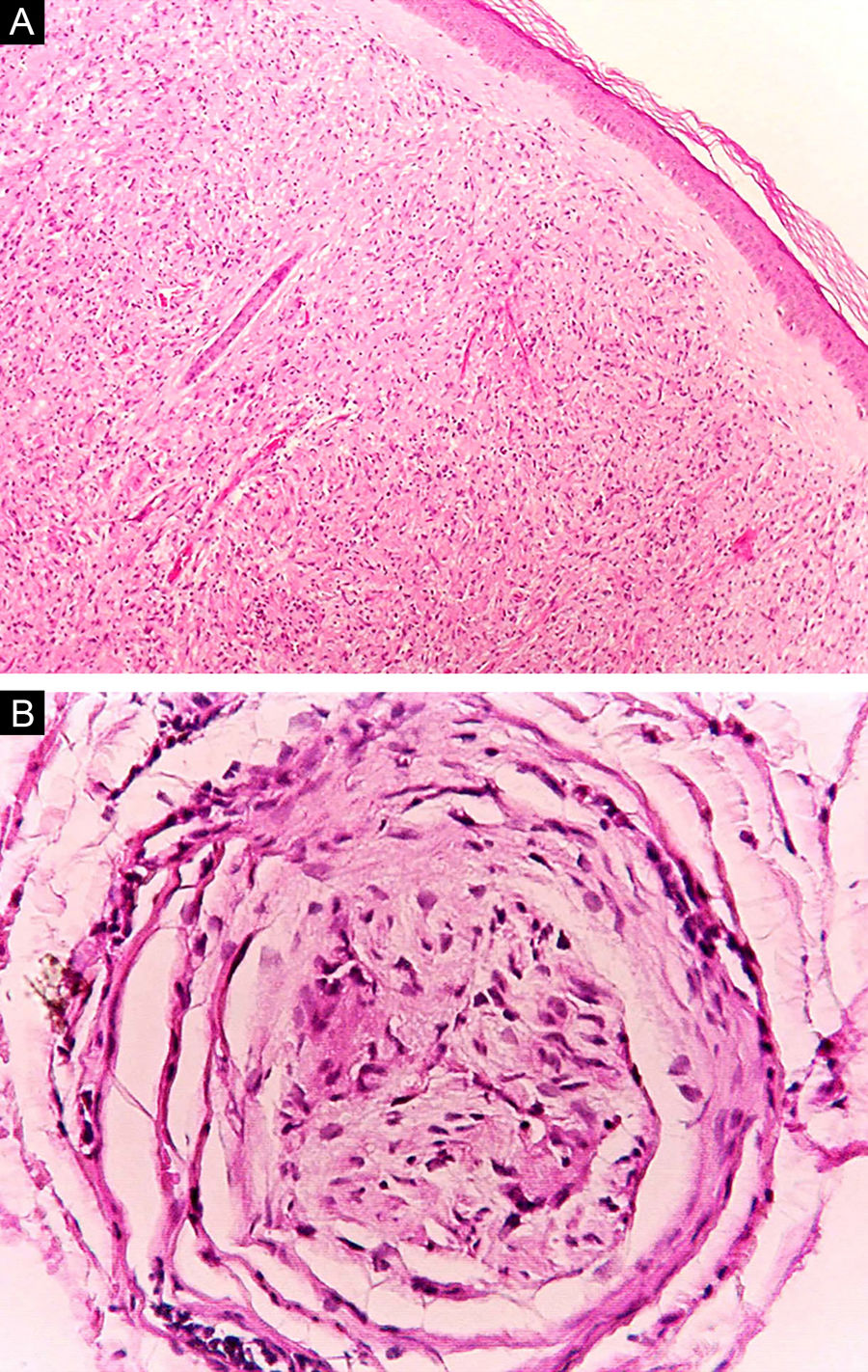
Algumas características‐chave podem ser úteis na classificação histológica da hanseníase. As células epitelioides estão presentes na resposta tecidual das lesões de TT, DT e DD. Células de Langerhans são observadas nas lesões de TT e DT (fig. 7 A). Células gigantes vacuolizadas podem ser encontradas em lesões DD e DV (fig. 7 B). Macrófagos espumosos estão presentes nas lesões DV e VV. A zona grenz (termo em alemão para “fronteira”) corresponde a uma área subepidérmica livre de infiltrado inflamatório, observada nas lesões das formas VV, DV e DD (fig. 8 A); já a laminação do perineuro em “casca de cebola” é um achado típico de lesões das formas VV e DV (fig. 8 B).33
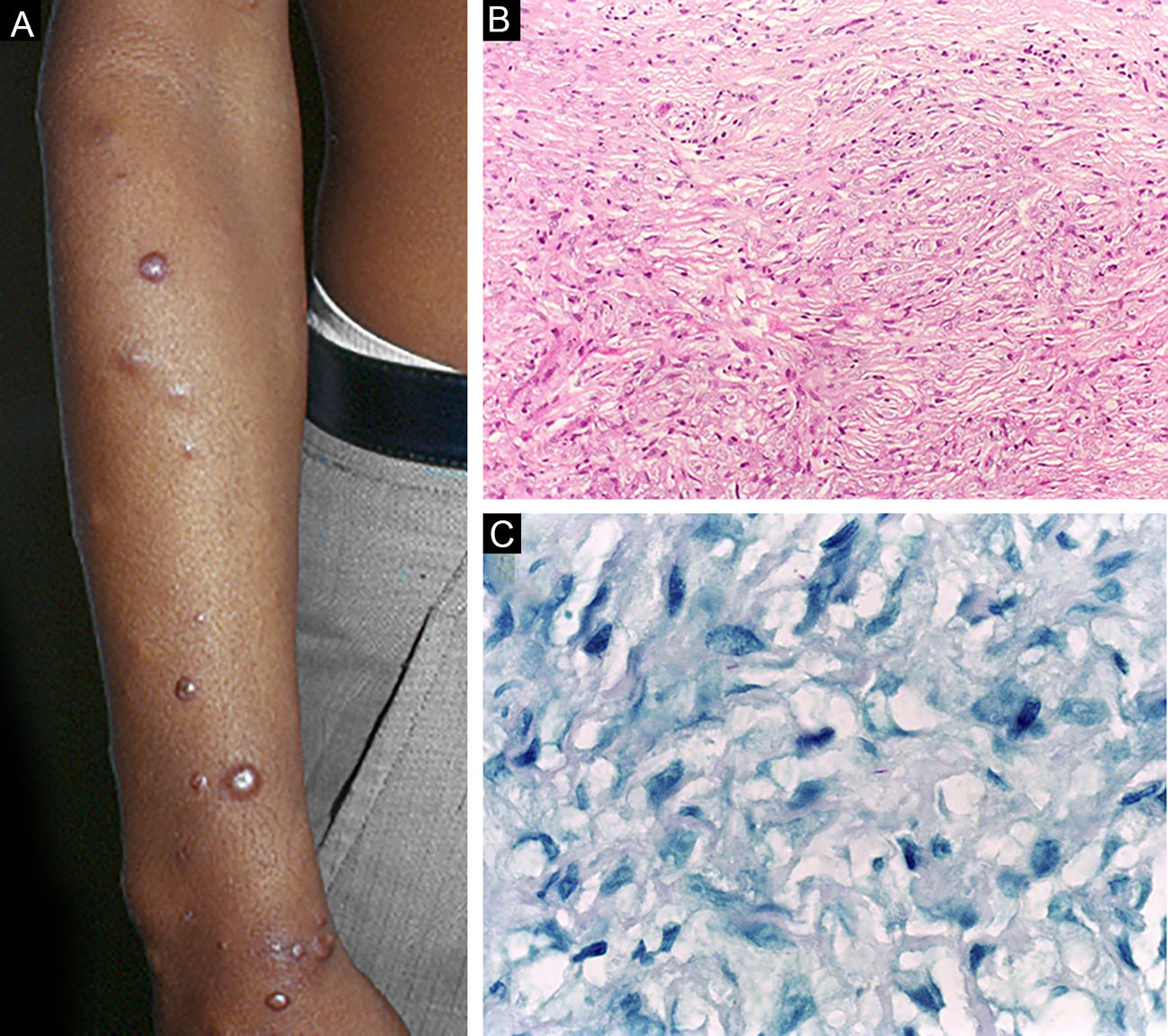
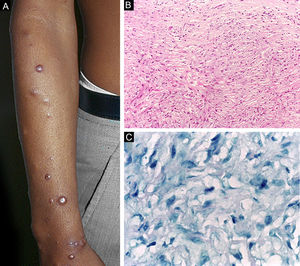
A hanseníase histoide, variante da apresentação virchowiana, é entidade única e incomum, com características clínicas e histopatológicas particulares. O termo hanseníase histoide foi originalmente cunhado por Wade, em 1963, como conceito histopatológico de hansenoma rico em bacilos e composto de macrófagos fusiformes (fig. 9 B), juntamente com a ausência de formação de globias. Caracteriza‐se por pápulas e nódulos cutâneos ou subcutâneos, indolores, firmes, cobertos por pele marrom‐amarelada, por vezes assemelhando‐se a dermatofibromas, a lesões VV ou a reação tipo ENH (fig. 9 A). A hanseníase histoide associava‐se classicamente a recaídas da doença após monoterapia com dapsona em presença de resistência do bacilo à mesma; no entanto, desde a introdução da terapia multidroga, a maioria dos casos observados é hanseníase histoide de novo.34
Hanseníase históide. (A), Pápulas eritemato‐ferruginosas bem‐delimitadas dispersas pelo membro. (B), Proliferação de macrófagos fusiformes com citoplasma finamente vacuolizado. (Hematoxilina & eosina, 200×) (C), Bacilos álcool‐ácido resistentes no citoplasma de macrófagos fusiformes. (Faraco, 1000×).
A hanseníase em sua apresentação inicial, chamada hanseníase “indeterminada”, costuma se manifestar clinicamente de modo discreto, por uma pequena mácula hipocrômica com sensibilidade reduzida, podendo haver hipoidrose e/ou rarefação de pelos no local da lesão. No exame histológico, observa‐se apenas a presença de infiltrado linfo‐histiocitário de localização perineural e perianexial, sem presença de bacilos. A hanseníase indeterminada pode evoluir com cura espontânea ou para qualquer uma das cinco apresentações clássicas, dependendo do padrão de resposta imune desenvolvida pelo hospedeiro.32
Finalmente, os episódios reacionais da hanseníase correspondem a exacerbações imunes agudas da doença infecciosa crônica. A RR ocorre tipicamente em pacientes com formas dimorfas, havendo surgimento de lesões novas e agravamento das lesões preexistentes, com desenvolvimento de eritema e edema sobre as lesões, que se tornam hiperestésicas e dolorosas. O quadro tem início súbito, diferenciando‐se da recidiva da doença, que é lenta e insidiosa. As neurites são comuns, com perda de função sensitiva ou sensitivo‐motora e dor à palpação dos nervos acometidos, que se encontram aumentados de volume. Artrites podem ocorrer, sobretudo quando há lesões de pele próximas a articulações.35 Histologicamente, é definida pela presença de duas características: granulomas com edema extra e intracelular, canais vasculares dilatados, dissociação do colágeno dérmico, evidência de intensa resposta de hipersensibilidade do tipo tardio (IV) com dano agudo aos nervos dérmicos.36,37
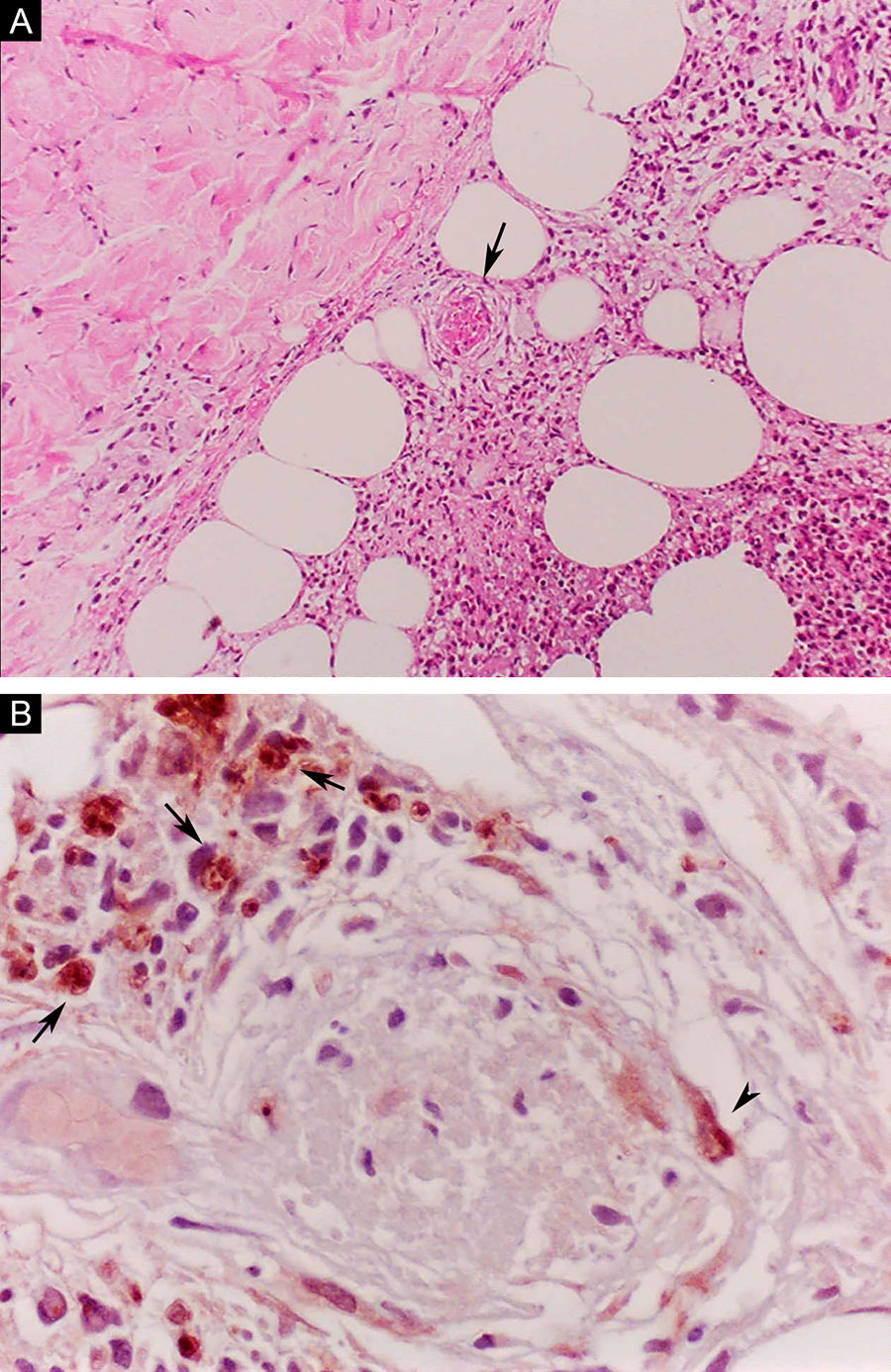
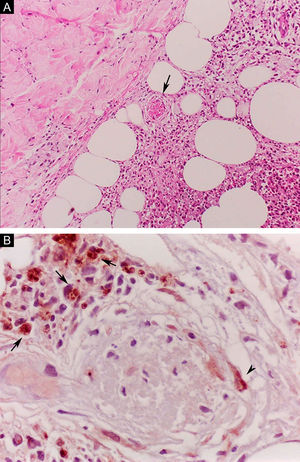
O ENH, por sua vez, é diagnosticado quando um paciente multibacilar (DD, DV ou VV) desenvolve abruptamente lesões pápulo‐nodulares eritematosas, dolorosas e tensas ao toque. Em casos mais graves, pode haver formação de bolhas e ulceração das lesões, caracterizando o eritema nodoso necrotizante. Ao contrário do eritema nodoso clássico que se limita aos membros inferiores, o ENH tende a apresentar distribuição simétrica, atingindo face, tronco e membros, sobretudo nas áreas extensoras. Mais raramente, pode apresentar clínica idêntica ao eritema polimorfo, com placas eritematosas, lesões purpúricas e bolhas. Pode haver neurite, irite, orquite, dactilite, adenopatia, edema e febre. Artropatia é comum, ocorrendo em diversos padrões – o poliarticular de pequenas e grandes articulações, semelhante à artrite reumatoide, é o mais comum.35 Pode ocorrer acometimento visceral importante nos casos mais graves, com elevação de provas inflamatórias (leucocitose, VHS, PCR), disfunção hepática, anemia e hematúria. Deve‐se diferenciar o quadro de farmacodermias e outras patologias. Histologicamente, é caracterizado por focos de infiltrado polimorfonuclear neutrofílico de permeio a resposta granulomatosa macrofágica, edema e, muitas vezes, com evidências de vasculite. O processo inflamatório envolve a derme e a hipoderme (fig. 10).36
Eritema nodoso hansênico. (A), Comprometimento de lóbulos da hipoderme com focos de exsudação neutrofílica, macrófagos, ruptura de adipócitos e vaso sanguíneo com trombose (seta). (Hematoxilina & eosina, 100×) (B), Material antigênico de micobactéria no citoplasma de macrófagos (setas) e em célula endotelial (cabeça de seta) de vaso sanguíneo com trombose. Reação imuno‐histoquímica com anticorpo anti‐BCG (400×).
As estratégias de controle da hanseníase ainda se baseiam apenas no diagnóstico clínico e tratamento precoces, a fim de bloquear a transmissão e prevenir, ou ao menos minimizar, as sequelas. No entanto, condizente com seu caráter de doença negligenciada, ainda não se beneficia de métodos sorológicos sensíveis e específicos capazes de auxiliar no diagnóstico e seguimento dos pacientes. Nesse sentido, alguns anticorpos específicos contra M. leprae têm sido estudados como marcadores potenciais, com especial atenção ao PGL‐1.
Tipicamente, indivíduos multibacilíferos produzem grandes quantidades de imunoglobulina M anti‐PGL‐1, em quantidade proporcional à carga bacilífera. Em pacientes não tratados, a sensibilidade média para multibacilares é de 78%, enquanto pacientes paucibacilares apresentam sensibilidade de apenas 23%. Esses números permitem sugerir uma utilidade da sorologia positiva para o diagnóstico de casos suspeitos multibacilares iniciais (em especial os neurais primários, sem lesões de pele), bem como nos casos reacionais recidivantes, além do seguimento dos contatos multibacilares.38–40 Entretanto, a sorologia não se encontra disponível comercialmente, limitando‐se a alguns centros de pesquisa, o que restringe sua utilização na prática clínica atualmente.35,38
A pesquisa do anticorpo IgM anti‐PGL‐1 por meio de teste rápido tem sido recomendada nos contatantes de pacientes com hanseníase sem lesões clínicas características, visando à detecção precoce da doença. A positividade, entretanto, não implica no diagnóstico de hanseníase, uma vez que, em áreas endêmicas, a positividade do teste pode traduzir mera infecção subclínica.40,41 Casos positivos, na ausência de alterações dermatológicas ou neurológicas, devem ser acompanhados anualmente para o surgimento de lesões. Na presença de alterações suspeitas inconclusivas (dermatológicas ou neurológicas) em contactantes, o teste rápido é recomendado como passo inicial, e os casos positivos devem ser investigados a seguir por meio de exame baciloscópico.39,40
Por fim, a PCR é uma técnica molecular utilizada para amplificar o DNA de M. leprae, de elevada acurácia, apresentando sensibilidade de 72% e especificidade de 87% para a forma multibacilar. Em paciente paucibacilíferos, a sensibilidade cai para 45%, mas a especificidade se mantém estável, em 86%. A técnica se mostra particularmente útil em casos clínicos de difícil diagnóstico, com baciloscopia negativa e histologia inconclusiva.41
ConclusãoAs manifestações clínicas da hanseníase são caracterizadas por sua apresentação espectral bipolar, com forte correlação entre o braço do sistema imunológico (Th1/Th2) mais proeminentemente ativado e o quadro clínico. A baixa variabilidade genética encontrada no genoma de M. leprae sugere fortemente que a resposta imunológica dependa principalmente do hospedeiro, e não de variações do patógeno. De fato, alguns estudos genéticos já demonstraram correlação entre certos haplótipos e manifestações clínicas específicas, embora os determinantes imunogenéticos da história natural da doença ainda estejam longe de ser totalmente conhecidos.
A base da eliminação e controle da hanseníase tem consistido principalmente em melhorar o acesso aos cuidados de saúde, combinado com uma melhor capacidade de triagem e diagnóstico precoce dos casos. Um estudo brasileiro indicou que os pacientes iniciam o tratamento, em média, de um ano e meio a dois anos após o aparecimento dos primeiros sintomas, com o atraso creditado, ao menos em parte, à capacidade limitada dos profissionais de saúde em reconhecer a doença.38 Nesse sentido, a ampla difusão dos conhecimentos atuais sobre a hanseníase é uma etapa essencial para se obter diagnóstico e tratamento precoces, controle das reações e das sequelas, além do bloqueio de transmissão da doença – aspectos negligenciados em muitas partes do mundo há muito tempo.
Suporte financeiroFundo de Apoio à Dermatologia de São Paulo –Sebastião Sampaio (FUNADERSP).
Bolsa de pesquisadora do CNPq: processo 306371/2018‐9 (bolsa de produtividade em pesquisa da autora MNS).
Contribuição dos autoresLuis Alberto Froes: Revisão crítica da literatura; obtenção, análise e interpretação dos dados; elaboração e redação do manuscrito.
Mirian Sotto: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito.
Maria Angela: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito.
Conflito de interessesNenhum.
Os autores agradecem o apoio financeiro do Fundo de Apoio à Dermatologia de São Paulo – Sebastião Sampaio (FUNADERSP) e do Conselho Nacional de Pequisa (CNPq) processo 306371/2018‐9.
Como citar este artigo: Froes Junior LAR, Sotto MN, Trindade MAB. Leprosy: clinical and immunopathological characteristics. An Bras Dermatol. 2022;97:338–47.
Trabalho realizado no Departamento de Patologia da Faculdade de Medicina, Universidade de São Paulo e Hospital das Clínicas da Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil.