A hanseníase representa uma doença transmissível de longa duração, resultante de infecção por Mycobacterium leprae. A interleucina‐17A (IL‐17A) é uma das citocinas pró‐inflamatórias que protege o ser humano contra muitos patógenos fúngicos e bacterianos.
ObjetivoInvestigar o polimorfismo do gene IL‐17A (rs2275913) e seu nível circulante em pacientes com hanseníase e correlacionar os resultados detectados com diferentes aspectos clínicos da hanseníase nos pacientes investigados.
MétodosSessenta pacientes com hanseníase e 29 voluntários pareados por idade e sexo foram investigados em relação ao nível sérico de IL‐17A e o polimorfismo de nucleotídeo único (PNU) de IL‐17A por ELISA e RFLP‐PCR, respectivamente.
ResultadosO nível sérico de IL‐17A foi significativamente maior em pacientes com hanseníase do que nos controles (p=0,034), e em HT do que em HV (p=0,017). O alelo G de IL‐17A (rs2275913 A/G) e o genótipo GG foram significativamente associados a HV (p=0,005 e 0,001, respectivamente). Os portadores do genótipo AG de IL‐17A (rs2275913 A/G) demonstraram os níveis séricos mais elevados de IL‐17A; entretanto, os níveis mais baixos foram encontrados em portadores do genótipo AA de IL‐17A (rs2275913 A/G; p=0,005). O grau de deficiência 2 (p=0,030) e a baciloscopia (SSS, slit skin smear) positiva (p=0,005) foram significativamente associados ao genótipo GG de IL‐17A (rs2275913 A/G).
Limitações do estudoO pequeno número de indivíduos estudados.
ConclusõesA IL‐17A pode ter um papel fundamental na patogênese da hanseníase. O genótipo GG da IL‐17A (rs2275913) mais a presença do alelo G podem explicar o desenvolvimento de HV na população egípcia.
A hanseníase é doença infecciosa de longa duração causada por Mycobacterium leprae. Pode afetar principalmente nervos, pele, trato respiratório e olhos, causando lesões. Os sinais da hanseníase podem aparecer dentro de um ano, mas para algumas pessoas podem levar 20 anos ou mais para ocorrer.1
A doença continua sendo um grande problema de saúde em alguns países,2 incluindo o Egito, que ainda é um dos 22 países de prioridade global.3
A hanseníase é classificada em dois tipos polares: hanseníase tuberculoide (HT) e hanseníase virchowiana (HV), mais três tipos intermediários; borderline tuberculoide (BT), borderline borderline (BB) e borderline virchowiana (BV). A HT é caracterizada pela presença de poucos bacilos (paucibacilar ‐ PB) e imunidade mediada por células eficiente. No entanto, a HV é caracterizada por numerosos bacilos (multibacilar ‐ MB) e imunidade mediada por células ineficiente.4
Na HT, há alta proporção de células T CD4+com aumento de citocinas tipo 1. Por outro lado, a HV mostra predominância de células T CD8+com citocinas tipo 2. Os dados mencionados demonstram as interações imunopatológicas entre as citocinas tipo 2 e tipo 1 e produtos de macrófagos ativados (monocinas) na hanseníase.5
No entanto, certo subconjunto de células T mostrou produzir citocinas que não podem ser classificadas de acordo com o esquema Th1‐Th2. A interleucina (IL)‐17 está entre essas citocinas, e as células T produtoras de IL‐17 foram denominadas células Th17.6
A IL‐17A é uma proteína que em seres humanos é codificada pelo gene IL‐17A. É uma citocina pró‐inflamatória.7 Originalmente, a IL‐17A deveria ser produzida exclusivamente por células T, mas também é secretada por muitas outras células, incluindo células dendríticas (CD), macrófagos, células natural killer (NK) e células γδ‐T.8
A IL‐17A atua em células estruturais, como células epiteliais, fibroblastos e queratinócitos em vários tecidos, incluindo a pele. Essas células expressam o receptor de IL‐17 e produzem muitas citocinas necessárias para a resposta inflamatória, como o fator estimulador de colônias de granulócitos (GCSF, do inglês granulocyte colony‐stimulating factor) e IL‐6, bem como quimiocinas para atrair neutrófilos e macrófagos para os tecidos inflamados. Essas células inflamatórias (neutrófilos e macrófagos) podem tanto eliminar a infecção como iniciar um processo patogênico.6
Além disso, a ligação da IL‐17A ao receptor de IL‐17 causa mudanças conformacionais importantes que possibilitam a ligação de adaptadores de sinalização, como os fatores associados ao receptor de TNF (TRAFs, do inglês TNF‐receptor associated factors). A ligação desses adaptadores de sinalização desencadeia a ativação de várias vias de sinalização, incluindo o fator nuclear kappa B (NF‐κB) e vias da proteína‐quinase ativada por mitógeno (MAPK).9
A ativação dessas vias leva à produção de muitas citocinas inflamatórias, como IL‐1β, fator de necrose tumoral alfa (TNF‐α) e quimiocinas, que atraem macrófagos, bem como produtos antimicrobianos como mucinas e defensinas. Por meio de seus efeitos inflamatórios, esses produtos ajudam na eliminação de muitos patógenos estranhos.10
Foi demonstrado que a IL‐17A protege o corpo humano contra várias infecções bacterianas e fúngicas causadas por patógenos invasores.9
O objetivo do presente estudo foi esclarecer o hipotético papel da IL‐17A na patogênese da hanseníase, por meio da análise do polimorfismo do gene IL‐17A (rs2275913), além de seus níveis séricos em pacientes com hanseníase, e correlacionar os resultados obtidos com diferentes aspectos clínicos da hanseníase nos pacientes investigados.
Materiais e métodosO presente trabalho foi um estudo de caso‐controle. Foi realizado em 60 pacientes com tipos variados de hanseníase e 29 voluntários saudáveis pareados por idade e sexo, sem história pregressa ou familiar de hanseníase (grupo controle). Os pacientes com hanseníase e o grupo controle foram selecionados no Ambulatório de Dermatologia e Hanseníase, Menoufia Teaching and University Hospitals. A parte laboratorial do estudo foi realizada no Departamento de Microbiologia e Imunologia, Faculdade de Medicina, Menoufia University.
O estudo foi aprovado pelo Comitê de Ética em Direitos Humanos em Pesquisa, Menoufia University. O termo de consentimento informado por escrito foi assinado por cada participante após a informação sobre o estudo.
Foram incluídos pacientes de ambos os sexos com hanseníase confirmada por meio do aspecto clínico das lesões, baciloscopia (SSS, do inglês slit skin smear) positiva prévia e/ou avaliação histopatológica.
Indivíduos com qualquer uma das seguintes condições foram excluídos deste estudo: 1‐ doenças sistêmicas (por exemplo, diabetes mellitus, cirrose, infecção sistêmica, insuficiência renal, doença do colágeno ou neoplasia maligna); 2‐ endocrinopatias (como síndrome de Cushing, hiper‐ e hipotireoidismo); 3‐ em uso de medicamentos anti‐inflamatórios ou medicamentos hormonais, como esteroides. 4‐ gravidez e lactação.
Uma ficha foi aberta para todos os pacientes, incluindo nome, idade, sexo, residência, ocupação e histórico da doença hansênica. Para avaliar o nível socioeconômico (NSE), utilizou‐se a escala que inclui sete domínios (escolaridade e cultural; ocupação; bens da família; família; saneamento doméstico; econômico; e assistência à saúde). Foi perguntado a cada participante sobre ocupações, renda e níveis educacionais. O escore total do NSE é 84. NSE alto foi indicado como pelo menos 70% (59 a 84); nível médio, 40% a menos de 70% (34 a 58); e nível baixo como menos de 40% (menos de 34).11
Foi realizado exame dermatológico incluindo avaliação clínica completa das lesões cutâneas para determinar a distribuição, número e, consequentemente, a classificação clínica. Além disso, foi realizado exame neurológico para detectar possíveis nervos afetados. Os pacientes com hanseníase avaliados foram categorizados pelos critérios de Madrid (1953) em: HT, HB ou dimorfa e HV.12
Sob condição de assepsia completa, 5mL de sangue foram obtidos de cada indivíduo e divididos em duas partes. A primeira parte (2mL) foi mantida em tubo simples, deixada a 37°C por 30 minutos para coagular, depois centrifugada a 4000rpm por 10 minutos. O soro obtido foi separado em alíquotas e mantido a−80°C até o momento da análise para determinação do nível sérico de IL‐17A utilizando kits de ELISA (Neo Bio science Technology Co., Ltd, Shenzhen, China) de acordo com as instruções do fabricante.
A segunda parte (3mL) foi transferida imediatamente para tubo vacutainer com EDTA e armazenada para extração de DNA. A extração de DNA foi feita utilizando o mini kit Gene JET™ Whole Blood Genomic DNA Purification (THERMO SCIENTIFIC, EU/Lituânia), seguindo as instruções do fabricante. A genotipagem do SNP para IL17A ‐197G\A (rs2275913) foi obtida pela análise de polimorfismo de fragmentos de restrição utilizando a reação em cadeia da polimerase (PCR‐RFLP). As sequências de primers para IL17A‐197G\A foram 5’‐AACAAGTAAGAATGAAAAGAGGACATGGT‐3’(sense) e 5’‐ CCCCCAATGAGGTCATAGAAGAATC‐3’(anti‐sense).
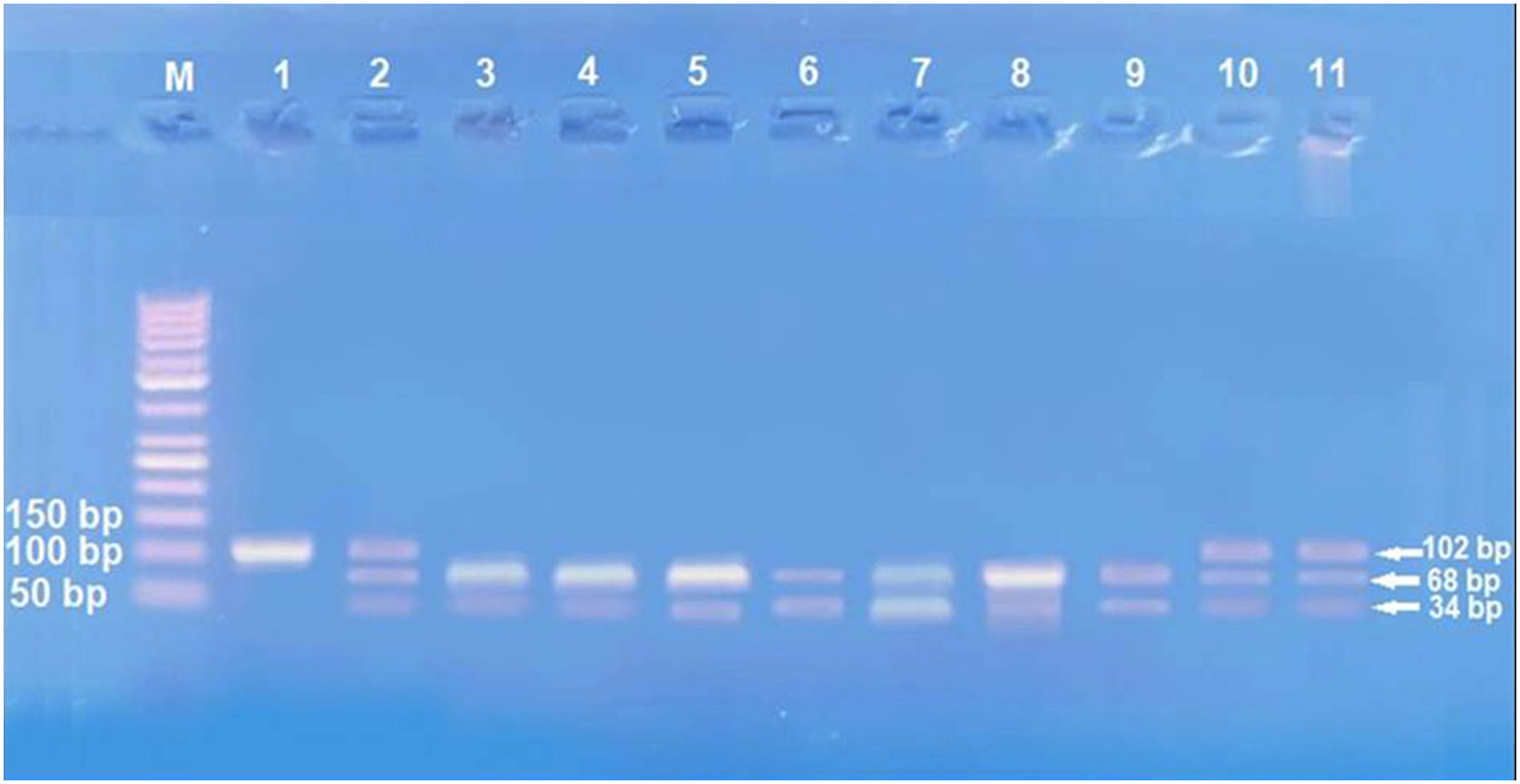
A amplificação de PCR foi realizada em um volume de 30μL de mistura contendo 100 ng de DNA genômico, 1,0μM de cada primer, 200μM de cada dNTP, 2,0mM de MgCl2, 3μL de tampão de PCR 10×e 1,5 U Taq DNA polimerase (Invitrogen Life Technologies, Grand Island, NY, EUA). As enzimas de restrição XagI (THERMO SCIENTIFIC, EU/Lituânia) foram usadas para diferenciar os genótipos IL17A‐197G\A (rs2275913) – 102, 68, 34 pb. O produto de PCR e a enzima foram bem misturados e incubados a 37°C durante 1,5 hora. O padrão de migração dos produtos da digestão em gel de agarose a 3% possibilitou a identificação dos genótipos IL17A‐197G\A. A genotipagem foi realizada às cegas e em quantidades iguais de casos e controles. O genótipo G (68+34 pb), o genótipo A (102 pb) e o AG (102, 68, 34 pb) foram identificados.13
Análise estatísticaOs dados coletados foram analisados estatisticamente pelo software SPSS (versão 20) em computador compatível com IBM. Duas formas de análise estatística foram realizadas: 1) estatística descritiva: foram expressas como média±desvio padrão (X±DP) bem como mediana e intervalo para dados quantitativos ou número e porcentagem (No e %) para dados qualitativos; 2) estatística analítica: foram utilizados os testes Qui‐Quadrado (χ2), Mann‐Whitney, Kruskal‐Wallis e Z; p ≤ 0,05 foi considerado estatisticamente significativo.
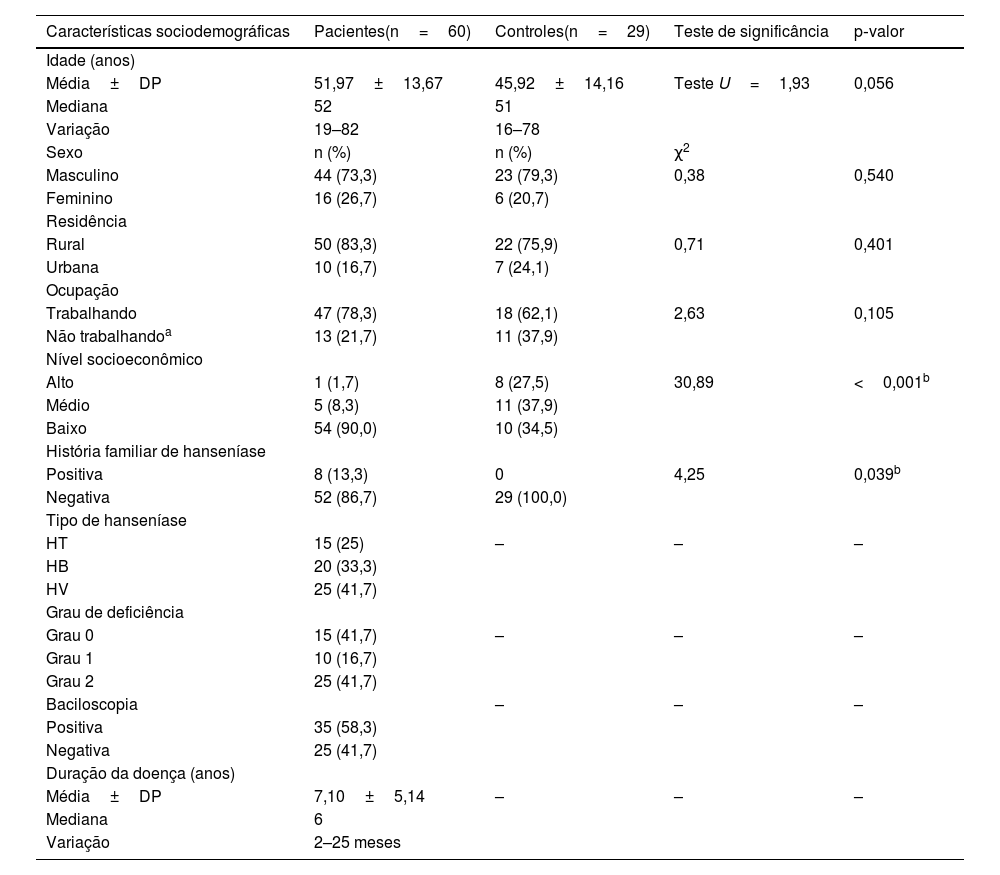
ResultadosDados sociodemográficos e clínicosA idade dos casos selecionados variou de 19 a 82 anos, dos quais 44 (73,3%) eram homens e 16 (26,7%) mulheres, e 83% dos pacientes estudados eram da zona rural. Quinze (25%) pacientes com hanseníase tinham HT, 25 (41,7%) pacientes tinham HV e 20 (33,3%) casos tinham BV.
Em comparação aos controles, a maioria dos pacientes com hanseníase (90%) tinha NSE significativamente baixo (p=0,001) e 13,3% deles tinham história familiar positiva de hanseníase (p=0,039; tabela 1).
Dados sociodemográficos e clínicos dos indivíduos estudados
| Características sociodemográficas | Pacientes(n=60) | Controles(n=29) | Teste de significância | p‐valor |
|---|---|---|---|---|
| Idade (anos) | ||||
| Média±DP | 51,97±13,67 | 45,92±14,16 | Teste U=1,93 | 0,056 |
| Mediana | 52 | 51 | ||
| Variação | 19–82 | 16–78 | ||
| Sexo | n (%) | n (%) | χ2 | |
| Masculino | 44 (73,3) | 23 (79,3) | 0,38 | 0,540 |
| Feminino | 16 (26,7) | 6 (20,7) | ||
| Residência | ||||
| Rural | 50 (83,3) | 22 (75,9) | 0,71 | 0,401 |
| Urbana | 10 (16,7) | 7 (24,1) | ||
| Ocupação | ||||
| Trabalhando | 47 (78,3) | 18 (62,1) | 2,63 | 0,105 |
| Não trabalhandoa | 13 (21,7) | 11 (37,9) | ||
| Nível socioeconômico | ||||
| Alto | 1 (1,7) | 8 (27,5) | 30,89 | <0,001b |
| Médio | 5 (8,3) | 11 (37,9) | ||
| Baixo | 54 (90,0) | 10 (34,5) | ||
| História familiar de hanseníase | ||||
| Positiva | 8 (13,3) | 0 | 4,25 | 0,039b |
| Negativa | 52 (86,7) | 29 (100,0) | ||
| Tipo de hanseníase | ||||
| HT | 15 (25) | – | – | – |
| HB | 20 (33,3) | |||
| HV | 25 (41,7) | |||
| Grau de deficiência | ||||
| Grau 0 | 15 (41,7) | – | – | – |
| Grau 1 | 10 (16,7) | |||
| Grau 2 | 25 (41,7) | |||
| Baciloscopia | – | – | – | |
| Positiva | 35 (58,3) | |||
| Negativa | 25 (41,7) | |||
| Duração da doença (anos) | ||||
| Média±DP | 7,10±5,14 | – | – | – |
| Mediana | 6 | |||
| Variação | 2–25 meses |
χ2, Teste do qui‐quadrado; n, número; U, teste de Mann‐Whitney; HT, hanseníase tuberculoide; HV, hanseníase virchowiana; HB, hanseníase borderline.
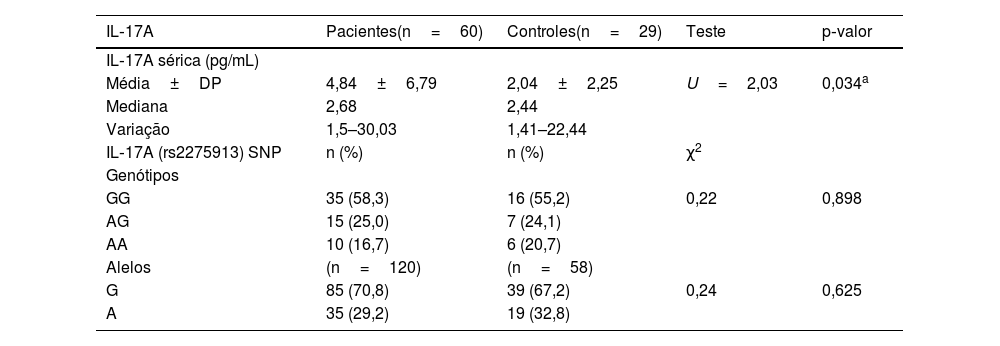
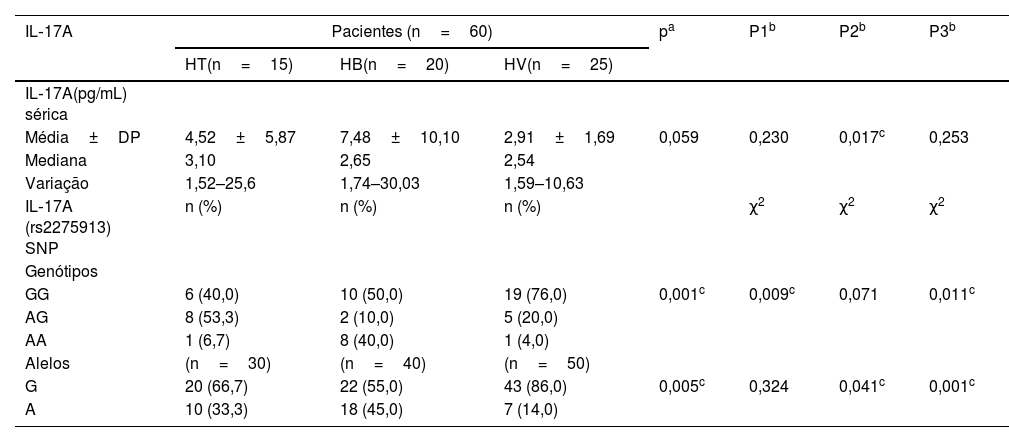
Níveis séricos de IL‐17A significativamente mais altos foram observados nos pacientes com hanseníase (4,84±6,79) do que no grupo controle (2,04±2,25; p=0,034; tabela 2), que foram significativamente maiores no grupo HT (4,52±5,87) do que no grupo HV (2,91±1,69; p=0,017; tabela 3).
Níveis séricos de IL‐17A e polimorfismo gênico em pacientes com hanseníase e grupo controle
| IL‐17A | Pacientes(n=60) | Controles(n=29) | Teste | p‐valor |
|---|---|---|---|---|
| IL‐17A sérica (pg/mL) | ||||
| Média±DP | 4,84±6,79 | 2,04±2,25 | U=2,03 | 0,034a |
| Mediana | 2,68 | 2,44 | ||
| Variação | 1,5–30,03 | 1,41–22,44 | ||
| IL‐17A (rs2275913) SNP | n (%) | n (%) | χ2 | |
| Genótipos | ||||
| GG | 35 (58,3) | 16 (55,2) | 0,22 | 0,898 |
| AG | 15 (25,0) | 7 (24,1) | ||
| AA | 10 (16,7) | 6 (20,7) | ||
| Alelos | (n=120) | (n=58) | ||
| G | 85 (70,8) | 39 (67,2) | 0,24 | 0,625 |
| A | 35 (29,2) | 19 (32,8) |
DP, desvio padrão; pg/mL, picograma por mililitro; χ2, teste de Qui‐quadrado; U, teste de Mann‐Whitney.
Níveis séricos de IL‐17A e polimorfismo gênico em pacientes com diferentes tipos de hanseníase
| IL‐17A | Pacientes (n=60) | pa | P1b | P2b | P3b | ||
|---|---|---|---|---|---|---|---|
| HT(n=15) | HB(n=20) | HV(n=25) | |||||
| IL‐17A(pg/mL) sérica | |||||||
| Média±DP | 4,52±5,87 | 7,48±10,10 | 2,91±1,69 | 0,059 | 0,230 | 0,017c | 0,253 |
| Mediana | 3,10 | 2,65 | 2,54 | ||||
| Variação | 1,52–25,6 | 1,74–30,03 | 1,59–10,63 | ||||
| IL‐17A (rs2275913) SNP | n (%) | n (%) | n (%) | χ2 | χ2 | χ2 | |
| Genótipos | |||||||
| GG | 6 (40,0) | 10 (50,0) | 19 (76,0) | 0,001c | 0,009c | 0,071 | 0,011c |
| AG | 8 (53,3) | 2 (10,0) | 5 (20,0) | ||||
| AA | 1 (6,7) | 8 (40,0) | 1 (4,0) | ||||
| Alelos | (n=30) | (n=40) | (n=50) | ||||
| G | 20 (66,7) | 22 (55,0) | 43 (86,0) | 0,005c | 0,324 | 0,041c | 0,001c |
| A | 10 (33,3) | 18 (45,0) | 7 (14,0) | ||||
P1, HT versus HB; P2, HT versus HV; P3, HV versus HB; χ2, teste de Qui‐quadrado.
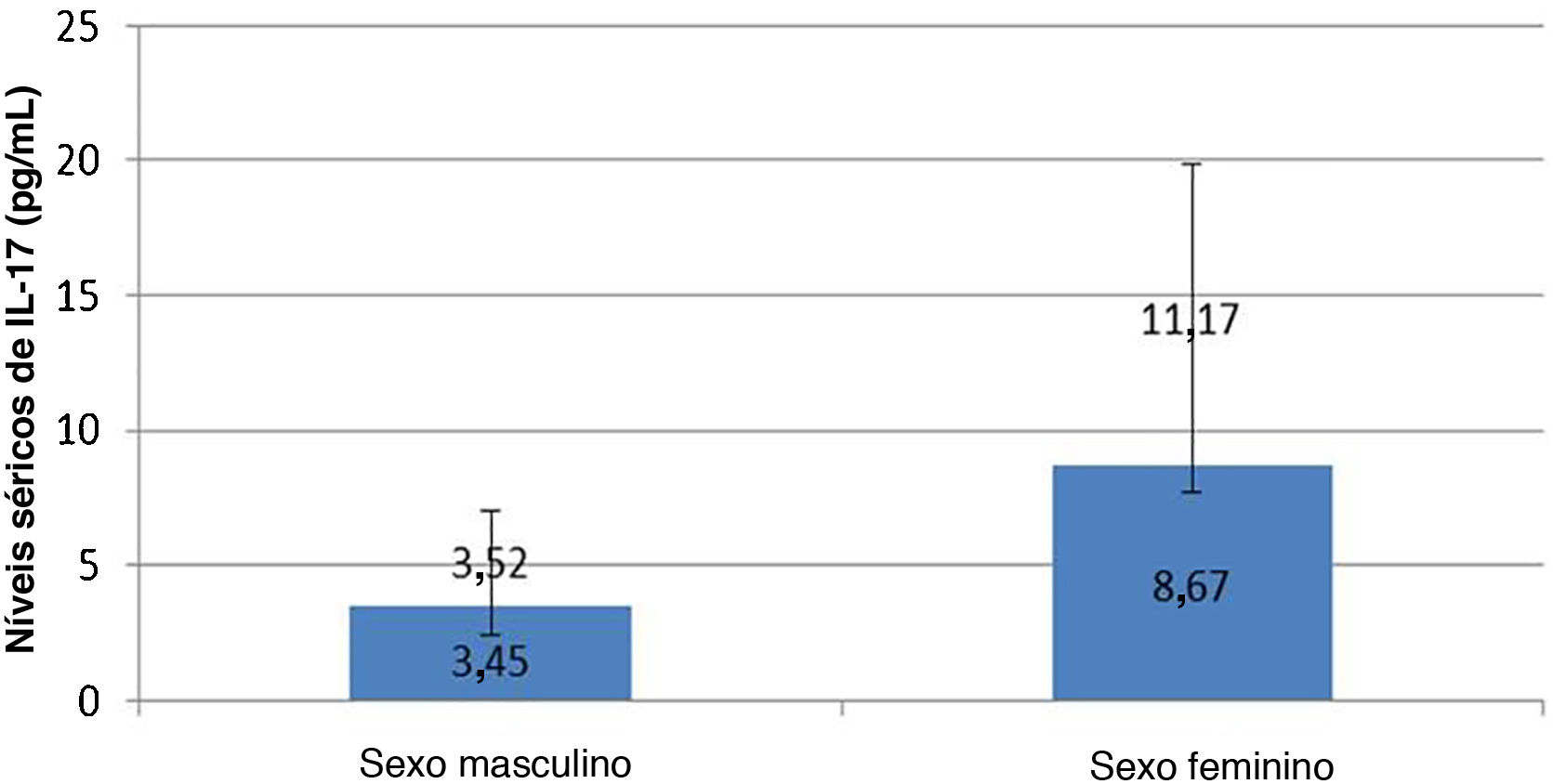
Os níveis séricos de IL‐17A não foram afetados por quaisquer dados pessoais ou clínicos nos casos de hanseníase estudados, exceto pelo sexo, pois níveis séricos de IL‐17A significativamente mais elevados foram relatados em pacientes com hanseníase do sexo feminino do que no sexo masculino (p=0,007; fig. 1).
Genótipos e alelos de IL‐17 (rs2275913A/G)O estudo do SNP de IL‐17A (rs2275913A/G; fig. 2) mostrou que havia diferença estatisticamente não significativa entre pacientes com hanseníase e grupo controle em relação aos genótipos de IL‐17A (rs2275913A/G; p=0,898) e distribuição de alelos (p=0,625; tabela 2). Entretanto, foram demonstradas diferenças significativas entre os pacientes com os três tipos de hanseníase em relação às distribuições percentuais dos genótipos de IL‐17A (p=0,001) e os alelos (p=0,005), uma vez que o genótipo GG do IL‐17A (rs2275913A/G) além do alelo G foram associados significativamente com HV, enquanto o genótipo AG estava significativamente associado a casos de HT (tabela 3).
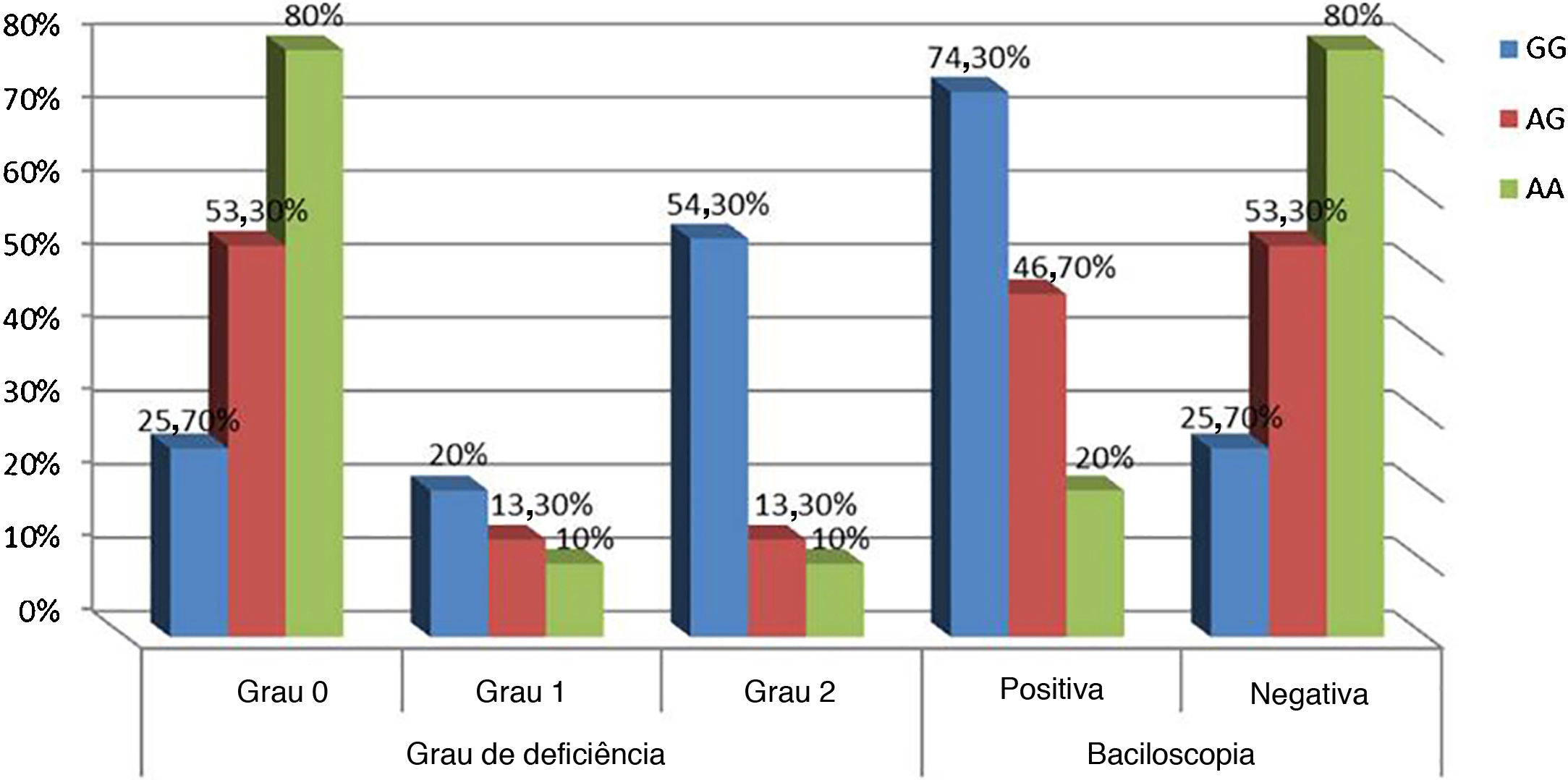
Relação entre genótipos de IL‐17A e dados clínicos em pacientes com hanseníaseDiferenças não significativas foram encontradas entre os genótipos de IL‐17A (rs2275913A/G) em relação aos dados pessoais e clínicos de pacientes com hanseníase, exceto grau de incapacidade e SSS, pois uma porcentagem maior de incapacidade de grau 2 e SSS positiva foram associadas significativamente com o genótipo GG de IL‐17A (rs2275913A/G) quando comparadas aos genótipos AG e GG (p=0,030 e 0,005; respectivamente; fig. 3).
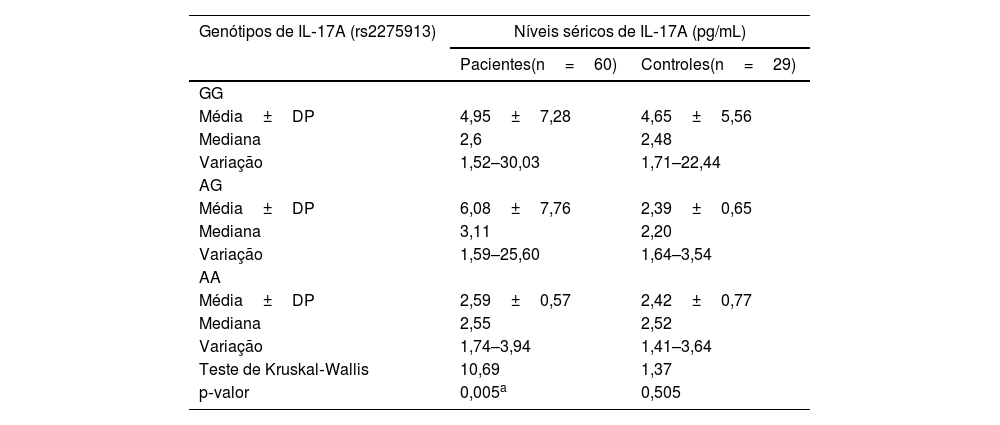
Relação entre os níveis séricos de IL‐17A e genótipos de IL‐17A (rs2275913A/G)Em pacientes com hanseníase, havia relação estatisticamente significativa entre os genótipos de IL‐17A (rs2275913A/G) e os níveis séricos de IL‐17A, pois os níveis mais altos foram encontrados em portadores do genótipo AG de IL‐17A (rs2275913A/G) e os níveis mais baixos foram encontrados em portadores do genótipo AA (p=0,005). Entretanto, no grupo controle, foi encontrada relação não significante (p=0,505; tabela 4).
Relação entre os níveis séricos de IL‐17A e genótipos de IL‐17A (rs2275913) em pacientes com hanseníase e grupo controle
| Genótipos de IL‐17A (rs2275913) | Níveis séricos de IL‐17A (pg/mL) | |
|---|---|---|
| Pacientes(n=60) | Controles(n=29) | |
| GG | ||
| Média±DP | 4,95±7,28 | 4,65±5,56 |
| Mediana | 2,6 | 2,48 |
| Variação | 1,52–30,03 | 1,71–22,44 |
| AG | ||
| Média±DP | 6,08±7,76 | 2,39±0,65 |
| Mediana | 3,11 | 2,20 |
| Variação | 1,59–25,60 | 1,64–3,54 |
| AA | ||
| Média±DP | 2,59±0,57 | 2,42±0,77 |
| Mediana | 2,55 | 2,52 |
| Variação | 1,74–3,94 | 1,41–3,64 |
| Teste de Kruskal‐Wallis | 10,69 | 1,37 |
| p‐valor | 0,005a | 0,505 |
DP, desvio‐padrão; pg/mL, picograma por mililitro.
Em várias condições patogênicas, a IL‐17A pode eliminar a infecção e iniciar a reação inflamatória que pode ser mediada pela via NF‐κB,9 via produção de muitas citocinas inflamatórias como TNF‐α, IL‐1β,10 G‐CSF e IL‐6, bem como quimiotaxia de macrófagos e neutrófilos para os tecidos inflamados.6
De acordo com esses dados, foi demonstrado que os níveis circulantes de IL‐17A apresentaram valores médios significativamente mais altos em pacientes com hanseníase do que os controles e em HT do que em HV. Esse nível alto pode representar o mecanismo de defesa do organismo contra a infecção pelo bacilo da hanseníase.
Em concordância com o resultado do presente estudo, Sakdiah et al.14 estudaram 40 pacientes indonésios com hanseníase versus 40 controles. Eles demonstraram que os níveis séricos de IL‐17 em pacientes com hanseníase eram maiores do que nos controles. Além disso, Santos et al.15 investigaram 51 pacientes brasileiros com hanseníase e 23 controles. Os autores revelaram que as concentrações de IL‐17A eram mais elevadas em pacientes com HT do que HV e controles. Além disso, eles demonstraram mais células CD4+/IL‐17A+em lesões de pele de pacientes com HT do que em pacientes com HV. Santos et al. relataram uma associação significativa entre as células Th17 e uma resposta inflamatória efetiva nas formas PB.15
No presente estudo, foi demonstrado um nível sérico significativamente mais alto de IL‐17A em pacientes do sexo feminino do que no sexo masculino. Tsuboi et al.16 estudaram 409 pacientes (200 homens, 208 mulheres) no Japão e encontraram níveis séricos elevados de IL‐17A em mulheres com depressão. Portanto, pode‐se especular que o aumento dos níveis séricos de IL‐17A em pacientes do sexo feminino pode ser explicado pelo fato de essas mulheres estarem sofrendo de alterações psiquiátricas, incluindo depressão resultante de seu estado de adoecimento. Além disso, as mulheres são mais suscetíveis a desenvolver mais alterações inflamatórias e autoimunes do que os homens, e o aumento dos níveis séricos de IL‐17 pode sinalizar para isso antes mesmo do aparecimento do quadro clínico.
Embora M. leprae possa infectar muitas pessoas, poucas adoecem, o que pode ser atribuído, em parte, à influência da herança genética na resposta imune. Acredita‐se que muitos SNPs estão ligados à produção de citocinas e quimiocinas que foram implicadas nas formas clínicas de hanseníase e episódios reacionais.17,18
O presente estudo mostrou diferença estatisticamente não significativa entre pacientes com hanseníase e grupo controle quanto aos genótipos de IL‐17 (rs2275913A/G) e distribuição de alelos. No entanto, a comparação entre os subgrupos de hanseníase (HV, HT e BV) revelou que o genótipo IL‐17 (rs2275913A/G) GG, além do alelo G, estavam associados significativamente com HV.
Em concordância com os resultados do presente estudo, Aquino et al.19 estudaram 150 pacientes brasileiros com hanseníase e 150 contatos domiciliares. Eles descobriram que as frequências genotípicas apresentavam diferenças não significativas nos pacientes com hanseníase em geral e os controles.19 Além disso, Escamilla‐Tilch et al.20 investigaram 75 pacientes mexicanos mestiços com hanseníase versus 69 controles. Sessenta e dois pacientes foram classificados como HV, dois como HT, dois como BV e nove como borderline. Eles não encontraram associação entre os SNPs do gene IL‐17A (rs2275913A/G) e hanseníase.20 Portanto, o presente estudo confirmou a evidência de falta de relação entre o polimorfismo do gene IL‐17A (rs2275913A/G) e a suscetibilidade à hanseníase.
Em relação aos subgrupos de hanseníase, embora tenha sido relatada uma associação significativa entre o alelo G de IL‐17A (rs2275913A/G) e o genótipo GG com HV, Escamilla‐Tilch et al.20 não encontraram essa associação. Essa diferença pode ser explicada com base em fatores ambientais e socioeconômicos que podem influenciar o desenvolvimento de diferentes doenças. Além disso, Escamilla‐Tilch et al. investigaram apenas quatro casos (dois como HT e dois como BV) versus 62 com HV, e esse tamanho de amostra pode não ser adequado para avaliação estatística.20
No presente estudo, observou‐se que maior porcentagem de incapacidade grau 2 e baciloscopia positiva estavam significativamente associadas ao genótipo GG de IL‐17A (rs2275913A/G), confirmando que o estudo atual demonstrou maior predominância do genótipo GG nos pacientes com HV.
Entre os genótipos de IL‐17 (rs2275913A/G) estudados, os portadores do genótipo AG demonstraram os níveis séricos mais elevados de IL‐17. Isso pode ser esclarecido pela predominância do genótipo AG nos casos de HT estudados no presente estudo, que é caracterizado por boa imunidade e alta resposta imune mediada por células.
Entretanto, Aquino et al.19 mostraram que o genótipo AA de IL‐17A (rs2275913) estava relacionado a níveis séricos elevados de IL‐17A. Essa diferença pode ser atribuída a fatores étnicos/raciais e genéticos. Aquino et al.19 estudaram uma população parda do sul do Brasil; porém o presente estudo investigou a população egípcia, que pertence à raça africana. De acordo com a SNPedia para IL‐17A (rs2275913), o alelo A de IL‐17A (rs2275913) foi encontrado apenas em 1,8%‐21,1% em povos africanos. De acordo com os dados da SNPedia, descobriu‐se que o alelo A de IL‐17A (rs2275913) era inferior ao alelo G (29,2% e 70,8%, respectivamente), e o genótipo AA era o genótipo mais baixo (10/60, 16,7%) no grupo de pacientes com hanseníase. Recentemente, Mazurek‐Mochol et al.21 relataram que o alelo A estava associado a um aumento na produção de IL‐17. Portanto, a diminuição do alelo A de IL‐17A (rs2275913) e do genótipo AA nos casos estudados do presente estudo também poderia explicar essa diferença.
ConclusõesA IL‐17A pode ter papel ativo na patogênese da hanseníase. Embora os polimorfismos de IL‐17A (rs2275913A/G) tenham papel não significativo na suscetibilidade genética ao desenvolvimento da hanseníase, o genótipo GG de IL‐17A (rs2275913A/G), bem como o alelo G, mostraram ter valor significativo e também foi comprovada sua ligação com a progressão para HV na população egípcia.
Suporte financeiroNenhum.
Contribuição dos autoresTodos os autores fizeram contribuições substanciais para todos os itens a seguir:
Azza Gaber Antar Farag: Revisão crítica da literatura; Concepção e planejamento do estudo.
Azza Zagloul labeeb: Obtenção, análise e interpretação de dados.
Amany Nagy Abdalla Gerges: Obtenção de dados.
Mustafa Elsayed Elshaib: Análise estatística.
Todos os autores aprovaram o artigo final. Os autores confirmam que todos os autores nomeados concordaram com a submissão do manuscrito e participaram do estudo o suficiente para serem nomeados como autores.
Os autores confirmam que não há conflito de interesses, e o presente estudo tem o número de aprovação do Comitê de Ética (1202/2/4/2019), fornecido pelo Comitê de Direitos Humanos em Pesquisa, Menoufia University, que estão de acordo com a Declaração de Helsinque de 1975 (revisada em 2000).
Conflito de interessesNenhum.
Como citar este artigo: Farag AG, Labeeb AZ, Gerges AN, Elshaib ME. Interleukin‐17A in Egyptian leprosy patients: A clinical, genetic, and biochemical study. An Bras Dermatol. 2022;97:735–41.
Trabalho realizado no Departamento de Dermatologia, Andrologia e ISTs e Departamento de Biologia Molecular, Faculdade de Medicina, Menoufia University, Egito.