No pênfigo foliáceo (PF), há produção de anti‐desmogleína (Dsg) 1, com acometimento exclusivo da pele. No pênfigo vulgar (PV), há produção de anti‐Dsg3 na forma mucosa e de anti‐Dsg1 e 3 na forma mucocutânea. Autoanticorpos anti‐Dsg3 têm sido raramente relatados no PF.
ObjetivosDeterminar fatores associados à produção e à patogenicidade de anti‐Dsg3 no PF.
MétodosEstudo analítico comparativo de três grupos de pacientes: 16 PF‐anti‐Dsg3+, e 42 PF‐anti‐Dsg3(−) e 22 PV virgens de tratamento. Soro foi utilizado no ELISA anti‐Dsg1 e 3, e no immunoblotting (IB) com extrato de epiderme humana. A expressão das Dsg1 e 3 em cortes parafinizados foi analisada por imuno‐histoquímica (IHQ). Os alelos HLA‐DRB1 foram compilados de banco de dados.
ResultadosNo grupo PF‐anti‐Dsg3+: faixa etária semelhante à do grupo PV (p>0,9999); predomínio da forma generalizada do PF (p=0,002); títulos de anti‐Dsg3 menores do que no PV (p<0,0001); IB reconheceu Dsg3 em um (8,33%) de 12 pacientes; IHQ mostrou internalização citoplasmática exclusiva da Dsg1; presença de alelos HLA‐DRB1 de suscetibilidade ao PF, com ausência de alelos associados ao PV, nos cinco pacientes tipificados.
Limitações do estudoMaioria dos pacientes do grupo PF‐anti‐Dsg3+ em tratamento.
ConclusãoA presença de anticorpos anti‐Dsg3 no PF esteve relacionada à faixa etária mais elevada (comparável à do PV) e à forma generalizada do PF. A não patogenicidade dos anticorpos anti‐Dsg3 no PF pode ser atribuída aos títulos séricos baixos de anti‐Dsg3, à ausência de internalização da Dsg3 avaliada pela IHQ e à ausência de alelos HLA‐DRB1 associados ao PV.
Pênfigos são doenças autoimunes, cujas bolhas acantolíticas intraepidérmicas são causadas pela deposição de anticorpos séricos nas desmogleínas (Dsg), componentes dos desmossomos da epiderme.1–3 O pênfigo vulgar (PV) e o pênfigo foliáceo (PF) são prevalentes na região Sudeste do Brasil.4,5 No PV, usualmente, os pacientes são idosos, com acometimento inicial mucoso, e apresentam autoanticorpos contra Dsg3. Na forma mucocutânea do PV, também há produção de anti‐Dsg1. O PF (também conhecido por “fogo selvagem” [FS] no Brasil) incide no adulto jovem, com acometimento exclusivo da pele e produção de anti‐Dsg1.1–5As Dsg1 e 3 são proteínas transmembrana de 160 kDa e 130 kDa, respectivamente, expressas por genes localizados no cromossomo 18.6 A teoria da compensação das Dsgs explica o nível da acantólise intraepidérmica nos pênfigos.7 Anticorpos anti‐Dsg1 no PF causam acantólise subgranulosa, pois a Dsg1 é mais expressa nas camadas superiores da epiderme. Já anticorpos anti‐Dsg3 causam acantólise suprabasal, uma vez que a Dsg3 é mais expressa nas camadas inferiores da epiderme na pele e em todas as camadas da epiderme nas mucosas. Além disso, como há menor expressão da Dsg1 nas mucosas, elas não são acometidas pelos anticorpos anti‐Dsg1 no PF, pois a Dsg3 compensa a coesão da epiderme na mucosa.8 A hipótese da compensação das Dsgs para justificar o nível de clivagem da acantólise epidérmica relacionada à produção de anti‐Dsg1 e 3 passa a ser rediscutida, já que a acantólise exclusivamente suprabasal no PV não seria explicada na forma mucocutânea, quando anti‐Dsg1 também estão presentes. Outras moléculas‐alvo de adesão da epiderme passam a ser identificadas na patogênese dos pênfigos, assim como proteínas mitocondriais, receptores colinérgicos e outras moléculas que atuam sinergicamente aos anticorpos anti‐Dsg1 e 3 na acantólise epidérmica.9–18Como ambos PV e PF são prevalentes na região Sudeste do Brasil, tem‐se a oportunidade do acompanhamento ambulatorial de vasta casuística de doentes.4,5 Na casuística de PF, num período de 25 anos, observou‐se que 6,64% dos pacientes, além de positividade para anti‐Dsg1, também apresentavam títulos reativos à Dsg3 ao ELISA, sem, contudo, apresentarem fenótipo de lesões mucosas. Assim, tivemos por objetivo analisar dados clínico‐laboratoriais no grupo de pacientes com PF e reatividade para Dsg3 (PF‐anti‐Dsg3+). Para tal, três grupos foram comparados: PF‐anti‐Dsg3+, PF com negatividade para anti‐Dsg3 e virgens de tratamento [PF‐anti‐Dsg3(−)] e PV virgens de tratamento. Por objetivos específicos, (i) dados demográficos e clínicos; (ii) evolução temporal dos títulos de anti‐Dsg1 e 3 por ELISA e reconhecimento das Dsg1 e 3 por immunoblotting (IB) no grupo PF‐anti‐Dsg3+; (iii) expressão das Dsg1 e 3 em biopsias parafinadas de pele por imuno‐histoquímica (IHQ); e (iv) tipificação dos alelos HLA‐DRB1 associados ao PF e PV nos grupos PF‐anti‐Dsg3+ e PF‐anti‐Dsg3(−) foram avaliados.
MétodosTrata‐se de estudo analítico comparativo de três grupos. O banco de amostras do Laboratório de Dermatologia do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto, da Universidade de São Paulo, conta com a aprovação do Comitê de Ética em Pesquisa (Processo HCRP n° 3605/2006). Os pacientes e indivíduos controles assinaram o termo de consentimento por ocasião da coleta das amostras.
CasuísticaO estudo foi composto por 80 pacientes: 16 PF‐anti‐Dsg3+, 42 PF‐anti‐Dsg3(−) e 22 PV. Os achados clínicos foram confirmados por exame histopatológico e por imunofluorescência direta (IFD) e/ou imunofluorescência indireta (IFI). Os dados demográficos, clínicos e laboratoriais (anti‐Dsg1 e 3 por ELISA e alelos HLA) foram compilados dos dados registrados no Laboratório de Dermatologia. No grupo PF‐anti‐Dsg3+, três (20%) dos 15 pacientes (com informação sobre o tratamento) estavam sem tratamento no momento da coleta do sangue, enquanto 42 dos pacientes PF‐anti‐Dsg3(−) e 22 PV eram virgens de tratamento. Os ensaios de IB foram realizados com 12 (75%) dos 16 soros do grupo PF‐anti‐Dsg3+; alguns pacientes tiveram mais do que uma amostra analisada, coletadas em diferentes tempos. Para a realização da IHQ, cortes de blocos de parafina de quatro pacientes do grupo PF‐anti‐Dsg3+ e de um PF‐anti‐Dsg3(−) foram utilizados.
ELISA para detecção de anticorpos IgG contra Dsg1 e 3As recomendações do fabricante foram seguidas; valores ≥ 20 U/mL, entre 9‐20 U/mL e <9 U/mL foram considerados positivos, indeterminados e negativos, respectivamente (MBL, Nagoya, Japão).
IB com extrato de epiderme humana e soro dos pacientesResumidamente, fragmentos de pele foram incubados por 48 horas em PBS com EDTA (Merck) e PMSF (Sigma‐Aldrich) para a separação da epiderme e derme. A extração proteica da epiderme foi feita com solução de Tris‐HCL, SDS, 2‐mercaptoetanol e, posteriormente, adicionados EDTA, PMSF e coquetel de inibidores de proteinase (Sigma‐Aldrich). Finalizada a corrida eletroforética, montou‐se o gel de poliacrilamida em sandwich com membrana de nitrocelulose 0,45μm (BioRad) para a transferência proteica. Após bloqueio com 3% de leite desnatado em TBS e lavagens consecutivas, as amostras de soro (1:20) foram incubadas às tiras de nitrocelulose, seguindo‐se incubação com anticorpo secundário HRP IgG anti‐humano (BioRad). Após lavagens, reagente de cor (Color‐Plus HRP, BioRad) foi adicionado para a revelação colorimétrica.
Expressão das Dsgs1 e 3 em amostras parafinadas por IHQPara os ensaios de IHQ, foram seguidas as recomendações do fabricante (HRP‐Polymer MACH1, Biocare Medical, Concord, CA, USA). Resumidamente, cortes de 5μm, após a recuperação antigênica em citrato, inibição da peroxidase endógena e uso da solução de bloqueio, foram incubados com anticorpos monoclonais anti‐Dsg1 e 3 produzidos em camundongo (Abcam, MA, USA). Após lavagens e incubações com Probe e polímero HRP, a reação foi finalizada com diaminobenzidina (DAB).
Análise estatísticaPara a análise estatística e geração de gráficos, utilizou‐se o software GraphpPad Prism 9.2.0. As frequências entre os grupos foram analisadas por testes de Fisher ou Qui‐Quadrado, e os dados numéricos, por testes de Kruskal‐Wallis seguido pela comparação múltipla de Dunn. Considerou‐se resultado significante p ≤ 0,05.
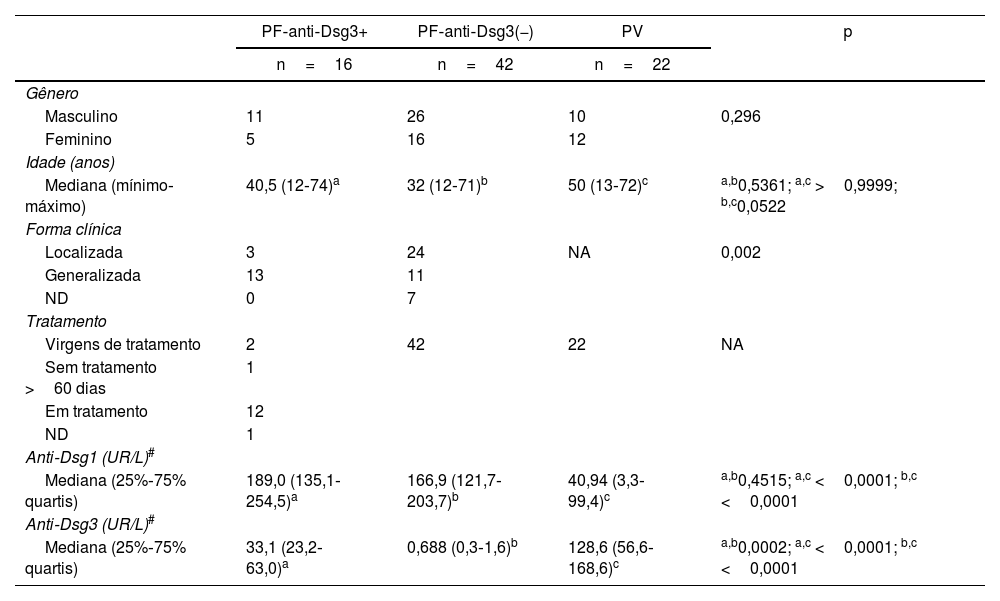
ResultadosDados demográficos e clínicosNão houve diferença estatística quanto ao gênero nos três grupos. Quanto à faixa etária, o grupo PF‐anti‐Dsg3(−) se mostrou mais jovem do que o grupo PV (p=0,0522). Não houve diferença estatística quando comparados os grupos PF‐anti‐Dsg3+ com PF‐anti‐Dsg3(−) e com PV (p=0,5361 e p>0,9999, respectivamente). A forma generalizada predominou no grupo PF‐anti‐Dsg3+, comparada ao grupo PF‐anti‐Dsg3(−); p=0,002 (Tabela 1).
Dados demográficos, clínicos e de anticorpos contra Dsg1 e 3 do grupo PF‐anti‐Dsg3+, comparados aos grupos PF‐anti‐Dsg3(−) e PV
| PF‐anti‐Dsg3+ | PF‐anti‐Dsg3(−) | PV | p | |
|---|---|---|---|---|
| n=16 | n=42 | n=22 | ||
| Gênero | ||||
| Masculino | 11 | 26 | 10 | 0,296 |
| Feminino | 5 | 16 | 12 | |
| Idade (anos) | ||||
| Mediana (mínimo‐máximo) | 40,5 (12‐74)a | 32 (12‐71)b | 50 (13‐72)c | a,b0,5361; a,c >0,9999; b,c0,0522 |
| Forma clínica | ||||
| Localizada | 3 | 24 | NA | 0,002 |
| Generalizada | 13 | 11 | ||
| ND | 0 | 7 | ||
| Tratamento | ||||
| Virgens de tratamento | 2 | 42 | 22 | NA |
| Sem tratamento >60 dias | 1 | |||
| Em tratamento | 12 | |||
| ND | 1 | |||
| Anti‐Dsg1 (UR/L)# | ||||
| Mediana (25%‐75% quartis) | 189,0 (135,1‐254,5)a | 166,9 (121,7‐203,7)b | 40,94 (3,3‐99,4)c | a,b0,4515; a,c <0,0001; b,c <0,0001 |
| Anti‐Dsg3 (UR/L)# | ||||
| Mediana (25%‐75% quartis) | 33,1 (23,2‐63,0)a | 0,688 (0,3‐1,6)b | 128,6 (56,6‐168,6)c | a,b0,0002; a,c <0,0001; b,c <0,0001 |
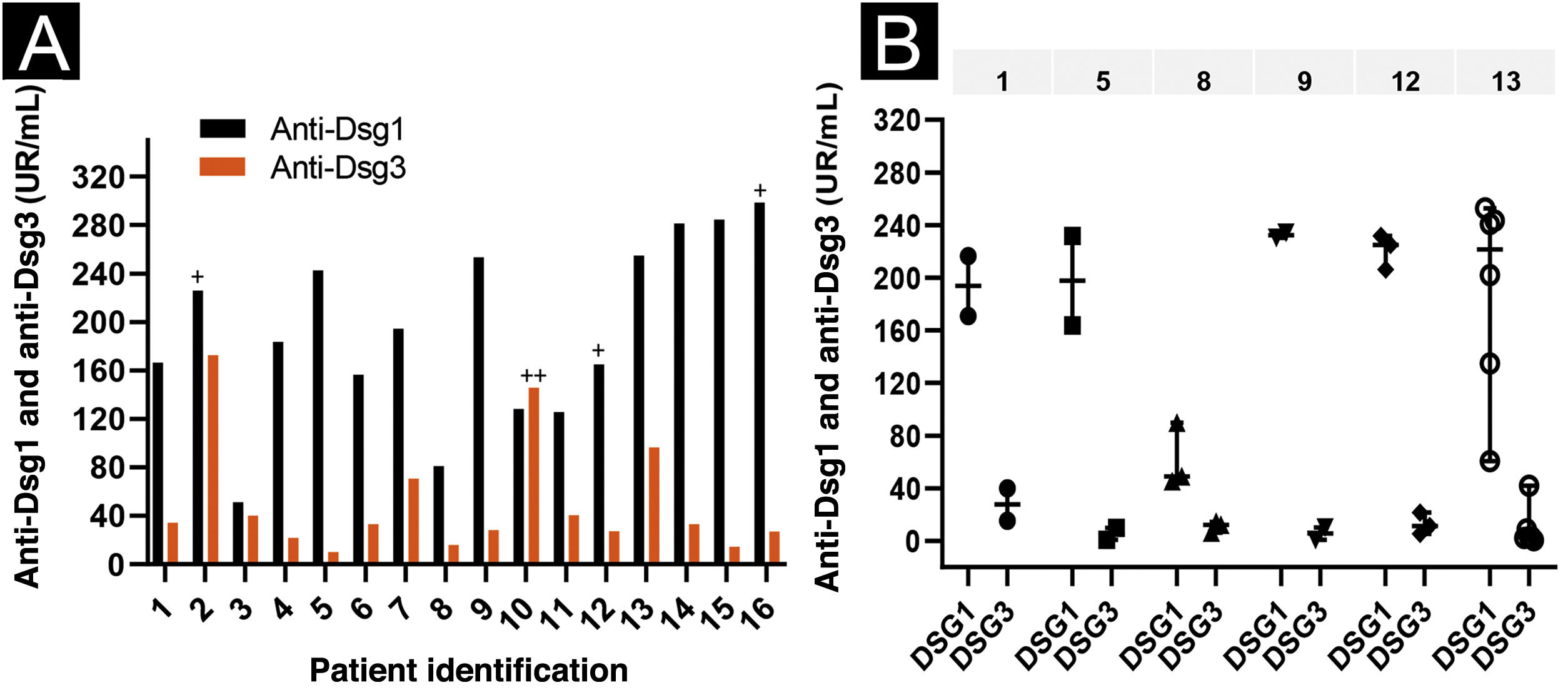
Em relação aos anticorpos anti‐Dsg3, o grupo PF‐anti‐Dsg3+ apresentou títulos menores aos do grupo PV (p<0,0001; tabela 1). A distribuição dos títulos de anti‐Dsg3 no grupo PF‐anti‐Dsg3+ pode ser vista na figura 1A. A figura 1B mostra discreta variação com o tempo dos títulos de anti‐Dsg3 em seis pacientes.
Titulação de anti‐Dsg1 e 3 por ELISA no grupo PF‐anti‐Dsg3+. Valores ≥ 20 U/mL, entre 9‐20 U/mL e <9 U/mL foram considerados positivos, indeterminados e negativos, respectivamente (MBL, Jp). (A) Titulação dos soros dos 16 pacientes no primeiro atendimento. Pacientes PF5 e PF14: soros coletados enquanto virgens de tratamento; PF6, sem tratamento há mais de 60 dias; PF3, não consta o tratamento; os demais em tratamento. Pacientes PF4, PF5 e PF7: forma clínica localizada; os demais, forma generalizada. Os símbolos + e ++ acima das barras indicam a positividade do soro no IB (fig. 2). (B) Titulação seriada de seis pacientes. A linha acima do gráfico mostra o número dos pacientes. Cada símbolo corresponde a uma amostra de soro coletada em datas consecutivas; as linhas verticais mostram a variação dos títulos (mínimo e máximo); e a linha horizontal, a mediana. Observar a discreta variação dos títulos de anti‐Dsg3.
No IB realizado com soros de 12 pacientes, três reconheceram a Dsg1 e um reconheceu a Dsg3 (fig. 2). O PF10, que reconheceu a Dsg3 no IB, apresentou o segundo maior título de anti‐Dsg3 no ELISA (fig. 1A).
Immunoblotting com amostras de soro de 12 pacientes do grupo PF‐anti‐Dsg3+ (alguns com amostras consecutivas) e extrato proteico de epiderme humana. Controles positivos correspondem a amostras de pênfigo foliáceo (PF), que reconhecem a Dsg1 (160 kDa), e de pênfigo vulgar (PV), que reconhecem as Dsg1 e 3 (130 kDa). Controles negativos correspondem a amostras de indivíduos sadios. Observar as tiras de nitrocelulose com a banda de 160 kDa (*) correspondentes aos pacientes PF2, PF12 e PF16, e a banda de 130 kDa (**) correspondente ao PF10 para os títulos ELISA de anti‐Dsg1 e 3 (fig. 1A).
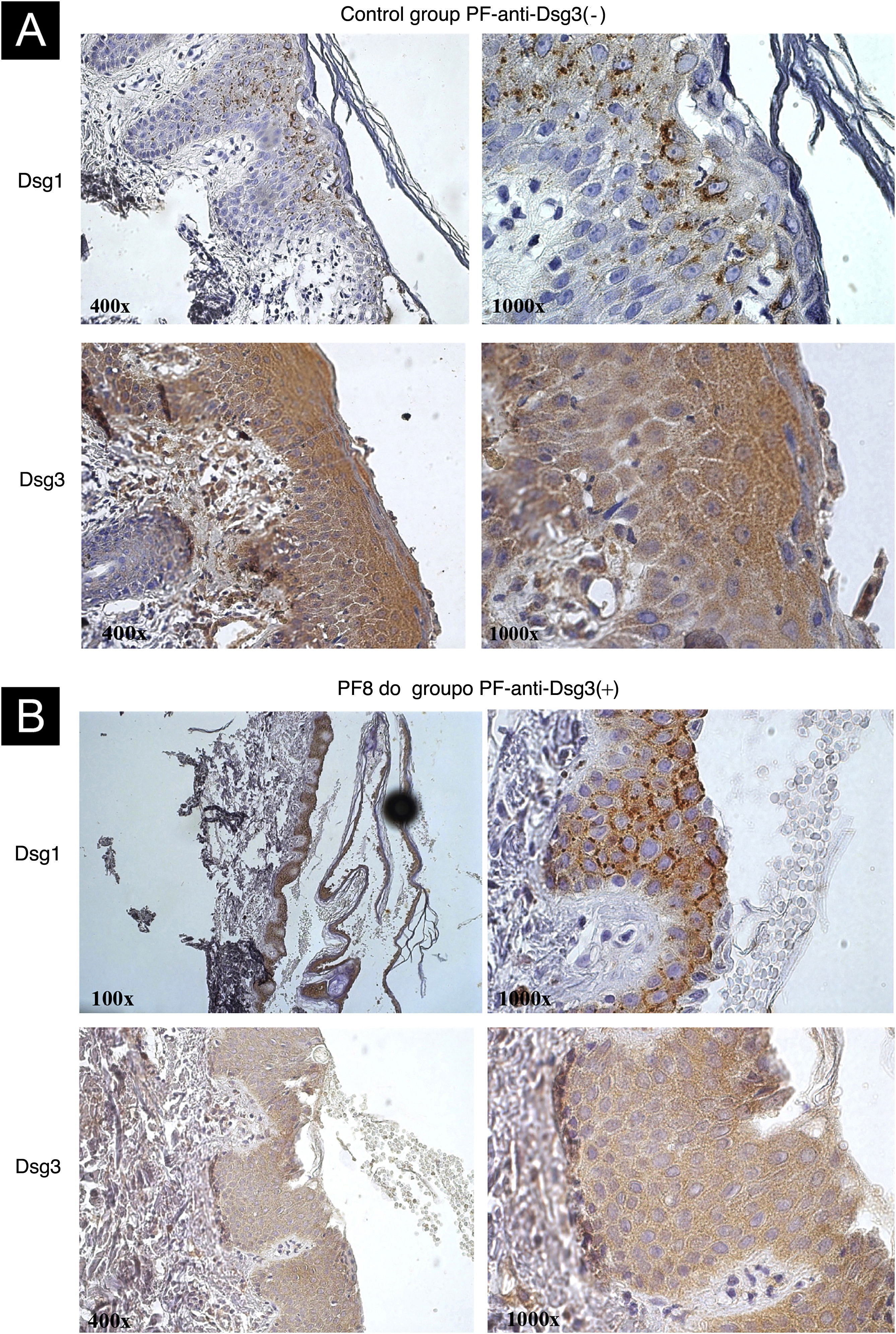
A IHQ mostrou a internalização da Dsg1, com grumos grosseiros dentro do citoplasma, às vezes, perinuclear, em amostras de pele de pacientes dos grupos PF‐anti‐Dsg3(−) (fig. 3A) e PF‐anti‐Dsg3+ (fig. 3B). A expressão da Dsg3 ocorreu no envoltório dos queratinócitos e intracitoplasmática, com destaque para sua expressão em toda a epiderme. Não se observou internalização da Dsg3.
Imagens de imuno‐histoquímica com expressão das Dsg1 e 3 coradas com diaminobenzidina em cortes parafinados de biopsias de lesão bolhosa mostrando acantólise superficial. (A) Amostra controle do grupo PF‐anti‐Dsg3(−). Observar expressão da Dsg1 em grumos intracitoplasmáticos e a expressão da Dsg3 em toda a epiderme. (B) Amostra do paciente PF8 do grupo anti‐Dsg3+. As expressões das Dsg1 e 3 são semelhantes às do controle.
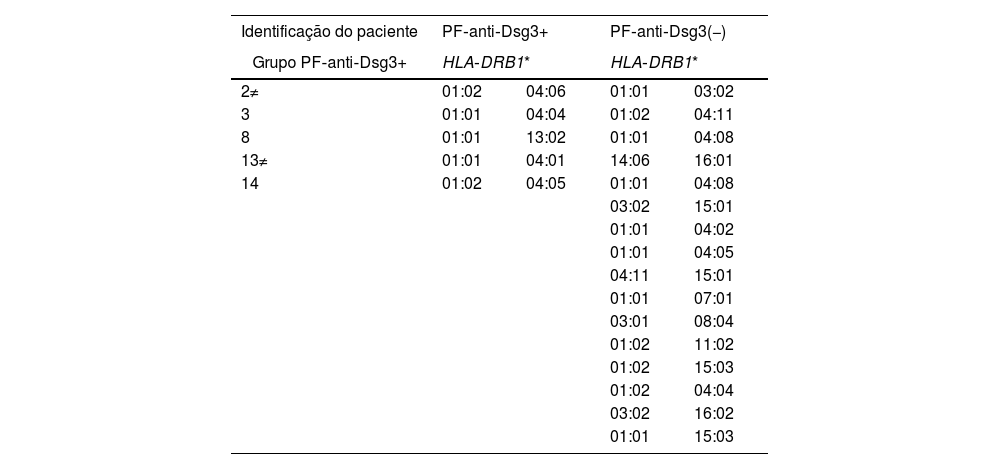
Foram tipificados cinco (31,3%) de 16 pacientes do grupo PF‐anti‐Dsg3+ e 16 (38,1%) de 42 do grupo PF‐anti‐Dsg3(−). No grupo PF‐anti‐Dsg3+, cinco pacientes apresentaram um ou dois alelos de suscetibilidade para PF e nenhum deles apresentou alelos associados ao PV. No grupo PF‐anti‐Dsg3(−), 11 apresentaram alelos de suscetibilidade ao PF e dois pacientes apresentaram alelos, em heterozigose, de suscetibilidade ao PV Tabela 2.
Distribuição dos alelos HLA‐DRB1 associados ao pênfigo foliáceo (PF) e ao pênfigo vulgar (PV) nos grupos PF‐anti‐Dsg3+ e PF‐antiDsg3(−)
| Identificação do paciente | PF‐anti‐Dsg3+ | PF‐anti‐Dsg3(−) | ||
|---|---|---|---|---|
| Grupo PF‐anti‐Dsg3+ | HLA‐DRB1* | HLA‐DRB1* | ||
| 2≠ | 01:02 | 04:06 | 01:01 | 03:02 |
| 3 | 01:01 | 04:04 | 01:02 | 04:11 |
| 8 | 01:01 | 13:02 | 01:01 | 04:08 |
| 13≠ | 01:01 | 04:01 | 14:06 | 16:01 |
| 14 | 01:02 | 04:05 | 01:01 | 04:08 |
| 03:02 | 15:01 | |||
| 01:01 | 04:02 | |||
| 01:01 | 04:05 | |||
| 04:11 | 15:01 | |||
| 01:01 | 07:01 | |||
| 03:01 | 08:04 | |||
| 01:02 | 11:02 | |||
| 01:02 | 15:03 | |||
| 01:02 | 04:04 | |||
| 03:02 | 16:02 | |||
| 01:01 | 15:03 | |||
a Pacientes com títulos mais elevados de anti‐Dsg3 (fig. 1A). Em laranja e em amarelo: alelos de suscetibilidade ao PF na região nordeste do estado de São Paulo e em outras regiões do Brasil, respectivamente. Em verde escuro: alelo de resistência ao PF descrito em outras regiões do Brasil. Em vermelho e em verde claro: alelos de suscetibilidade e de resistência ao PV, respectivamente, na região nordeste do estado de São Paulo. Os alelos de associação ao PF e PV foram coletados de Franco Brochado et al., 201636 e Franco Brochado et al., 2016.37
A produção de autoanticorpos séricos contra Dsg3 não é esperada no PF, já que, em sua patogênese, apenas anticorpos anti‐Dsg1 estão implicados na acantólise subgranulosa, com consequente formação de bolhas flácidas na pele. O fenótipo do PF não inclui lesões mucosas, observadas no PV em virtude dos anticorpos contra Dsg3.1–5 Porém, autoanticorpos contra Dsg3 têm sido raramente reportados em casuísticas de PF.19–21 Mais recentemente, anticorpos anti‐Dsg3 foram relatados em outras formas de pênfigo.22,23 Arteaga et al. descreveram anti‐Dsg3 em 7% de 276 pacientes com PF, demonstrando que anticorpos anti‐Dsg3 não apresentavam reação sorológica cruzada com a Dsg1.19 Flores et al. relataram anti‐Dsg3 em 40% de 101 soros de FS, e em 14% dos controles de região endêmica para FS no Brasil.20 Já Oliveira et al. relataram anti‐Dsg3 em 4% da casuística de PF (incluídos pacientes da região nordeste do estado e São Paulo).21 A nossa casuística confirmou 6,64% dos pacientes com PF apresentando resultados indeterminados ou positivos para anti‐Dsg3 ao ELISA.
Comparando‐se os três grupos, a faixa etária do grupo PF‐anti‐Dsg3+ tendeu a ser mais elevada, comparável à do grupo PV (p>0,999), e semelhante à do grupo PF‐anti‐Dsg3(−). A forma clínica generalizada predominou no grupo PF‐anti‐Dsg3+ (p=0,0020). Em relação aos títulos de anti‐Dsg3 do grupo PF‐anti‐Dsg3+, foram menores quando comparados aos do grupo PV (p<0,0001). A dosagem de anti‐Dsg3 no grupo PV foi realizada em pacientes virgens de tratamento, enquanto, no grupo PF‐anti‐Dsg3+, três (20%) dos 15 pacientes (com informação sobre tratamento) estavam sem tratamento (PF5, PF6 e PF14). Os títulos de anti‐Dsg3 no grupo PF‐anti‐Dsg3+ não mostrou diferença entre pacientes tratados e não tratados (fig. 1A). Destacam‐se dois pacientes, dentre a casuística de 16, com títulos mais elevados de anti‐Dsg3, cuja coleta do sangue foi feita enquanto em tratamento. O paciente PF2, sexo masculino, de 63 anos, apresentava a forma generalizada, com 14 anos de evolução, e ceratoacantoma e melanoma no seguimento. Outro paciente (PF10), sexo masculino, de 46 anos, apresentava forma generalizada, com dois anos de história. Os fatores coincidentes nos dois casos, além dos títulos mais elevados de anti‐Dsg3, foram sexo masculino, terem apresentado PF com idade mais elevada e forma generalizada da doença. O IB confirmou a produção de anti‐Dsg3 somente no PF10 (fig. 2).
A internalização das Dsgs no processo da acantólise é observada à IHQ pela formação de grânulos intracitoplasmáticos e perinucleares nos queratinócitos, quando se emprega anticorpos anti‐Dsg1 e 3 no PF e PV, respectivamente.24 Nas amostras do grupo PF‐anti‐Dsg3(−) e PF‐anti‐Dsg3+, observou‐se a internalização da Dsg1; porém, não houve internalização da Dsg3. Os títulos baixos de anti‐Dsg3 no grupo PF‐anti‐Dsg3+ poderiam justificar a ausência de internalização da Dsg3, assim como a ausência de lesões mucosas. No PV exclusivamente cutâneo, títulos baixos de anti‐Dsg3 poderiam explicar a ausência de lesões mucosas.25
Embora alelos HLA‐DRB1 não tenham sido tipificados no grupo total de PF‐anti‐Dsg3+, nos cinco tipificados houve determinação de alelos exclusivos de suscetibilidade ao PF, em homozigose ou heterozigose, não havendo presença de alelos associados ao PV. Recentemente, Sielski et al. demonstraram que casos de PV que contrariavam a hipótese da compensação de Dsgs estiveram relacionados à ausência de alelos DRB1 de suscetibilidade ao PV.26 Assim, a ausência de alelos de suscetibilidade ao PV no grupo PF‐anti‐Dsg3+ poderia auxiliar para a não patogenicidade dos anticorpos contra a Dsg3.
A produção de anti‐Dsg3 no PF poderia ser justificada pelo fenômeno de epitope spreading – pacientes com determinada doença bolhosa apresentam autoanticorpos não patogênicos contra outras moléculas da epiderme não causadoras da doença bolhosa específica. Sua patogênese é explicada pela exposição de outras moléculas da epiderme durante o processo de inflamação causada pela acantólise, no caso dos pênfigos.27–30 Neste estudo, a IHQ mostrou a expressão da Dsg3 em todas as camadas da epiderme. Assim, poderia justificar a maior exposição da Dsg3, com consequente produção de anti‐Dsg3. No entanto, essa expressão em todas as camadas da epiderme foi observada em amostras de ambos os grupos – PF‐anti‐Dsg3(−) e PF‐anti‐Dsg3+. Como o grupo PF‐anti‐Dsg3(−) foi constituído de pacientes virgens de tratamento, desconhecemos se haveria produção de anti‐Dsg3 na evolução do pênfigo.
Além disso, há raros relatos de pacientes com PF, clínica e laboratorialmente comprovados, que migram para o fenótipo PV, ou de pacientes com ambas as caraterísticas de PF e de PV.31–34 Já PV migrando para PF é mais comumente observado.35 Em nossa casuística, não temos casos semelhantes.
ConclusõesA presença de anticorpos anti‐Dsg3 no PF esteve relacionada à faixa etária mais elevada (comparável à do PV) e à forma generalizada do PF. A não patogenicidade dos anticorpos anti‐Dsg3 no PF pode ser atribuída aos títulos baixos de anti‐Dsg3, à ausência de internalização da Dsg3 à IHQ e à ausência de alelos HLA‐DRB1 associados ao PV.
Suporte financeiroO projeto foi financiado pela Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), #2010/51729‐2. SV recebeu bolsa PhD da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES). TAJ recebeu bolsa PhD da FAPESP.
Contribuição dos autoresSebastian Vernal: Contribuiu com o levantamento, obtenção e interpretação dos dados; responsável pelos ensaios de blotting.
Tamiris Amanda Julio: Contribuiu com o levantamento, obtenção e interpretação dos dados; responsável pelos ensaios de ELISA.
Fernando Henrique Alves: Contribuiu com o levantamento e obtenção dos dados, e participação em conduta propedêutica e terapêutica, e nos ensaios de IB.
Aline Turatti: Contribuiu com o levantamento, obtenção e interpretação dos dados; responsável pelos ensaios de IFD, IFI e IHQ.
Eduardo Antonio Donadi: Contribuiu com o levantamento, obtenção e interpretação dos dados; responsável pela determinação dos alelos HLA‐DR.
Ana Maria Roselino: Contribuiu com a concepção e o desenho do estudo, levantamento e análise dos dados; redação do artigo; participação em conduta propedêutica e terapêutica; e revisão crítica da literatura.
Todos os autores aprovaram a versão final do manuscrito.
Conflito de interessesNenhum.
Agradecemos ao staff médico pelo atendimento e acompanhamento dos pacientes com pênfigos.
Como citar este artigo: Vernal S, Julio TA, Alves FH, Turatti A, Donadi EA, Roselino AM. Factors associated with non‐pathogenic antibodies against desmoglein‐3 in pemphigus foliaceus. An Bras Dermatol. 2024;99:680–7.
Trabalho realizado no Laboratório do Setor de Dermatologia, Hospital das Clínicas, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, São Paulo, SP, Brasil.