Melasma é uma discromia crônica adquirida frequente que acomete áreas fotoexpostas, especialmente em mulheres em idade fértil. A radiação ultravioleta (RUV) é o principal estímulo ambiental na indução da pigmentação do melasma; entretanto, o papel da luz visível (LV: 400‐700nm) em sua patogênese ainda é incerto. A LV compreende cerca de 44% da irradiação solar e promove pigmentação mais duradoura (superior a duas semanas) que a UVA – no entanto, apenas em fototipos mais elevados (IV a VI).1
Opsina‐3, encefalopsina ou panopsina (OPN3) é um fotorreceptor acoplado à proteína G, que promove melanogênese induzida pela luz azul (420‐490nm). Na retina, foram descritas OPN 1 a 5, porém a OPN3 é a forma mais expressa na pele, que induz a fosforilação do fator de transcrição associado à microftalmia (MITF) nos melanócitos, resultando na ativação da tirosinase.2 Até o momento, não foi investigada a expressão diferencial de OPN3 na pele com melasma em comparação com a pele adjacente.
Neste estudo, após aprovação no Comitê de Ética, 20 mulheres com melasma facial (diagnosticado clinicamente por dermatologista experiente), sem tratamento há mais de 30 dias (exceto filtro solar) foram submetidas a duas biópsias (3mm): pele com melasma e pele adjacente não afetada (< 2cm de distância).
Os 40 espécimes foram submetidos à imunofluorescência de tripla marcação pelos anticorpos primários e diluições padronizadas: anti‐OPN3 rabbit (ab228748‐Abcam, Cambridge‐MA, EUA) 1:150; anti‐vimentina mouse (ab8978‐Abcam, Cambridge‐MA, EUA) 1:100, que se expressa em melanócitos e nos filamentos intermediários dos fibroblastos; e pelo DAPI (4′,6‐diamidino‐2‐phenylindole), para marcação dos núcleos celulares. Para os anticorpos secundários (cromóforos) e as diluições para o OPN3: AlexaFluor 594, 1:500 (vermelho); e, para a vimentina: AlexaFluor 488, 1:500 (verde). Todas as reações foram testadas para seus controles positivos e negativos.
Três áreas de maior imunomarcação das lâminas de cada topografia (melasma e pele não afetada) foram fotografadas por microscopia confocal a laser LEICA TCS‐SP8. Utilizando o canal do laser vermelho (cromóforo do OPN3), orientado pela colocalização de pontos verdes citoplasmáticos, e fora da colocalização azul nuclear, as intensidades médias dos histogramas de imagem (variação de 0 a 255) foram estimadas pelo software ImageJ, para os diferentes tipos celulares, de forma cega em relação à topografia. A intensidade média de fluorescência em cada grupo celular foi comparada entre as topografias pelo teste‐t de Student (dados dependentes). Foram também estimadas as contagens celulares entre as topografias. Considerou‐se significativo p<0,05, bicaudal.
Receptores de OPN3 foram identificados em todas as células estudadas: queratinócitos, melanócitos da camada basal, melanócitos em pêndulo e fibroblastos da derme superior (fig. 1). Não houve expressão diferencial em nenhum grupo celular ao se comparar a pele com melasma em relação à pele adjacente sã (tabela 1).
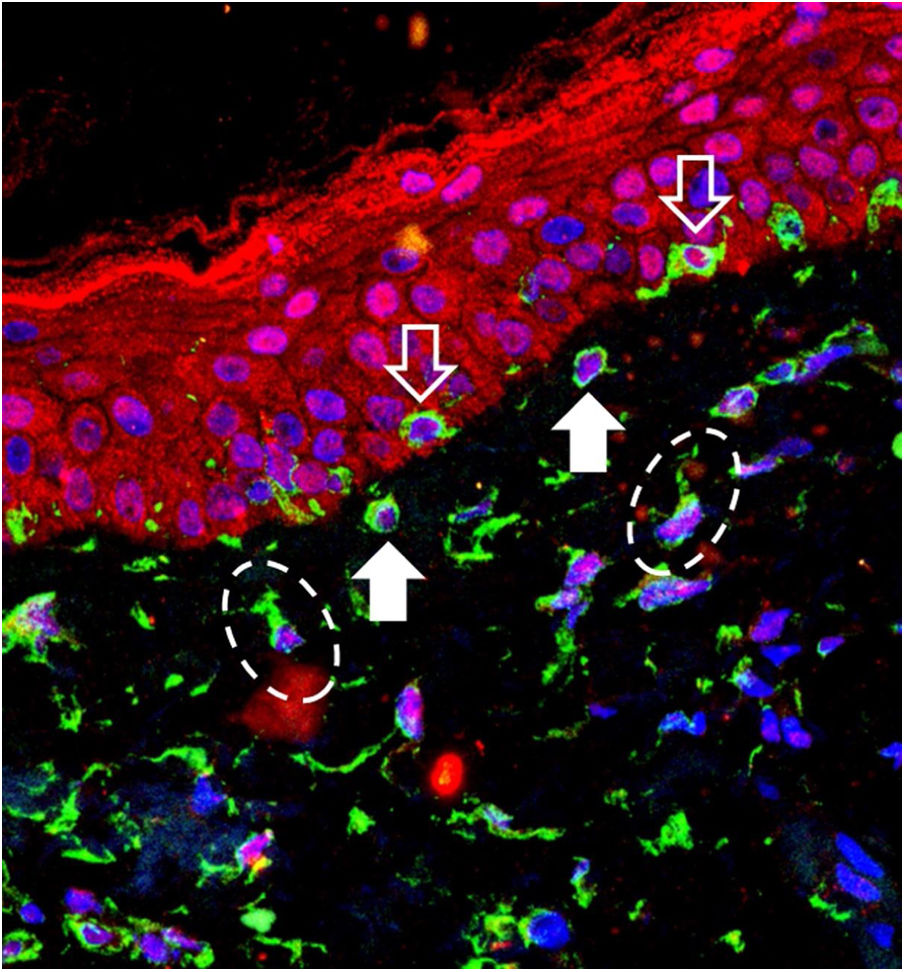
Imagem de sobreposição da imunofluorescência de tripla marcação na pele com melasma. Marcação em verde (vimentina), vermelho (Opsina‐3), azul (núcleos celulares). Seta com contorno branco: melanócitos na camada basal. Seta branca cheia: melanócitos em pêndulo. Elipses tracejadas: fibroblastos da derme superior.
Avaliação da expressão média (desvio‐padrão) de OPN3 nas 20 participantes, de acordo com a topografia e os tipos celulares avaliados
| Melasma | Pele não afetada | pa | |
|---|---|---|---|
| Epiderme suprabasal | 30,4 (10,3) | 33,9 (9,3) | 0,170 |
| Melanócitos da camada basal | 23,3 (9,6) | 26,0 (7,9) | 0,364 |
| Melanócitos em pêndulo | 23,7 (11,8) | 22,3 (8,8) | 0,652 |
| Fibroblastos da derme superior | 16,6 (10,2) | 17,3 (6,7) | 0,763 |
Não houve diferença da contagem de melanócitos e fibroblastos na derme superior por campo de grande aumento (400×) entre as duas topografias. Entretanto, a pele com melasma apresentou maior densidade de melanócitos em pêndulo (tabela 2).
Contagem média (desvio‐padrão) de células (melanócitos, melanócitos em pêndulo e fibroblastos) por campo de grande aumento (400×)
| Melasma | Pele não afetada | pa | |
|---|---|---|---|
| Melanócitos da camada basal | 3,2 (1,3) | 3,6 (1,5) | 0,451 |
| Melanócitos em pêndulo | 2,3 (0,9) | 1,8 (0,7) | 0,031 |
| Fibroblastos da derme superior | 4,5 (2,0) | 4,4 (1,4) | 0,915 |
Os resultados deste estudo sugerem que a expressão de OPN3 não justifica a diferença de pigmentação cutânea no melasma em relação à pele adjacente não afetada. Caso a LV apresente um papel importante em sua patogênese, ela não o exerce em função da expressão de OPN3. De fato, pacientes com melasma facial não apresentaram piora das lesões após exposição à tela de computador (8h/dia, cinco dias consecutivos), a uma distância de 20cm.3 Além disso, a expressão das OPN 1 a 5 na pele sabidamente não apresenta diferença de acordo com os fototipos.2
Há um efeito sinérgico entre LV e RUV do tipo A1 (UVA1: 340‐400nm). Quando indivíduos de fototipo IV a V são irradiados com LV isolada, a pigmentação ocorre de maneira não linear com a dose irradiada. Já quando UVA1 é associada à LV, há pigmentação mais intensa e a resposta é diretamente proporcional à dose utilizada.4 O sinergismo de LV com UVA1 na pigmentação diferencial do melasma precisa ser explorado com desenhos experimentais específicos.
A ocorrência de OPN3 em tecidos humanos fora da retina é chamada expressão “não visual”, cujas funções não são totalmente esclarecidas. Na pele, além da modulação da melanogênese, promove diferenciação de queratinócitos e ativação de metaloproteinases (MMP‐1, ‐2, ‐3 e ‐9) pelos fibroblastos.2 A OPN3 também pode ser induzida na pele após irradiação por luz azul em modelos de reparo cicatricial, sugerindo que exerça papel na cicatrização cutânea.5
Melanócitos em pêndulo são melanócitos da camada basal que se projetam em direção à derme superior e são característicos da pele com melasma, apesar de serem encontradas em menor proporção na pele fotoagredida adjacente.6 Seu significado fisiopatológico não é claro, mas sua ocorrência parece estar relacionada ao aumento de MMP‐2 e fragmentação da membrana basal. O maior número na pele com melasma reforça o papel da RUV na fisiopatologia da doença, já que UVA promove um microambiente inflamatório na derme superior, com aumento da atividade das MMP (especialmente MMP‐2 e ‐9) e degradação da membrana basal, o que facilita a protusão dos melanócitos em direção à derme.7,8
Este estudo apresenta limitações ligadas à técnica de investigação semiquantitativa in situ, que não identifica diferentes isoformas (splicing) dos fotorreceptores ou detecta alterações funcionais de sua via. Existem outras células fusiformes na derme superior além dos fibroblastos (p. ex., células dendríticas indiferenciadas mesenquimais CD4+) que, apesar de menos numerosas, não são distinguíveis à morfologia nem à marcação pela vimentina. Ainda, as demais OPN (OPN‐1, ‐2, ‐4 e ‐5) não foram exploradas, apesar de menos expressas na pele normal.
Em conclusão, não há expressão diferencial de OPN3 nos queratinócitos, melanócitos ou fibroblastos no melasma facial em comparação com a pele adjacente não afetada.
Suporte financeiroFUNADERSP – Fundo de Apoio à Dermatologia de São Paulo – Sebastião Sampaio.
Contribuição dos autoresAna Cláudia Cavalcante Espósito: Participação na concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; redação do manuscrito; aprovação da versão final.
Nathália Pereira de Souza: Obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; aprovação da versão final.
Luciane Donida Bartoli Miot: Concepção e planejamento do estudo; interpretação dos dados; revisão crítica do manuscrito; aprovação da versão final.
Hélio Amante Miot: Participação na concepção e planejamento do estudo; análise e interpretação dos dados; redação do manuscrito; aprovação da versão final.
Conflito de interessesNenhum.
Como citar este artigo: Espósito ACC, Souza NP, Miot LDB, Miot HA. Expression of OPN3 in fibroblasts, melanocytes, and keratinocytes of skin with facial melasma in comparison with unaffected adjacent skin. An Bras Dermatol. 2021;96:367–9.
Trabalho realizado no Departamentos de Dermatologia e de Patologia, Faculdade de Medicina, Universidade Estadual Paulista, Botucatu, SP, Brasil.