A expansão da epidemia zoonótica de esporotricose causada por Sporothrixbrasiliensis, iniciada no final da década de 1990, no Rio de Janeiro, e presente hoje em quase todos os estados brasileiros, vem avançando igualmente nos países vizinhos ao Brasil. Mudanças no perfil clínico‐epidemiológico, avanços no diagnóstico laboratorial da doença e dificuldades terapêuticas vêm sendo observados ao longo desses quase 25 anos de epidemia, embora inexista uma unidade nacional. O último guideline internacional é de 2007.
ObjetivosAtualizar a classificação clínica, os métodos diagnósticos e as recomendações para o manejo terapêutico nos pacientes acometidos por esporotricose.
MétodosForam selecionados 12 experts em esporotricose humana, de diferentes regiões brasileiras, divididos em três grupos de trabalho: clínica, diagnóstico e tratamento. A pesquisa bibliográfica foi realizada na plataforma EBSCOHost. As reuniões ocorreram via correio eletrônico e à distância/presencial e híbrida, resultando em um questionário que apontou 13 divergências que foram solucionadas com base na opinião da maioria.
ResultadosA classificação clínica e o diagnóstico laboratorial foram atualizados. Foram feitas recomendações terapêuticas para as diferentes formas clínicas.
ConclusãoPublicação da primeira recomendação nacional, realizada pela Sociedade Brasileira de Dermatologia, voltada para a comunidade científica brasileira, em especial médicos dermatologistas, infectologistas, pediatras, de medicina da família e profissionais de laboratório que atuam no manejo da esporotricose humana.
Causada por espécies do gênero Sporothrix, a esporotricose é a micose subcutânea mais frequente na América Latina e Ásia, embora o primeiro caso tenha sido descrito por Schenck, em Baltimore, Estados Unidos.1 No Brasil, Lutz e Splendore foram os primeiros a reportar infecções em ratos e humanos, tendo descrito os corpúsculos asteroides na esporotricose humana. Em decorrência da epidemia de transmissão zoonótica iniciada no Rio de Janeiro, a doença se apresentou com manifestações clínicas não usuais, causando dificuldades terapêuticas não observadas anteriormente. O diagnóstico micológico também evoluiu, especialmente a sorologia e a contribuição sobre epidemiologia molecular e filogenia de Sporothrix spp. Entretanto, a última recomendação terapêutica de esporotricose foi publicada há 15 anos, referência usada como base para este estudo.2
ObjetivosAtualizar a classificação das formas clínicas e o diagnóstico laboratorial da esporotricose e recomendar a escolha terapêutica mais adequada à nova realidade dessa micose neglicenciada.
MétodosEste trabalho foi conduzido pelo Departamento de Micologia da Sociedade Brasileira de Dermatologia (SBD), gestão 2021‐2022.
Escolha dos componentesEntendeu‐se como expert aquele com experiência clínico‐laboratorial no atendimento à população acometida pela esporotricose nas diversas regiões brasileiras – a maioria da região sudeste, local de início da epidemia, há 25 anos. Desse modo, 12 profissionais foram convidados a participar do estudo e divididos em três grupos: clínica, diagnóstico laboratorial e tratamento. Cada grupo foi liderado pelo participante mais representativo de cada categoria.
Pesquisa bibliográficaUtilizou‐se a plataforma EBSCOHost com as estretégias: Sporotrichosis OR Sporothrix AND Diagnosis, Sporotrichosis OR Sporothrix AND Pathogeny, Sporotrichosis OR Sporothrix AND Treatment. A pesquisa incluiu os idiomas inglês, português, espanhol e francês, sem limite de data, e resultou em aproximadamente 2.800 artigos. Foram encontrados poucos ensaios clínicos, a maioria abertos, e nenhum estudo randomizado e controlado em esporotricose humana, tornando difícil a seleção de artigos baseada em evidências científicas robustas. Foram selecionados, preferencialmente, artigos de revisão e os que apresentavam novo conhecimento epidemiológico, clínico‐laboratorial ou terapêutico. Para as recomendações terapêuticas, escolhemos aqueles com maior casuística.
Divisão dos temas, discussões e consenso finalOs temas foram discutidos, escritos e revistos sob a superevisão dos líderes. Os textos unificados dos três grupos foram sintetizados pelo coordenador geral em um rascunho, posteriormente analisado por todos. Todos participaram das discussões, sugerindo, discordando, suprimindo e, finalmente, aprovando por e‐mail, contato telefônico ou reuniões virtuais, em decorrência da pandemia de COVID‐19. Dessas discussões resultaram 13 discordâncias, listadas em um questionário, das quais três eram relativas ao tratamento pediátrico, cinco aos cuidados locais e tratamento tópico, duas de clínica, duas sobre as formas imunorreativas e uma sobre grafia. As respostas foram enviadas e devolvidas por escrito, individualmente, prevalecendo a maioria. Ao final, decidiu‐se por enumerar as recomendações sobre a condução terapêutica de situações especiais enfrentadas na atividade clínica diária.
Após a resolução do questionário de discordâncias, houve uma reunião final, híbrida, à distância e na sede da SBD, para a aprovação final do texto, quadros e figuras. Qualquer dúvida ou divergência foi resolvida após discussão.
Resultados/discussãoEpidemiologiaA esporotricose afeta ambos os sexos e pode ocorrer em qualquer idade. A exposição ao fungo, de maneira ocupacional ou recreacional, é o principal fator para o desenvolvimento da doença.3 Atualmente, as principais áreas de endemicidade da esporotricose incluem a América Latina, sobretudo Brasil, México, Colômbia, Guatemala e Peru; a Ásia, especialmente China, Índia e Japão; e em menor número, EUA e Austrália.4 Como a notificação nem sempre é obrigatória, a avaliação epidemiológica mundial fica prejudicada. A incidência, notificada em 2019 no estado do Rio de Janeiro foi estimada em dez casos de esporotricose por 100.000 habitantes.5
A importância do gato doméstico na transmissão zoonótica da esporotricose foi relatada inicialmente nos EUA em 1982 e, posteriormente, em São Paulo, Rio de Janeiro e Rio Grande do Sul (Brasil).6–9 Nos últimos anos, estados do Nordeste brasileiro, especialmente Pernambuco, Alagoas e Rio Grande do Norte, têm observado epizootias na população felina, com consequente transmissão zoonótica.10 Até 2020, todos os estados do Brasil, exceto Roraima, tinham casos publicados de esporotricose humana.11
Sporothrix brasiliensis é o principal agente da transmissão zoonótica no Brasil e na Argentina, embora a transmissão zoonótica de S. schenckii tenha sido descrita no Brasil, EUA, México, Panamá, Argentina, Índia e Malásia.12–15
Em geral, a doença é benigna, por isso são escassos os dados de mortalidade associada à esporotricose. No Brasil, 65 óbitos foram relacionados à esporotricose no período de 1992‐2015.16
Epidemiologia molecularIsolados de casos de esporotricose humana e felina no Brasil apresentaram os mesmos genótipos, indicando que os gatos são a principal fonte de infecções por S. brasiliensis.17 Análises filogenéticas evidenciam que S. brasiliensis é espécie monofilética, com baixa diversidade haplotípica, baixa recombinação gênica e pequeno número de mutações, sugerindo modo reprodutivo clonal.18,19Sporothrix schenckii e S. brasiliensis devem ter divergido 2,2 a 3,1 milhões de anos atrás, indicando que as mesmas já existiam em habitat até hoje desconhecido, mesmo antes da emergência da esporotricose zoonótica nesses estados.20
Existe grande diversidade de genótipos de S. brasiliensis circulando no território brasileiro. Entretanto, as tendências epidemiológicas revelam que a recente expansão geográfica da esporotricose transmitida por gatos ocorre via efeito fundador, dada a baixa diversificação de isolados de S. brasiliensis ocorrendo em epizootias e zoonoses. Tal padrão é suportado por eventos fundadores contínuos (e.g., contínua migração de gatos doentes para novas áreas), levando a surtos predominantemente clonais em uma população hospedeira naïve. Além disso, estudos de epidemiologia molecular indicam o Rio de Janeiro como o possível centro de origem que levou à disseminação da doença para outras regiões do Brasil, dada a presença regular de genótipos cariocas de S. brasiliensis em estados adjacentes como São Paulo, Minas Gerais e Espírito Santo, ou mesmo em áreas mais afastadas do epicentro, como Pernambuco.21
EtiopatogeniaSporothrix spp. são encontradas na vegetação viva ou em decomposição, nos excrementos animais e no solo. Surtos da doença estão associados à fonte de transmissão comum, como no clássico exemplo das minas de ouro da África do Sul, onde o fungo foi encontrado nas vigas de madeira que as sustentavam.4
Estudos filogenéticos evidenciaram diferenças morfológicas, fisiológicas, genéticas, epidemiológicas e terapêuticas entre as espécies de Sporothrix.22 Atualmente, 53 espécies são reconhecidas por meio de análises filogenéticas, incluindo as espécies do clado clínico como S. brasiliensis, S. schenckii, S. globosa e S. luriei.11
Na maioria dos casos, a doença é causada por uma única espécie molecular dominante: S. brasiliensis no sudeste da América do Sul (88%); S. schenckii no oeste da América do Sul, Américas Central e do Norte (89%), na Austrália e África do Sul (94%); S. globosa na Ásia (99,3%).23 No Brasil, S. brasiliensis, S. schenckii e S. globosa ocorrem em simpatria. A primeira espécie é a mais virulenta em modelos murinos e tem sido associada a quadros clínicos atípicos e formas graves da doença, incluindo doença sistêmica com manifestação cutânea em hospedeiros imunocompetentes.22,24,25
Todas as espécies patogênicas de Sporothrix são termodimórficas, apresentando‐se como fungo filamentoso saprobioticamente no solo, plantas e excretas de animais ou in vitro a 25°C, e como estruturas leveduriformes em parasitismo no tecido do hospedeiro ou in vitro a 35°‐37°C.9
Sporothrix spp. são transmitidas, principalmente, pela inoculação traumática na pele ou mucosa, de material contaminado com fragmentos de hifas ou conídios. Raramente, pode ocorrer inalação de propágulos fúngicos e disseminação hematogênica, com ou sem manifestação cutânea, semelhante ao que ocorre em outras infecções sistêmicas causadas por fungos dimórficos.9 Classicamente, associa‐se a transmissão ambiental da esporotricose com atividades de manipulação do solo, seja ocupacional ou de lazer. Na transmissão zoonótica, o fungo implanta‐se na pele a partir do contato com animais, doentes ou não, que abrigam o fungo. O principal animal envolvido é o gato doméstico, porém outros animais estão associados, como papagaios e outras aves, esquilos e outros roedores, peixes, cães e insetos.9,26 Nos gatos doentes, as lesões cutâneas apresentam grande número de estruturas fúngicas parasitárias – portanto, com alto potencial zoonótico de transmissão.27 Foram descritos acidentes de laboratório com colônias de fungos termodimórficos na forma leveduriforme; além do achado de células leveduriformes na cavidade oral de gatos. Provavelmente, a infecção ocorre pela carga de inóculo associada à solução de continuidade na pele, como na infeção experimental animal.28,29 A tolerância térmica de S. brasiliensis parece constituir importante mecanismo de adaptação nesses animais, cuja temperatura corporal média é de 39°C. Esse fato poderia explicar, parcialmente, por que esse animal é infectado mais comumente por essa espécie. O reconhecimento de outras formas de contágio é importante; recentemente, foram descritos dois casos de esporotricose cutânea fixa (CF) e linfocutânea (LC) sobre tatuagem; suspeita‐se que a fonte de infecção possa ter sido material utilizado no procedimento, como instrumentos, tinta ou água.30
A apresentação e o curso clínico da micose dependem da quantidade e profundidade do inóculo, da virulência do patógeno, bem como da resposta imune do hospedeiro.3 Após a implantação de Sporothrix spp. no hospedeiro, ocorrem alterações importantes na estrutura do fungo, incluindo mudanças de temperatura, pH e pressão osmótica, necessárias para a adaptação ao novo meio e, consequentemente, transformação da fase miceliana para leveduriforme. Algumas vias de sinalização, como proteína‐G heterotrimétrica, Ras e cAMP, bem como a cascata da proteína quinase ativada por mitógeno (MAPK), parecem ser importantes na indução da transformação dimórfica.31
A interação da parede celular de Sporothrix spp. com o sistema imune do hospedeiro desencadeia resposta imune mista Th1/Th17 com produção de citocinas como IFN‐α, TNF‐α e IL‐17A, que ativam macrófagos e neutrófilos. Os macrófagos podem ser ativados pela produção de IFN‐β durante a resposta Th1, citocina mais importante na infecção por Sporothrix spp. Já a IL‐17A, produzida pelas células Th17, é importante no reparo e ativação das barreiras epidérmicas, e crucial para controle das células natural killer. Outro mecanismo de evasão de Sporothrix spp. à fagocitose é o ergosterol, esteroide presente na membrana fúngica, que confere proteção e evita a destruição do fungo pelas espécies reativas ao oxigênio.32–34
As células leveduriformes de S. schenckii são capazes de ativar o sistema complemento, tanto pela via clássica como alternativa – esta dependente da presença de anticorpos. Apesar de a participação da resposta imune humoral contra patógenos fúngicos ter sido mais bem compreendida nos últimos anos, pouco se conhece sobre a resposta clinicamente relevante contra espécies de Sporothrix. Em modelo murino, a resposta humoral parece induzir resposta imune parcialmente protetiva e controlar a esporotricose.35
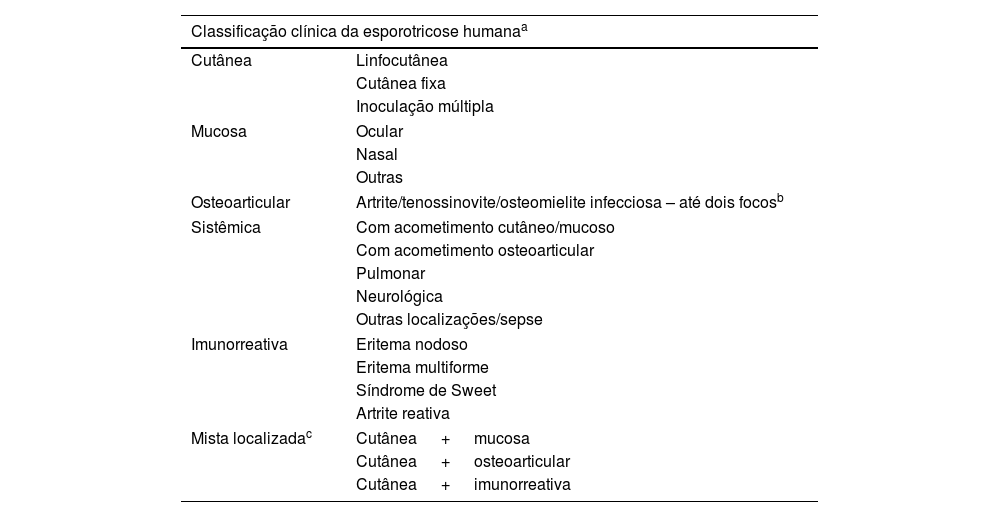
Classificação das formas clínicasEssa classificação, atualizada, facilita o entendimento fisiopatológico, a investigação diagnóstica e o tratamento do paciente, sobretudo face às mudanças na apresentação clínica da micose nas últimas décadas (tabela 1).9
Classificação clínica da esporotricose humana
| Classificação clínica da esporotricose humanaa | |
|---|---|
| Cutânea | Linfocutânea |
| Cutânea fixa | |
| Inoculação múltipla | |
| Mucosa | Ocular |
| Nasal | |
| Outras | |
| Osteoarticular | Artrite/tenossinovite/osteomielite infecciosa – até dois focosb |
| Sistêmica | Com acometimento cutâneo/mucoso |
| Com acometimento osteoarticular | |
| Pulmonar | |
| Neurológica | |
| Outras localizações/sepse | |
| Imunorreativa | Eritema nodoso |
| Eritema multiforme | |
| Síndrome de Sweet | |
| Artrite reativa | |
| Mista localizadac | Cutânea + mucosa |
| Cutânea + osteoarticular | |
| Cutânea + imunorreativa | |
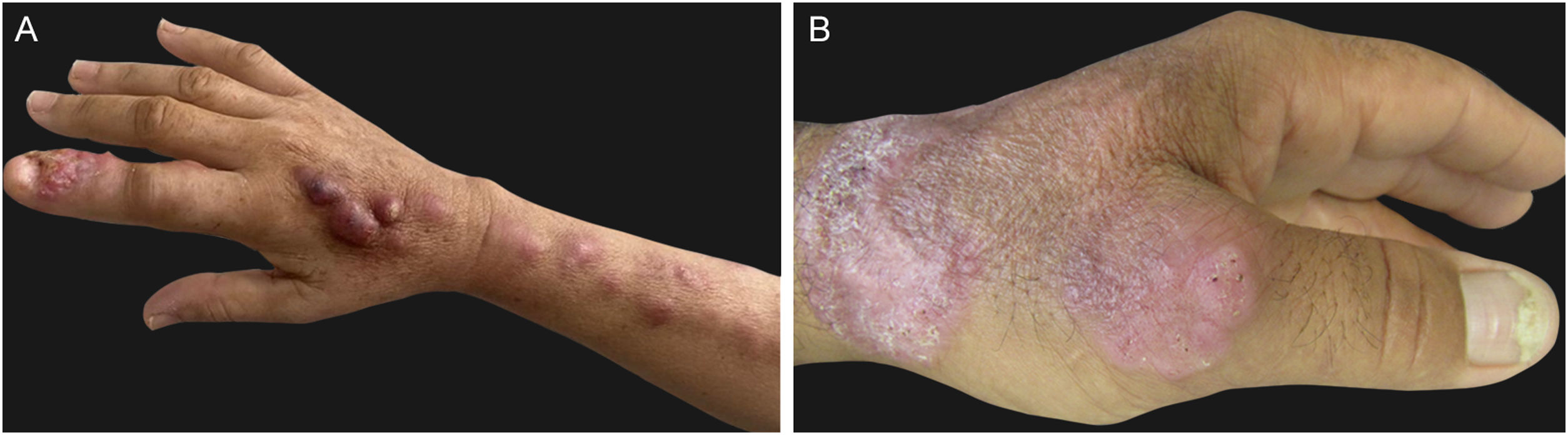
Linfocutânea (LC) ‐ forma clínica mais comum, representa 46% a 92% dos casos.36 Clinicamente, inicia‐se com o surgimento, dias a poucos meses após o trauma, de pequena pápula eritematosa ou pústula, no local de inoculação do fungo. Também chamada de cancro esporotricótico ou de inoculação é, habitualmente, assintomática, tende a aumentar de tamanho em poucas semanas, e tornar‐se nodular. Eventualmente, ocorre liquefação central, com fistulização ou ulceração e posterior drenagem de material purulento (lesão gomosa). Após alguns dias a semanas, surgem, no trajeto linfático regional, novas lesões pápulo‐nodulares, eritematosas, com aspecto de rosário, cujo trajeto pode ser ascendente ou descendente, a depender da drenagem regional (fig. 1 A). Assim como o cancro de inoculação, essas lesões podem tornar‐se gomosas e ulcerar. Embora ocorra em qualquer área do tegumento, locais expostos a traumas, especialmente os membros superiores, inferiores e a face, sobretudo em crianças, são os mais acometidos.37
Cutânea fixa (CF) – segunda forma clínica em frequência, corresponde, em média, a 25% dos casos. Após o trauma, surge o cancro de inoculação, que não exibe progressão linfática regional, provavelmente pela maior resistência do hospedeiro ou menor grau de termotolerância e virulência da cepa fúngica. A lesão inicial pode evoluir para ulceração, com bordas irregulares e tamanhos variados, ou aspecto verrucoso, com ou sem pontos de drenagem de material purulento (fig. 1B). A formação de nódulo não é rara – este pode flutuar, supurar ou ser recoberto por escamo‐crostas. Por vezes, pequenas pápulas satélites em torno da lesão inicial podem ser percebidas. Nessa forma, os locais expostos do corpo são também os mais acometidos.37
Inoculação múltipla ‐ apresenta‐se com múltiplas lesões cutâneas, polimórficas, em sítios não contíguos, sem envolvimento sistêmico. Essa forma clínica ganhou evidência com a emergência de casos zoonóticos relacionados a felinos doentes, nos quais é possível a ocorrência de múltiplos traumas, em razão de arranhaduras e mordeduras. Em geral, acomete pacientes imunocompetentes que costumam relatar, de modo consistente, a ocorrência de múltiplos traumas; as lesões surgem quase simultaneamente ou em sequência.9 É a forma cutânea menos comum.37,38
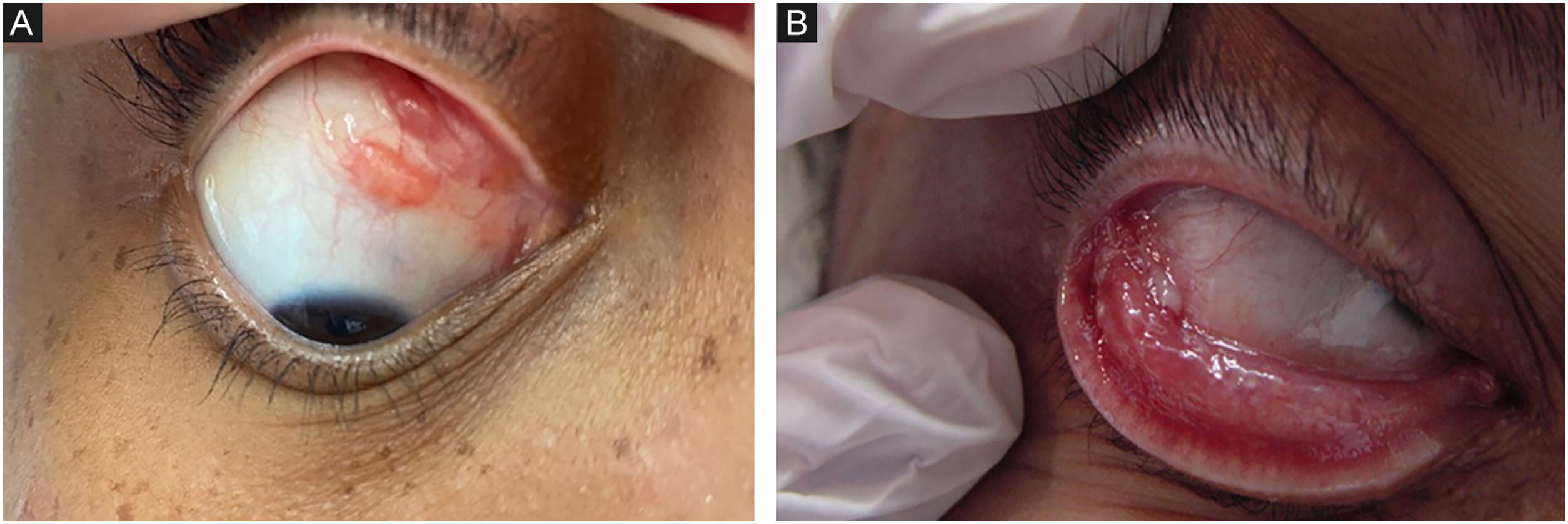
MucosaEmbora qualquer mucosa possa ser acometida por Sporothrix spp., a ocular é a mais comumente envolvida, pela maior exposição. A proximidade entre humanos e felinos domésticos aumentou a frequência dessa apresentação clínica, especialmente em crianças. Ao espirrar, os aerossóis dos animais atingem a mucosa ocular ou, após tocarem o animal ou fômites, os indivíduos levam as mãos contaminadas aos olhos.37,39 O quadro clínico mais característico é conjuntivite granulomatosa, caracterizada por lesões vegetantes na conjuntiva palpebral e/ou bulbar, podendo haver enantema e descarga purulenta (fig. 2 A e B).40 É possível coexistirem lesões cutâneas na pálpebra ipsilateral à conjuntivite. A presença de linfadenopatia satélite, associada à conjuntivite granulomatosa ipsilateral, caracteriza a síndrome óculo‐glandular de Parinaud, muitas vezes confundida com doença da arranhadura do gato.41 O comprometimento do saco lacrimal pode deixar, como sequela, a dacriocistite.42 Raramente ocorre episclerite, uveíte, coroidite e outras lesões retrobulbares, estas costumam estar relacionadas à disseminação hematogênica em pacientes imunossuprimidos, caracterizando a forma sistêmica com manifestação cutânea/mucosa.40
O acometimento de outras mucosas é menos comum, sendo a mucosa nasal a segunda região mais acometida. Existem relatos de lesões no palato, faringe e traqueia.43
OsteoarticularÉ a manifestação clínica mais comum depois da cutânea e mucosa. O comprometimento osteoarticular ocorre, usualmente, a partir do foco cutâneo contíguo, e é unifocal em muitos casos.44 Nestes, os fatores de risco mais importantes são lesão nas extremidades, sobretudo mãos e pés, pela proximidade anatômica íntima entre a pele e o sistema osteoarticular e pela fragilidade osteometabólica, especialmente nos idosos ou usuários crônicos de corticoides; e lesão por mordedura, em virtude da maior profundidade do inóculo (fig. 3 A).
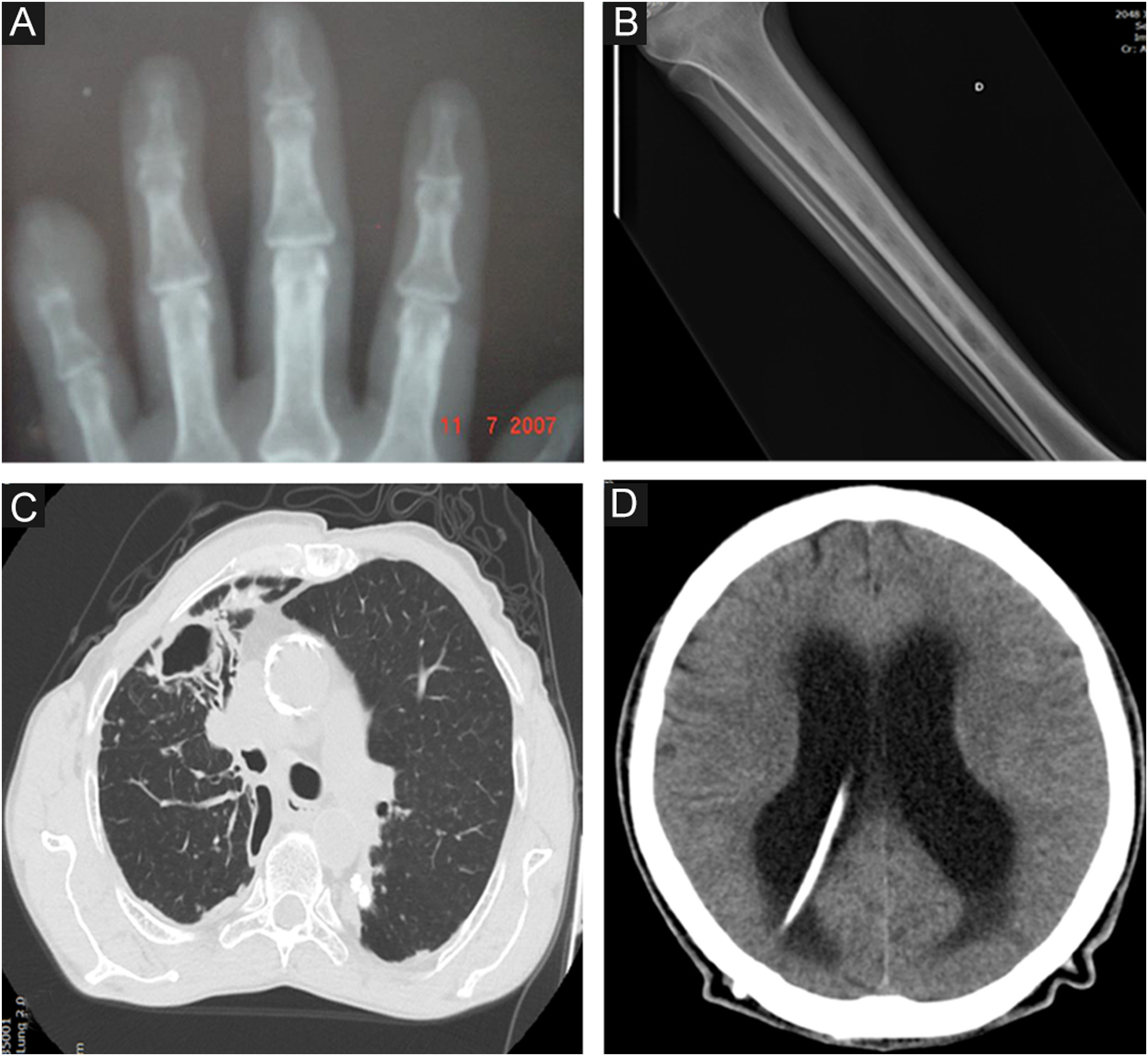
Imagens radiológicas na esporotricose humana. (A), Forma osteoarticular – reabsorção da falange distal do dedo mínimo causada por mordedura de gato (radiografia simples). (B), Forma sistêmica com manifestação osteoarticular – lesões osteolíticas na medula da tíbia por disseminação hematogênica em paciente com esporotricose sistêmica e AIDS (radiografia simples). (C), Pulmonar – cavidade no lobo superior do pulmão direito e extensa opacidade com aspecto fibrorretrátil (tomografia computadorizada). (D), Neuroesporotricose – meningite em paciente com esporotricose sistêmica e AIDS. Aumento das dimensões do sistema ventricular, principalmente na região supratentorial (hidrocefalia tetraventricular), cateter de derivação ventriculoperitoneal (tomografia computadorizada).
Na lesão osteoarticular unifocal observam‐se comprometimento articular com destruição da cartilagem, eventualmente apresentando derrame articular sinovial, e lesões osteolíticas, habitualmente de ossos curtos distais de mãos e pés. Manifesta‐se com dor, edema e limitação funcional. Demais sinais flogísticos como rubor e calor costumam ser mais brandos quando comparados a infecções de etiologia bacteriana. Frequentemente, Sporothrix spp. são isoladas de líquido ou fragmento sinovial. Já foi demonstrada sorologia positiva para antígenos de Sporothrix sp. no líquido sinovial.44
O envolvimento osteoarticular ocorre em aproximadamente 1% das grandes casuísticas.37 Na maior delas, com 41 casos, houve predomínio de comprometimento ósseo multifocal, associado à imunossupressão, sobretudo AIDS, provavelmente em razão de um viés de seleção pelo perfil de atendimento em centro de referência.45
Outras manifestações são o envolvimento dos tendões, por contiguidade de lesão na pele, caracterizado por tenossinovite de tendões extensores e/ou flexores, particularmente nas mãos, independente de comprometimento de ossos e articulações. Os achados de imagem são característicos e têm sido observados na transmissão zoonótica, por vezes quando as lesões cutâneas já estão cicatrizadas.
Para avaliação do comprometimento osteoarticular nos pacientes com lesão na extremidade, aconselha‐se radiografar, especialmente nos casos de mordedura associado a edema importante ou dor desproporcional ao quadro cutâneo. Nesses casos, considera‐se a osteomielite bacteriana diagnóstico diferencial em decorrência da composição da microbiota da cavidade oral dos gatos. Em geral, na osteomielite bacteriana os achados são mais agudos, inflamatórios, apresentando exsudato purulento com odor fétido, e nem sempre tão próximo ao foco de entrada como na esporotricose. O exame ultrassonográfico está indicado para avaliar tenossinovite nos casos com limitações funcionais que envolvam movimentos relacionados a algum tendão específico.46
SistêmicaNa forma sistêmica, mais rara, há acometimento de outros órgãos, com ou sem lesões cutâneas. Admite‐se que, ocasionalmente, a porta de entrada possa ser pulmonar com disseminação hematogênica do patógeno, conceito tradicional de ‘micose sistêmica’ proposto por Rippon, ou possa disseminar‐se por via hematogênica, a partir de lesão cutânea ou osteoarticular.47 Embora não haja fatores de risco específicos, pacientes com HIV/AIDS, com contagem de CD4+abaixo de 200 células/mm3, desnutridos, etilistas, diabéticos, transplantados, portadores de neoplasias hematológicas, em uso crônico de medicações imunossupressoras como corticosteroide, depletor da imunidade celular, anti‐TNF e imunobiológicos, além da imunossenescência, têm maior predisposição ao desenvolvimento de formas sistêmicas, podendo evoluir a óbito.48 Apesar de Sporothrix spp. serem patógenos primários, observa‐se comportamento oportunista dessa micose em condições de supressão importante da imunidade celular, podendo ser doença definidora de AIDS.42 Raramente, formas sistêmicas são observadas em indivíduos imunocompetentes, o que pode ser atribuído a cepas mais virulentas do fungo ou à imunodeficiência primária do hospedeiro.49
Com acomentimento cutâneo/mucoso ‐ não confundir com focos cutâneos primários por múltiplos inóculos ou da inoculação primária das mucosas. Suspeita‐se de disseminação hematogênica para pele/mucosas quando há lesões cutâneas numerosas, dispersas nas áreas mais protegidas de traumas, como tronco, ombros, raiz das coxas, região glútea, genitália e face, especialmente o maciço centrofacial, ou lesões oculares profundas, com redução da acuidade visual, associadas à queda do estado geral e imunossupressão de base.50 Lesões cutâneas disseminadas podem representar o único órgão acometido por disseminação hematogênica ou serem associadas ao envolvimento de outros órgãos, quando podem estar relacionadas a quadros mais graves de imunossupressão, particularmente HIV‐induzida.51,52
Apresentam‐se com morfologia variada, habitualmente ulceradas, supurativas, sem odor ou reação inflamatória importante, o que as diferencia de quadro bacteriano secundário. Por serem supurativas, é frequente recobrirem‐se por crostas, compostas por pus e sangue solidificados na superfície. Outros tipos de lesões cutâneas observadas nesses quadros disseminados são pápulas, nódulos, placas verrucosas, lesões necróticas, vegetantes, tumorais e molusco símile.52,53 Abscessos frios foram descritos em pacientes etilistas.50
O comprometimento mucoso na esporotricose sistêmica, secundário à disseminação hematogênica, envolve, com maior frequência, as mucosas nasal e oral (palato). Quando o olho é acometido por disseminação hematogênica, usualmente em pacientes imunossuprimidos, observa‐se envolvimento da câmara posterior, com coriorretinite.54,55 Por isso, recomenda‐se examinar o fundo de olho em todos os pacientes com esporotricose sistêmica e sinais clínicos de disseminação hematogênica.
Com acometimento osteoarticular ‐ o comprometimento do sistema osteoarticular por via hematogênica, em geral, está associado à doença invasiva e intensamente disseminada, sobretudo nos pacientes com AIDS, mas também pode ser observado em outras condições imunossupressoras.45 Nesses casos, nota‐se comprometimento multifocal de ossos longos, com lesões osteolíticas (fig. 3 B). Clinicamente, há dor e limitação funcional, podendo existir, raramente, sinais inflamatórios, considerando‐se o baixo potencial de resposta imune inflamatória celular desses pacientes.
A esporotricose óssea multifocal é, muitas vezes, oligossintomática, em decorrência da depleção da imunidade celular. O rastreio osteoarticular sistemático é indispensável, preferencialmente por cintilografia óssea ou, quando não estiver disponível, inventário ósseo com radiografia simples de todos os ossos longos, além de ossos das mãos, punhos, pés e tornozelos nos pacientes sob risco, sobretudo naqueles com AIDS.45
Pulmonar ‐ o acometimento pode ser primário, por inalação de conídios e outros propágulos infectantes de Sporothrix spp., ou secundário à disseminação hematogênica, habitualmente a partir de foco cutâneo primário. Quando primária, pode limitar‐se ao pulmão como, por exemplo, na doença pulmonar obstrutiva crônica (DPOC) ou disseminar‐se a partir dos pulmões, o que é comum nos imunossuprimidos.56 Nesses casos, é difícil identificar se a disseminação foi a partir desse órgão ou da pele. A história de trauma precedendo o quadro clínico pode auxiliar a definir a provável rota da disseminação. Manifesta‐se, usualmente, como dois padrões clínicos:
Pulmonar primária ‐ os pacientes têm doença pulmonar de base, geralmente tabagistas com DPOC, com uma ou múltiplas lesões cavitadas, associadas à fibrose do parênquima pulmonar e destruição arquitetural (fig. 3C).
Pulmonar multifocal ‐ ocorre em paciente imunossuprimido com esporotricose em outros órgãos, nos quais as lesões normalmente não são cavitadas.56 Imunossupressão por etilismo crônico intenso e lesões cavitadas pulmonares foi relatada em paciente com esporotricose disseminada.57
As lesões cavitadas confundem o diagnóstico com tuberculose pulmonar, contribuindo para o subdiagnóstico da esporotricose pulmonar, sobretudo nas regiões endêmicas.57 O principal sintoma respiratório é tosse persistente, seca ou produtiva, por mais de duas semanas, de maneira análoga à tuberculose. A investigação inclui radiografia simples de tórax e exame tomográfico, exame micológico e baciloscopia do escarro para exclusão de tuberculose, micobacteriose e outras micoses. Pacientes com AIDS podem ser oligossintomáticos.
Neurológica (neuroesporotricose) ‐ o acometimento do sistema nervoso central (SNC) por Sporothrix spp. é raro e grave. Geralmente, ocorre em quadros mais invasivos da doença, notadamente AIDS, por disseminação hematogênica através da barreira hematoencefálica. Além da suscetibilidade do hospedeiro, algumas espécies de Sporothrix exibem maior virulência com neurotropismo, destacando‐se cepas de S.brasiliensis. Na neuroesporotricose há, comumente, meningite de evolução subaguda a crônica, embora o quadro de irritação meníngea possa ser oligo ou assintomático, quando há depleção importante da imunidade celular (fig. 3 D). A punção lombar precoce para investigação de comprometimento do SNC deve ser rotina em pacientes com AIDS e sinais clínicos de esporotricose sistêmica.58 Por outro lado, sintomas neurológicos com sinais mais evidentes de meningismo podem ocorrer na síndrome inflamatória de reconstituição imune (SIRI), o que facilita a suspeita diagnóstica.59 Na neuroesporotricose o aspecto do líquor pode ser claro. Nota‐se aumento de celularidade às custas de mononucleares, hiperproteinorraquia e hipoglicorraquia. Em virtude da baixa carga parasitária de Sporothrix spp. no SNC, o isolamento e identificação do fungo em cultura é raro. Nesses casos, métodos moleculares parecem ser promissores para investigação diagnóstica.
Sepse ‐ ocorre quando há disfunção orgânica pela infecção generalizada causada por Sporothrix spp. Embora presente em vários órgãos, o isolamento do fungo em amostras de hemocultura não é frequente. Constitui progressão de outras formas sistêmicas em pacientes com baixa capacidade de reação à infecção, mais comumente observada em associação com AIDS. Qualquer órgão ou sistema pode ser acometido na sepse por Sporothrix spp.
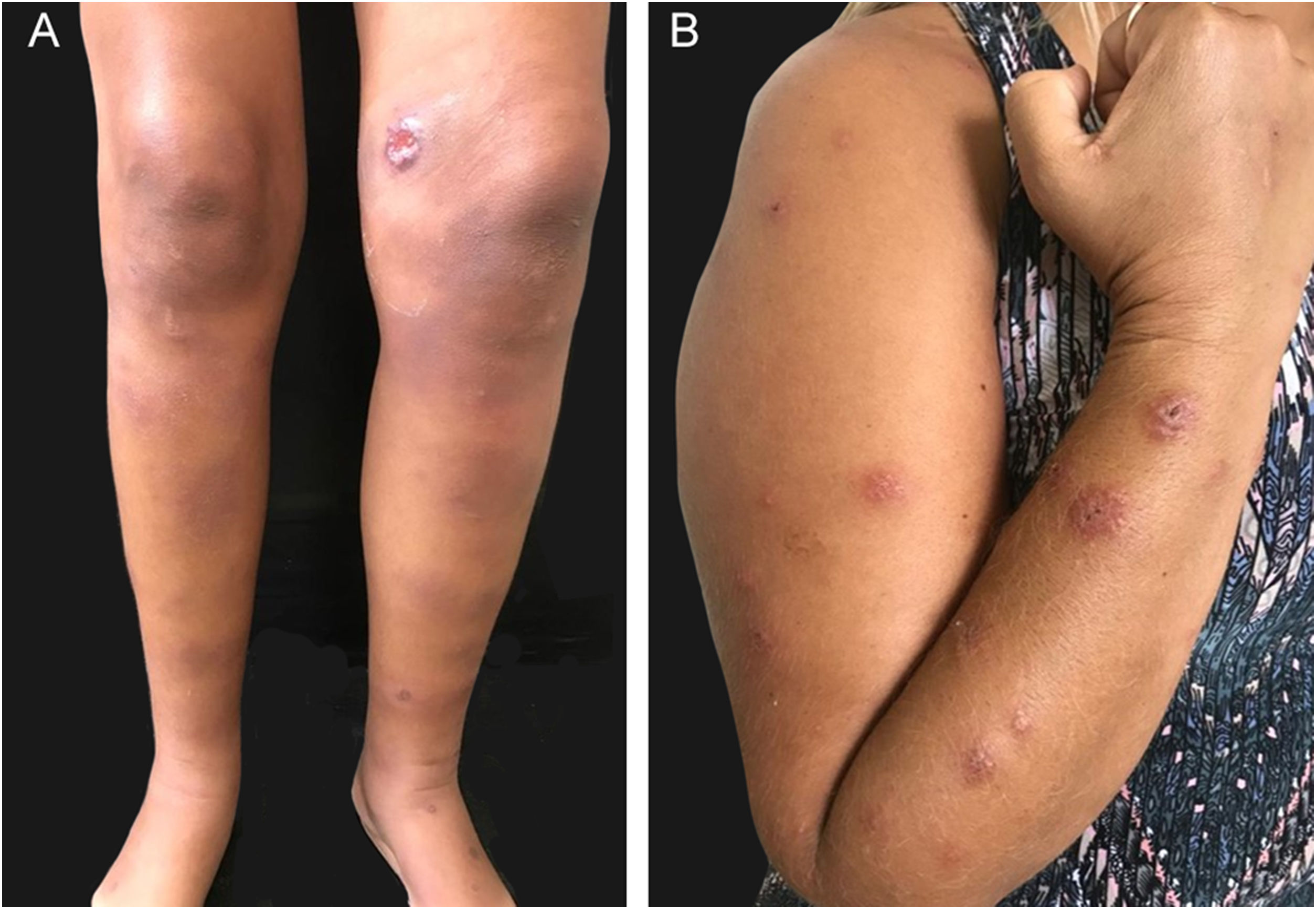
ImunorreativaPacientes com lesões cutâneas/mucosas de esporotricose podem desenvolver, no curso da doença, reações de hipersensibilidade. Essas formas reacionais têm sido observadas com maior frequência na epidemia de esporotricose zoonótica – eritema nodoso, eritema multiforme e síndrome de Sweet são as mais comuns (fig. 4 A e B).60,61 Artrite reativa como forma de hipersensibilidade, em geral, é poliarticular e migratória, desaparecendo antes ou após terapia específica.62 As formas imunorreativas estão, normalmente, associadas a quadros mais brandos e localizados de esporotricose, o que provavelmente demonstra melhor controle imunológico da doença, embora a mesma seja, por vezes, incapacitante. Lesões reativas exuberantes podem mascarar as lesões específicas e frustras da esporotricose.
MistaComo ocorre em outras doenças, pode haver associação de mais de uma forma de apresentação clínica no mesmo paciente. Por exemplo, cutânea e mucosa, cutânea e osteoarticular, cutânea e imunorreativa. Não confundir pacientes com comprometimento misto da pele, mucosa e sistema osteoarticular com esporotricose sistêmica, cujo acometimento ocorre por disseminação hematogênica.
Particularidades em grupos especiaisCriança ‐ apresenta maior risco de adoecimento em razão do convívio próximo com felinos domésticos e porque podem apresentar quadros clínicos atípicos. O hábito de acariciar animais domésticos próximo à região da face faz com que essa topografia tenha maior risco de infecção. Muitas vezes, essas formas de apresentação atípicas atrasam o diagnóstico e, consequentemente, apresentam maior risco de sequelas. Por outro lado, as crianças têm melhor perfil de resposta imune e os casos são habitualmente limitados.
Gestante – há dificuldade no manejo terapêutico, uma vez que a maioria dos tratamentos farmacológicos está contraindicada.63 Questiona‐se, também, a possibilidade de lesão fetal pela infecção.
Idoso ‐ o convívio domiciliar com animais e as comorbidades comuns nessa faixa etária podem acarretar maior risco de infecção, potencial de gravidade e dificuldade no manejo terapêutico, seja pelas comorbidades em si, como é o caso do diabetes mellitus, seja pelos medicamentos com os quais o itraconazol, primeira escolha no tratamento da esporotricose, interage. A fragilidade osteometabólica típica dessa faixa etária também é fator de risco para formas sistêmicas e de difícil manejo.9
Imunossuprimido ‐ esporotricose sistêmica em pacientes com condições imunossupressoras de base, particularmente HIV/AIDS, deve ser avaliada com cuidado e de maneira multidisciplinar; recomendada‐se avaliação rotineira de múltiplos órgãos, com destaque para mucosas nasal, oral e ocular (fundo de olho), ossos, articulações, pulmões e SNC.
DermatoscopiaOs achados dermatoscópicos na esporotricose cutânea não são específicos, sobrepõem‐se aos de outras micoses e leishmaniose, dependem da morfologia da lesão clínica e seu estágio evolutivo. Os mais comuns são eritema, crostas hemorrágicas, áreas amarelo‐alaranjadas, telangiectasias e áreas brancas brilhosas (crisálidas), que correspondem a lesões ativas, fase granulomatosa, neoangiogênese e posterior substituição por tecido fibroso.64 Portanto, não há, até o momento, consenso sobre os aspectos dermatoscópicos específicos da eporotricose.
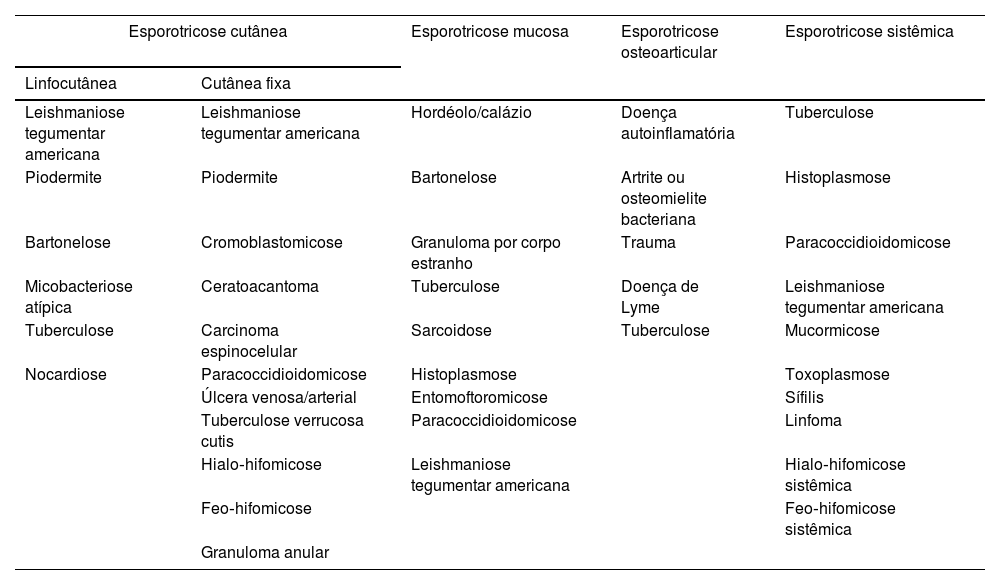
Diagnóstico diferencialEstão incluídas no diagnóstico diferencial doenças infecciosas ou não, restritas à pele ou sistêmicas (tabela 2).
Principais diagnósticos diferenciais das apresentações clínicas na esporotricose humana
| Esporotricose cutânea | Esporotricose mucosa | Esporotricose osteoarticular | Esporotricose sistêmica | |
|---|---|---|---|---|
| Linfocutânea | Cutânea fixa | |||
| Leishmaniose tegumentar americana | Leishmaniose tegumentar americana | Hordéolo/calázio | Doença autoinflamatória | Tuberculose |
| Piodermite | Piodermite | Bartonelose | Artrite ou osteomielite bacteriana | Histoplasmose |
| Bartonelose | Cromoblastomicose | Granuloma por corpo estranho | Trauma | Paracoccidioidomicose |
| Micobacteriose atípica | Ceratoacantoma | Tuberculose | Doença de Lyme | Leishmaniose tegumentar americana |
| Tuberculose | Carcinoma espinocelular | Sarcoidose | Tuberculose | Mucormicose |
| Nocardiose | Paracoccidioidomicose | Histoplasmose | Toxoplasmose | |
| Úlcera venosa/arterial | Entomoftoromicose | Sífilis | ||
| Tuberculose verrucosa cutis | Paracoccidioidomicose | Linfoma | ||
| Hialo‐hifomicose | Leishmaniose tegumentar americana | Hialo‐hifomicose sistêmica | ||
| Feo‐hifomicose | Feo‐hifomicose sistêmica | |||
| Granuloma anular | ||||
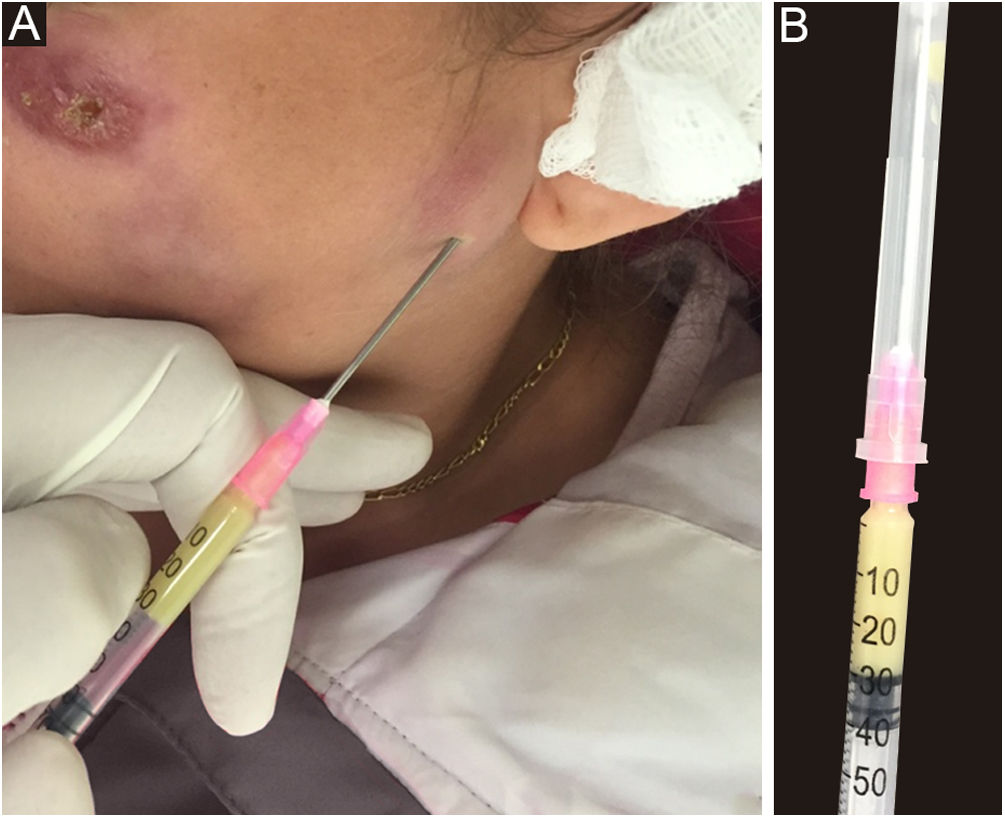
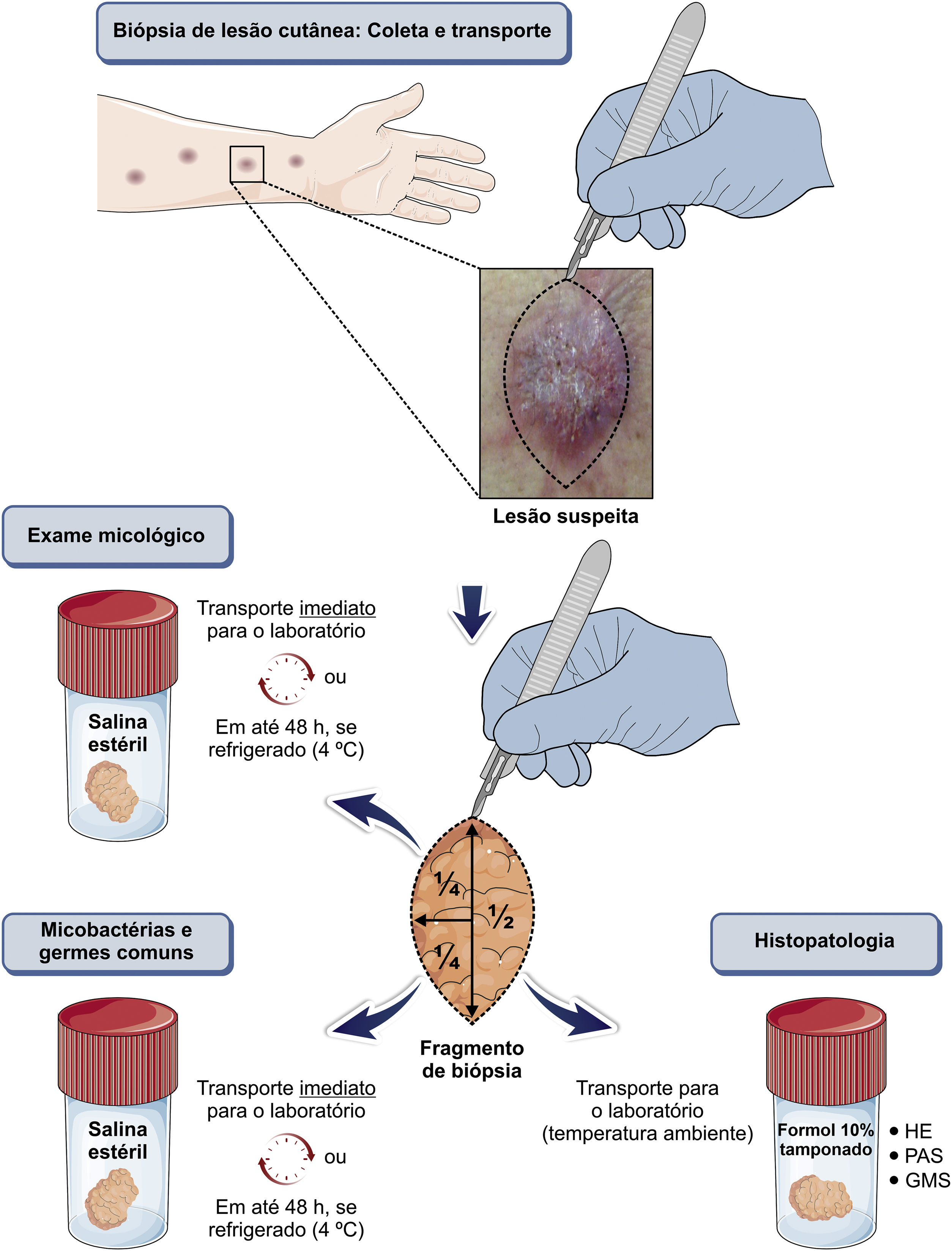
Qualquer amostra clínica é adequada, embora o pus seja o melhor material para diagnóstico.9,65 Pode ser obtido por meio de punção com agulha em abscessos (fig. 5) ou pela expressão manual profunda de feridas, especialmente após remoção de crostas. Esses métodos de coleta são simples, rápidos e custo‐efetivos. Na impossibilidade, a biópsia da lesão é o método de escolha. Para tal, pode‐se coletar com punch ou fazer um fuso com bisturi. Quando houver dúvida quanto ao diagnóstico de esporotricose, a melhor técnica é o fuso, pois o histopatológico vai diferenciá‐la de outras doenças, de origem infecciosa ou não. Outra vantagem do fuso é a correspondência entre as amostras que serão enviadas para cultura para fungos e germes comuns ou micobactéria e o histopatológico. Em ambos os casos, a profundidade da biópsia é essencial ao diagnóstico correto, devendo estender‐se até o tecido subcutâneo. A figura 6 esquematiza a divisão do fragmento coletado e o transporte do material aos respectivos setores do laboratório.
Exame micológico direto (EMD) – tem baixa sensibilidade e especificidade na esporotricose humana, principalmente nas formas LC e CF.
Isolamento ‐ é o padrão‐ouro para o diagnóstico definitivo da esporotricose a partir de amostras clínicas em meios de cultura. Nos meios de ágar Sabouraud dextrose e ágar Mycosel, Sporothrix spp. surgem em 3‐6 dias, em temperatura de 25°‐28°C, nas amostras coletadas de lesões cutâneas, e 10‐19 dias a partir de outros materiais orgânicos, podendo variar de acordo com a espécie.66
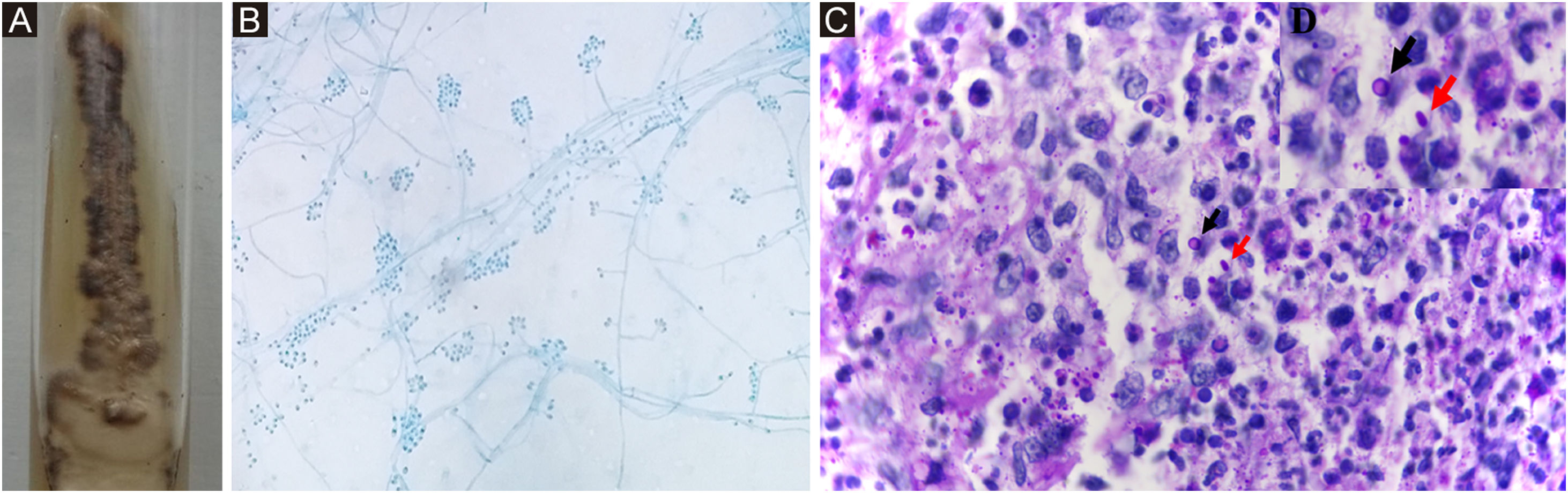
IdentificaçãoFenotípica ‐ Sporothrix spp. são identificadas por suas características macro e micromorfológicas (fig. 7 A e B). Algumas espécies, como S. globosa, são sensíveis à temperatura acima de 35°C. A demonstração laboratorial do termodimorfismo da colônia, isolada da lesão suspeita, confirma a identificação fenotípica de Sporothrix spp.67
Sporothrix sp. (A), Aspecto macromorfológico da colônia em ágar Mycosel, temperatura ambiente. Apresenta‐se com superfície de aspecto membranoso, brilho perolado, coloração esbranquiçada, circundada por halo enegrecido. (B), Micromorfologia da colônia, temperatura ambiente, evidencia hifas hialinas delicadas, septadas, ramificadas e conídios ovalados ou arredondados em arranjo de “margarida”, na extremidade de conidióforo (Azul de algodão, 100×). (C), Corte histopatológico de pele evidencia granuloma supurativo e fungo em parasitismo. Células epitelioides à esquerda, neutrófilos e piócitos à direita, célula fúngica leveduriforme redonda (seta preta) e alongada ou navicular (seta vermelha) – PAS, 1000×. (D), Detalhe das células fúngicas.
Molecular ‐ sequenciamento de DNA – método de referência para identificação molecular de espécies de Sporothrix de relevância médica, seguido de análise filogenética. Para a realização da análise filogenética é necessária a inclusão de sequências referências, oriundas de cepas utilizadas na descrição das espécies (cepas tipo), disponíveis em bancos de dados públicos como o GenBank (Disponível em: https://www.ncbi.nlm.nih.gov/genbank/). A análise filogenética em Sporothrix pode incluir um único marcador ou uma combinação de loci codificadores de proteínas, com o objetivo de aumentar a resolução da identificação molecular. A região ITS é descrita como excelente marcador “código de barras” e dá suporte à monofilia do clado clínico.68 O sequenciamento de DNA possibilita a investigação da diversidade genética e a estrutura populacional do fungo durante surtos e epidemias, esclarecendo, portanto, as rotas de transmissão e expansão de agentes emergentes como S. brasiliensis.
Métodos independentes do sequenciamento de DNA – são úteis para o diagnóstico rápido. Em geral, técnicas moleculares capazes de diferenciar S. brasiliensis, S. schenckii, S. globosa e S. luriei empregam DNA extraído de cultura pura e incluem PCR‐RFLP (CAL‐RFLP com enzima HhaI), PCR espécie‐específica amplificação por círculo rolante, T3B RAPD AFLP e qPCR.21,23,69 Cada uma dessas técnicas tem diferentes aplicações, que vão desde o diagnóstico de rotina em laboratório clínico, investigação da estrutura populacional, até o desenvolvimento de estudos ecológicos robustos com o objetivo de detectar DNA de Sporothrix spp. em amostras ambientais.11
A qualidade e quantidade do DNA isolado, bem como o alvo molecular utilizado, têm grande impacto no sucesso da identificação. Extrações que não envolvem nenhuma etapa de purificação, por exemplo, podem inibir a reação em cadeia da polimerase devido à presença de impurezas no material extraído. No entanto, métodos de extração de DNA que empregam kits comerciais têm sido usados de forma satisfatória e são eficazes na extração e purificação de DNA a partir de amostras clínicas.
MALDI‐ToF MS (espectrometria de massa por ionização com dessorção a laser assistida por matriz e analisador de tempo de voo) ‐ ferramenta potencial para a identificação rápida e específica de Sporothrix spp. a partir de colônias cultivadas in vitro, com considerável economia de material e mão de obra. A confiabilidade e precisão do MALDI‐ToF MS na identificação de Sporothrix spp. é comparável aos métodos moleculares atualmente em uso.70
Exame histopatológicoO padrão histopatológico é geralmente granulomatoso, mais frequentemente supurativo, mas granulomas epitelioides sem outras especificações, tuberculoides, em paliçada, tipo corpo estranho e sarcoidico também podem ser observados em ordem decrescente de frequência. Na maioria dos casos, linfócitos e plasmócitos complementam o infiltrado inflamatório.71 Utilizam‐se técnicas histológicas especiais de coloração, como PAS e impregnação argêntica (prata metenamina de Gomori‐Grocott), quando houver suspeita clínica e quadro histopatológico compatível. Sporothrix spp. mostram variação considerável de formato e relativa de tamanho; de arredondados a elípticos, de 2 a mais de 6 μm em seus maiores eixos, e naviculares com aproximadamente 3 × 10 μm (fig. 7C e D). Os brotamentos de base estreita são relativamente frequentes, geralmente únicos, raramente duplos ou múltiplos, por vezes alongados, em forma de clava. Mas podem ser oblongos, de largura uniforme, inclusive na base, não formando o aspecto em clava. Além disso, é importante a ocorrência de brotamentos desalinhados em relação ao maior eixo da célula mãe, considerados característicos de Sporothrix spp.72 Havendo abundância de elementos fúngicos teciduais, suspeita‐se de imunossupressão ou de outras micoses, sobretudo histoplasmose (elementos fúngicos são menores) ou criptococose (fungo capsulado e um pouco maior).
Os corpos asteroides são estruturas extracelulares, mais frequentemente encontradas no interior de abscessos, e correspondem a depósito de imunoglobulinas ao redor de uma célula fúngica leveduriforme. Representa uma das manifestações do fenômeno de Splendore‐Höeppli, é observado como material hialino, fibrilar ou em forma de clava, em arranjo radial, eosinofílico na coloração de HE e PAS‐positivo.73
Quadros histopatológicos de eritema nodoso e síndrome de Sweet, associados à esporotricose, podem ser indistinguíveis daqueles vistos nessas lesões relacionadas a outras causas.74 Entretanto, no eritema nodoso, foi relatado acometimento lobular significativo em um caso. Na síndrome de Sweet, foi observada diferenciação epitelioide de histiócitos, podendo indicar a variante histiocitoide.75
Teste de suscetibilidade a antifúngicos (TSA)Duas metodologias padronizadas são usadas para testar a suscetibilidade das espécies de Sporothrix a antifúngicos, Clinical and Laboratory Standards Institute (CLSI), que propõe o método de microdiluição utilizando inóculo obtido a partir de cultura de Sporothrix spp. na forma filamentosa, e European Committee on Antifungal Susceptibility Testing (EUCAST).76 Fluconazol, flucitosina e equinocandinas não inibem o crescimento de Sporothrix spp. in vitro, sendo, portanto, dispensável sua inclusão no TSA.67,76 Algumas cepas de Sporothrix podem ser inibidas pelo voriconazol. Itraconazol, terbinafina, posaconazol e anfotericina B apresentam perfis variados de suscetibilidade antifúngica, o que justifica sua inclusão em todos os TSA de espécies patogênicas humanas de Sporothrix, pela possibilidade de concentração inibitória mínima (CIM) elevada.77 Os valores de corte para isolados clínicos de S. brasiliensis e S. schenckii, pela metodologia do CLSI, são, respectivamente, anfotericina B, 4 e 4 μg/mL; itraconazol, 2 e 2μg/mL; posaconazol, 2 e 2 μg/mL e voriconazol, 64 e 32 μg/mL. Pontos de corte adicionais para S. brasiliensis são cetoconazol, 2 μg/mL e terbinafina, 0,12 μg/mL.76
Casos refratários ao tratamento não estão obrigatoriamente associados à CIM elevada nem ao desenvolvimento de resistência in vitro ao longo do tratamento antifúngico. Por outro lado, a esporotricose causada por cepas tipo não selvagem, ou seja, com elevados valores de CIM, tendem a necessitar de maior tempo de tratamento e maiores doses de antifúngico do que as recomendadas na literatura, além de poder evoluir com sequelas.78
Provas imunológicasTeste intradérmico (esporotriquina) – detecta reação de hipersensibilidade do tipo tardia, utilizando antígeno bruto obtido a partir de culturas de S. Schenckii.79 Propicia diagnóstico presuntivo, podendo indicar exposição prévia a Sporothrix spp. ou ocorrer pela reação cruzada com outros fungos. Utilizado na investigação epidemiológica em áreas endêmicas, embora só esteja disponível em centros de pesquisa. Na doença disseminada, o teste pode ser negativo pela anergia.80,81
Sorologia – ferramenta alternativa no diagnóstico laboratorial da esporotricose, útil para as formas sistêmicas e atípicas e como triagem diagnóstica.23,44 Os testes imunoenzimáticos, principalmente ELISA (Enzyme Linked Immunosorbent Assay) e imunoblot, são mais sensíveis, com resultados mais rápidos.82 O teste de ELISA, que utiliza a fração antigênica SsCBF (Sporothix schenckii Con A‐Binding Fraction), apresenta especificidade de 90% e sensibilidade de 80%.82,83 Pode ser aplicado para análise de diferentes amostras biológicas, além do sangue, como líquido sinovial e líquor, resultando em eficiente correlação clínico‐sorológica e controle de cura.44,62 O teste imunoenzimático com exoantígenos de S. brasiliensis, apesar de metodologia simples, mostrou variações de resultados.
O monitoramento dos títulos de anticorpos pode indicar recidiva ou falha no tratamento estabelecido; no entanto, não está disponível comercialmente para uso em humanos.83
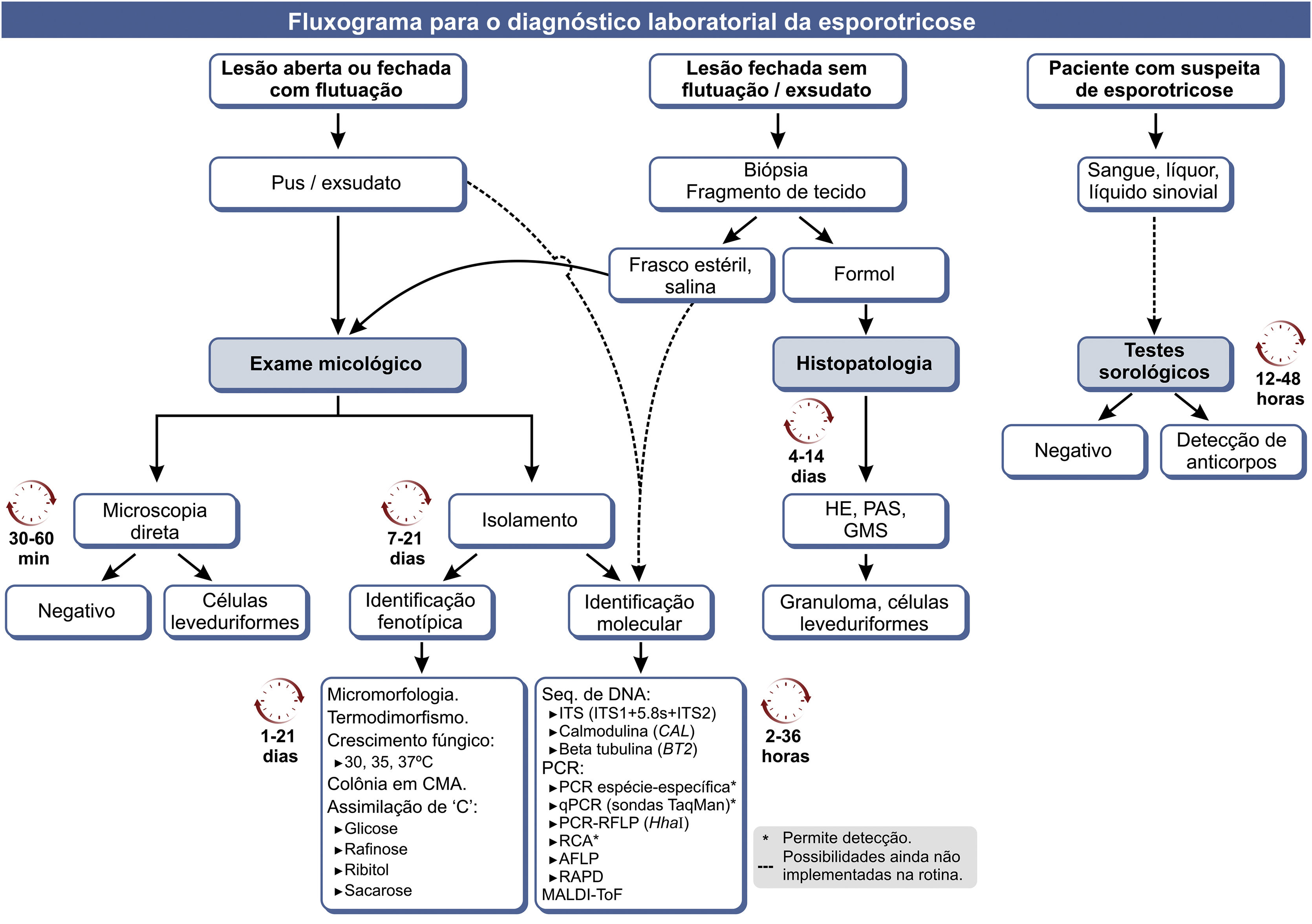
A figura 8 contém um fluxograma atualizado para o diagnóstico laboratorial da esporotricose humana.
Fluxograma para o diagnóstico laboratorial da esporotricose humana, com estimativa de tempo para o processamento de cada método.
GMS, prata metenamina de Gomori‐Grocott; CMA, ágar fubá; ’C’, fonte de carbono; ITS, espaçador transcrito interno; PCR, reação em cadeia da polimerase; qPCR, PCR quantitativa em tempo real; RCA, amplificação em círculo rolante; AFLP, amplified fragment length polymorphism; RAPD, random amplification of polymorphic DNA. Modificado de Orofino‐Costa et al., 2017.[9].
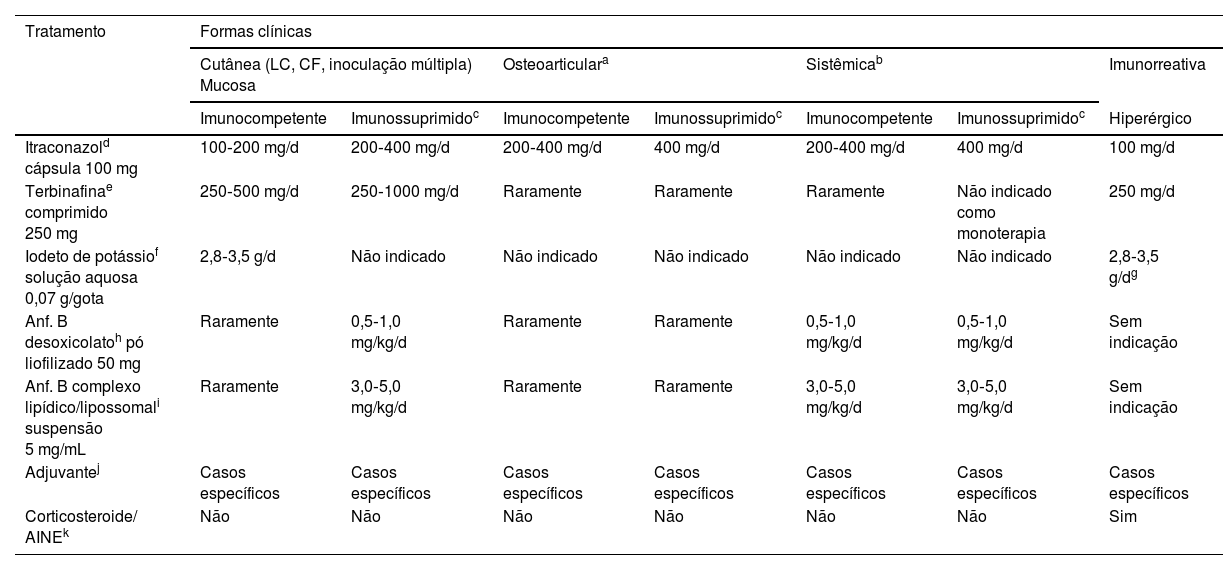
A tabela 3 contém as recomendações terapêuticas para os principais fármacos, com as devidas posologias, bem como outras modalidades terapêuticas usadas no tratamento da esporotricose, em suas diversas formas clínicas.
Principais modalidades terapêuticas usadas na esporotricose humana
| Tratamento | Formas clínicas | ||||||
|---|---|---|---|---|---|---|---|
| Cutânea (LC, CF, inoculação múltipla) Mucosa | Osteoarticulara | Sistêmicab | Imunorreativa | ||||
| Imunocompetente | Imunossuprimidoc | Imunocompetente | Imunossuprimidoc | Imunocompetente | Imunossuprimidoc | Hiperérgico | |
| Itraconazold cápsula 100 mg | 100‐200 mg/d | 200‐400 mg/d | 200‐400 mg/d | 400 mg/d | 200‐400 mg/d | 400 mg/d | 100 mg/d |
| Terbinafinae comprimido 250 mg | 250‐500 mg/d | 250‐1000 mg/d | Raramente | Raramente | Raramente | Não indicado como monoterapia | 250 mg/d |
| Iodeto de potássiof solução aquosa 0,07 g/gota | 2,8‐3,5 g/d | Não indicado | Não indicado | Não indicado | Não indicado | Não indicado | 2,8‐3,5 g/dg |
| Anf. B desoxicolatoh pó liofilizado 50 mg | Raramente | 0,5‐1,0 mg/kg/d | Raramente | Raramente | 0,5‐1,0 mg/kg/d | 0,5‐1,0 mg/kg/d | Sem indicação |
| Anf. B complexo lipídico/lipossomali suspensão 5 mg/mL | Raramente | 3,0‐5,0 mg/kg/d | Raramente | Raramente | 3,0‐5,0 mg/kg/d | 3,0‐5,0 mg/kg/d | Sem indicação |
| Adjuvantej | Casos específicos | Casos específicos | Casos específicos | Casos específicos | Casos específicos | Casos específicos | Casos específicos |
| Corticosteroide/ AINEk | Não | Não | Não | Não | Não | Não | Sim |
LC, linfocutânea; CF, cutânea fixa; Anf. B, anfotericina B; AINE, anti‐inflamatório não esteroide.
Primeira escolha, desde que sem contraindicação; manutenção após anf. B 12 meses; lipossolúvel, administrar junto à principal refeição; pode ser administrado em pulso de 200 mg, 2×/d/7 dias/mês; uso pediátrico off label em casos moderados a graves, 3–5 mg/kg/d, máximo 200 mg/d.
Primeira escolha em casos pediátricos leves a moderados; pode ser usada como manutenção pós anf. B 12 meses se itraconazol contraindicado; alimentação não interfere na absorção; pode ser administrada em pulso de 250 mg, 2×/d/7 d/mês.
KI foi o primeiro fármaco usado no tratamento da esporotricose e continua sendo boa opção terapêutica não só pelo baixo custo, mas também pela rápida resposta clínica.84 Tem nível de evidência científica A‐II; sua segurança e eficácia são bem conhecidas.2 Seus prováveis mecanismos de ação são inibição da formação de granulomas por mecanismos imunológicos e não imunológicos, atuação na quimiotaxia de neutrófilos, fagocitose de Sporothrix spp. e inibição do biofilme nas fases leveduriforme e filamentosa.85,86 O efeito anti‐inflamatório in vivo parece estar relacionado à regulação de citocinas, com aumento dos níveis de IL‐10 e IL‐35.87 É provável que os efeitos anti‐inflamatório e de imunomodulação sejam responsáveis pela melhora clínica mais rápida do que com itraconazol ou terbinafina.
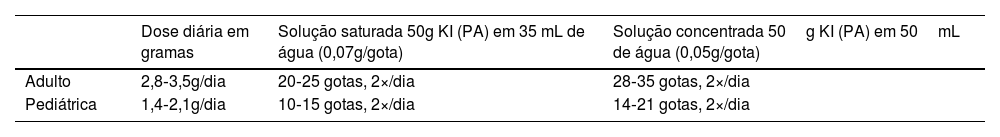
Doses menores, administradas duas vezes ao dia, foram usadas em ensaio clínico aberto e mostraram a mesma eficácia e segurança que as preconizadas, anteriormente, na literatura (tabela 4).85 A apresentação líquida é vantajosa para crianças e idosos. Útil no tratamento das formas imunorreativas por seu efeito anti‐inflamatório, e como primeira escolha para crianças, nas formas localizadas leves. Os eventos adversos mais comuns são cefaleia, diarreia, náusea, dor abdominal e gosto metálico, que raramente impedem a continuação do tratamento. A coadministração de diuréticos poupadores de potássio e inibidores da enzima conversora de angiotensina aumenta o risco de toxicidade (hipercaliemia). Na pele, pode ocorrer erupção acneiforme e iododerma. Por vezes observa‐se hipotireoidismo subclínico transitório e reversível, que não constitui o efeito de Wolf‐Chaikoff.84 Recomenda‐se investigar história pessoal ou familial de doenças tireoidianas e avaliar a função da tireoide antes do tratamento. Está contraindicado na insuficiência renal, alergia a iodo, doenças autoimunes, gravidez e lactação, além de formas disseminadas e graves da esporotricose, como monoterapia. No entanto, seu uso bem‐sucedido, em associação com o itraconazol em casos graves e refratários de esporotricose felina, pode sugerir que esta associação seja uma estratégia possível para casos humanos selecionados.88
Iodeto de potássio para tratamento da esporotricose humanaa
| Dose diária em gramas | Solução saturada 50g KI (PA) em 35 mL de água (0,07g/gota) | Solução concentrada 50g KI (PA) em 50mL de água (0,05g/gota) | |
|---|---|---|---|
| Adulto | 2,8‐3,5g/dia | 20‐25 gotas, 2×/dia | 28‐35 gotas, 2×/dia |
| Pediátrica | 1,4‐2,1g/dia | 10‐15 gotas, 2×/dia | 14‐21 gotas, 2×/dia |
KI, iodeto de potássio; PA, puro para análise; primeira escolha para crianças com formas leves e localizadas e para formas imunorreativas. Administrar com leite ou suco de frutas. Iniciar com 5 gotas, solução saturada ou 7 gotas, solução concentrada, 2×/dia. Aumentar 1 gota por tomada por dia até atingir a dose programada. Solicitar hemograma, bioquímica, TSH, T4L antes e após um mês de tratamento.
Itraconazol ‐ triazol de ação fungistática, atua na inibição da síntese do ergosterol da membrana celular do fungo e alcança altas concentrações no tecido cutâneo.89 Tem nível de evidência A‐II;, é a primeira escolha terapêutica pela segurança e eficácia de 90%‐100%, além da posologia conveniente, desde que não haja contraindicação.2,89 No entanto, não é a primeira escolha para tratamento pediátrico, já que existem outras opções terapêuticas eficazes e não consta em bula por falta de pesquisas nessa faixa etária, embora seu uso, off label, seja justificado nos casos moderados a graves. Atenção se manipular em solução ou xarope, devido à lipossolubilidade do itraconazol e dificuldade em medir sua biodisponibilidade, farmacodinâmica e, consequentemente, a dose real que está sendo administrada.
Cefaleia, náusea, dor abdominal, diarreia ou constipação intestinal são efeitos adversos comuns. Por ser teratogênico e embriotóxico, não deve ser utilizado em gestantes; é considerado categoria C.9 Seu metabolismo, dependente da CYP3A4, pode causar variação sérica de outros fármacos comumente usados em idosos ou estes influenciarem o nível sérico desse azol.90 Diminui o nível sérico de anticoncepcionais orais e está contraindicado em pacientes com hepatite, dislipidemia grave e insuficiência cardíaca (efeito inotrópico negativo sobre o músculo cardíaco).91 Recomenda‐se monitoração laboratorial com hemograma, bioquímica, lipidograma e provas da função hepática antes e 30 dias após o início do tratamento. Se normais, devem ser repetidos apenas após suspensão do fármaco.9
Posaconazol – segunda geração de triazol, tem bom perfil de atividade in vitro sobre S. schenckii e S. brasiliensis.77,92 No Brasil, está disponível em formulação oral líquida, na concentração de 40 mg/mL, e tem custo elevado. Doses de 600–800 mg/dia têm sido usadas em casos graves com imunossupressão, quando há intolerância ao itraconazol e após terapia endovenosa com anfotericina B. São necessários mais estudos para confirmar o benefício do tratamento, especialmente nas infecções por S. brasiliensis. Embora tenha baixa penetração no SNC, há relatos isolados de boa resposta clínica na meningite, possivelmente pelo aumento da permeabilidade da barreira hematoencefálica pela meningite.93,94
Fluconazol – não está indicado para tratamento da esporotricose, exceto na impossibilidade de uso de outros fármacos. São comuns as recaídas após suspensão da medicação.
Voriconazol – faltam estudos clínicos; os estudos in vitro demonstraram pouca inibição ao crescimento de isolados de Sporothrix spp.77,92
Cetoconazol – contraindicado em países da Europa, Austrália, China e EUA, não é recomendado para a esporotricose no Brasil.
TerbinafinaAlilamina fungicida com excelente concentração no tecido gorduroso, córnea, derme, epiderme e unhas. Interfere na síntese do ergosterol pela inibição da esqualeno epoxidase da membrana da célula fúngica, é metabolizada por diversas isoenzimas CYP, tem pouca interação com outros fármacos e, por isso, é útil nos idosos e em pacientes com comorbidades.95–97 É categoria B de risco para uso na gestação, penetra no leite materno, devendo o clínico pesar risco/benefício nesses casos.2 É medicamento de primeira escolha para casos leves a moderados nas crianças acima de 2 anos, com as doses recomendadas em bula (experiência dos autores). Pode ser usado como alternativa, se houver contraindicação absoluta ao itraconazol. Dentre os eventos adversos mais comuns estão cefaleia, náusea, distensão e dor abdominal, dispepsia, diarreia.97 Recomenda‐se cautela em pacientes com alteração hepática; pode precipitar ou exacerbar quadros preexisitentes de psoríase e lúpus eritematoso, provavelmente mediado pela exposição à radiação ultravioleta ou por influência de fatores ou características imunogenéticas.9
Anfotericina BMacrolídio poliênico que adere ao ergosterol da membrana fúngica, modificando sua permeabilidade. É cardiotóxico e nefrotóxico, sendo necessário o monitoramento da função renal e dosagem de potássio sérico. É a única medicação liberada para uso na gravidez com forma grave da doença, por não ser teratogênica.63
O Ministério da Saúde do Brasil fornece o complexo lipídico para casos graves, disseminados, ou que não responderam ao tratamento oral, via programa de micoses sistêmicas, exceto para HIV/AIDS. O ideal é administrar em regime de internação hospitalar; contudo, nos casos menos graves, é possível a infusão em regime de hospital‐dia, com aplicações diárias ou a cada duas a três vezes por semana.98 Por vezes, a associação com itraconazol ou terbinafina pode ser necessária.
DuraçãoVaria de um a 12 meses ou mais, com média de três a quatro meses na maioria das séries publicadas.2,85 Apesar de alguns autores ainda recomendarem, a manutenção do tratamento por duas a quatro semanas após a resolução das lesões é desnecessária. A identificação da cura clínica é fundamental e caracteriza‐se pela completa reepitelização, ausência de exsudação, crostas, infiltração, descamação ou eritema significativo. Nesse momento, o tratamento pode ser suspenso sem prejuízo. Fibrose, milia, cicatriz hipertrófica, eritema discreto, prurido e sensibilidade local não denotam atividade de doença.9
Perspectivas de novos fármacosHá poucos dados sobre o uso dos novos azóis na terapia de resgate, em casos refratários ao tratamento convencional.99 Isavuconazol, já aprovado no Brasil, apresenta atividade in vitro contra S. brasiliensis, porém há poucos estudos.100 Miltefosina, um análogo de fosfolipídio utilizado para tratamento de leishmaniose tegumentar e visceral, tem sido testada in vitro e apontada como possível opção terapêutica, sobretudo para pacientes sem resposta aos antifúngicos convencionais.101 Pesquisas em andamento avaliam se fitoterápicos e medicamentos antigos com outras indicações terapêuticas podem ser úteis para o tratamento da esporotricose humana, mas ainda sem perspectivas práticas.
Tratamento adjuvanteSão usados isoladamente ou associados a tratamento sistêmico, úteis para pacientes com intolerância ou contraindicação aos fármacos sistêmicos, ou baixa resposta terapêutica.102
Termoterapia – usada, mais comumente, em gestantes com manifestação clínica não complicada da esporotricose.63,103,104 Baseia‐se na intolerância térmica das espécies de Sporothrix a temperaturas superiores a 39°C.3 A fonte de calor pode ser bolsa de água quente, fonte de infravermelho ou outro método, com objetivo de atingir temperatura de 42°C‐43°C, durante 20 a30 minutos, três vezes ao dia.105 Promove a permeação de fármaco sistêmico, por meio da vasodilatação, se usados concomitantemente.
Criocirurgia – realizada com nitrogênio líquido em equipamento apropriado, com ponteira de spray, sem contato, em dois ciclos de congelamento/descongelamento, mensalmente, até a cura clínica. O tempo de congelamento depende do tamanho e da espessura da lesão, aproximadamente 10 a 30 segundos (Material Suplementar ‐ vídeo). A quantidade de sessões depende da evolução clínica. Útil para terapêutica precoce das lesões verrucosas e vegetantes. É possível que aumente a penetração dos antifúngicos sistêmicos na lesão cutânea devido à necrose epidérmica e à consequente exposição dos antígenos fúngicos ao sistema imune do hospedeiro, diminuindo o tempo de tratamento.106
Eletrocirurgia – para casos refratários, constitui recurso de exceção, mantendo‐se o antifúngico sistêmico no perioperatório e no pós‐operatório para evitar a disseminação.107 Executado por profissional especializado e associado à curetagem, constitui método fácil e simples, mantendo a função e estética local. Pode ser indicada nos locais em que a criocirurgia oferece maior risco de complicações, como nariz e orelhas, por exemplo.
Outros – drenagem ou punção de lesões encistadas/abscedidas e curetagem isolada de lesões verruco‐crostosas podem auxiliar no tratamento das lesões cutâneas por reduzirem o pool parasitário, embora não haja estudos sobre esses métodos. Há relatos do uso bem‐sucedido da terapia fotodinâmica, em monoterapia ou associada a doses intermitentes de itraconazol.108
Recomendações em situações especiais:
- 1)
Iniciar tratamento das formas clínicas localizadas em pacientes imunocompetentes com a menor dose de cada fármaco e aguardar, pelo menos um mês, pela evolução clínica. Raramente, doses maiores de itraconazol ou terbinafina são necessárias. Se o paciente não evolui bem, é melhor associar outros fármacos ou outra modalidade terapêutica. Do mesmo modo, iniciar com a menor dose eficaz de KI. Doses iniciais maiores aumentam a toxicidade e não são garantia de rapidez da resposta terapêutica.
- 2)
Em casos clássicos de esporotricose com baixa resposta terapêutica, questionar sobre uso de medicações que reduzem a absorção de itraconazol. Se possível, dosar o nível sérico do fármaco, pois é medicação de absorção errática. O uso de inibidores de bomba de prótons é um exemplo, pois reduzem a absorção do itraconazol. Verificar as medicações concomitantes na lista de interações do itraconazol. Considerar, também, se o antifúngico foi manipulado ou se houve baixa adesão.
- 3)
Caso haja interações medicamentosas ou contraindicações ao itraconazol, terbinafina ou KI são opções eficazes de tratamento. Ambos são bem tolerados e têm baixo potencial de interações com outros medicamentos.
- 4)
Dar preferência ao tratamento de crianças com terbinafina e KI.
- 5)
Cuidado ao medicar mulheres em idade fértil, pois os antifúngicos sistêmicos podem diminuir a concentração do contraceptivo oral. Aconselha‐se o uso adicional de métodos contraceptivos de barreira.
- 6)
Em decorrência do potencial teratogênico dos azóis e pela contraindicação ao uso de KI, aconselha‐se, no período gestacional e de aleitamento, a utilização de métodos físicos adjuvantes para o tratamento; a anfotericina B é reservada apenas para os casos graves.2,102,104
- 7)
Nas lesões osteoarticulares, a dose inicial de itraconazol deve ser 400 mg/dia durante seis meses.2,46,109,110 Após esse período, pode‐se suspender se houver cura, exceto se HIV/AIDS, quando o medicamento deve ser mantido até que CD4+> 200 células/μL. Se ainda houver sinais ou sintomas, mantém‐se com 200–400 mg/dia por mais seis meses (experiência pessoal dos autores). Eventualmente, é necessário sinovectomia.2,111
- 8)
Ainda não há consenso quanto ao medicamento, dose e duração do tratamento da esporotricose pulmonar, que deve ser guiado pela gravidade da apresentação clínica. Casos leves podem ser tratados com itraconazol oral e mais graves com anfotericina B, seguido por itraconazol. A maioria preconiza duração de 6‐12 meses.2,56,112,113
- 9)
Intervenção cirúrgica é recomendada para pacientes com envolvimento pulmonar localizado e/ou que exibem características radiológicas de doença cavitária.56,112 Resultados superiores são obtidos com cirurgia precoce associada à anfotericina B, quando comparados ao uso de medicamentos isoladamente.56,113,114
- 10)
Administração de corticosteroide oral, como prednisona, nas formas imunorreativas sintomáticas, tem papel importante na neutralização da resposta imune exacerbada; é prescrito na dose de ataque de 20 a 40 mg/dia, ou 0,5 mg/kg/dia, desde que não exceda 40 mg/dia. Doses baixas, 20 mg/dia, geralmente são suficientes. É controversa a forma de retirada do corticosteroide, que pode ser feita em 7‐14 dias, ou diminuir gradativamente para evitar recidiva.63,74,75 Eritema nodoso requer desmame mais lento. Casos leves e localizados, oligossintomáticos, podem ser tratados com antifúngico associado a anti‐inflamatório não esteroide (AINE) ou apenas com KI, por seu mecanismo imunomodulador.
- 11)
Pode haver resposta paradoxal com exacerbação do quadro clínico, incluindo o aparecimento de novas lesões, no início da terapia antifúngica. Esse fenômeno se deve ao processo inflamatório decorrente da liberação de antígenos e consequente resposta imune do hospedeiro. O tratamento deve ser, preferencialmente, com antifúngico associado a AINE ou iodeto de potássio isoladamente, evitando‐se os corticosteroides, nesses casos, pelo risco de piorar a infecção ou mesmo pelo potencial de invasão, sobretudo óssea, nas lesões de extremidades. Reservar corticosteroides para formas imunorreativas moderadas a graves, sempre associado à terapia antifúngica. O surgimento de novos nódulos no trajeto linfático pode não significar piora, mas apenas um mecanismo do organismo para eliminar a doença.
- 12)
O uso de corticosteroides tópicos é contraindicado nas lesões de esporotricose, pois reduzem a imunidade local e promovem crescimento centrífugo ou aprofundamento da lesão. Evitar medicações tópicas porque além de não terem efeito, podem causar dermatite de contato. Lavar a ferida com água e sabão, sem muito atrito, é suficiente; não é necessário o uso de antissépticos tópicos. Ocluir as lesões abertas para evitar miíase, de preferência trocando o curativo duas vezes ao dia. Óleo mineral ou vaselina líquida podem ser utilizados no curativo para que a gaze não fique aderida à ferida. Se houver sinais de infecção bacteriana secundária, dar preferência ao uso de antibiótico sistêmico.
- 13)
Controle de doenças crônicas, redução da ingestão de álcool e interrupção de esteroides ou anti‐TNF são medidas importantes em todas as formas sistêmicas da esporotricose, quando possível.48
- 14)
Tentar reduzir a dose dos imunossupressores e, se possível, suspender o uso de anti‐TNFs em pacientes com doenças autoimunes. Para isso, aconselha‐se estabelecer boa comunicação entre as equipes médicas envolvidas. Reduzir a dose de imunossupressores em transplantados pode ser a chave para o sucesso terapêutico da esporotricose.48,100
- 15)
Os níveis séricos de inibidores da calcineurina (tacrolimus e ciclosporina) aumentam significativamente após o início do itraconazol, por isso o monitoramento das concentrações séricas deve ser rigoroso.100
- 16)
Anfotericina B é o principal medicamento para tratar a esporotricose sistêmica grave, visceral e com risco de vida, embora a resposta terapêutica não seja tão favorável como em outras micoses sistêmicas.2,48,98,115 Geralmente, a manutenção do tratamento após a administração de anfotericinaB é feita com itraconazol pelo período de 12 meses.
- 17)
Formulações lipídicas da anfotericina B são uma alternativa mais tolerável em relação à convencional, contudo não está comprovada sua superioridade em termos de eficácia para esporotricose.
- 18)
Pacientes com HIV/AIDS parecem ter um prognóstico pior, sendo necessárias doses elevadas de itraconazol, anfotericina B e hospitalização devido à extensão das lesões e/ou comorbidades.42,98,116,117
- 19)
Atenção à interação medicamentosa entre itraconazol e antirretrovirais, como efavirenz, ritonavir e darunavir.48 O impacto da implementação da terapia antirretroviral (TARV) durante a esporotricose é desconhecido e o melhor momento para seu início é incerto. Devido à predisposição à meningite na SIRI sugere‐se atrasar o início da TARV, em analogia à tuberculose e criptococose, nos pacientes considerados como de alto risco: acometimento neurológico, contagem baixa de células‐T CD4+e carga viral alta.118
- 20)
As formulações lipídicas de anfotericina B são a primeira escolha na neuroesporotricose, seguida pela manutenção com itraconazol por 12 meses.2 A suspensão do tratamento depende da remissão dos sinais e sintomas neurológicos, devendo‐se monitorar a celularidade do líquor a cada 3‐6 meses, até atingir níveis normais (experiência dos autores).
- 21)
Risco de recidiva da esporotricose meníngea é alto nesses pacientes, por isso é prudente manter terapia supressiva antifúngica ou suspender após contagem de células‐T CD4+> 200 células/μL em pelo menos duas aferições distintas, com intervalo de seis meses (experiência dos autores).118 Geralmente, indica‐se terapia supressiva prolongada ou mesmo vitalícia, com itraconazol na dose de 200 mg/dia, quando a imunossupressão não puder ser controlada, tanto no acometimento meníngeo quanto disseminado.2,49,119,120
Habitualmente, o prognóstico é bom, com cura, ainda que mais lenta nos pacientes com imunossupressão e outras comorbidades. As sequelas podem variar desde as mais frequentes, como cicatrizes hiper ou hipopigmentadas, hipertróficas ou queloideanas, até outras mais raras, como anquilose ou amputação de extremidades nos casos de envolvimento osteoarticular, perda de substância tecidual, como cartilagem auricular e nasal, ou mesmo perfuração de septo.37,45,121 Alguns pacientes vão precisar de cirurgia reparadora por sequela da doença.
Durante a epidemia zoonótica, foram observados casos de regressão espontânea.
O óbito pode ser um desfecho nos casos extremos de disseminação.42,117 O prognóstico desfavorável é mais frequente em pessoas com HIV/AIDS e nos moradores de locais cujo acesso aos serviços de saúde e às condições socioeconômicas é precário.115
ProfilaxiaSporothrix spp. estão no ambiente, portanto, medidas de controle e profilaxia devem ser adotadas, contemplando o conceito de saúde única, sobretudo em áreas de maior prevalência, com grande concentração de pessoas com pouco acesso à educação, saúde e condições sanitárias.122 Entre elas estão o uso de luvas, roupas e calçados adequados para manuseio de plantas e de animais com lesões cutâneas e/ou mucosas ou na realização de trabalhos rurais, limpeza periódica de quintais, remoção de restos de materiais de construção e detritos de matéria orgânica em decomposição. Deve‐se incentivar a guarda responsável dos animais, tratando os doentes, separando‐os dos demais animais e humanos da casa, até obter a cura. Procurar castrar os gatos, para diminuir sua ida à rua para caça, briga, passeio ou acasalamento. Encontrar meios viáveis de cremação dos animais mortos para evitar que o fungo se perpetue na natureza. Oferecer, ativamente, informações sobre o modo de transmissão e profilaxia da doença aos tutores dos animais doentes, visando estimular o tratamento assistido sem abandono.3 O abandono de animais e a negligência aos seus cuidados contribuem para a perpetuação e expansão da epidemia.
ConclusõesNeste artigo, os autores atualizaram as apresentações clínicas e o diagnóstico da esporotricose, bem como as recomendações terapêuticas, com base nos novos desafios encontrados face à epidemia zoonótica no Brasil.
Suporte financeiroNenhum.
Contribuição dos autoresRosane Orofino‐Costa idealizou e coordenou o projeto e participou de todas as etapas até a finalização do mesmo. Dayvison Francis Saraiva Freitas, Priscila Marques de Macedo e Rodrigo de Almeida‐Paes, lideraram e coordenaram grupos de trabalho e participaram de todas as etapas até a aprovação final.
Dayvison Francis Saraiva Freitas gravou o vídeo, com voz de Rosane Orofino‐Costa. Claudia Elise Ferraz, John Verrinder Veasey, Dayvison Francis Saraiva Freitas, Rosane Orofino‐Costa, Priscila Marques de Macedo, Andréa Reis Bernardes‐Engemann, Rodrigo de Almeida‐Paes e Leonardo Quintella forneceram as fotos clínicas, laboratoriais e de imagem.
Andréa Reis Bernardes‐Engemann foi responsável pela organização das referências e Anderson Messias Rodrigues pelas figuras esquemáticas.
Rosane Orofino‐Costa, Dayvison Francis Saraiva Freitas, Andréa Reis Bernardes‐Engemann, Anderson Messias Rodrigues, Carolina Talhari, Claudia Elise Ferraz, John Verrinder Veasey, Leonardo Quintella, Maria Silvia Laborne Alves de Sousa, Rodrigo Vettorato, Rodrigo de Almeida‐Paes e Priscila Marques de Macedo, participaram da coleta de dados, redação e revisões do texto completo até a aprovação final. Todos os autores leram, concordaram e aprovaram a versão final.
Conflito de interessesNenhum.
À Vanessa Mafra Xavier Salgado, pelo auxílio com a bibliografia; ao Raphael da Silva Roma, pela edição do vídeo; e aos pacientes, por cederem, gentilmente, suas imagens.
Como citar este artigo: Orofino‐Costa R, Freitas DF, Bernardes‐Engemann AR, Rodrigues AM, Talhari C, Ferraz CE, et al. Human sporotrichosis: Recommendations from the Brazilian Society of Dermatology for the clinical, diagnostic and therapeutic management. An Bras Dermatol. 2022;97:757–77.
Trabalho realizado no Departamento de Micologia da Sociedade Brasileira de Dermatologia, 2021‐2022, Rio de Janeiro, RJ, Brasil.










![Fluxograma para o diagnóstico laboratorial da esporotricose humana, com estimativa de tempo para o processamento de cada método. GMS, prata metenamina de Gomori‐Grocott; CMA, ágar fubá; ’C’, fonte de carbono; ITS, espaçador transcrito interno; PCR, reação em cadeia da polimerase; qPCR, PCR quantitativa em tempo real; RCA, amplificação em círculo rolante; AFLP, amplified fragment length polymorphism; RAPD, random amplification of polymorphic DNA. Modificado de Orofino‐Costa et al., 2017.[9]. Fluxograma para o diagnóstico laboratorial da esporotricose humana, com estimativa de tempo para o processamento de cada método. GMS, prata metenamina de Gomori‐Grocott; CMA, ágar fubá; ’C’, fonte de carbono; ITS, espaçador transcrito interno; PCR, reação em cadeia da polimerase; qPCR, PCR quantitativa em tempo real; RCA, amplificação em círculo rolante; AFLP, amplified fragment length polymorphism; RAPD, random amplification of polymorphic DNA. Modificado de Orofino‐Costa et al., 2017.[9].](https://static.elsevier.es/multimedia/26662752/0000009700000006/v4_202410140645/S2666275222002144/v4_202410140645/pt/main.assets/thumbnail/gr8.jpeg?xkr=ue/ImdikoIMrsJoerZ+w99UWGL/RPJZyNYV9edvxfE4=)
