A doença de Paget extramamária (DPEM) pode estar associada a várias outras neoplasias malignas.1 A relação entre DPEM e neoplasias malignas secundárias tem sido frequentemente relatada. Em decorrência dos riscos aumentados de outras neoplasias malignas, recomenda‐se o acompanhamento prolongado para DPEM e avaliação para neoplasias malignas. Pacientes com DPEM da vulva e regiões perianais apresentam maior risco de neoplasias malignas derivadas dos sistemas geniturinário e colorretal.2 Entretanto, outras neoplasias malignas também podem se desenvolver. Apenas alguns casos de DPEM associada a linfomas foram relatados anteriormente.1,3 O presente relato descreve um paciente que desenvolveu linfoma de células B de alto grau durante o seguimento de DPEM invasiva com metástases linfonodais.
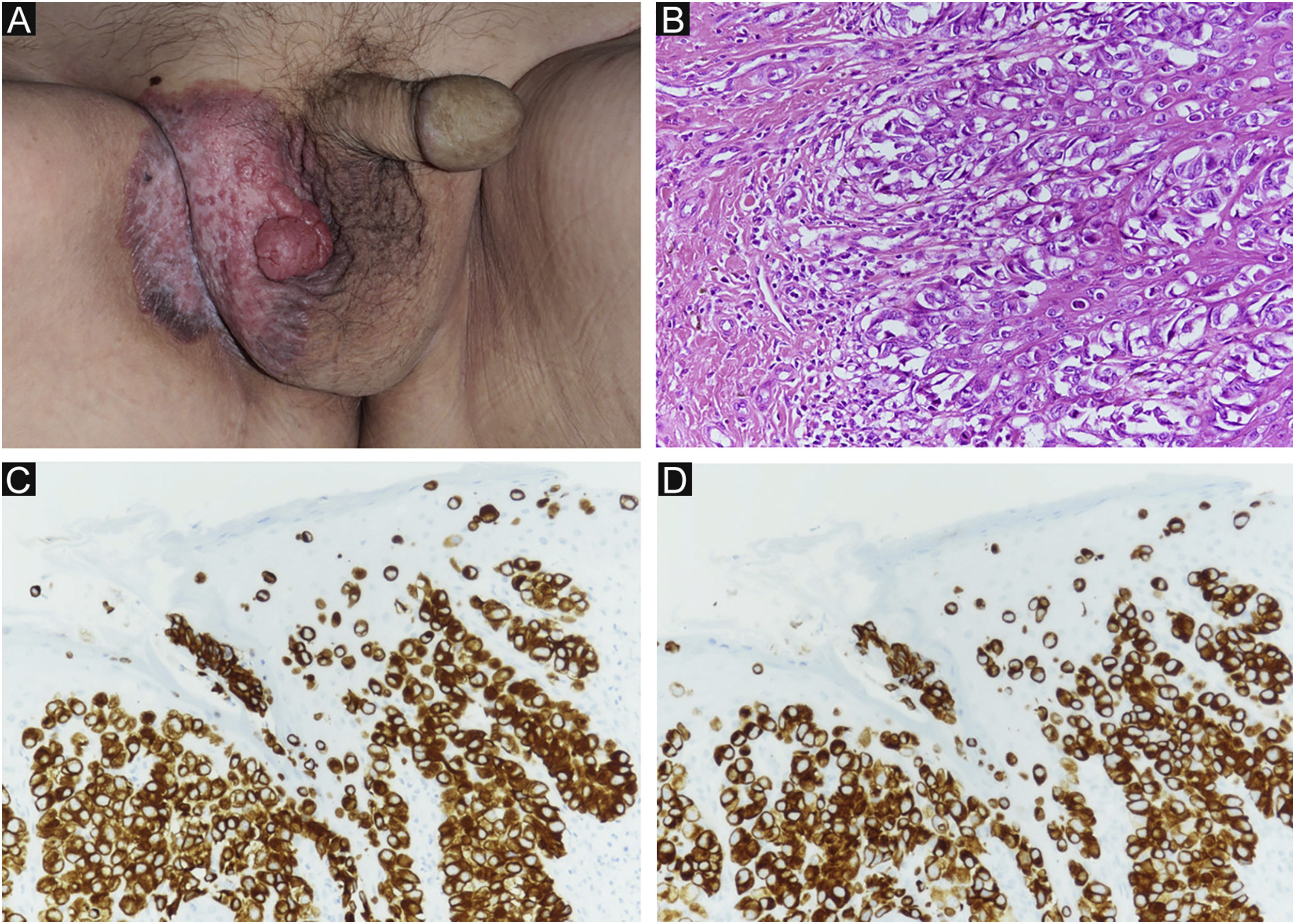
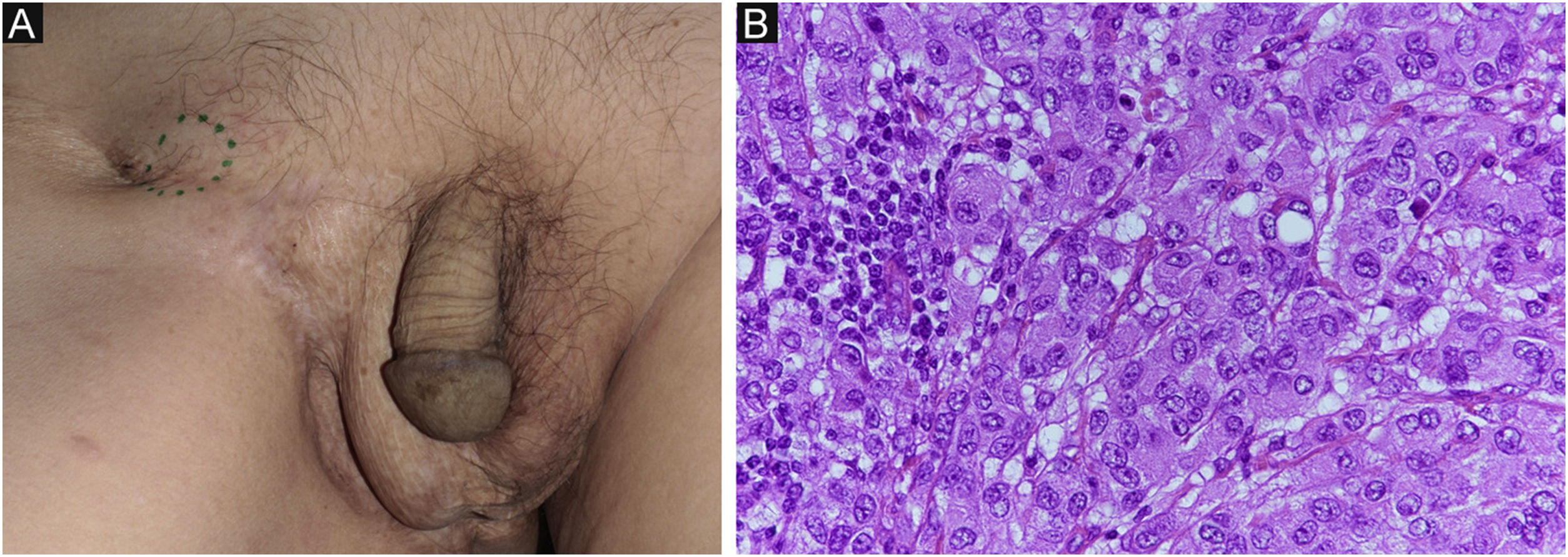
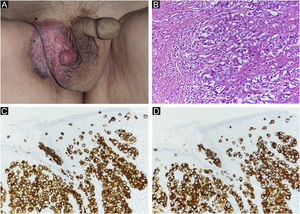
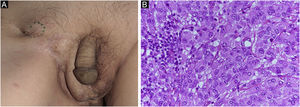
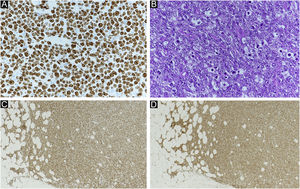
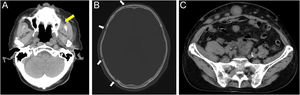
Relato do casoPaciente do sexo masculino, 80 anos, foi encaminhado ao departamento dos autores em decorrência de DPEM in situ da região escrotal (fig. 1A). A tomografia computadorizada (TC) pré‐operatória não revelou metástases. Foi realizada ressecção tumoral com margem de 10mm e enxertia de pele. A histopatologia do espécime excisado revelou DPEM invasiva (fig. 1B‐D). Entretanto, as margens horizontais e verticais estavam livres de neoplasia. O paciente realizou seguimento ambulatorial. Aproximadamente dois anos após a cirurgia, observou‐se linfadenopatia inguinal direita (fig. 2A), sem lesões cutâneas evidentes. A biópsia de linfonodo revelou metástases da DPEM. Foi realizada dissecção linfonodal nas áreas inguinal e da artéria ilíaca externa. Histopatologicamente, 7/12 linfonodos apresentaram evidências de metástases de DPEM invasiva (fig. 2B). Radioterapia (RT) pós‐operatória foi administrada e o paciente recebeu dose total de 46Gy.
(A) Achados clínicos de DPEM primária. Erupção cutânea e lesões elevadas a região escrotal direita. (B) DPEM primária: as células neoplásicas proliferam individualmente e em arranjo alveolar na camada basal da epiderme e infiltram a derme. As células tumorais têm vesículas de cor pálida e os núcleos têm formato irregular e distribuição desigual (Hematoxilina & eosina, 200×). (C) Imunomarcação positiva para CK7 (CK7 200×). (D) Imunomarcação positiva para CAM2.5 (CAM2.5, 200×).
Um mês após a RT, a TC revelou linfonodos intraperitoneais diminuídos. No entanto, foram observadas linfadenopatias em gânglios para‐aórticos e supraclaviculares esquerdos. O paciente não desejava receber RT adicional ou quimioterapia sistêmica e optou por receber tratamento paliativo de suporte. Posteriormente, foram observadas disseminação peritoneal e múltiplas metástases linfonodais intra‐abdominais.
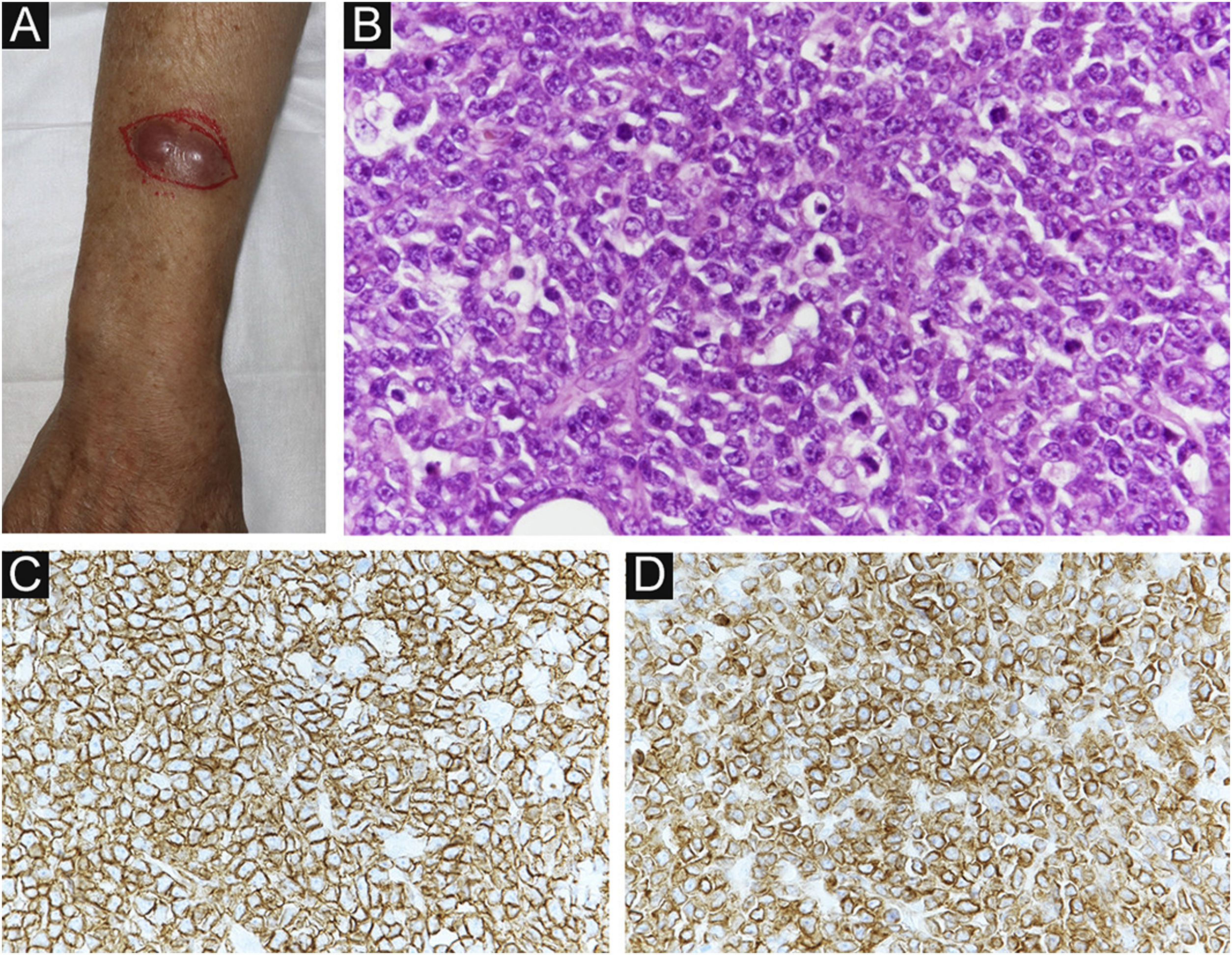
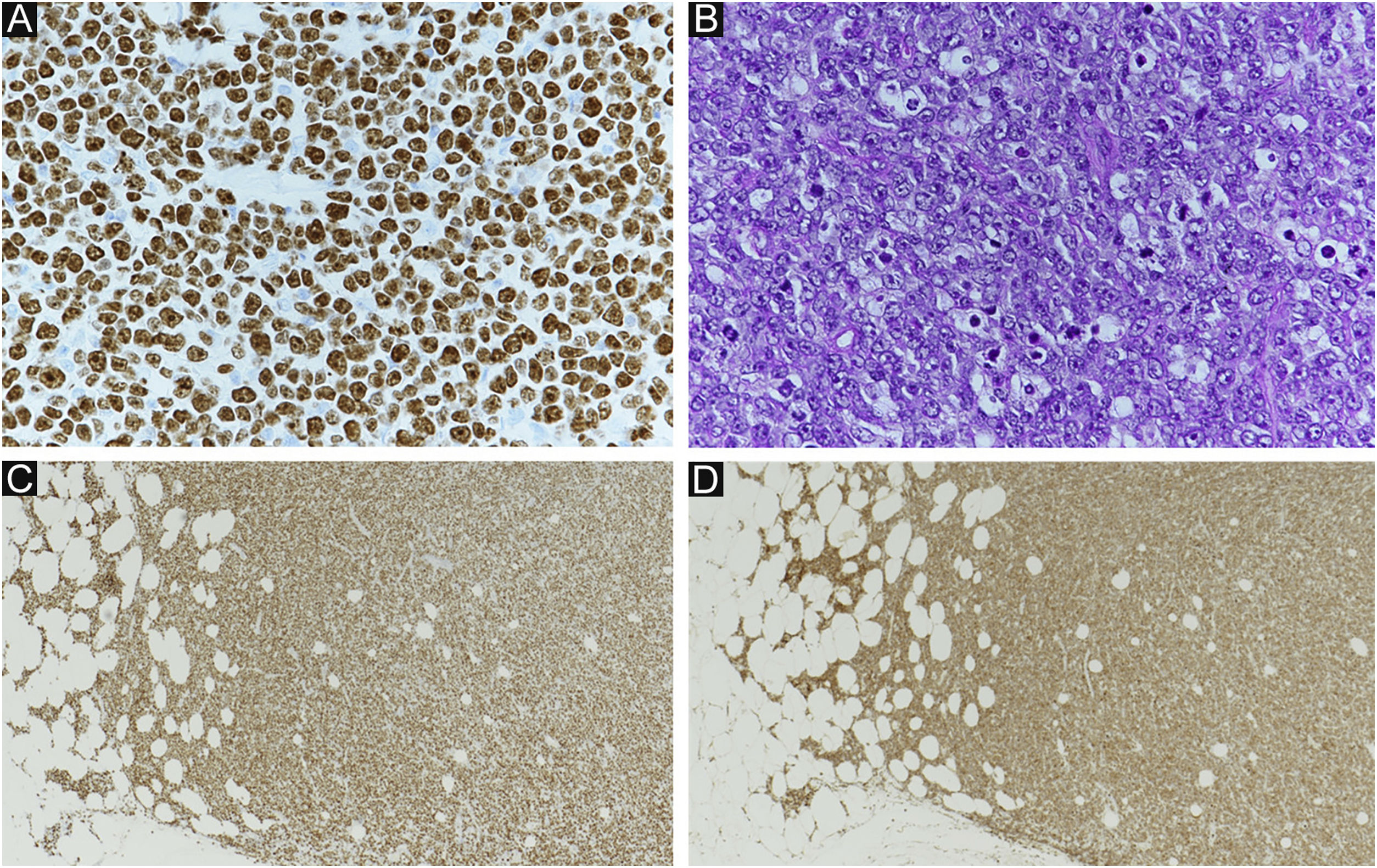
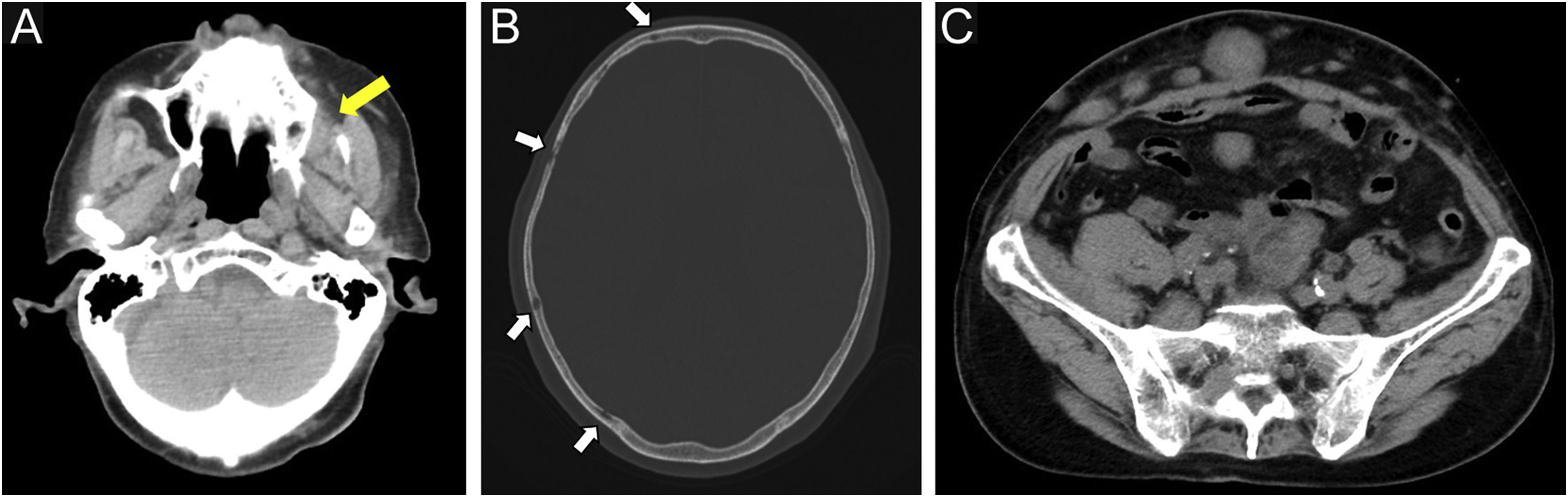
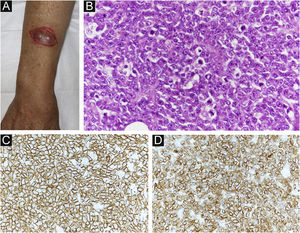
Quatro meses após a RT, observou‐se tumoração subcutânea dolorosa no antebraço direito (fig. 3A). O tumor foi ressecado para alívio da dor. Histopatologicamente, observou‐se proliferação difusa de pequenas células atípicas arredondadas (fig. 3B). Tanto CD20 quanto CD79a, que são marcadores específicos para a linhagem B de células linfoides, foram positivos na imuno‐histoquímica (fig. 3C‐D). Ki‐67 estava significantemente elevado a 99% (fig. 4A). Além disso, foi observado aspecto de “céu estrelado” (observaram‐se macrófagos fagocitando fragmentos nucleares em meio à proliferação de linfócitos atípicos; fig. 4B). Esses achados indicavam neoplasia maligna de alto grau. O exame patológico confirmou linfoma de células B de alto grau. A imuno‐histoquímica mostrou positividade para MYC e BCL‐2, consistente com linfoma de dupla expressão (fig. 4C‐D). Uma semana depois, o paciente deu entrada no departamento por deterioração de seu estado geral. A TC revelou achados sugestivos de lesões no seio maxilar, crânio e lesões sistêmicas múltiplas (fig. 5). O paciente recebeu tratamento paliativo e progrediu a óbito 12 dias após a internação.
(A) Achados clínicos: observa‐se tumoração subcutânea que era dolorosa no antebraço direito. (B) Proliferação difusa de pequenas células arredondadas atípicas na derme profunda (Hematoxilina & eosina, 200×). (C) Imunomarcação positiva para CD20 (MYC, 400×). (D) Imunomarcação positiva para CD79a (BCL‐2, 400×).
(A) Índice Ki‐67: 99%. (B) Aspecto de “céu estrelado” (macrófagos fagocitando fragmentos nucleares em meio à proliferação de linfócitos atípicos). (A e B) mostram linfoma de alto grau. (C) Imunomarcação positiva para MYC (MYC, 40×). (D) Imunomarcação positiva para BCL‐2 (BCL‐2, 40×). (C e D) mostram achados de linfoma de dupla expressão.
O prognóstico da DPEM, neoplasia maligna intraepidérmica, é favorável na maioria dos casos. No entanto, o prognóstico da DPEM invasiva é ruim, especialmente em casos de invasão linfovascular.4 Metástases linfonodais são fator prognóstico importante.5
Outros tumores primários podem se desenvolver de modo secundário à DPEM. A incidência de neoplasias malignas secundárias é supostamente alta (8,6%‐42%).2,6–8 DPEM invasiva está associada a maior risco de neoplasias malignas secundárias do que DPEM in situ. Pacientes com DPEM invasiva têm risco 50% maior de desenvolver neoplasias malignas secundárias após o diagnóstico original.1 Esse risco permanece significantemente elevado ao longo do tempo. Portanto, o exame minucioso de outros tumores durante o seguimento é recomendado em pacientes com DPEM.8
Tem sido frequentemente relatado que a DPEM está associada a vários tumores malignos.1,2,8,9 Em particular, foi relatado que há risco aumentado de tumores geniturinários e colorretais secundários em pacientes com DPEM das regiões vulvar e perianal.2
Kiltos et al.9 conduziram um estudo de análise de banco de dados nos Estados Unidos e relataram que os cânceres gastrintestinal, de mama e urogenital são as neoplasias malignas secundárias mais comuns em pacientes com doença de Paget vulvar invasiva, e que o risco de desenvolver neoplasias malignas secundárias é maior nesses pacientes do que na população em geral (controles). Os autores também relataram que a frequência de neoplasias malignas secundárias do trato gastrintestinal, trato urinário, trato genital, sangue e pele é maior em pacientes com DPEM vulvar invasiva do que na população em geral. Karam et al.1 analisaram a razão de prevalência padronizada para o desenvolvimento de neoplasias malignas secundárias após o diagnóstico inicial de DPEM invasiva e relataram que a razão observada para a esperada (taxa observada/taxa esperada) para linfoma era ≥ 1, embora nenhuma diferença significante fosse aparente. Entretanto, existem apenas alguns relatos de DPEM associada a linfoma.1,3 Além disso, nenhum estudo forneceu descrição detalhada.
No presente caso, as linfadenopatias em torno da artéria ilíaca externa direita foram consideradas metástases de DPEM invasiva. No entanto, as metástases distantes subsequentes provavelmente eram linfoma. O rápido aumento do tecido subcutâneo abdominal, do seio maxilar e do osso do crânio eram sugestivos de comprometimento por linfoma.
No presente caso, a imunomarcação para MYC e BCL‐2 mostrou achados positivos. A coexpressão de MYC/BCL‐2 sem rearranjos subjacentes é um novo indicador de prognóstico adverso, denominado linfoma de dupla expressão.10 Esse paciente apresentava neoplasia maligna avançada, e o índice Ki‐67 estava significantemente elevado a 99%. A doença era altamente maligna e progredia rapidamente.
DPEM invasiva também apresenta metástases linfáticas e pode ser difícil de diferenciar de linfoma maligno, como observado no presente caso. O diagnóstico de linfoma maligno de células B de alto grau foi estabelecido pela primeira vez com base em amostra de lesão cutânea metastática ressecada. Essa condição patológica afeta significantemente o tratamento, o prognóstico e a condição sistêmica dos pacientes.
Os autores acreditam que pacientes com DPEM invasiva necessitam de seguimento, considerando a possibilidade de desenvolvimento de tumores malignos que podem influenciar o prognóstico, além de neoplasias malignas geniturinárias e colorretais.
Suporte financeiroNenhum.
Contribuição dos autoresMisato Ueda: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta terapêutica dos casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Makoto Omori: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta terapêutica de casos estudados; revisão crítica do manuscrito.
Ayumi Sakai: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação intelectual em conduta terapêutica de casos estudados; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Ueda M, Omori M, Sakai A. Invasive extramammary Paget's disease with lymph node metastases and high‐grade B‐cell lymphoma. An Bras Dermatol. 2023;98:424–8.
Trabalho realizado no Departamento de Cirurgia Plástica, Yodogawa Christian Hospital, Kunijima, Osaka, Japão.