A doença de Hailey‐Hailey (DHH) é genodermatose rara descrita em 1939, com padrão de herança autossômica dominante, caracterizada pelo comprometimento da adesão entre os queratinócitos epidérmicos. A DHH tem prevalência estimada em 1/50.000, sem predileção de gênero ou raça; ela decorre de mutação em heterozigose do gene ATP2C1, que codifica a proteína transmembrânica hSPA1C, presente em todos os tecidos, com expressão preferencial nos queratinócitos. Mutações do gene ATP2C1 acarretam modificação da síntese de proteínas juncionais, levando a acantólise. Habitualmente, a DHH tem início na idade adulta, com casos isolados nos extremos da vida. Ela se manifesta com lesões vesicobolhosas, principalmente nas áreas flexurais, que evoluem com erosões e crostas. As lesões crônicas podem formar placas vegetantes ou verrucosas; prurido, sensação de queimação e dor são frequentes. O curso clínico evolui com períodos de remissão e exacerbação, geralmente desencadeadas por umidade, fricção, calor, trauma e infecções secundárias. O diagnóstico baseia‐se em critérios clínicos e histopatológicos: acantólise suprabasal acentuada, com queratinócitos frouxamente unidos, dando o aspecto de “muro dilapidado”, com células disceratósicas de permeio. A acantólise acomete a epiderme e poupa o epitélio dos anexos, o que auxilia no diagnóstico diferencial com o pênfigo vulgar. A imunofluorescência direta é negativa. Os principais diagnósticos diferenciais são: doença de Darier, pênfigo vegetante, intertrigo, dermatite de contato e psoríase invertida. Não há cura para a DHH; o tratamento é desafiador, incluindo medidas para controle do calor, suor e fricção, medicamentos tópicos (corticosteroides, inibidores da calcineurina, antibióticos), sistêmicos (antibióticos, corticosteroides, imunossupressores, retinoides e imunobiológicos) e procedimentos tais como toxina botulínica, laser e cirurgia. Faltam ensaios clínicos controlados para respaldar a escolha do melhor tratamento.
A doença de Hailey‐Hailey (DHH), também denominada pênfigo benigno familiar, é genodermatose rara, com padrão de herança autossômica dominante, caracterizada pelo comprometimento da adesão entre os queratinócitos epidérmicos.1 Como consequência, ocorre a formação de vesículas, bolhas, erosões e maceração principalmente nas áreas intertriginosas, de maneira crônica e recidivante. O diagnóstico baseia‐se em características clínicas e histopatológicas, e o tratamento é desafiador.2
Este artigo de Educação Médica Continuada oferece uma revisão sobre patogênese, quadro clínico, métodos diagnósticos e opções terapêuticas para a DHH, que tanto impacta a qualidade de vida dos pacientes.
HistóricoA história da DHH remonta a 1939, quando a afecção foi descrita pela primeira vez pelos irmãos dermatologistas norte‐americanos Hugh Edward e William Howard Hailey. Eles identificaram um distúrbio bolhoso familiar único, caracterizado por pápulas eritematosas, exsudativas e crostosas que apareciam em áreas intertriginosas do corpo.3
Os irmãos Hailey publicaram dois estudos de caso envolvendo membros da família afetados pela doença. Um ano depois, os mesmos autores descreveram 22 casos de duas famílias distribuídas por quatro gerações com características semelhantes.3 Alguns autores chegaram a considerar a nova afecção descrita uma variante da doença de Darier ou de epidermólise bolhosa,4 o que foi elucidado após o entendimento molecular da fisiopatologia. Inicialmente, eles a denominaram “pênfigo benigno familiar” em virtude da semelhança com o pênfigo vulgar. No entanto, o termo “doença de Hailey‐Hailey” ganhou popularidade e é amplamente utilizado para se referir a essa enfermidade.5
EpidemiologiaA prevalência da DHH é desconhecida, porém, estima‐se que seja similar à da doença de Darier, que é prevista por volta de 1/50.000, sem predileção de sexo ou raça.1 A ocorrência da doença acontece em dois picos: no fim da adolescência e entre a terceira e quarta décadas de vida. Existem casos relatados na infância com crianças de 3 e 5 anos (esta com mutação documentada do gene ATP2C1), com padrão histopatológico sugestivo.6–8
EtiopatogeniaA DHH ocorre por mutação em heterozigose do gene ATP2C1,6 situado no braço longo do cromossomo 3 (3q21‐q24),9 que codifica a proteína hSPA1C.1 É genodermatose autossômica dominante com penetrância completa e expressividade variável.1 Em 15%‐30% dos casos, essa mutação é esporádica – os portadores da doença não apresentam antecedente familiar.10 A mutação em homozigose é letal em animais.11
Além do padrão de herança mendeliana, mutações pós‐zigóticas podem afetar um dos alelos de um embrião normal provocando lesões exclusivamente segmentares – mosaicismo tipo 1 – ou promover perda do alelo normal de um embrião que possui a mutação germinativa em heterozigose, resultando em manifestação segmentar precoce da doença posteriormente associada ao quadro clássico de Hailey‐Hailey – mosaicismo tipo 2.12 Pacientes com doença segmentar tipo 1 apresentam risco de transmitir para a prole quando há mosaicismo gonadal. Já no mosaicismo tipo 2, a chance de transmissão da mutação é de 50%.13
Já foram descritas pelo menos 250 mutações14 do tipo missense, nonsense, frameshift e splice‐site.15 Acredita‐se que alterações do tipo nonsense determinem a redução ou ausência da síntese de hSPA1C por degradação do RNAm (haploinsuficiência).15 Já as mutações missense podem provocar alterações da estrutura, localização e estabilidade da proteína hSPCA1, com diminuição de sua expressão e funcionalidade.15
A proteína transmembrânica hSPA1C ocorre em todos os tecidos, com expressão preferencial nos queratinócitos.16 Atua como uma ATPase transportadora de Ca2+ e Mn2+ no aparelho de Golgi promovendo influxo do cálcio para essa organela e redução de seu nível citoplasmático.11 Mutações do gene ATP2C1 alteram esse gradiente levando ao acúmulo citosólico de Ca2+ com subsequente: a) modificação da síntese de proteínas juncionais levando à acantólise; b) redução da adenosina trifosfato mitocondrial, com desorganização das fibras de actina que compõem a adherens junction; c) aumento do estresse oxidativo e de espécies reativas de oxigênio, afetando a proliferação e diferenciação dos queratinócitos.1
O comprometimento exclusivo da pele na DHH parece estar relacionado com a expressão predominante da proteína hSPCA1 nos queratinócitos, enquanto os demais tecidos apresentam outras proteínas transportadoras de Ca2+.16 A alteração da homeostasia do cálcio também interfere na diferenciação dos queratinócitos e na expressão de pró‐filagrina e lipídeos, favorecendo a perda da integridade da barreira cutânea.1 Estudos recentes sugerem que mutações conformacionais da proteína hSPCA1 aumentam sua afinidade por Ca2+ e reduzem seletivamente o transporte de Mn2+, contribuindo para a patogênese da doença.16
Btadini et al. também avaliaram a expressão de ATP2C1 nos fibroblastos de pacientes com DHH após exposição ao calor. Os autores demonstraram expressão reduzida de RNAm de ATP2C1 nos fibroblastos obtidos da pele doente em comparação com os fibroblastos normais, sugerindo que uma resposta inadequada ao aumento de temperatura possa contribuir para a perda da homeostasia celular em áreas intertriginosas.17
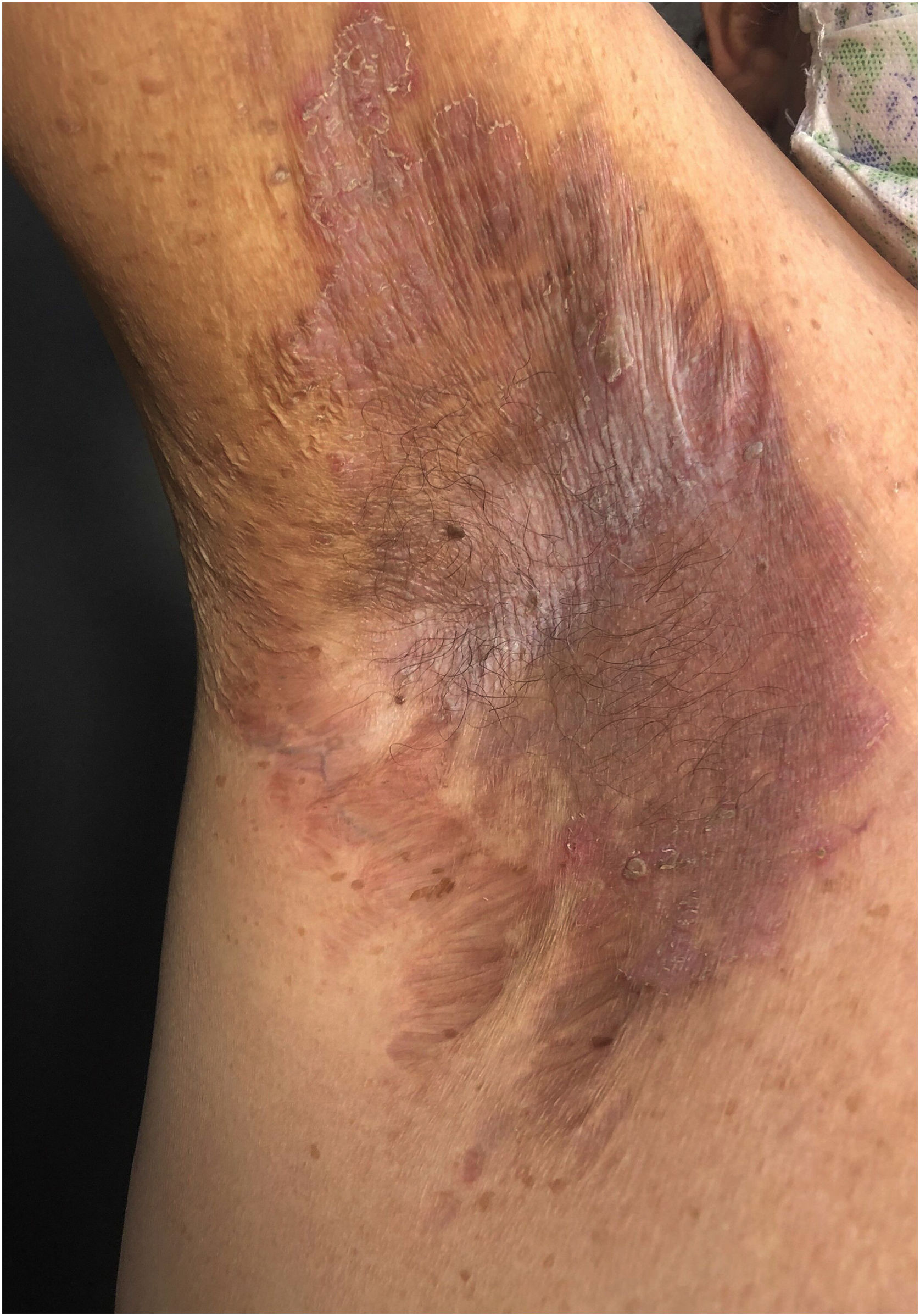
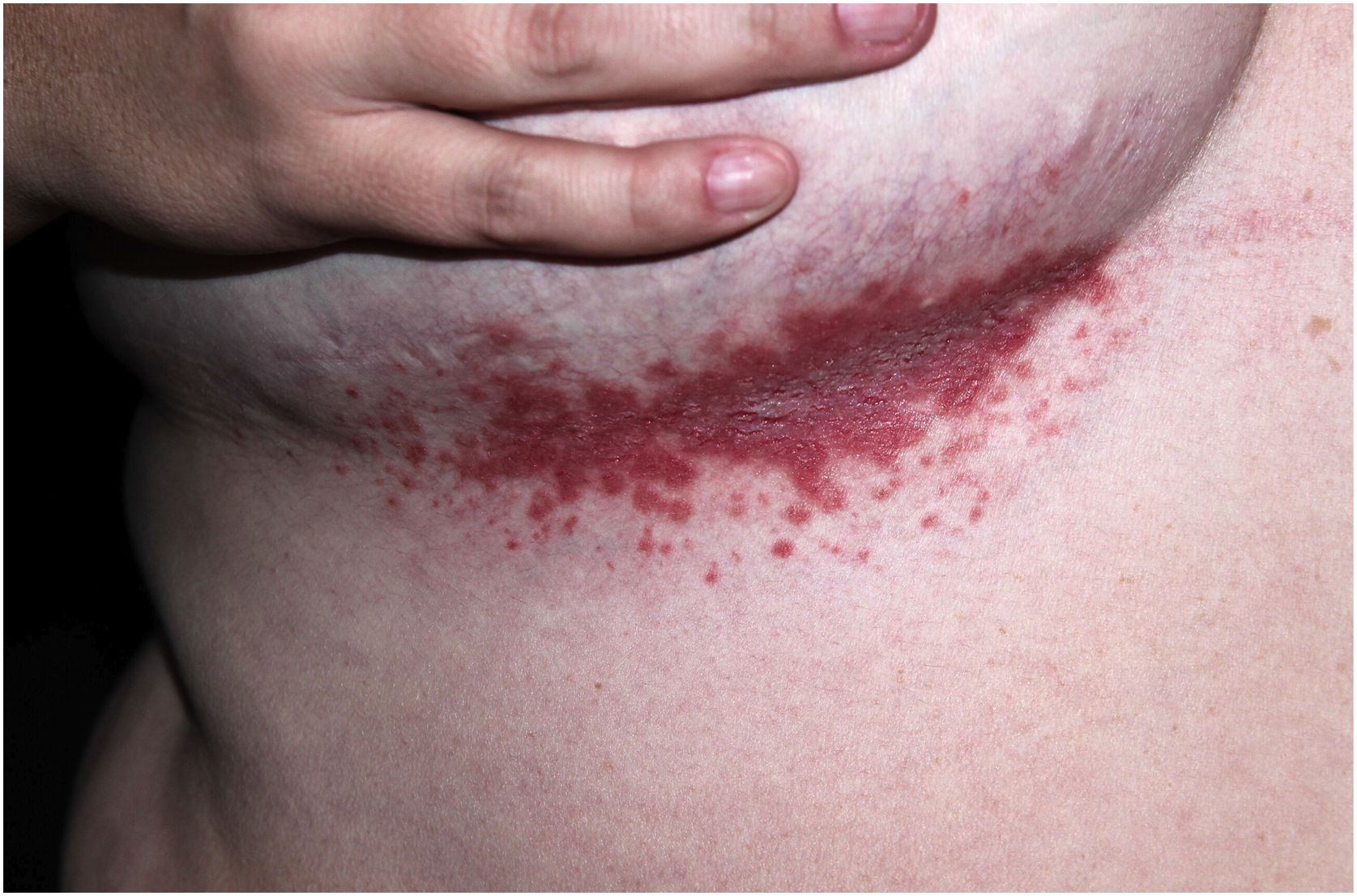
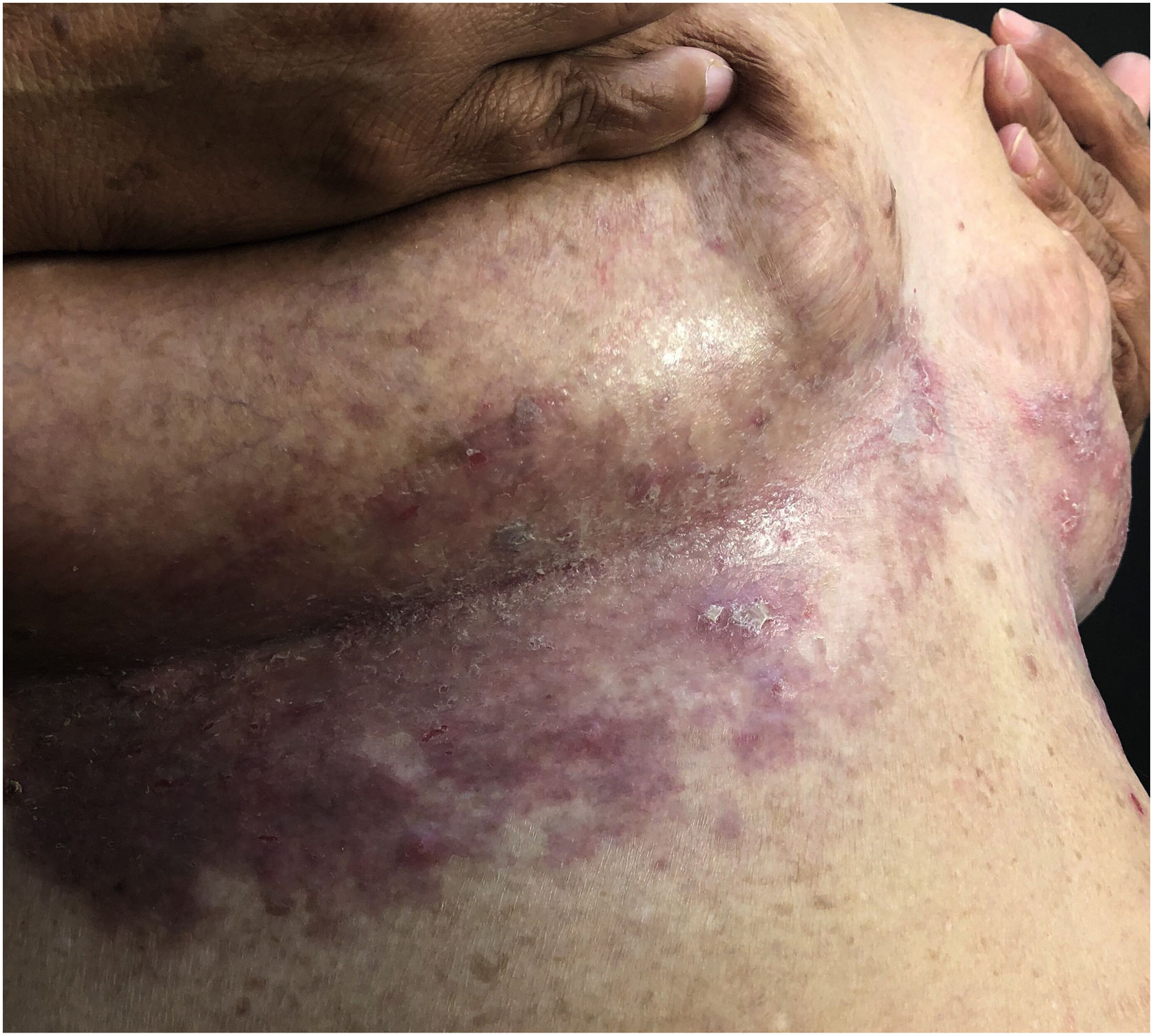
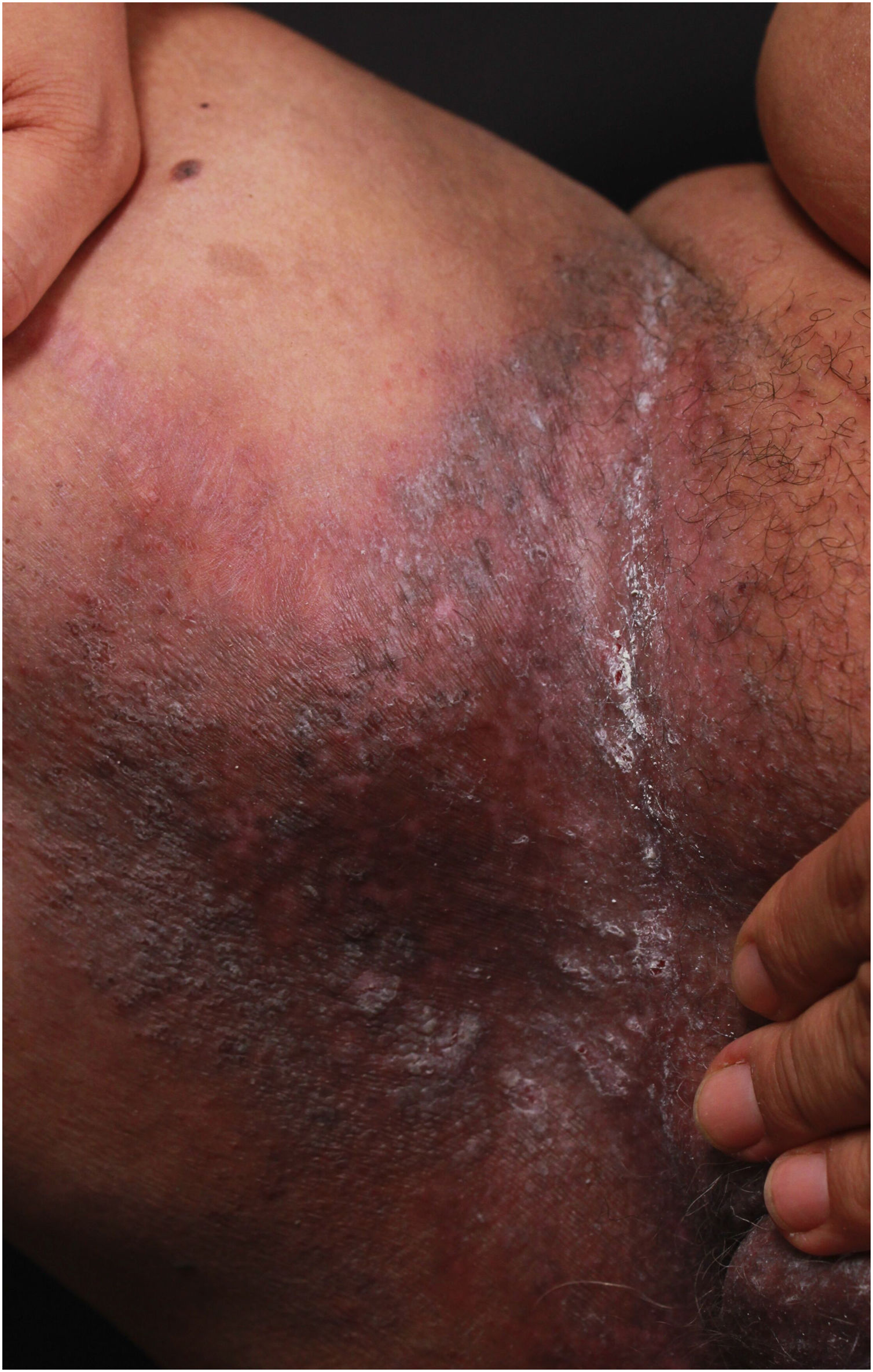
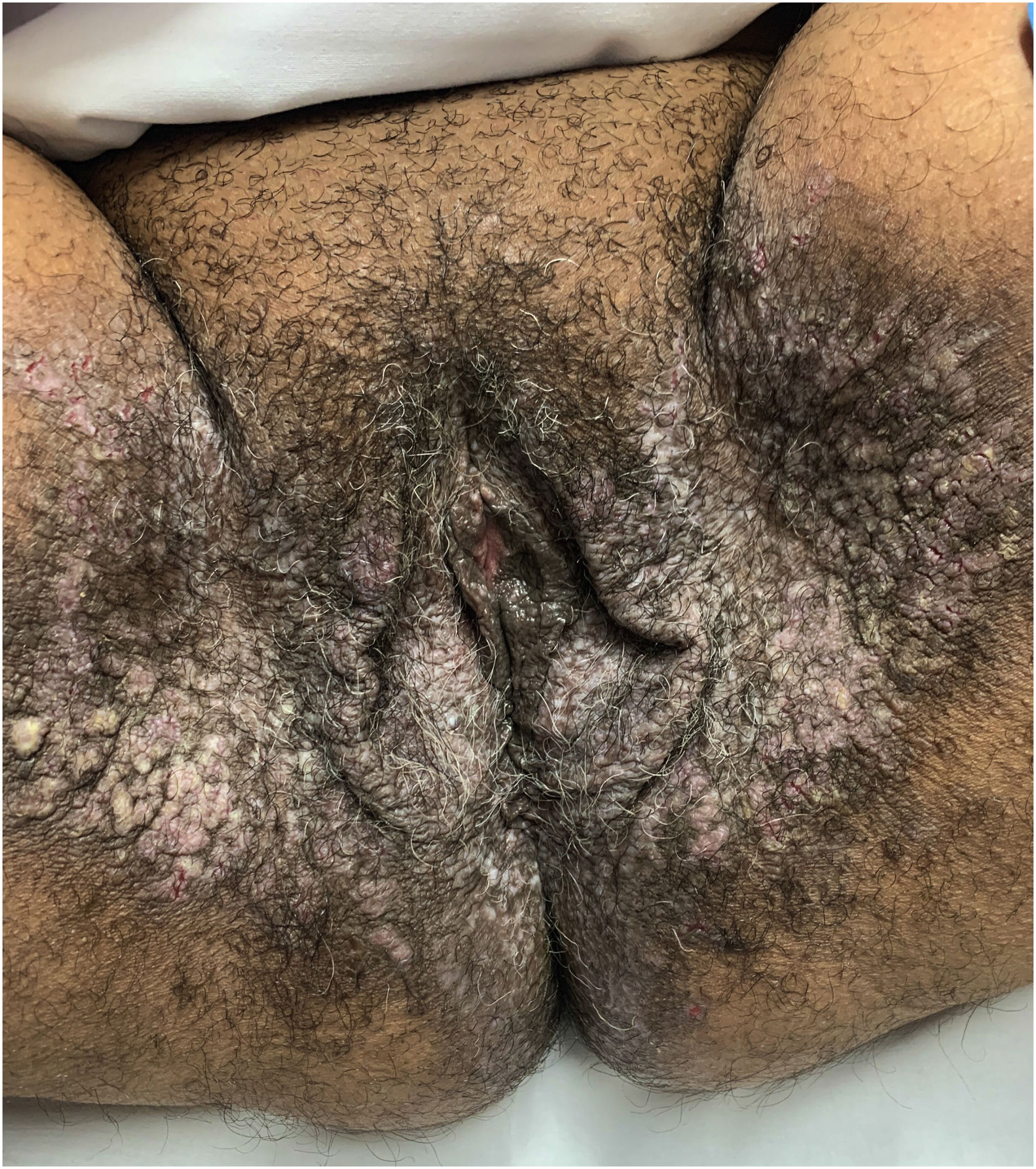
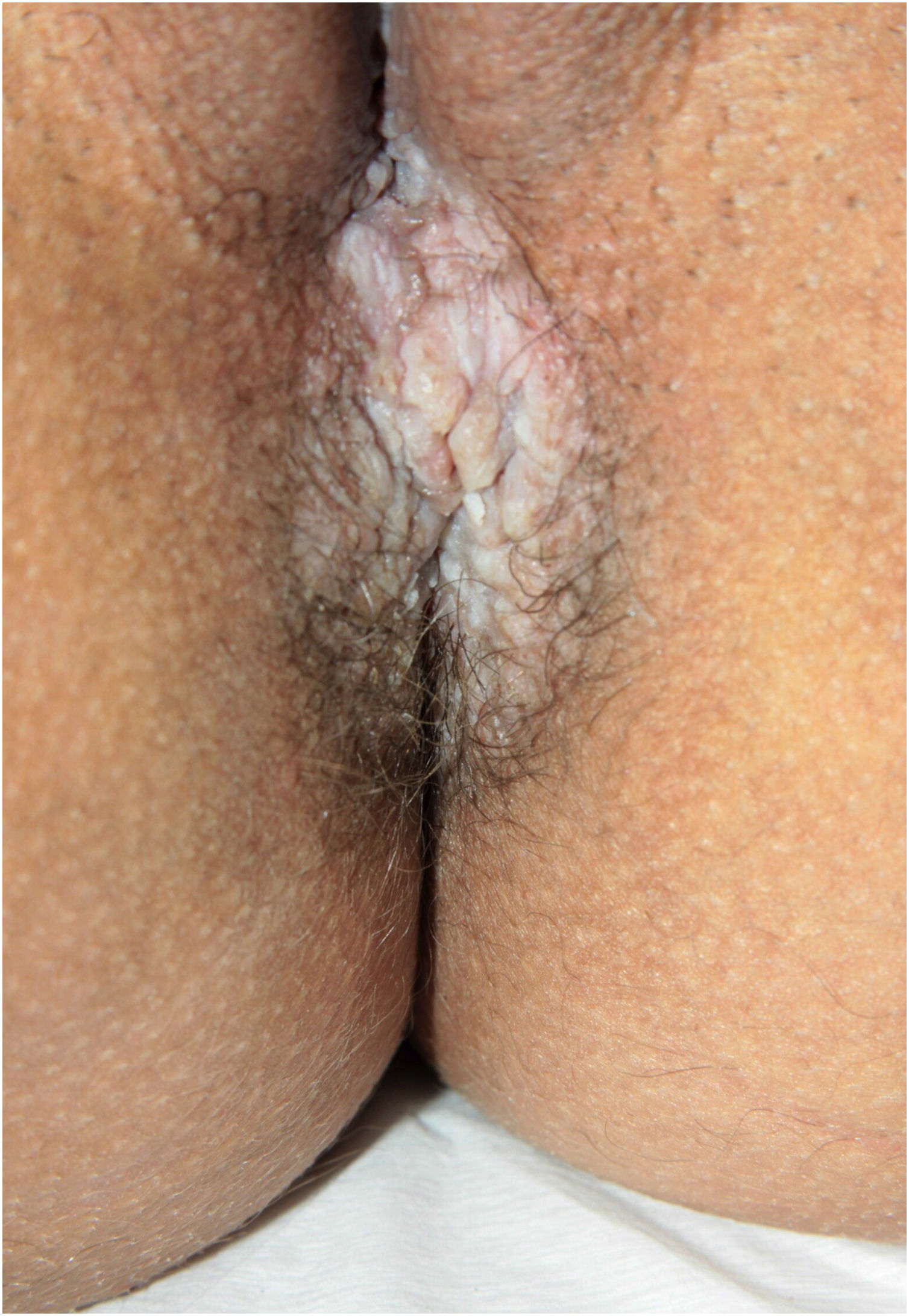
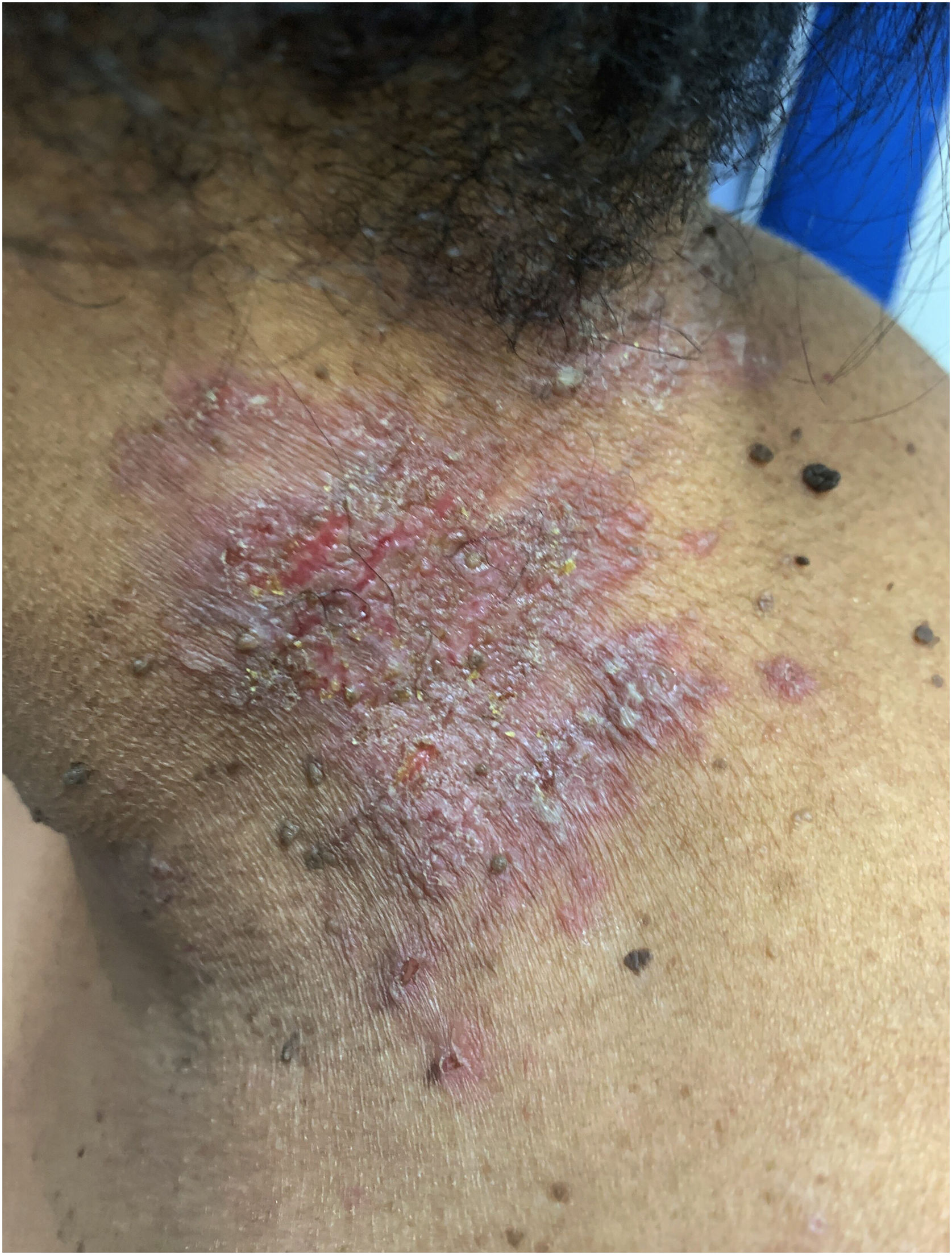
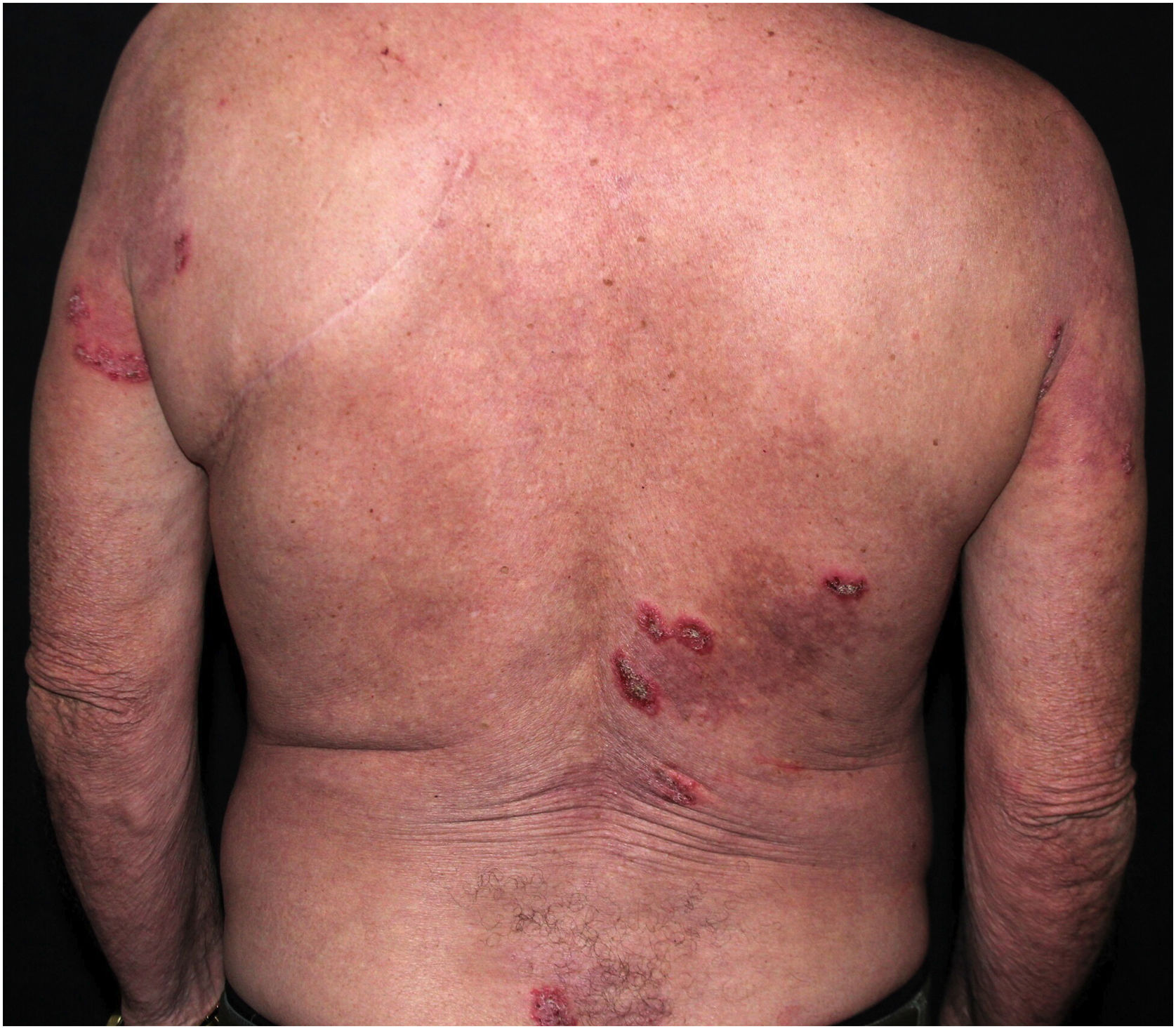
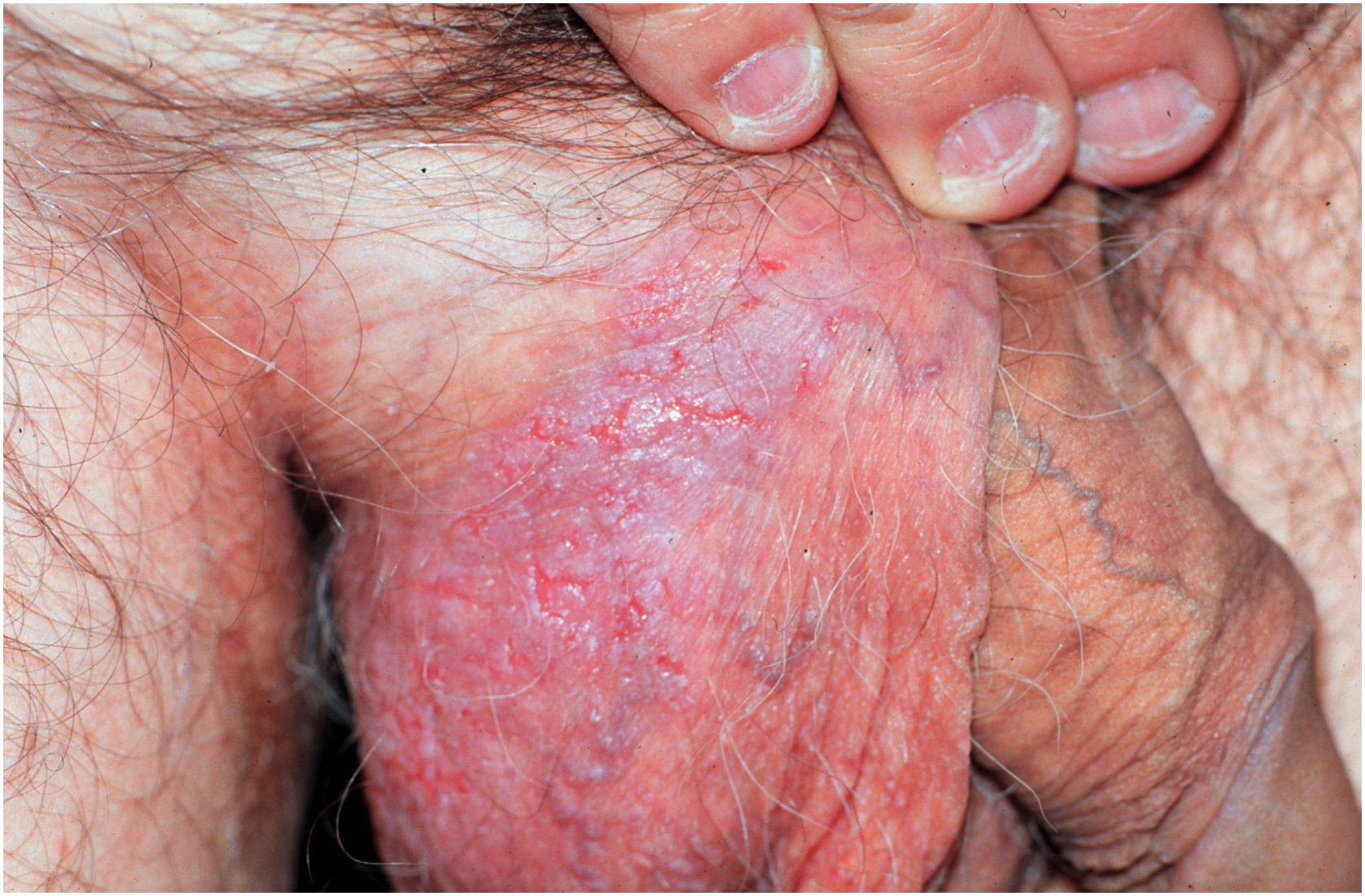
Aspectos clínicosA DHH é dermatose crônica que se manifesta na idade adulta (2ª a 4ª décadas), com casos isolados nos extremos da vida. O curso clínico caracteriza‐se por períodos de remissão e exacerbação, com relatos de possível melhora com a idade.10 Manifesta‐se com lesões vesicobolhosas distribuídas preferencialmente nas áreas flexurais, como a região axilar, inframamária em mulheres e inguino‐crural (figs. 1‐4), além da região cervical posterior, genital e perianal (figs. 5‐7). As lesões apresentam‐se de forma simétrica com distribuição bilateral, e podem evoluir com erosões e crostas, ou progressão centrífuga com borda ativa circinada e resolução central com discromia (fig. 8). As lesões crônicas podem formar placas vegetantes ou verrucosas dependendo da localização, com pequenas erosões lineares características da doença (fig. 9). Áreas menos comumente acometidas incluem o couro cabeludo, fossas antecubitais e poplíteas, além da região vulvar, que pode ser a única manifestação.9 Prurido, queimação e dor são sintomas frequentes que comprometem a qualidade de vida dos doentes. Alterações ungueais são encontradas em até 70% dos pacientes e são caracterizadas por bandas longitudinais esbranquiçadas.10
Formas clínicas segmentares, como já referidas como mosaicismo tipo 1 e tipo 2 (vide etiopatogenia), são respectivamente responsáveis pelas manifestações segmentares tipo 1 e tipo 2. O tipo 1 apresenta‐se exclusivamente com lesões segmentares seguindo as linhas de Blaschko. Já no tipo 2, as lesões apresentam dois padrões topográficos – o padrão segmentar tem aparecimento precoce, seguido pelo padrão clássico intertriginoso na fase adulta. Quando o quadro intertriginoso se manifesta, há piora das lesões segmentares por superposição.18
A doença pode sofrer exacerbações agudas desencadeadas por umidade, fricção, calor, trauma e infecções secundárias bacterianas, fúngicas e virais herpéticas,2 com possível evolução para erupção variceliforme de Kaposi por disseminação do vírus herpes simples tipo I/II.19 Nas exacerbações infecciosas, as lesões podem apresentar exsudação com odor fétido. Há relatos de piora da doença com a exposição à radiação ultravioleta,20,21 e recidiva durante a gravidez.22
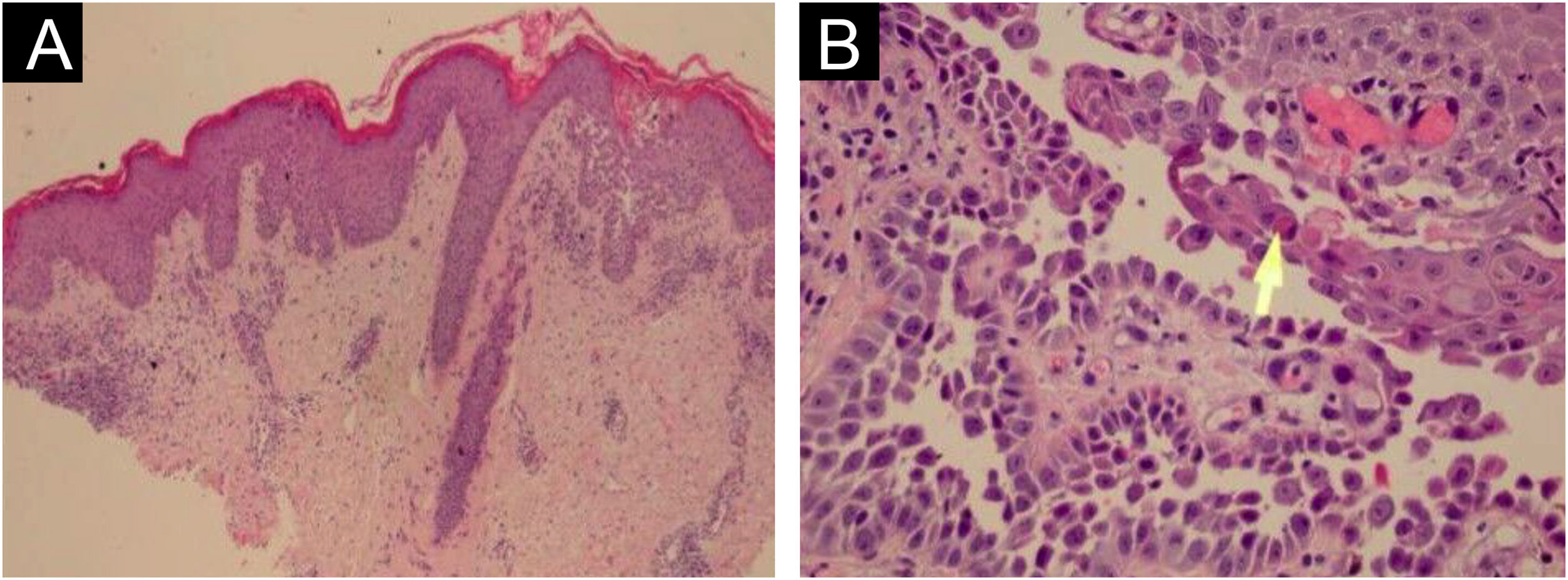
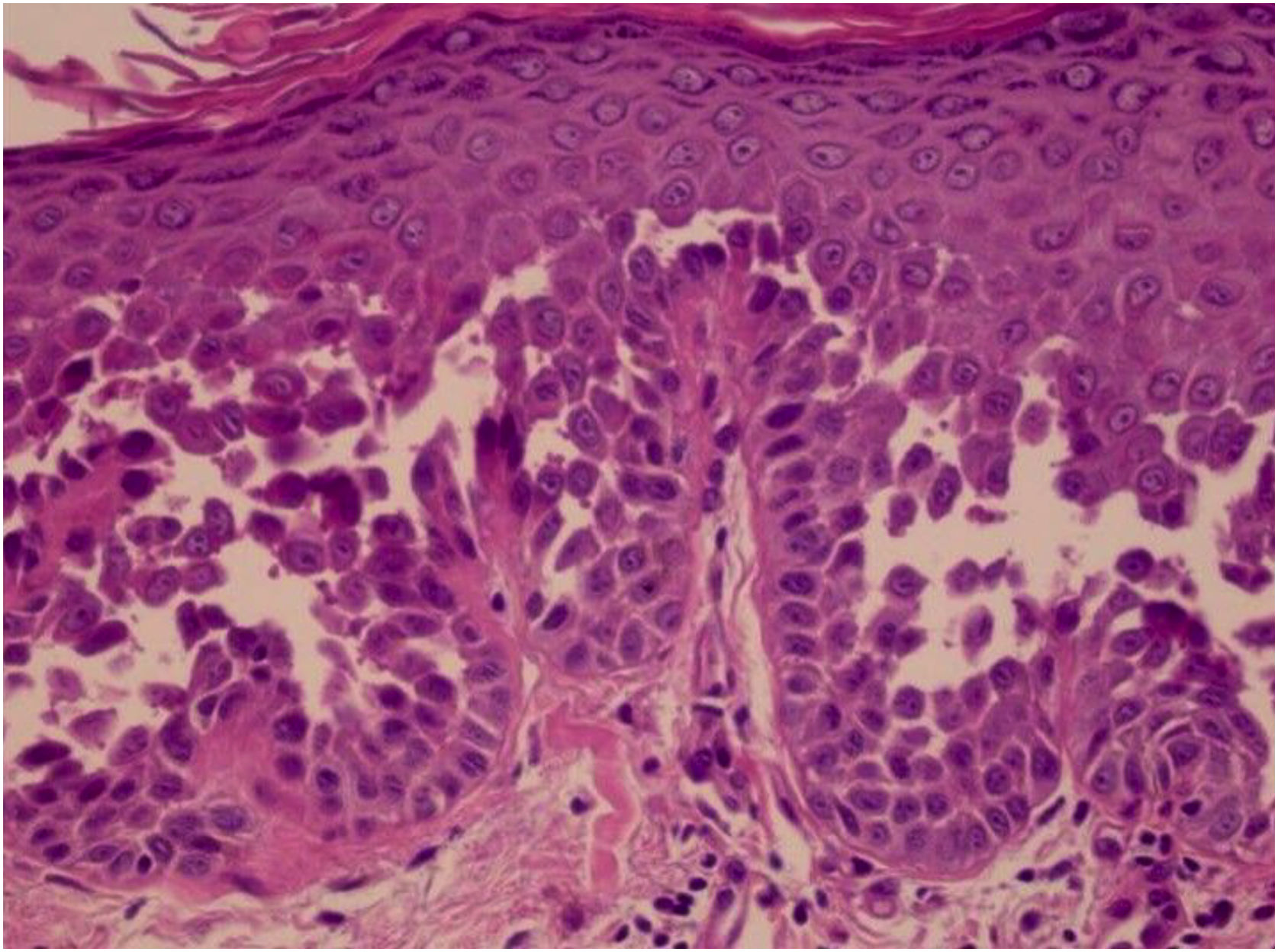
HistopatologiaA DHH é um tipo de disceratose acantolítica. O aspecto morfológico das lesões precoces é de bolha suprabasal com células acantolíticas delineando a camada basal e preenchendo a área de descolamento (fig. 10A).23 O achado característico é a acantólise acentuada; de permeio notam‐se células disceratósicas (fig. 10B), frouxamente unidas, dando o aspecto de “muro dilapidado” (também descrito como “muro sem reboco”, como na fig. 11). Essa acantólise costuma acometer a epiderme e poupar os epitélios anexiais, o que auxilia no diagnóstico diferencial com o pênfigo vulgar, no qual a acantólise acomete todos os epitélios.24 Por vezes, pode‐se notar também hiperceratose compacta eosinofílica com paraceratose e acantose. O exame de imunofluorescência direta é negativo. Estudos imuno‐histoquímicos têm confirmado que proteínas desmossômicas e glicoproteínas são sintetizadas na DHH. Na pele lesada, nota‐se a imunoexpressão citoplasmática de desmogleínas 2 e 3, desmoplaquinas I e II e desmocolinas.25
O diagnóstico da DHH fundamenta‐se nos achados clínicos característicos e na confirmação histopatológica.
Publicações recentes têm tentado estabelecer padrões dermatoscópicos típicos para a DHH.26–29 A detecção da mutação no gene ATP2C1 através de técnicas de biologia molecular não é realizada rotineiramente, mas pode ser útil em casos difíceis.2
Diagnóstico diferencialOs diagnósticos diferenciais clínicos de DHH incluem: doença de Darier, pênfigo vegetante, psoríase invertida, dermatite de contato, impetigo, acantose nigricante, eritrasma, intertrigo (candidiásico ou não), tinea cruris e, na região perianal, os quadros eczematosos e o condiloma acuminado.2,30
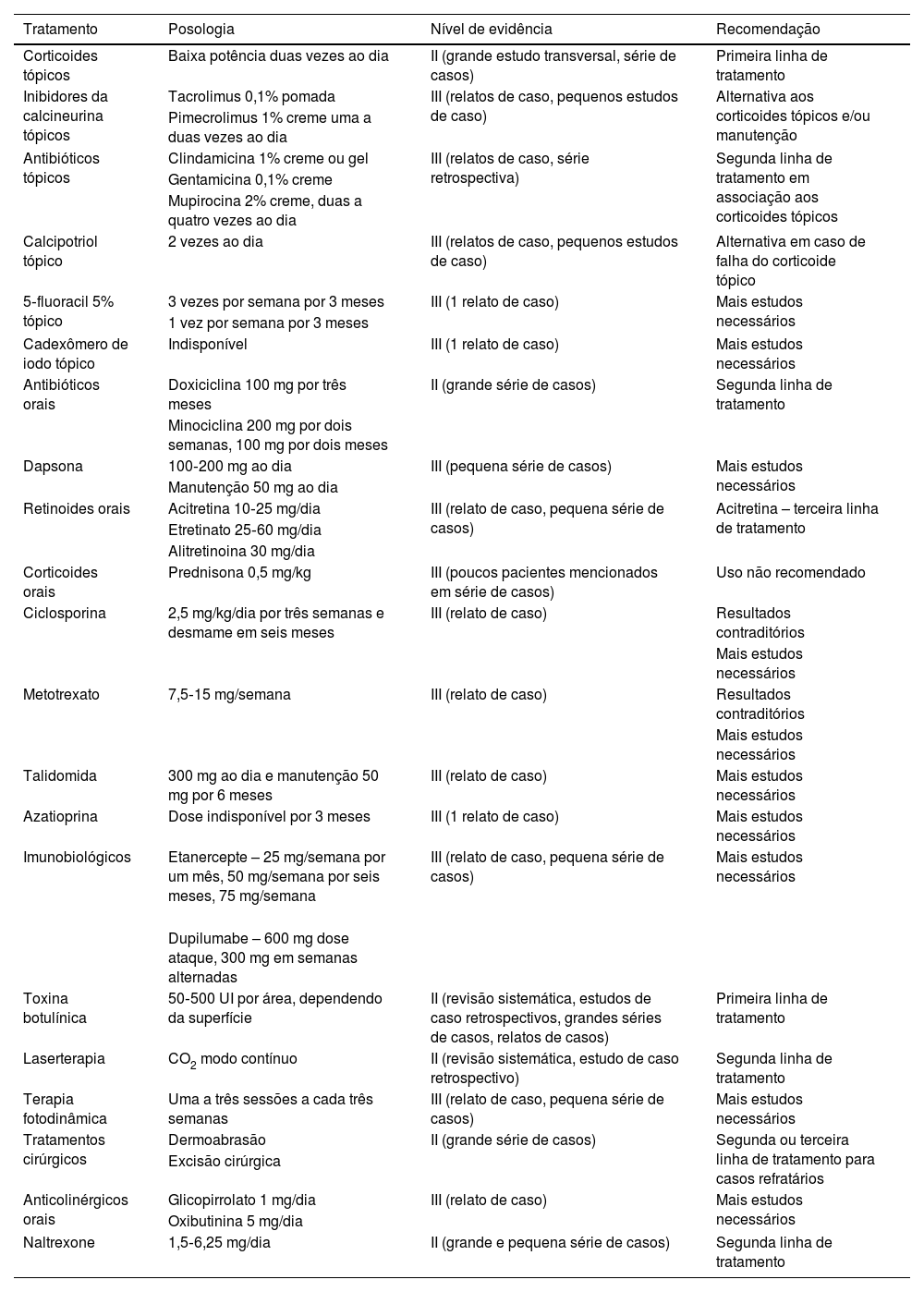
TratamentoEm virtude dod caráter multifatorial e da ausência de estudos clínicos randomizados com alto grau de evidência científica, o tratamento da DHH é desafiador. Inúmeras modalidades de tratamento são descritas em relatos ou séries de casos retrospectivos, abordadas a seguir e resumidas na tabela 1.
Modalidades terapêuticas da doença de Hailey‐Hailey, com respectivas posologias, nível de evidência e recomendação
| Tratamento | Posologia | Nível de evidência | Recomendação |
|---|---|---|---|
| Corticoides tópicos | Baixa potência duas vezes ao dia | II (grande estudo transversal, série de casos) | Primeira linha de tratamento |
| Inibidores da calcineurina tópicos | Tacrolimus 0,1% pomada | III (relatos de caso, pequenos estudos de caso) | Alternativa aos corticoides tópicos e/ou manutenção |
| Pimecrolimus 1% creme uma a duas vezes ao dia | |||
| Antibióticos tópicos | Clindamicina 1% creme ou gel | III (relatos de caso, série retrospectiva) | Segunda linha de tratamento em associação aos corticoides tópicos |
| Gentamicina 0,1% creme | |||
| Mupirocina 2% creme, duas a quatro vezes ao dia | |||
| Calcipotriol tópico | 2 vezes ao dia | III (relatos de caso, pequenos estudos de caso) | Alternativa em caso de falha do corticoide tópico |
| 5‐fluoracil 5% tópico | 3 vezes por semana por 3 meses | III (1 relato de caso) | Mais estudos necessários |
| 1 vez por semana por 3 meses | |||
| Cadexômero de iodo tópico | Indisponível | III (1 relato de caso) | Mais estudos necessários |
| Antibióticos orais | Doxiciclina 100 mg por três meses | II (grande série de casos) | Segunda linha de tratamento |
| Minociclina 200 mg por dois semanas, 100 mg por dois meses | |||
| Dapsona | 100‐200 mg ao dia | III (pequena série de casos) | Mais estudos necessários |
| Manutenção 50 mg ao dia | |||
| Retinoides orais | Acitretina 10‐25 mg/dia | III (relato de caso, pequena série de casos) | Acitretina – terceira linha de tratamento |
| Etretinato 25‐60 mg/dia | |||
| Alitretinoina 30 mg/dia | |||
| Corticoides orais | Prednisona 0,5 mg/kg | III (poucos pacientes mencionados em série de casos) | Uso não recomendado |
| Ciclosporina | 2,5 mg/kg/dia por três semanas e desmame em seis meses | III (relato de caso) | Resultados contraditórios |
| Mais estudos necessários | |||
| Metotrexato | 7,5‐15 mg/semana | III (relato de caso) | Resultados contraditórios |
| Mais estudos necessários | |||
| Talidomida | 300 mg ao dia e manutenção 50 mg por 6 meses | III (relato de caso) | Mais estudos necessários |
| Azatioprina | Dose indisponível por 3 meses | III (1 relato de caso) | Mais estudos necessários |
| Imunobiológicos | Etanercepte – 25 mg/semana por um mês, 50 mg/semana por seis meses, 75 mg/semana | III (relato de caso, pequena série de casos) | Mais estudos necessários |
| Dupilumabe – 600 mg dose ataque, 300 mg em semanas alternadas | |||
| Toxina botulínica | 50‐500 UI por área, dependendo da superfície | II (revisão sistemática, estudos de caso retrospectivos, grandes séries de casos, relatos de casos) | Primeira linha de tratamento |
| Laserterapia | CO2 modo contínuo | II (revisão sistemática, estudo de caso retrospectivo) | Segunda linha de tratamento |
| Terapia fotodinâmica | Uma a três sessões a cada três semanas | III (relato de caso, pequena série de casos) | Mais estudos necessários |
| Tratamentos cirúrgicos | Dermoabrasão | II (grande série de casos) | Segunda ou terceira linha de tratamento para casos refratários |
| Excisão cirúrgica | |||
| Anticolinérgicos orais | Glicopirrolato 1 mg/dia | III (relato de caso) | Mais estudos necessários |
| Oxibutinina 5 mg/dia | |||
| Naltrexone | 1,5‐6,25 mg/dia | II (grande e pequena série de casos) | Segunda linha de tratamento |
Condições locais, como excesso de suor, calor e fricção, podem agravar as lesões na DHH. Portanto, alterações no estilo de vida que melhorem tais fatores trazem benefícios a todos os pacientes. Evitar ambientes quentes e sudorese quando possível, manter as lesões sempre limpas e secas, higienizando‐as com soluções antissépticas, uso de roupas adequadas que reduzam a fricção e o aquecimento, e perda ponderal são sempre recomendados.31
Tratamentos tópicosCorticoides tópicosSão considerados primeira linha de tratamento na DHH em virtude do efeito modulador da inflamação. Em estudo transversal com 58 pacientes, houve boa resposta em 86% após tratamento com corticoide tópico.10 A aplicação precoce pode interromper a progressão no início do surgimento das lesões. Exacerbações são preferencialmente tratadas com corticoides tópicos de baixa potência em cursos curtos, para reduzir complicações. Embora mais eficazes, corticoides de alta potência devem ser evitados pelo risco de efeitos colaterais como atrofia, estrias, telangiectasias e absorção sistêmica, especialmente em áreas intertriginosas. É possível considerar o uso de corticoide intralesional nas lesões refratárias ao tratamento com corticoides tópicos.32
Inibidores de calcineurina tópicosSão indicados para o controle da inflamação a longo prazo, em decorrência do bom perfil de segurança para uso em áreas intertriginosas quando comparado aos corticoides tópicos, embora apresentem menor evidência científica quanto a eficácia, uma vez que tais resultados provêm apenas de relatos isolados e pequenas séries de casos. A pomada de tacrolimus 0,1% tem melhor penetração do que o creme de pimecrolimus 1% em virtude do veículo. Pode ser usado em monoterapia uma ou duas vezes ao dia, com remissão em duas a quatro semanas de tratamento, em substituição ou alternado com o corticoide tópico após controle inicial das lesões, ou ainda em associação a tratamentos sistêmicos em casos refratários. Há relatos de recidiva das lesões após suspensão dos inibidores de calcineurina.31,33
Antibióticos tópicosColonização bacteriana e infecção por Staphylococcus e Streptococcus são fatores modificadores da DHH por desencadearem o surgimento de lesões ou retardarem a resposta ao tratamento. Portanto, antibióticos e antissépticos tópicos auxiliam o manejo da doença. Há relatos com boa resposta ao uso de clindamicina 1% em creme ou gel, gentamicina 0,1% em creme ou mupirocina 2% em creme, duas a quatro vezes ao dia por duas a quatro semanas, associados a lavagem das lesões com solução antisséptica. Há indícios de que os aminoglicosídeos tópicos, especialmente a gentamicina, sejam capazes de induzir a leitura translacional de mutações em doenças genéticas e, portanto, beneficiariam os pacientes com DHH uma vez que aproximadamente 20% das mutações patogênicas dessa doença levam a um códon de parada prematura.31,34
Agentes tópicos alternativos (calcipotriol, 5‐fluoracil, cadexômero de iodo)Apresentam baixo nível de evidência científica quanto a eficácia, mas são considerados tratamentos em potencial à medida que novos estudos surgirem.
Calcitriol ou calcipotriol (1,25‐di‐hidroxivitamina D3) é o metabólito ativo da vitamina D capaz de induzir a diferenciação dos queratinócitos pelo efeito cálcio regulatório. Há relatos de eficácia ao uso duas vezes ao dia por um mês, com remissão completa por três meses, e resposta superior a betametasona tópica em tratamento de metade da lesão no mesmo paciente. É alternativa de tratamento após falha com uso de corticoide tópico.35
Há um relato de tratamento bem‐sucedido com 5‐flluoracil tópico em creme aplicado três vezes por semana por três meses, seguido de aplicações semanais por mais três meses, e remissão completa após três meses do término do tratamento, sem recidivas em um ano. No entanto, mais estudos são necessários para comprovar a real eficácia.36
O cadexômero de iodo tem propriedades antimicrobianas, anti‐inflamatórias e absortivas do exsudato da pele, necessárias nos casos de DHH. Um relato de caso demonstrou melhora completa das lesões após uso por 10 meses. No entanto, são necessárias mais evidências para comprovar tal efeito.37
Tratamentos sistêmicosAntibióticos oraisSão úteis no manejo da DHH, especialmente em associação aos tratamentos tópicos, e considerados terapia de segunda linha. A eficácia de antibióticos como eritromicina e penicilina já foi demonstrada em relatos de casos. Tetraciclinas também são eficazes no tratamento da DHH. Doxiciclina 100mg ao dia por três meses, seguida do uso de 50mg como dose de manutenção, obteve melhora completa de 5/6 pacientes em relato de casos. Minociclina 100‐200mg ao dia também se mostrou eficaz no controle das lesões após dois meses, sem recidiva em seguimento de três meses. É importante reforçar que as tetraciclinas têm efeito anti‐inflamatório adicional ao efeito antimicrobiano desejado.38,39
DapsonaSulfona com efeito anti‐inflamatório e antimicrobiano raramente usada na DHH. Há relato de melhora de lesões e prurido em três casos após uso de dapsona 100‐200mg ao dia, seguida de dose de manutenção de 50mg ao dia. No entanto, como muitos outros tratamentos citados, são necessárias mais evidências para validar sua eficácia.40
Retinoides oraisSão considerados terapia de terceira linha na DHH. Os prováveis mecanismos de ação são regulação da homeostase do cálcio e da diferenciação dos queratinócitos na epiderme. Diversos relatos de casos demonstraram a eficácia da acitretina entre 10 e 25mg ao dia, por pelo menos cinco meses, e do etretinato entre 25 e 60mg ao dia em duas a seis semanas. Para pacientes do sexo feminino em idade reprodutiva, a alitretinoína 30mg ao dia foi eficaz em monoterapia em um relato de caso, e evitou a recidiva das lesões após suspensão de prednisolona via oral em outro relato. No entanto, a isotretinoína não tem eficácia demonstrada na DHH.41,42
Corticoides oraisO uso do corticoide oral no tratamento da DHH não é recomendado em virtude das altas taxas de recorrência e do efeito rebote após a suspensão, exceto quando absolutamente necessário para controle de casos graves ou em baixas doses, como terapia de manutenção. Assim, os corticoides orais podem controlar a doença a curto prazo, mas devem ser evitados pelo risco de exacerbação após a interrupção.10
Outros imunossupressores (ciclosporina, metotrexato, talidomida, azatioprina)Inúmeros imunossupressores já foram testados na DHH refratária, com resultados contraditórios. Portanto, são considerados tratamentos de exceção, e mais estudos são necessários.
A ciclosporina promove a regulação dos níveis de cálcio intracelular e dos níveis de citocinas pró‐inflamatórias nos queratinócitos. Assim como os corticoides, ela oferece rápida melhora nos casos refratários de DHH, porém com recidiva após a suspensão. Há relato de remissão completa após ciclosporina em baixa dose (2,5mg/kg/dia) em três semanas, com desmame lento em seis meses e remissão por dois anos, com pequenas recidivas que responderam a tacrolimus tópico. Nefrotoxicidade e hipertensão arterial são possíveis efeitos colaterais.43
Metotrexato na dose de 7,5‐15mg por semana apresentou resposta completa após três meses em relatos de caso, sustentada por dois anos após a suspensão da medicação. No entanto, há mais relatos de falha de tratamento do que sucesso no uso de metotrexato na DHH.44
A talidomida é opção considerada em casos graves refratários a outros tratamentos. Há relato de melhora rápida em uma semana com talidomida 300mg ao dia em paciente que previamente não respondeu a dapsona e corticoide endovenoso. Assim, a talidomida pode ser útil para um grupo específico de pacientes, após discussão aprofundada dos efeitos colaterais a longo prazo.45
A azatioprina foi recentemente relatada como tratamento de DHH em associação a antibiótico tópico, com boa resposta em cinco dias e remissão parcial em três meses.46
ImunobiológicosHá relatos com respostas controversas após uso de etanercepte (anti‐TNF‐α) com doses semanais entre 25 e 50mg. No entanto, a maioria dos relatos argumenta contra qualquer efeito positivo dos anti‐TNF‐α na DHH.47
Recentemente, foi relatado o uso de dupilumabe (anti‐interleucinas 4 e 13) como tratamento para DHH. Uma série de três casos demonstrou resposta importante após dois meses de tratamento, com resposta sustentada por até 25 meses. No entanto, outra série de três casos não apresentou a mesma resposta sustentada.48,49
Há também relato de paciente com esclerose múltipla e DHH que foi tratado com ocrelizumabe (anticorpo monoclonal humanizado anti‐CD20) e apresentou controle das lesões cutâneas.50
ProcedimentosToxina botulínicaAmplamente utilizada, a toxina botulínica pode ser considerada tratamento adjuvante de escolha no manejo da DHH. A toxina botulínica promove a redução da produção de suor pelas glândulas écrinas ao bloquear a liberação de acetilcolina nas respectivas terminações nervosas. A diminuição da sudorese protege conta colonização bacteriana e subsequente exacerbação da doença. Em revisão sistemática recente, dentre 38 pacientes tratados com toxina botulínica, apenas um não respondeu ao tratamento, e os demais apresentaram melhora parcial ou completa. Não foram relatados efeitos colaterais. Entretanto, não há padronização quanto ao tipo de toxina botulínica utilizada, sua diluição, e a dose aplicada por área é extremamente variável (50‐500 dUI, a depender da superfície). Alguns relatos recomendam a aplicação de toxina botulínica na dose de 50 UI por área como tratamento de primeira linha da DHH.51,52
LaserterapiaEm virtude do caráter recidivante da DHH e da escassez de tratamentos comprovadamente eficazes, a laserterapia tem sido explorada; o laser de CO2 no modo contínuo apresenta mais relatos e melhores respostas. Em revisão sistemática que incluiu 23 pacientes tratados com laser de CO2, 10 pacientes não tiveram recorrência, 12 tiveram melhora inferior a 50% e um paciente não teve nenhuma melhora em período de seguimento de quatro a 144 meses. Os efeitos adversos foram poucos, como despigmentação e cicatrizes em dois casos. O provável mecanismo de ação consiste na ablação da epiderme com preservação da maior parte da derme e estruturas anexiais, que induz a reepitelização e resolução das lesões.53
Há relatos de casos utilizando lasers como erbium YAG e laser de corante pulsado (pulsed dye laser) com respostas e graus de recidiva variáveis. Mais estudos são necessários. Não há evidência de benefício do laser de diodo no tratamento da DHH.54
Terapia fotodinâmicaEmbora apresente resultados conflitantes e seja de difícil acesso à prática clínica, a terapia fotodinâmica pode ser considerada em pacientes com doença refratária a múltiplos tratamentos prévios, como laser de CO2, cirurgias e uso de retinoides. Uma série de oito casos demonstrou cura completa sem recidivas em três pacientes e melhora parcial com diminuição da frequência e intensidade das recidivas nos outros cinco casos.55
Tratamentos cirúrgicosA abordagem cirúrgica é indicada para DHH localizada refratária aos tratamentos convencionais, seja por falta de eficácia ou por resposta apenas temporária. Embora ofereçam resultados permanentes, os procedimentos cirúrgicos implicam em elevada morbidade.
A dermoabrasão leva à destruição da epiderme e da derme superficial, poupando os anexos, o que torna possível a reepitelização da área tratada. Em uma série de casos, a dermoabrasão foi realizada em um total de 46 regiões de dez pacientes com DHH. Houve remissão por até 79 meses em 38 das áreas tratadas. No geral, a taxa de resolução de lesões de DHH com dermoabrasão é de 83%.56A exérese cirúrgica seguida de enxerto de pele pode ser considerada o único tratamento curativo da DHH recalcitrante e proporciona alívio definitivo das lesões e consequente melhora da qualidade de vida. A maior série relatou oito pacientes tratados com excisão cirúrgica seguida de enxerto, com remissão completa ou quase completa após nove anos de seguimento.57
Novos tratamentosAnticolinérgicos oraisSão opções de tratamento em virtude da ação antitranspirante. Em um caso relatado, o glicopirrolato oral 1mg associado a mometasona tópica e minociclina oral 100mg obteve boa resposta após um mês de tratamento, e a melhora foi mantida por seis meses apenas com o uso do glicopirrolato. Outro caso apresentou melhora expressiva após uso de oxibutinina 5mg ao dia.58
NaltrexoneAntagonista opioide indicado para o tratamento da dependência ou intoxicação por opioides na dose de 50‐100mg ao dia. Em baixas doses, tem sido utilizado para o tratamento em doenças inflamatórias crônicas, como fibromialgia, doença de Crohn e a própria DHH. Sua eficácia é explicada pela presença de receptores opioides na pele, responsáveis pelas respostas nociceptivas e inflamatórias associadas ao estresse, bem como pela diferenciação adequada dos queratinócitos. Há inúmeras séries de casos com uso de naltrexone entre 1,5 e 6,25mg ao dia na DHH, com resultados promissores (rápida resposta e remissão sustentada) e poucos efeitos colaterais (náusea e tontura). Atualmente, é recomendado como tratamento de segunda linha, dadas as evidências até o momento e o bom perfil de segurança.59,60
Outros tratamentos emergentesEstudos piloto ou relatos de série de casos sinalizam a eficácia dos seguintes tratamentos na DHH: hormônio estimulador de α‐melanócitos,61 apremilast (inibidor da fosfodiesterase‐4),62 cloreto de magnésio,63 vitamina D oral,64 terapia ultravioleta B nas formas generalizadas65 e radiação por feixe de elétrons.66 No entanto, são resultados incipientes que necessitam de maior evidência quanto a sua eficácia e segurança.
Evolução e prognósticoNão existe cura para essa genodermatose que apresenta, em geral, evolução crônica com períodos de remissão e exacerbação. Os principais objetivos do tratamento são aliviar a dor e o prurido, reduzir o risco de infecção secundária e minimizar os fatores que desencadeiam as exacerbações. São necessários ensaios clínicos controlados randomizados para respaldar melhor a escolha da opção terapêutica para cada paciente.
Suporte financeiroNenhum.
Contribuição dos autoresAdriana Maria Porro: Obtenção, análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Camila Arai Seque: Obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação final da versão final do manuscrito.
Denise Miyamoto: Obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação final da versão final do manuscrito.
Diego Vanderlei Medeiros da Nóbrega: Obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação final da versão final do manuscrito.
Milvia Maria Simões e Silva Enokihara: Obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação final da versão final do manuscrito.
Claudia Giuli Santi: Obtenção, análise e interpretação dos dados; Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; Aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Porro AM, Seque CA, Miyamoto D, Nóbrega DVM, Enokihara MMSS, Santi CG. Hailey‐Hailey disease: clinical, diagnostic and therapeutic update. An Bras Dermatol. 2024;99:651–61.
Trabalho realizado no Departamento de Dermatologia, Escola Paulista de Medicina, Universidade Federal de São Paulo, São Paulo, SP, Brasil.