O líquen plano é uma doença mucocutânea inflamatória crônica. Estudos recentes sugeriram que ela está associada a um maior risco de comorbidades cardiovasculares.
ObjetivoAvaliar e comparar a rigidez arterial e a hemodinâmica cardiovascular em pacientes com líquen plano e um grupo controle saudável.
MétodosForam incluídos 55 pacientes com líquen plano e 42 controles saudáveis. Todos os pacientes foram submetidos a um exame ecocardiográfico; a rigidez arterial foi mensurada por tonometria de aplanação.
ResultadosNenhuma diferença estatisticamente significante foi observada entre os grupos paciente e controle em termos de rigidez arterial, mas ela foi significativamente maior nos pacientes com líquen plano erosivo em comparação com o grupo controle e outros pacientes (p=0,006 e p=0,023, respectivamente). Observou‐se uma correlação positiva moderada entre a duração da doença e a rigidez arterial. O comprometimento das funções sistólica e diastólica também foi observado em pacientes com líquen plano em comparação ao grupo controle (p <0,001 e p=0,005, respectivamente).
Limitações do estudoNúmero relativamente baixo de pacientes.
ConclusãoA correlação positiva observada entre a duração da doença e a rigidez arterial em pacientes com líquen plano sugere que esses pacientes devam ser monitorados quanto ao risco cardiovascular na presença de doença resistente e de longo prazo, principalmente no caso de líquen plano erosivo.
O líquen plano (LP) é uma doença mucocutânea inflamatória crônica, cuja prevalência oscila entre 0,6% e 1,2% da população.1 Acredita‐se que a doença seja causada por respostas imunológicas mediadas por células e que os linfócitos T reativos sejam as células efetoras que causam a destruição dos queratinócitos.2 A duração da doença varia de acordo com o tipo de LP. A forma que se apresenta apenas com comprometimento cutâneo exibe início rápido e pode melhorar em um ano, enquanto as que acometem a mucosa oral e as unhas tendem a ser mais persistentes. Em particular, o LP oral erosivo e ulcerativo pode durar a vida toda.3 Estudos recentes sugerem que o LP está associado a uma maior prevalência de doenças cardiovasculares (DCV) devido à inflamação sistêmica crônica.2,4,5 Estudos também mostraram que pacientes com LP apresentam maior prevalência de síndrome metabólica, dislipidemia, hiperglicemia e hipertensão. Além disso, a inflamação crônica causa disfunção endotelial, o estágio inicial da aterogênese.2,4,6
A rigidez arterial consiste em inflamação crônica e alteração da função endotelial, com lesão de elementos estruturais da parede arterial inclusive músculo; ela é um fator de risco conhecido para DCV.7 Hipertensão, hiperlipidemia, idade avançada, diabetes melito, insuficiência cardíaca crônica, obesidade central, tabagismo, doença renal, doença coronariana (DC) e acidente vascular cerebral estão associados à rigidez.8 Dos diferentes métodos usados para medir a rigidez arterial, a velocidade da onda de pulso carotidofemoral (VOP) e o índice de dilatação da aorta (IDA), ambos não invasivos, são as técnicas padrão de medição8,9.
Hiper‐homocisteinemia, resistência a insulina, dislipidemia, obesidade, hipertensão e aumento da proteína C reativa sérica de alta sensibilidade (PCR‐as) são fatores de risco para aterosclerose e doenças vasculares.2 As informações sobre a relação entre LP e rigidez arterial são limitadas; a rigidez foi medida com o exame ecocardiográfico em apenas um estudo.
O objetivo deste estudo foi avaliar a rigidez arterial com o método padrão‐ouro, hemodinâmica cardiovascular e marcadores inflamatórios associados em pacientes com LP.
MétodosDesenho do estudoEste estudo foi feito para avaliar a rigidez arterial, marcadores inflamatórios associados e hemodinâmica cardíaca em pacientes com LP. Os pacientes e controles foram pareados por idade e sexo. Foram cadastrados todos os pacientes com LP atendidos neste Departamento de Dermatologia nos últimos 18 meses. Os critérios de inclusão foram idade superior a 18 anos e diagnóstico clínico e histopatológico de LP. Foram excluídos pacientes com hipertensão refratária, doença arterial periférica, DC, insuficiência renal ou obesidade mórbida e em uso de medicamentos como prednisolona e agentes hipolipemiantes (fig. 1). Durante o período do estudo, 68 pacientes foram diagnosticados com LP e 55 foram incluídos no grupo de pacientes. Desses, 19 pacientes tinham doença cutânea, 24 doença mucocutânea e 12 apresentavam apenas lesões em mucosas. O grupo controle foi composto por 42 indivíduos. Esses não tinham DCV conhecida, nem qualquer doença inflamatória. A população fonte foi a mesma para os pacientes e controles.
Coleta de dadosO termo de consentimento livre e esclarecido foi assinado por pacientes e controles. Os dados demográficos, clínicos e laboratoriais foram registrados em formulários de estudo por um dermatologista. A pressão arterial foi medida após o participante estar sentado por pelo menos 5 minutos. A rigidez arterial e o exame ecocardiográfico foram avaliados por um único cardiologista experiente para avaliar o perfil cardiovascular em cada caso. As amostras de sangue foram coletadas após um jejum noturno de 12h. Os níveis de colesterol total, triglicerídeos e glicose foram determinados por métodos enzimáticos. A velocidade de hemossedimentação (VHS) foi determinada com o método clássico de Westergren. Os níveis de homocisteína foram avaliados por imunonefelometria. A lipoproteína de alta densidade (HDL‐C) e a lipoproteína de baixa densidade (LDL‐C) foram medidas com métodos de surfactante seletivo. Os níveis de PCR‐as foram avaliados com imunonefelometria (Dade Behring, BN II, Marburg, Alemanha).
Exame ecocardiográficoA ecocardiografia foi feita em repouso com um dispositivo ecocardiográfico (Vivid 7, GE Medical Systems, Milwaukee, Wis., Estados Unidos). As dimensões do átrio esquerdo (AE) e ventrículo esquerdo (VE), fração de ejeção do VE (FE), padrão de fluxo mitral e imagens de Doppler tecidual foram obtidas de acordo com as recomendações atuais da Sociedade Americana de Ecocardiografia.10 A FE foi avaliada com o método biplano modificado (regra de Simpson modificada). O volume amostral do Doppler pulsado foi avaliado entre as pontas dos folhetos da válvula mitral para obter velocidades máximas de enchimento. As velocidades de fluxo transmitral precoce (E) e tardia (A) foram expressas em metros por segundo e o tempo de desaceleração (TD), em milissegundos. Também foi determinada a razão entre as velocidades de pico precoce e tardia (E/A). As velocidades sistólicas de pico (S’) e diastólica precoce e tardia (e’ e a’) foram medidas com Doppler tecidual da parede livre do VE a partir do corte apical de quatro câmaras. Os valores de todos os parâmetros foram calculados em três ciclos cardíacos separados. E/A e E/e’ foram calculados para avaliar a disfunção diastólica do VE (DD). O índice de desempenho miocárdico (índice IDM/Tei), inclusive intervalos de tempo sistólico e diastólico, também foi calculado para avaliar a disfunção cardíaca global.11
Mensuração da rigidez arterialAs propriedades da parede arterial, VOP de reflexão de onda, pressão de dilatação (PD) e IDA foram avaliadas com tonometria de aplanação (SphygmoCor, AtCor Medical, Sydney, Austrália).12 Foram calculados registros consecutivos de ondas de pulso da artéria carótida e femoral e o deslocamento do tempo de aparecimento de ondas no primeiro e no segundo locais. A distância entre os pulsos das artérias carótida e femoral foi medida na superfície do corpo para determinar a VOP aórtica em metros por segundo. A PA foi definida como pressão arterial sistólica máxima menos a pressão no ponto de inflexão. IDA foi definido como PA dividido pela pressão de pulso. Valores mais altos de IDA indicam aumento da reflexão da onda da periferia ou retorno precoce da onda refletida como resultado do aumento da VOP. O IDA depende das propriedades elásticas das artérias. Como o IDA é influenciado pela frequência cardíaca, foi usado um índice normalizado para uma frequência cardíaca de 75 bpm (IDA@75).13 Todas as medidas foram tiradas pelo mesmo indivíduo. As medidas médias para dez ciclos cardíacos foram calculadas. As medidas foram repetidas em caso de valores extremos.
Aprovação pelo Comitê de ÉticaEste estudo foi aprovado pelo comitê de ética da Universidade Técnica Karadeniz (2016/173) com número de protocolo 5554.
Análise estatísticaOs dados foram analisados no software SPSS 23.0. Os resultados foram expressos em número (n) e porcentagem (%) para dados descritivos. O teste qui‐quadrado foi usado para comparação das variáveis categóricas. A distribuição normal foi avaliada pelo teste de Kolmogorov‐Smirnov. O teste t de Student foi usado para comparar variáveis constantes distribuídas normalmente e o teste U de Mann‐Whitney para comparar variáveis distribuídas não normalmente. A análise de correlação foi feita com o teste de correlação de Spearman. A análise de regressão linear foi usada para comparar o impacto da idade, duração da doença, níveis de PCR e da forma erosiva do PL na rigidez arterial. Valores‐p <0,05 foram considerados significativos.
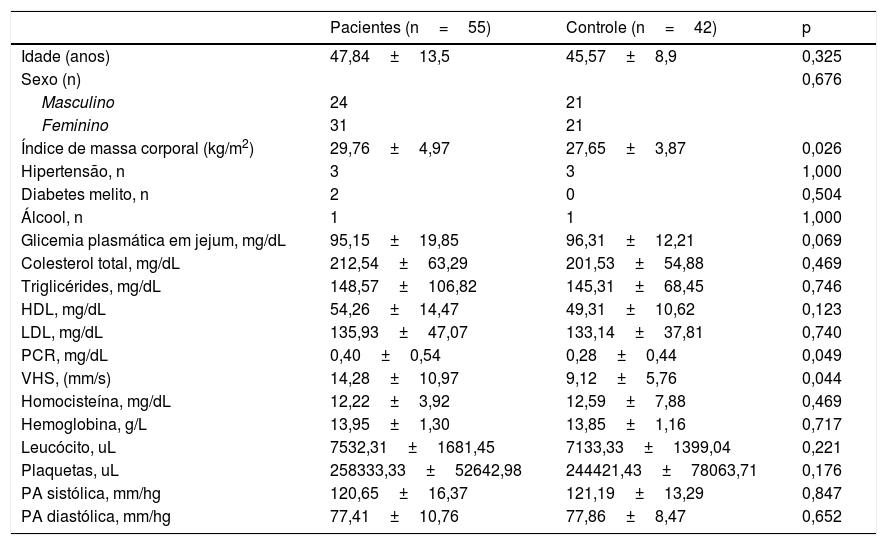
ResultadosO estudo incluiu 55 pacientes (31 mulheres, 24 homens, média de 47,84±13,55 anos) e 42 indivíduos controle (21 mulheres, 21 homens e média de 45,57±8,91 anos). O comprometimento ocorreu no tronco em 28 pacientes (51%), nas extremidades em 40 (73%), na mucosa oral em 37 (67%), na mucosa genital em oito (15%) e nas unhas em três (6%). Lesões reticulares brancas estavam presentes em 25 (68%) dos pacientes com comprometimento da mucosa oral e foram observadas erosões em 12 (32%). A duração média da doença foi de 4,09±4,46 anos. A duração média da doença foi significativamente maior nos pacientes com LP erosivo oral (8,16±4,19 anos) do que nos demais pacientes (2,96±3,86 anos; p <0,001). A tabela 1 apresenta os dados clínicos e laboratoriais da população estudada. O índice de massa corporal foi significativamente maior nos pacientes do que nos controles (p=0,02). Não foram observadas diferenças estatisticamente significativas nas demais características nem comorbidades cardiovasculares entre os grupos paciente e controle. Marcadores inflamatórios, como PCR e VHS, foram significativamente maiores em pacientes com LP (p=0,049 e p=0,044, respectivamente), enquanto nenhuma diferença foi determinada em outros parâmetros laboratoriais.
Características clínicas, comorbidades cardiovasculares e dados laboratoriais de pacientes com líquen plano e controles
| Pacientes (n=55) | Controle (n=42) | p | |
|---|---|---|---|
| Idade (anos) | 47,84±13,5 | 45,57±8,9 | 0,325 |
| Sexo (n) | 0,676 | ||
| Masculino | 24 | 21 | |
| Feminino | 31 | 21 | |
| Índice de massa corporal (kg/m2) | 29,76±4,97 | 27,65±3,87 | 0,026 |
| Hipertensão, n | 3 | 3 | 1,000 |
| Diabetes melito, n | 2 | 0 | 0,504 |
| Álcool, n | 1 | 1 | 1,000 |
| Glicemia plasmática em jejum, mg/dL | 95,15±19,85 | 96,31±12,21 | 0,069 |
| Colesterol total, mg/dL | 212,54±63,29 | 201,53±54,88 | 0,469 |
| Triglicérides, mg/dL | 148,57±106,82 | 145,31±68,45 | 0,746 |
| HDL, mg/dL | 54,26±14,47 | 49,31±10,62 | 0,123 |
| LDL, mg/dL | 135,93±47,07 | 133,14±37,81 | 0,740 |
| PCR, mg/dL | 0,40±0,54 | 0,28±0,44 | 0,049 |
| VHS, (mm/s) | 14,28±10,97 | 9,12±5,76 | 0,044 |
| Homocisteína, mg/dL | 12,22±3,92 | 12,59±7,88 | 0,469 |
| Hemoglobina, g/L | 13,95±1,30 | 13,85±1,16 | 0,717 |
| Leucócito, uL | 7532,31±1681,45 | 7133,33±1399,04 | 0,221 |
| Plaquetas, uL | 258333,33±52642,98 | 244421,43±78063,71 | 0,176 |
| PA sistólica, mm/hg | 120,65±16,37 | 121,19±13,29 | 0,847 |
| PA diastólica, mm/hg | 77,41±10,76 | 77,86±8,47 | 0,652 |
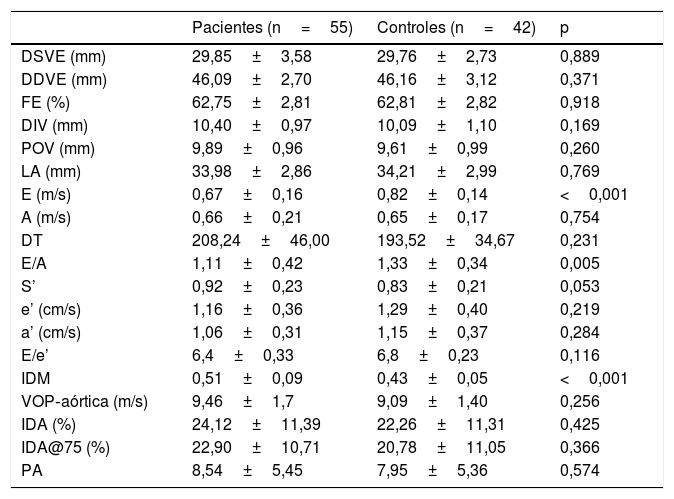
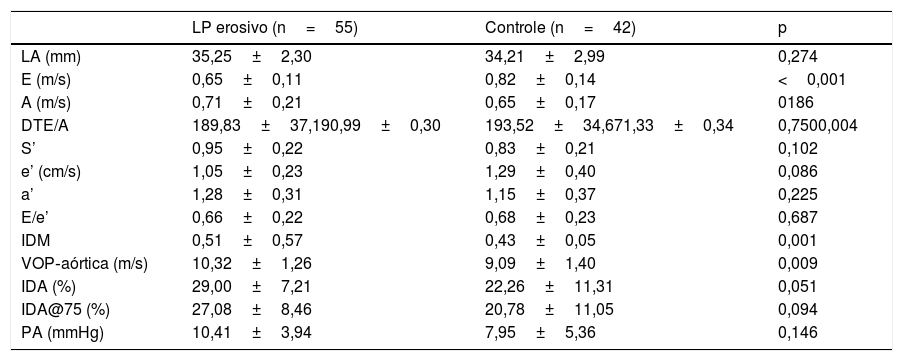
A tabela 2 apresenta as medidas ecocardiográficas transtorácicas e os achados de rigidez arterial na população estudada. A velocidade do IDM e E, bem como a relação E/A, todos marcadores de disfunção diastólica, diferiram significativamente entre os pacientes com LP e os controles (p <0,001, p <0,001 e p=0,005, respectivamente). Não foi observada diferença estatisticamente significativa nas medidas de rigidez arterial entre os grupos paciente e controle, embora a rigidez tenha sido significativamente maior nos pacientes com LP oral erosivo (10,32±1,26) em comparação com o grupo controle (9,09±1,40) e com os demais pacientes com LP (9,12±1,75; p=0,009 e p=0,023, respectivamente; tabela 3). Os níveis médios de VHS foram 21,50±13,40mm/s nos pacientes com LP erosivo e 12,21±9,37mm/s nos outros pacientes; os níveis de PCR foram significativamente maiores no grupo LP erosivo (0,78±0,89mg/dL) em comparação com os demais pacientes com LP (0,29±0,33mg/dL; p=0,01 e p=0,002, respectivamente).
Parâmetros de rigidez arterial e ecocardiográficos nos pacientes e controles
| Pacientes (n=55) | Controles (n=42) | p | |
|---|---|---|---|
| DSVE (mm) | 29,85±3,58 | 29,76±2,73 | 0,889 |
| DDVE (mm) | 46,09±2,70 | 46,16±3,12 | 0,371 |
| FE (%) | 62,75±2,81 | 62,81±2,82 | 0,918 |
| DIV (mm) | 10,40±0,97 | 10,09±1,10 | 0,169 |
| POV (mm) | 9,89±0,96 | 9,61±0,99 | 0,260 |
| LA (mm) | 33,98±2,86 | 34,21±2,99 | 0,769 |
| E (m/s) | 0,67±0,16 | 0,82±0,14 | <0,001 |
| A (m/s) | 0,66±0,21 | 0,65±0,17 | 0,754 |
| DT | 208,24±46,00 | 193,52±34,67 | 0,231 |
| E/A | 1,11±0,42 | 1,33±0,34 | 0,005 |
| S’ | 0,92±0,23 | 0,83±0,21 | 0,053 |
| e’ (cm/s) | 1,16±0,36 | 1,29±0,40 | 0,219 |
| a’ (cm/s) | 1,06±0,31 | 1,15±0,37 | 0,284 |
| E/e’ | 6,4±0,33 | 6,8±0,23 | 0,116 |
| IDM | 0,51±0,09 | 0,43±0,05 | <0,001 |
| VOP‐aórtica (m/s) | 9,46±1,7 | 9,09±1,40 | 0,256 |
| IDA (%) | 24,12±11,39 | 22,26±11,31 | 0,425 |
| IDA@75 (%) | 22,90±10,71 | 20,78±11,05 | 0,366 |
| PA | 8,54±5,45 | 7,95±5,36 | 0,574 |
DDVE, diâmetro diastólico final do ventrículo esquerdo; DSVE, diâmetro sistólico final do ventrículo esquerdo; DIV, diâmetro interventricular.
Parâmetros de rigidez arterial e ecocardiográficos em pacientes com LP erosivo e controles
| LP erosivo (n=55) | Controle (n=42) | p | |
|---|---|---|---|
| LA (mm) | 35,25±2,30 | 34,21±2,99 | 0,274 |
| E (m/s) | 0,65±0,11 | 0,82±0,14 | <0,001 |
| A (m/s) | 0,71±0,21 | 0,65±0,17 | 0186 |
| DTE/A | 189,83±37,190,99±0,30 | 193,52±34,671,33±0,34 | 0,7500,004 |
| S’ | 0,95±0,22 | 0,83±0,21 | 0,102 |
| e’ (cm/s) | 1,05±0,23 | 1,29±0,40 | 0,086 |
| a’ | 1,28±0,31 | 1,15±0,37 | 0,225 |
| E/e’ | 0,66±0,22 | 0,68±0,23 | 0,687 |
| IDM | 0,51±0,57 | 0,43±0,05 | 0,001 |
| VOP‐aórtica (m/s) | 10,32±1,26 | 9,09±1,40 | 0,009 |
| IDA (%) | 29,00±7,21 | 22,26±11,31 | 0,051 |
| IDA@75 (%) | 27,08±8,46 | 20,78±11,05 | 0,094 |
| PA (mmHg) | 10,41±3,94 | 7,95±5,36 | 0,146 |
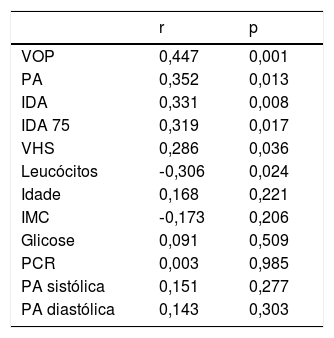
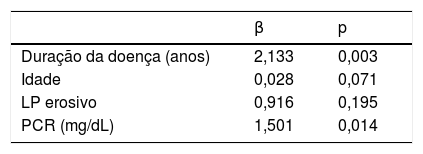
A correlação entre a duração da doença e a rigidez arterial e os parâmetros ecocardiográficos e laboratoriais são apresentados na tabela 4. Observou‐se uma correlação positiva entre a duração da doença e os marcadores de rigidez arterial. Os efeitos dependentes do LP erosivo, duração da doença, idade do paciente e níveis de PCR na rigidez arterial foram avaliados por meio de análise de regressão e observou‐se que o aumento da duração da doença e os níveis de PCR constituem riscos para o desenvolvimento de rigidez (tabela 5).
Correlações entre duração da doença e rigidez arterial, parâmetros ecocardiográficos e laboratoriais
| r | p | |
|---|---|---|
| VOP | 0,447 | 0,001 |
| PA | 0,352 | 0,013 |
| IDA | 0,331 | 0,008 |
| IDA 75 | 0,319 | 0,017 |
| VHS | 0,286 | 0,036 |
| Leucócitos | ‐0,306 | 0,024 |
| Idade | 0,168 | 0,221 |
| IMC | ‐0,173 | 0,206 |
| Glicose | 0,091 | 0,509 |
| PCR | 0,003 | 0,985 |
| PA sistólica | 0,151 | 0,277 |
| PA diastólica | 0,143 | 0,303 |
No presente estudo, a rigidez arterial foi significativamente maior no tipo erosivo de LP, que evolui com erosões resistentes na boca e/ou mucosa genital. Também foi observada uma correlação positiva entre a duração da doença e a rigidez arterial. Os níveis de PCR e VHS foram significativamente mais altos nos pacientes com LP do que no grupo controle; eles também foram significativamente mais altos nos pacientes com LP erosivo do que nos pacientes sem LP erosivo. Com base nesses achados, os autores concluem que os níveis de rigidez arterial aumentam na forma oral erosiva do LP e que uma duração prolongada da doença aumenta a rigidez arterial.
LP é uma doença que progride com inflamação crônica, semelhante à psoríase vulgar, na qual se observa uma resposta imune mediada por células T acompanhada de disfunção endotelial. Enquanto os linfócitos T auxiliares predominam no infiltrado dérmico nas lesões precoces, a infiltração de células T citotóxicas CD8+é observada nas lesões tardias. As células T ativadas induzem citocinas e células inflamatórias, como o fator de necrose tumoral‐α (TNF‐α), interleucina‐2 (IL‐2) e interferon‐γ (IFN‐γ), levam a danos aos queratinócitos3. Além disso, citocinas elevadas, como IL‐2, IL‐6 e TNF‐α, produzem metaloproteinases que reduzem o conteúdo da íntima aórtica e, portanto, podem promover aumento da rigidez arterial.14 Um aumento das espécies reativas de oxigênio e de peróxidos lipídicos também foi apontado na patogênese do LP.15 Aumentos de 50% nas taxas de DCV, como infarto do miocárdio e acidente vascular cerebral, foram observados em indivíduos com várias doenças inflamatórias crônicas, como psoríase, artrite reumatoide e doença inflamatória intestinal, quando comparados com a população em geral.16 Da mesma forma, vários estudos examinaram a relação entre LP e comorbidades cardiovasculares e metabólicas; foram relatadas prevalências aumentadas de síndrome metabólica, dislipidemia e hipertensão.2,4,6 Em um estudo anterior, os presentes autores observaram uma prevalência aumentada de síndrome metabólica no LP, particularmente na forma oral.17
A disfunção diastólica pode ser o primeiro sinal de DCV e doenças metabólicas. O tempo de relaxamento isovolumétrico (TRIV), a razão de velocidades de enchimento ventricular precoce e tardia e o tempo de desaceleração precoce do fluxo foram usados para avaliar a função diastólica na ecocardiografia.18 A disfunção diastólica do VE é uma condição clinicamente significativa. A disfunção diastólica pode, por si só, dar origem a sintomas e achados de insuficiência cardíaca, mesmo que as funções sistólicas sejam normais. As funções diastólicas do coração dependem de fatores inter‐relacionados complexos. As principais causas de disfunção diastólica são idade avançada, hipertensão e cardiopatia isquêmica, embora várias doenças que progridem com inflamação sistêmica também possam afetar as funções diastólicas do VE. Estudos anteriores determinaram o comprometimento das funções cardíacas em doenças relacionadas à inflamação difusa, como AR e psoríase.19,20 Da mesma forma, um estudo das funções sistólica e diastólica do VE em pacientes com LP determinou diferenças significativas nos pacientes em comparação com um grupo controle.14 No presente estudo, a disfunção diastólica foi similarmente maior no grupo de pacientes. Embora a relação E/A tenha sido menor do que no grupo controle, ainda estava dentro da faixa normal nos dois grupos. Isso indica que o comprometimento existente é muito baixo. Ao serem semelhantes ao do grupo controle, as medidas de disfunção diastólica, como TD, dimensão do AE e E/e, respaldam essa teoria. Achados semelhantes foram observados quando pacientes com LP erosivo, com maior inflamação e duração da doença, foram analisados separadamente, ao contrário do observado por Koseoglu et al. Considerando esses achados, o LP parece ter um efeito leve na disfunção diastólica do ventrículo esquerdo. O IDM foi avaliado no presente estudo, pois reflete a função global do coração no nível subclínico. Similarmente a estudos anteriores, o IDM foi significativamente maior nos pacientes com LP14. Um efeito semelhante foi determinado no grupo de pacientes com LP erosivo.
A avaliação da rigidez arterial e das características elásticas da aorta por meio de reflexões de ondas tem sido amplamente usada na avaliação clínica de pacientes com doenças inflamatórias.21 A rigidez arterial é uma condição sistêmica que causa um impacto nas funções cardíacas; reflexões de ondas maiores também contribuem para o risco de DCV.16,21–23 A VOP carotidofemoral é um indicador de rigidez aórtica do tipo elástico, enquanto o IDA é um marcador de reflexão da onda. A VOP carotidofemoral e o IDA são os métodos padrão‐ouro. O aumento da rigidez arterial afeta adversamente as funções sistólica e diastólica do miocárdio e a estrutura cardíaca.24
A inflamação sistêmica crônica pode levar à aterosclerose, que progredirá enquanto a inflamação persistir. Acredita‐se que a inflamação e a disfunção endotelial existentes no LP sejam capazes de aumentar a rigidez arterial, resultem em danos na parede arterial.14,25 Um estudo anterior indicou aumento da rigidez arterial e dos valores do IDM em pacientes com LP em comparação ao grupo controle. Nesse estudo, Koseoglu et al. avaliaram a rigidez arterial por ecocardiografia. A rigidez aórtica significativamente alta foi determinada independentemente do tipo de doença em comparação com o grupo controle.14 Em contraste com o estudo daqueles autores, no presente estudo não foi observada diferença significativa na rigidez arterial entre os grupos de pacientes e controle, mas uma rigidez significativamente maior foi observada em pacientes com LP oral erosivo. Similarmente a outros estudos, foi observada uma correlação positiva entre a duração da doença e a rigidez arterial, avaliada por meio da VOP. A avaliação da rigidez por VOP e IDA é o padrão‐ouro, mais sensíveis do que a ecocardiografia. Em contraste com outros estudos, todos os parâmetros de rigidez arterial foram semelhantes nos grupos de pacientes e controle no presente estudo, mas uma rigidez arterial significativamente maior foi observada em pacientes com LP erosivo. Com base nesses achados, pode‐se concluir que a rigidez arterial no LP é mais comumente observada em pacientes com maior duração da doença e maior inflamação. Apesar da ausência de comprometimento acentuado das funções cardíacas no grupo de pacientes, a elevação acentuada da rigidez arterial sugere que a inflamação é mais danosa no nível das células vasculares do que no nível do miocárdio. Mais estudos no nível celular são necessários para elucidar esse ponto.
Sabe‐se que a homocisteína produz efeitos pró‐aterogênicos e pode desempenhar um papel no dano endotelial.18 A PCR é depositada na íntima arterial nas lesões ateroscleróticas precoces, induz um fenótipo inflamatório e aterogênico nas células endoteliais e estimula a migração e proliferação de células musculares lisas vasculares.26 Saleh et al. relataram homocisteína, fibrinogênio e PCR‐as significativamente mais altos em pacientes com LP do que nos controles.2 Entretanto, no presente estudo os níveis de homocisteína foram semelhantes, mas os valores de PCR e VHS foram maiores no grupo de pacientes e, principalmente, nos pacientes com LP erosivo.
O número relativamente baixo de pacientes no presente estudo deve ser considerado uma limitação. São necessários mais estudos com um número maior para respaldar as presentes conclusões.
ConclusãoFoi observada correlação significativa entre rigidez arterial e duração da doença em pacientes com LP, particularmente naqueles com LP erosivo, uma forma resistente. Com base nos presentes achados, o risco de doença cardiovascular é maior em indivíduos com uma duração mais longa da doença e com uma forma resistente e esses pacientes devem ser submetidos a um monitoramento mais constante.
Suporte financeiroUnidade de Pesquisa Científica da Universidade Técnica Karadeniz, sob o projeto número 5554.
Contribuição dos autoresLeyla Baykal Selcuk: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Mursel Sahin: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Deniz Aksu Arıca: Concepção e planejamento do estudo.
Asım Orem: Concepção e planejamento do estudo.
Zeynep Karaca Ural: Análise estatística; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa.
Savaş Yaylı: Concepção e planejamento do estudo; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
A todos os colegas pela cooperação e participação no estudo. Ao Prof. Dr. Sevgi Bahadir (Departamento de Dermatologia, Faculdade de Medicina, Universidade Técnica Karadeniz, Trabzon, Turquia), Prof. Dr. Merih Kutlu (Departamento de Cardiologia, Faculdade de Medicina, Universidade Técnica Karadeniz, Trabzon, Turquia) pelo apoio habitual.
Como citar este artigo: Baykal Selcuk L, Sahin M, Arica DA, Orem A, Ural ZK, Yaylı S. Impairment of myocardial functions and arterial stiffness in patients with lichen planus. An Bras Dermatol. 2020;95:180–186.
Trabalho realizado nos Departamentos de Dermatologia, Cardiologia e Bioquímica, Faculdade de Medicina, Universidade Técnica Karadeniz, Trabzon, Turquia.