Os ácaros Demodex são encontrados na pele de muitos indivíduos saudáveis. Considera‐se que a presença dos ácaros Demodex em grande quantidade desempenha um papel patogênico.
ObjetivoInvestigar a associação entre a infestação por Demodex e as três dermatoses faciais mais comuns: acne vulgar, rosácea e dermatite seborreica.
MétodosEstudo prospectivo observacional de caso‐controle que incluiu 127 pacientes (43 com acne vulgar, 43 com rosácea e 41 com dermatite seborreica e 77 controles saudáveis). A presença de demodicose foi avaliada por biópsia padronizada da superfície da pele nos grupos paciente e controle.
ResultadosEm termos de sexo e idade, não foi encontrada diferença significativa entre os pacientes e os controles (p> 0,05). As taxas de infestação por Demodex foram significativamente maiores nos pacientes do que nos controles (p=0,001). As taxas de infestação por Demodex foram significativamente maiores no grupo rosácea do que nos grupos de acne vulgar e dermatite seborreica e controles (p=0,001; p=0,024; p=0,001, respectivamente). A infestação por Demodex foi significativamente maior nos grupos de acne vulgar e dermatite seborreica do que nos controles (p=0,001 e p=0,001, respectivamente). Não foi observada diferença entre os grupos acne vulgar e dermatite seborreica em termos de demodicose (p=0,294).
Limitações do estudoO tamanho pequeno da amostra é uma limitação do estudo. A falta de um sistema objetivo de pontuação no diagnóstico da infestação por Demodex é outra limitação.
ConclusãoOs achados do presente estudo enfatizam que a acne vulgar, a rosácea e a dermatite seborreica estão significativamente associadas à infestação por Demodex. A biópsia padronizada da superfície da pele é uma ferramenta prática na determinação da infestação por Demodex.
Os ácaros Demodex foram relatados pela primeira vez por Jakup Henle em 1871; descrições detalhadas e demonstrações do patógeno foram feitas nos anos seguintes.1 O ácaro Demodex pertence à família Demodicidae. Demodex folliculorum e Demodex brevis são os dois tipos de ácaros Demodex presentes na pele e nos folículos pilosos humanos.2 Embora o parasita possa ser encontrado em todas as áreas da pele humana, o ácaro tem uma predileção pela área facial. Os ácaros Demodex podem ser encontrados na pele normal a uma densidade <5 ácaros/cm2. O diagnóstico de demodicose ou infestação por Demodex é feito quando surgem sinais/sintomas clínicos e quando mais de 5 ácaros/cm2 estão presentes ou quando penetram na derme.3–6
Recentemente, estudos que avaliam infestações por Demodex aumentaram. O papel da demodicose foi investigado em algumas dermatoses faciais e foi relatado que os ácaros Demodex estão associados a várias manifestações cutâneas, inclusive pitiríase folicular,3 rosácea papulopustular e granulomatosa,4,5 foliculite pustular,7 pápula inflamatória,8 foliculite,9 dermatite seborreica (DS),10 dermatite perioral11 e blefarite.12,13
Rosácea, acne vulgar (AV) e DS são as três dermatoses inflamatórias faciais mais comuns; eles afetam a unidade pilossebácea e têm predileção pelas áreas faciais ricas em glândulas sebáceas. 6 Os ácaros Demodex também são encontrados na unidade pilossebácea, causam inflamação e levam a reações imunológicas.10 O presente estudo foi feito para investigar a associação entre AV, rosácea, DS e demodicose.
MétodosO estudo foi revisado e aprovado pelo comitê de ética local (protocolo n° 22481095‐020‐1956, data de aprovação: 19/09/2018) e todos os participantes assinaram um termo de consentimento livre e esclarecido. O estudo foi feito em consonância com os princípios expressos na Declaração de Helsinque.
Um estudo de caso‐controle foi planejado para investigar a relação entre demodicose e dermatoses faciais, como AV, rosácea e DS. Pacientes com apenas AV papulopustular e apenas rosácea papulopustular foram incluídos. No grupo DS, pacientes com comprometimento da área malar, sobrancelhas e/ou área do queixo ou bochecha foram incluídos no estudo. Todos os diagnósticos foram feitos com base em exames clínicos pelo mesmo dermatologista. Variantes complicadas de cada doença foram excluídas do estudo.
O estudo incluiu 127 pacientes (43 com AV, 43 com rosácea e 41 com DS) e 77 controles saudáveis. O grupo controle foi composto por 77 pessoas saudáveis, estudantes de medicina ou funcionários do hospital, pareados por idade e sexo, que não tinham doença e não recebiam tratamento sistêmico ou tópico. Todos os participantes tinham pele tipo 2 ou 3 de Fitzpatrick. Para cada paciente, foram registrados idade, sexo, diagnóstico clínico, sintomas, outras possíveis dermatoses faciais, tratamento recente para a condição facial e data da consulta. Nenhum dos sujeitos estava sob tratamento tópico, inclusive hidratantes, nos últimos dois meses. Indivíduos com histórico de qualquer tratamento facial ablativo (por exemplo, peeling e laser) nos seis meses anteriores também foram excluídos. Também foram excluídos pacientes com histórico de qualquer doença sistêmica, tratamento sistêmico nos seis meses anteriores ao estudo e tabagistas.
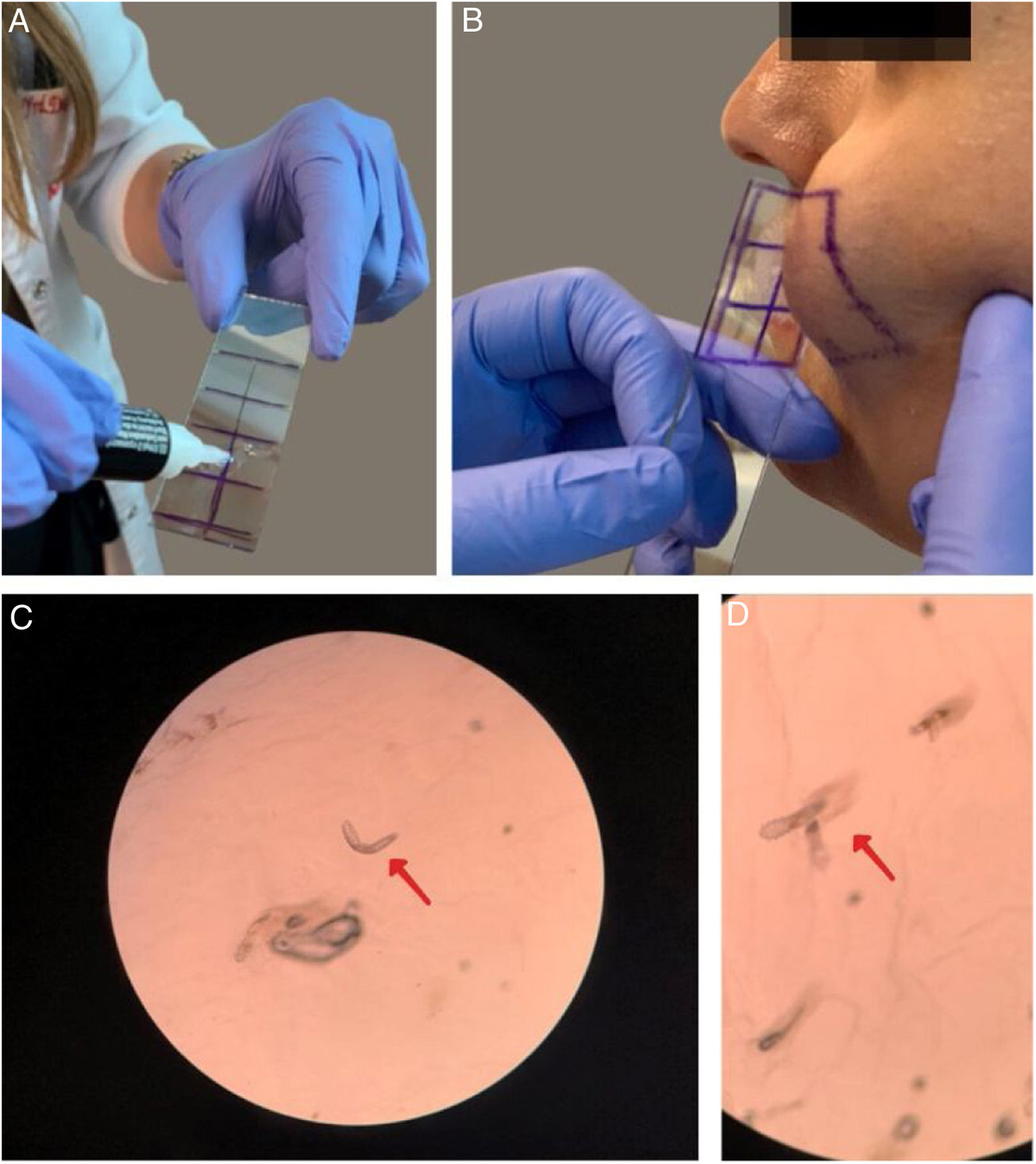
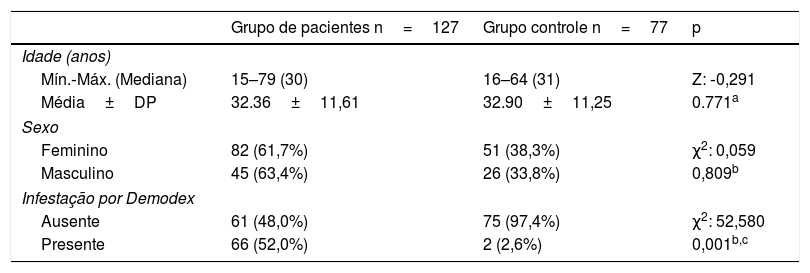
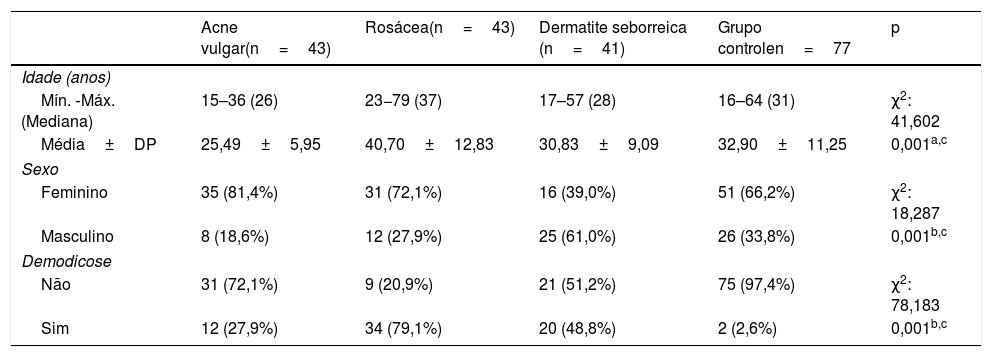
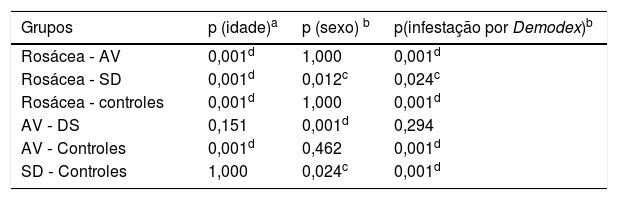
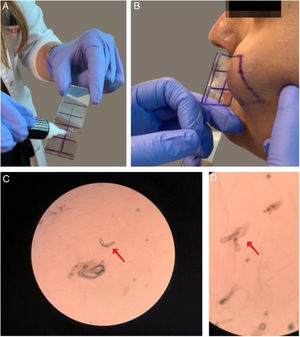
A presença de demodicose foi avaliada pelo mesmo dermatologista em cada paciente. O exame microscópico dos ácaros foi feito por biópsia padronizada da superfície da pele (BPSP) com cola de cianoacrilato nos grupos de pacientes e controle. Duas amostras foram coletadas na face para exame de ácaros das lesões eritematosas/inflamatórias da doença. Nos controles, as amostras foram coletadas nas bochechas e na área frontal. Uma lâmina coberta com cola de cianoacrilato e com um quadrado assinalado na superfície foi pressionado contra a superfície da pele. Após 30 segundos, a lâmina foi removida e as amostras foram coletadas. A preparação foi examinada sob um microscópio óptico com as objetivas de 40× e 100×. A figura 1 apresenta o resultado da BPSP. O resultado foi considerado positivo quando havia mais de cinco ácaros Demodex em uma área de 1cm2 na BPSP.14 A maioria dos Demodex observados por BPSP foi D. folliculorum. D. brevis, que vive principalmente mais profundamente nas glândulas sebáceas, raramente é observado nesse método de amostragem.15
O exame microscópico dos ácaros foi feito por biópsia padronizada de superfície da pele (BPSP) com cola de cianoacrilato nos grupos de pacientes e controles. (a) Preparação da lâmina com cola de cianoacrilato; (b) Coleta da amostra na bochecha; (c e d) Exame microscópico dos ácaros Demodex (40×).
O programa Number Cruncher Statistical System 2007 (NCSS; Kaysville, Utah, EUA) foi usado para a análise estatística. Os dados descritivos foram expressos como média±desvio‐padrão, mediana, frequência e razão. Na análise de variáveis normalmente distribuídas, foi aplicado o teste independente de Shapiro‐Wilks para discernir as diferenças entre os dois grupos. As diferenças entre os dois grupos independentes também foram examinadas com o teste de Kruskal‐Wallis e o teste de Dunn para variáveis distribuídas normalmente. Para comparação das variáveis qualitativas, foram usados os testes U de Mann‐Whitney, Pearson × 2 e o Bonferroni corrigido × 2 post‐hoc. Os resultados estavam dentro do intervalo de confiança de 95%, e valores p <0,05 foram considerados estatisticamente significativos.
ResultadosForam incluídos no estudo 204 indivíduos, inclusive 127 pacientes com dermatose facial e 77 controles saudáveis. Em termos de sexo e idade, não foi observada diferença significativa entre os pacientes e os controles (p> 0,05); 66 dos 127 pacientes (52,0%) apresentaram infestação por Demodex, observada em apenas dois dos 77 controles saudáveis (2,6%). As taxas de infestação por Demodex foram significativamente maiores nos pacientes do que nos controles (p=0,001; tabela 1).
Dados demográficos e presença de infestação por Demodex em pacientes e controles
| Grupo de pacientes n=127 | Grupo controle n=77 | p | |
|---|---|---|---|
| Idade (anos) | |||
| Mín.‐Máx. (Mediana) | 15–79 (30) | 16–64 (31) | Z: ‐0,291 |
| Média±DP | 32.36±11,61 | 32.90±11,25 | 0.771a |
| Sexo | |||
| Feminino | 82 (61,7%) | 51 (38,3%) | χ2: 0,059 |
| Masculino | 45 (63,4%) | 26 (33,8%) | 0,809b |
| Infestação por Demodex | |||
| Ausente | 61 (48,0%) | 75 (97,4%) | χ2: 52,580 |
| Presente | 66 (52,0%) | 2 (2,6%) | 0,001b,c |
Os grupos de pacientes foram compostos por 43 pacientes com AV, 43 com rosácea e 41 com DS. As tabelas 2 e 3 apresentam as comparações feitas entre esses grupos e controles.
Comparação dos dados demográficos e presença de infestação por Demodex entre pacientes com acne vulgar, rosácea, dermatite seborreica e controles
| Acne vulgar(n=43) | Rosácea(n=43) | Dermatite seborreica (n=41) | Grupo controlen=77 | p | |
|---|---|---|---|---|---|
| Idade (anos) | |||||
| Mín. ‐Máx. (Mediana) | 15–36 (26) | 23−79 (37) | 17–57 (28) | 16–64 (31) | χ2: 41,602 |
| Média±DP | 25,49±5,95 | 40,70±12,83 | 30,83±9,09 | 32,90±11,25 | 0,001a,c |
| Sexo | |||||
| Feminino | 35 (81,4%) | 31 (72,1%) | 16 (39,0%) | 51 (66,2%) | χ2: 18,287 |
| Masculino | 8 (18,6%) | 12 (27,9%) | 25 (61,0%) | 26 (33,8%) | 0,001b,c |
| Demodicose | |||||
| Não | 31 (72,1%) | 9 (20,9%) | 21 (51,2%) | 75 (97,4%) | χ2: 78,183 |
| Sim | 12 (27,9%) | 34 (79,1%) | 20 (48,8%) | 2 (2,6%) | 0,001b,c |
Comparações de subgrupos em termos de idade, sexo e presença de infestação por Demodex
| Grupos | p (idade)a | p (sexo) b | p(infestação por Demodex)b |
|---|---|---|---|
| Rosácea ‐ AV | 0,001d | 1,000 | 0,001d |
| Rosácea ‐ SD | 0,001d | 0,012c | 0,024c |
| Rosácea ‐ controles | 0,001d | 1,000 | 0,001d |
| AV ‐ DS | 0,151 | 0,001d | 0,294 |
| AV ‐ Controles | 0,001d | 0,462 | 0,001d |
| SD ‐ Controles | 1,000 | 0,024c | 0,001d |
AV, acne vulgar; DS, dermatite seborreica.
A idade média dos pacientes com rosácea foi significativamente maior do que nos pacientes com AV, pacientes com DS e controles (p=0,001, p=0,001 e p=0 0,001, respectivamente). A idade média dos pacientes com AV foi significativamente menor do que a os controles (p=0,003).
Quanto ao sexo, a proporção masculino‐feminino foi significativamente maior no grupo DS em comparação com os grupos AV, DS e controle (p=0,012, p=0,001 e p=0,024, respectivamente).
As taxas de infestação por Demodex foram significativamente maiores no grupo rosácea do que nos grupos AV, DS e controles (p=0,001, p=0,024 e p=0,001, respectivamente). A infestação por Demodex foi significativamente maior nos grupos AV e DS do que nos controles (p=0,001 e p=0,001, respectivamente). Não foi observada diferença entre os grupos AV e DS em termos de demodicose (p=0,294).
DiscussãoEste estudo demonstrou que a infestação por Demodex estava associada a AV, rosácea e DS. A maior incidência de infestação foi observada nos pacientes com rosácea, seguida por DS e AV. A presença de infestação por Demodex foi significativamente maior nos pacientes com rosácea do que nos pacientes com AV e SD e controles, enquanto a infestação foi significativamente mais comum nos pacientes com AV e SD em comparação com os controles.
D. folliculorum e D. brevis, as duas espécies de Demodex, são costumeiramente encontradas na pele normal de humanos adultos, particularmente nas unidades pilossebáceas da face.16D. folliculorum reside dentro do folículo piloso, enquanto D. brevis é encontrado predominantemente nas glândulas sebáceas e meibomianas.2 Os ácaros Demodex penetram nas células da pele (particularmente nos queratinócitos que revestem os folículos pilossebáceos) e ingerem seu conteúdo. Os ácaros Demodex alimentam‐se do sebo e das proteínas celulares obtidas pela ação da protease contida nas enzimas salivares dos ácaros.16,17 Acredita‐se também que as enzimas lipase do Demodex desempenhem um papel na digestão de bactérias ou outros micro‐organismos, além da digestão do material lipídico.18,19 O processo enzimático leva à degradação do epitélio folicular, o que pode resultar em inflamação perifolicular.16,17 Os ácaros Demodex também podem causar bloqueio mecânico da abertura do folículo. Além disso, acredita‐se que os ácaros extrafoliculares possam induzir uma reação granulomatosa do tipo por corpo estranho por meio de seu exoesqueleto quitinoso. Acredita‐se que os ácaros moribundos desencadeiem uma resposta imune no hospedeiro, liberem seu conteúdo interno e os exoesqueletos quitinosos dos ácaros moribundos e em decomposição e causem alterações inflamatórias.20–22 Os ácaros Demodex também podem suprimir a resposta imune inata dos hospedeiros para garantir sua sobrevivência.16 Foi demonstrado que o antígeno Tn, um revestimento de carboidratos que protege células cancerígenas e parasitas de reações imunologicamente mediadas, é expresso pelos ácaros Demodex.23,24 Também foi demonstrado que os ácaros Demodex afetam a secreção de citocinas inflamatórias, como a expressão de IL‐8 e TNF‐alfa e TLR, por meio da interação com as células da unidade pilossebácea.23–28
A causa dos achados clínicos na infestação por Demodex ainda é desconhecida; entretanto, considera‐se que os mecanismos mencionados acima desempenhem um papel na ocorrência dessa infestação. Embora a demodicose tenha sido demonstrada em várias condições da pele, o papel dos ácaros Demodex em condições dermatológicas ainda é controverso.
A AV é uma doença multifatorial da unidade pilossebácea. Pode ser classificada como acne comedônica, papulopustular e nodular. Embora a etiologia da AV permaneça desconhecida, andrógenos, aumento da secreção sebácea, hiperceratose do ducto pilossebáceo, bloqueio do orifício folicular e proliferação de Propionibacterium acne são alguns dos fatores que contribuem para o desenvolvimento da AV.29,30 Os ácaros Demodex podem contribuir para o desenvolvimento de lesões de acne por meio do bloqueio folicular, levam à distensão e hiperqueratose intrafolicular e causam inflamação e reações imunológicas.31,32
Muitos estudos que avaliam a relação entre AV e infestação por Demodex foram feitos recentemente. Positividade para Demodex foi observada em 11,8% dos 101 pacientes com AV em um estudo33 e 15,38% dos 78 pacientes com AV em outro estudo34. Outros autores não observaram uma associação significativa entre Demodex e AV.35 Em uma metanálise recente, 48 de 63 artigos demonstraram uma associação positiva entre infestação por Demodex e AV, enquanto 15 apresentaram achados controversos.31 No presente estudo, foi observada uma positividade para Demodex significativamente maior em pacientes com AV do que em controles saudáveis.
A rosácea é uma doença cutânea inflamatória crônica comum, observada principalmente em pacientes com mais de 30 anos, com períodos de remissão e exacerbação.36,37 Rubor, eritema, telangiectasia, edema, pápulas, pústulas, alterações fimatosas e lesões oculares são os sinais da doença.36–38 A rosácea pode ser classificada como rosácea eritematotelangiectática (ETR), rosácea papulopustular (PPR), rosácea fimatosa, rosácea ocular e rosácea granulomatosa de acordo com o sistema de classificação e estadiamento do Comitê de Especialistas da American National Rosacea Society (NRS), que também pode ser usado como uma ferramenta de diagnóstico.36,37 Vários fatores, inclusive anormalidades na homeostase vascular cutânea, exposições climáticas, degradação da matriz dérmica, agentes químicos e ingeridos, anormalidades das unidades pilossebáceas e organismos microbianos, são considerados envolvidos na patogênese, embora a etiologia da rosácea permaneça incerta.37,38 Recentemente, muitos estudos examinaram a relação entre os ácaros Demodex e a rosácea e demonstraram principalmente uma correlação positiva. Os ácaros Demodex podem contribuir para a patogênese da rosácea de várias maneiras. O bloqueio dos folículos pilosos e das glândulas sebáceas por um número maior de ácaros pode resultar em rompimento da barreira cutânea e danos aos tecidos. Aumentos subsequentes na expressão de TLR, exoesqueletos de quitina e liberação do conteúdo interno dos ácaros, inclusive antígenos bacterianos, podem desencadear uma reação inflamatória e também resultar em uma resposta imune, seguida de ativação de neutrófilos e macrófagos.26,27,39–41 Em particular, foi relatado que as respostas imunes mediadas por células T da rosácea ao Demodex desempenham um papel na patogênese. Os linfócitos T auxiliares/indutores CD4 foram predominantemente observados em granulomas e em infiltrados perifoliculares.5,42–44 Além disso, sugere‐se que a imunidade humoral também desempenhe um papel nas reações inflamatórias.45
Estudos clínicos revelaram um aumento no número de ácaros Demodex na pele de pacientes com rosácea em comparação com controles saudáveis.45 Foi relatado que a demodicose é maior nas bochechas dos pacientes com RPP do que nos controles com pele saudável.4,5,45,46 No presente estudo, 34 dos 43 pacientes com rosácea apresentaram infestações por Demodex, o que foi significativamente maior que os pacientes com AV e DS e controles saudáveis.
A DS, uma dermatose inflamatória crônica e superficial da pele, é caracterizada por escamas eritematosas, amarelas e oleosas nas áreas da pele ricas em glândulas sebáceas, inclusive as áreas do couro cabeludo, face, tórax, costas e de flexão.47,48 O aumento da atividade sebácea, infecção por Pityrosporum ovale, drogas, anormalidades imunológicas, predisposição genética, distúrbios neurológicos, estresse emocional, dieta, estilo de vida e fatores ambientais foram identificados como contribuintes na patogênese da doença ou agravantes dos sintomas de DS; entretanto, a etiologia exata da DS permanece desconhecida.10,49 Os ácaros Demodex tendem a ser encontrados nas áreas de predileção da DS. Os autores acreditam que a inflamação induzida por Demodex também pode contribuir na patogênese da DS. Karincaoglu et al.10 observaram quantidade significativamente maior de Demodex na pele lesional e não lesional de pacientes com DS do que controles saudáveis. Eles também sugeriram que a própria DS pode ser um fator predisponente à infestação por Demodex, mas não há dados que respaldem essa hipótese.10 No presente estudo, também foi observada uma maior presença de infestação por Demodex em pacientes com DS do que em controles.
O estudo tem algumas limitações. Por exemplo, o diagnóstico de infestação por Demodex foi feito sem um sistema de pontuação objetivo, o que limita extrapolações sobre a associação entre a gravidade da infestação e as dermatoses. D. folliculorum é o ácaro mais demonstrado pelo BPSP, pois reside dentro dos folículos, enquanto D. brevis vive em camadas mais profundas. A ausência de um exame para detectar D. brevis, que também pode contribuir na patogênese das doenças, é uma limitação do estudo. O pequeno tamanho da amostra é outra limitação.
ConclusãoAinda não está claro se a demodicose causa doenças na pele. Porém, com base nos achados do presente estudo, pode‐se concluir que rosácea, AV e DS estão significativamente associadas à infestação por Demodex. A reativação do sistema imunológico, a inflamação e as alterações foliculares causadas pelos ácaros Demodex podem contribuir para o desenvolvimento dessas doenças. O BPSP, uma ferramenta prática e facilmente acessível, pode ser usada para determinar a presença de uma infestação por Demodex. Particularmente nos casos resistentes a tratamento, deve‐se considerar uma infestação por Demodex.
Suporte financeiroNenhum.
Contribuição dos autoresEzgi Aktaş Karabay: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Aslı Aksu Çerman: Análise estatística; aprovação da versão final do manuscrito; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Aktas Karabay E, Aksu Çerman A. Demodex folliculorum infestations in common facial dermatoses: acne vulgaris, rosacea, seborrheic dermatitis. An Bras Dermatol. 2020;95:187–193.
Trabalho realizado no Departamento de Dermatologia, Faculdade de Medicina, Bahçeşehir Üniversitesi, Istambul, Turquia.