Nesta revisão não sistemática sobre o papiloma vírus humano (HPV) são abordados o diagnóstico complementar, o tratamento e as medidas de prevenção. Entre os métodos disponíveis para o diagnóstico complementar, discute‐se a histopatologia, método consagrado na prática dermatológica, suas indicações, principais achados e limitações. Sobre a microscopia eletrônica, discute‐se brevemente sua importância para os conhecimentos acumulados sobre o HPV e em pesquisas que buscam respostas que possam ser aplicadas na prática médica. São revistas as aplicações práticas do conhecimento molecular sobre o vírus em relação à sorologia, tipagem genômica e suas indicações. O enfoque na terapêutica é colocado nas opções disponíveis para tratamento das principais manifestações clínicas, com suas evidências e limitações, tanto aquelas de uso local quanto as propostas de tratamentos sistêmicos e o uso de medicações off label. Por fim, discutem‐se as medidas de prevenção, incluindo as vacinas e a educação em saúde. As vacinas são um recurso valioso na prevenção primária e estão disponíveis em vários países. Sua composição, indicações e efeitos adversos são abordados. Na educação em saúde, é enfatizada a infecção pelo HPV como doença de transmissão sexual e as dificuldades enfrentadas com as prevenções primária e secundária desse agravo.
Em artigo anterior, foram discutidos os aspectos da epidemiologia, a patogênese e as principais manifestações clínicas do papiloma vírus humano (HPV, do inglês human papillomavirus). Neste artigo de revisão não sistemática são abordados os tópicos de diagnóstico complementar, tratamento e medidas de prevenção.
Diagnóstico complementarHistopatologia e microscopia eletrônicaO exame histopatológico das lesões causadas pelo HPV deve ser considerado sempre que houver dúvida no diagnóstico diferencial e também diante de suspeita de malignidade, tanto na pele quanto nas mucosas. A colpocitologia oncótica permanece recomendada como exame periódico, para rastreio do câncer de colo de útero (CCU).1 Existem evidências de que a citopatologia para seguimento de pacientes de alto risco para desenvolvimento de câncer anal tem boa relação custo/efetividade – no entanto, seu uso rotineiro ainda é restrito.2
Sabe‐se que os HPV infectam células epiteliais e dependem da diferenciação epitelial para a conclusão de seu ciclo de vida.3 Ademais, a expressão dos produtos gênicos do vírus é regulada à medida que a célula basal infectada migra para a superfície epitelial. A expressão das proteínas E6 e E7, na parte inferior das camadas epiteliais, direciona as células para a fase S do ciclo celular, o que cria um ambiente propício para a replicação do genoma viral e para a proliferação celular. Consequentemente, haveria um estímulo para a hiperplasia epitelial que se traduziria, do ponto de vista histopatológico, como acantose e papilomatose.4
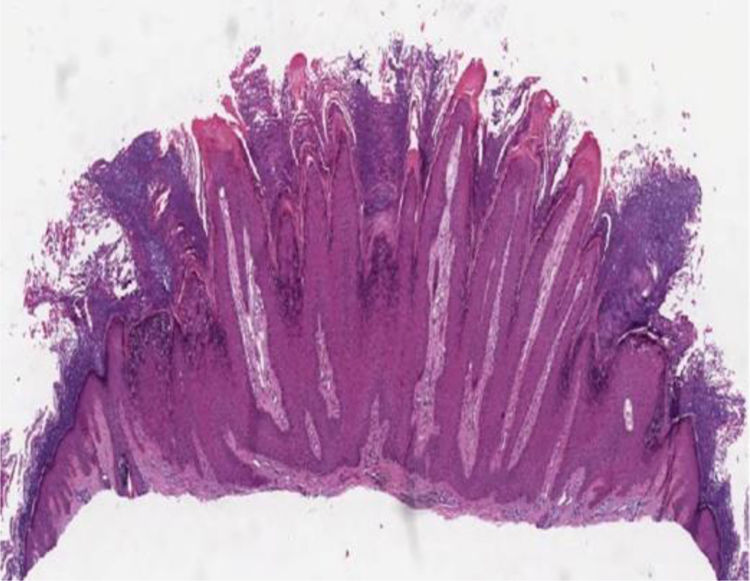
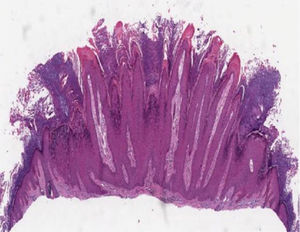
Histopatologia das lesões cutâneasVerruga vulgarAs características histológicas das verrugas vulgares são evidentes na epiderme, onde se observa presença de acantose, papilomatose, hiperceratose acentuada e colunas de paraceratose no topo dos cones epiteliais com ausência da camada granular, que se acentua nos vales entre os cones adjacentes.5 Nas áreas de paraceratose, pequenos acúmulos de sangue ou serosidade podem ser vistos.6 Os cones epiteliais alongados na borda da lesão exibem uma curvatura interna na base em direção ao centro da mesma, referida como arborização (fig. 1).
As três características histopatológicas usadas para distinguir a verruga comum de outros papilomas incluem: presença de focos de células vacuoladas, os coilócitos; colunas verticais de paraceratose; e focos adensados de grânulos cerato‐hialinos. Essas alterações epidérmicas características são mais bem observadas em verrugas jovens.
Os coilócitos (do grego koilos, cavidade), característicos da infecção por HPV, são observados no estrato superior de Malpighi e na camada granulosa. Caracterizam‐se por apresentar núcleos pequenos, redondos e densamente basofílicos, circundados por halo claro e com citoplasma pálido. Por vezes, essas lesões podem se assemelhar a ceratoses seborreicas em razão da perda de sua silhueta característica. As alterações dérmicas na verruga vulgar costumam ser mínimas. Cerca de 8% estão inflamadas e mostram infiltrado liquenoide. As verrugas filiformes mostram papilomatose bem mais evidente, com hiperceratose acentuada, capilares dilatados na derme e, por vezes, pequenos focos de hemorragia.5
Verrugas palmoplantaresNa histopatologia, as verrugas palmoplantares têm elementos comuns com a verruga vulgar; no entanto, seu crescimento endofítico mostra grande parte da lesão penetrando a derme, abaixo do plano da epiderme. Existem diferenças na aparência dos grânulos eosinofílicos de cerato‐hialina observados nas células da camada espinhosa, dependendo do tipo de HPV. As infecções por HPV do tipo 1 são associadas a grânulos grandes e citoplasma com vacuolização marcante, enquanto o tipo 4 se correlaciona com ceratinócitos grandes, claros, com núcleo pequeno e excêntrico e poucos grânulos de cerato‐hialina.
As lesões causadas pelo HPV‐2 têm microscopia semelhante à da verruga vulgar.6 Pequenos corpos de inclusão eosinofílicos intranucleares podem ser observados nas células do estrato superior de Malpighi. As células no estrato córneo tendem a reter seus núcleos, que aparecem como corpos redondos fortemente basófilicos envoltos por ampla zona clara.5,7
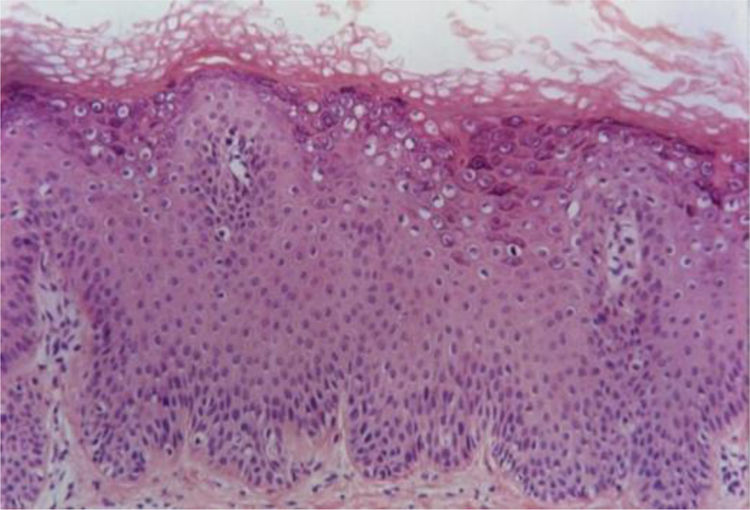
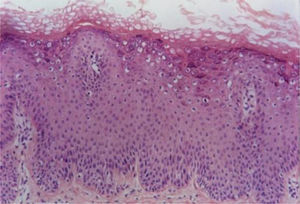
Verruga planaAs verrugas planas exibem hiperceratose e acantose com alongamento leve dos cones epiteliais. Uma característica distintiva dessas lesões é a ausência de papilomatose e paraceratose. As células no estrato superior malpighiano exibem vacuolização difusa e podem estar com tamanho aumentado. O estrato córneo tem aspecto em cesta bem evidente e aparência compacta por espessamento uniforme da camada granular (fig. 2). Na derme normal não se observa infiltrado inflamatório.5,6
Verrugas de açougueiroAs verrugas de açougueiro, induzidas por HPV‐7, mostram acantose proeminente e pequenas células vacuolizadas com picnose dos núcleos localizados centralmente. Essas células vacuolizadas estão presentes exclusivamente nos cones epiteliais proliferados, isoladas e circundadas por células granulares fortemente coradas. Esse efeito citopático é bastante característico da infecção pelo HPV‐7.7
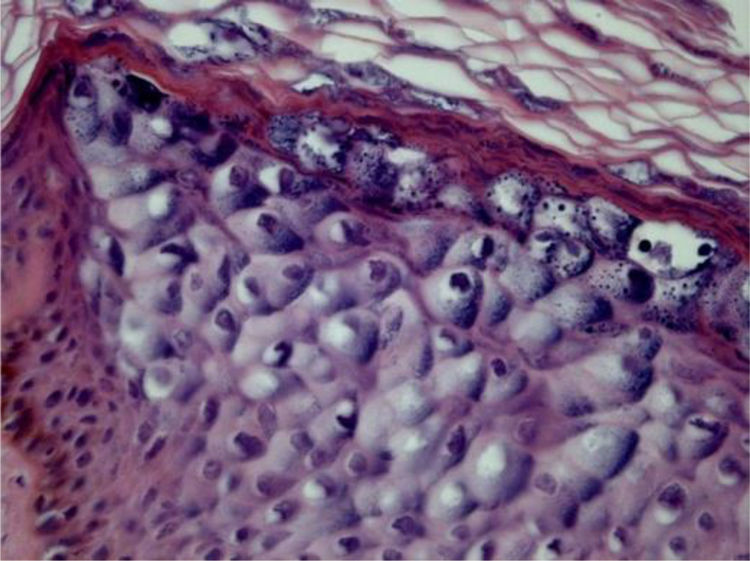
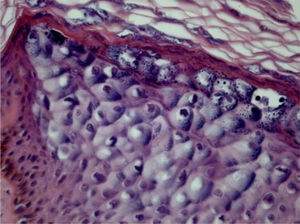
Epidermodisplasia verruciformeAs lesões da epidermodisplasia verruciforme (EV) são caracterizadas por estrato córneo com aparência em cesta e edema dos ceratinócitos. Esses mostram aspecto pálido, levemente basofílicos e grânulos cerato‐hialinos de tamanho e forma variáveis, e estão agrupados nas camadas granular e espinhosa da epiderme, lembrando a verruga plana, mas podendo atingir toda a extensão da epiderme. Essas células têm núcleos pequenos e picnóticos soltos como um balão em vacúolo celular (fig. 3). É descrito que a transformação maligna nas lesões de EV tende a começar no entorno dos folículos pilosos. Caracteristicamente, o efeito citopático desaparece, e há predominância de células disceratóticas e pronunciada atipia do tipo bowenoide nas áreas não invasivas e invasivas.5,7
Histopatologia das lesões de mucosasRegião anogenitalAs lesões localizadas na região anogenital englobam o condiloma acuminado, o condiloma gigante ou tumor de Buschke‐Lowestein, a papulose bowenoide, a doença de Bowen e a eritroplasia de Queyrat. A classificação em lesões intraepiteliais escamosas de baixo grau (LSIL, do inglês, low grade squamous intraepithelial lesions) e lesões intraepiteliais escamosas de alto grau (HSIL, do inglês high grade squamous intraepithelial lesions) tem sido utilizada para designá‐las de acordo com suas características histopatológicas e seu comportamento clínico.6
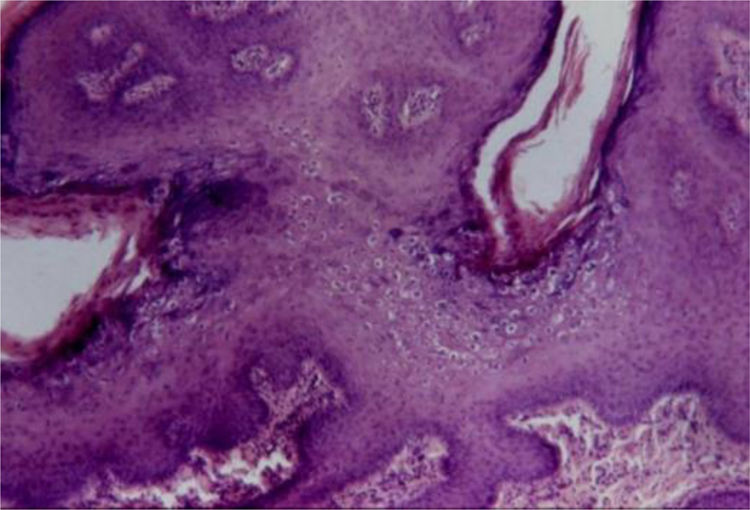
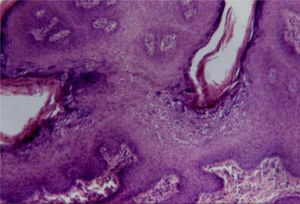
Condiloma acuminadoFazel et al. descrevem a epiderme no condiloma acuminado (do grego kondulos, côndilo e do latim acuminatum, acuminado) como ondulada e moderadamente acantótica.5 Há espessamento leve da camada córnea, e a camada granular apresenta‐se proeminente com grânulos de cerato‐hialina grosseiros e coilócitos. Nas lesões de mucosas há paraceratose.
Os coilócitos são ceratinócitos com núcleos picnóticos profundamente basofílicos cercados por um halo e citoplasma claro, grânulos de cerato‐hialina discretos ou ausentes. Essas células tendem a formar agregados na superfície malpighiana e na camada granular, predominando nos vales das ondulações (fig. 4). Pode haver semelhança com ceratose seborreica pelo achado ocasional de pseudocistos córneos.
As lesões tratadas com podofilina exibem numerosos ceratinócitos necróticos e aumento acentuado no número de figuras mitóticas detidas em metáfase na metade inferior da epiderme. Sua apresentação histopatológica pode ser confundida com carcinoma espinocelular (CEC) in situ ou com papulose bowenoide. A mácula acrômica plana evidenciada pelo ácido acético mostra epitélio acantótico e presença de coilócitos associados a cones epiteliais alargados e disceratose superficial. Muitas vezes, há graus variados de displasia, com maturação anormal, perda de polaridade, aumento da atividade mitótica e atipia nuclear. Essas lesões podem evoluir para lesões do tipo carcinoma escamoso intraepitelial ou carcinoma in situ (CIC).5
O condiloma acuminado gigante de Buschke‐Lowenstein exibe leve vacuolização de ceratinócitos e acentuada papilomatose da epiderme, com extensões bulbosas bem diferenciadas do epitélio escamoso na derme profunda. Os ceratinócitos são minimamente atípicos.5 Essas alterações poderiam ser observadas na papilomatose oral florida, bem como no epitelioma cuniculatum.
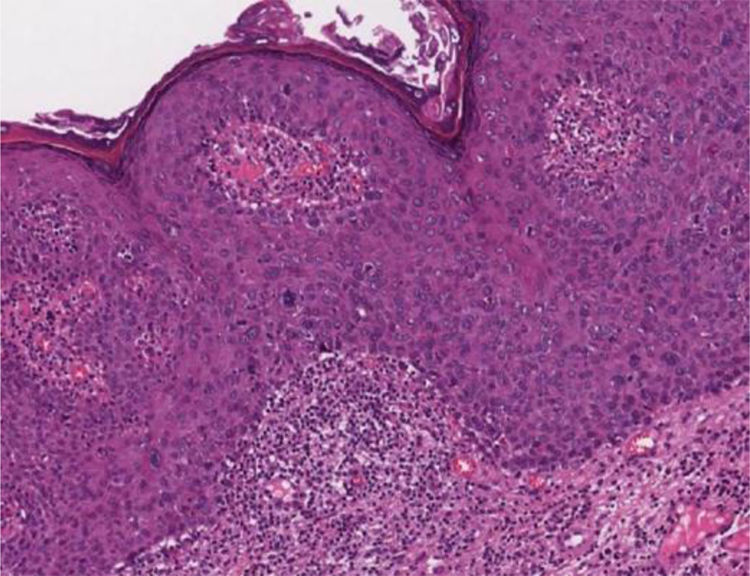
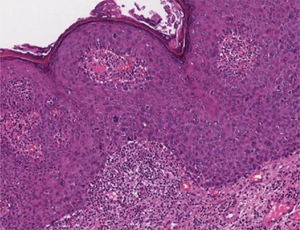
Papulose bowenoideEm cortes microscópicos, a epiderme mostra hiperplasia psoriasiforme e hiperceratose. Os ceratinócitos aparecem agrupados e exibem núcleos maiores, hipercromáticos, pleomórficos, disceratose e perda da estratificação epidérmica. Há aumento do número de figuras mitóticas, algumas atípicas, vistas em todos os níveis da epiderme5 (fig. 5). Os achados são considerados indistinguíveis do CEC in situ, para o qual pode evoluir.5,8 A doença de Bowen extracutânea e a eritroplasia de Queyrat corresponderiam a HSIL, com displasia acentuada e maior risco de evolução para CEC invasivo.8
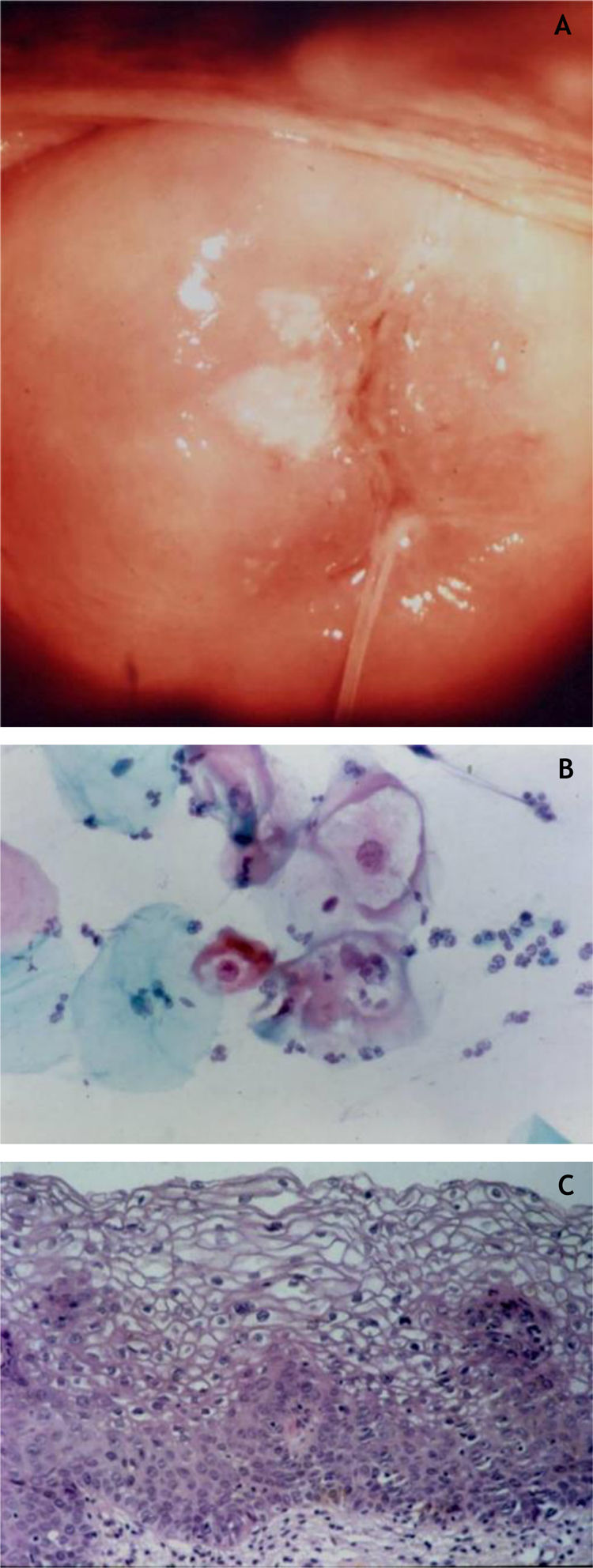
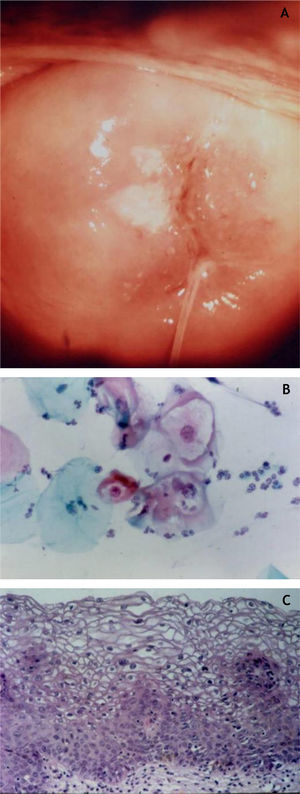
Colo uterinoNo colo uterino surgem lesões proliferativas de dois tipos: as lesões precursoras de neoplasia intraepitelial cervical (NIC) e o carcinoma invasor. O conhecimento das lesões precursoras que mostram características morfológicas bem definidas possibilita o diagnóstico precoce antes que ocorra invasão neoplásica. Clinicamente, mostram‐se como máculas aceto‐claras (fig. 6A) à colposcopia ou de aspecto espiculado lembrando condiloma.
Essas lesões foram denominadas NIC e subdivididas em NIC‐I (displasia leve), NIC‐II (displasia moderada) e NIC‐III (displasia acentuada), na mesma categoria do CIS. Posteriormente, foi proposta a divisão das lesões em dois grupos: as LSIL, que correspondem ao NIC‐I, englobando alterações epiteliais sugestivas de infecção por HPV (coilocitose) mesmo sem displasia; e as HSIL, compreendendo NIC‐II e NIC‐III e CIS.9
Na histopatologia, as lesões precursoras de neoplasia mostram alterações na proliferação e maturação das células e perda da estratificação da epiderme, que exibe graus variados de atipias. Nos casos de displasia leve, as alterações encontram‐se no terço inferior do epitélio, que mostra atipias celulares leves e perda discreta da polaridade celular. Na displasia moderada, as atipias e a perda de polaridade, além da diferenciação celular, são mais intensas e englobam a metade da espessura epitelial. Mitoses são mais frequentes. A displasia acentuada mostra alterações em toda a espessura do epitélio, com perda de estratificação e presença de mitoses típicas e atípicas. O achado de coilocitose é indicativo de infecção por HPV (fig. 6B e 6C).10
Mucosa oralSegundo Betz, as lesões benignas da cavidade oral relacionadas ao HPV compreendem verruga vulgar, papiloma escamoso, condiloma acuminado e hiperplasia epitelial multifocal. As características histopatológicas dessas lesões podem ser semelhantes às de outras lesões inflamatórias relacionadas a algumas síndromes, o que torna importante a comunicação entre clínicos e patologistas, com vistas a um melhor manejo dos pacientes.11
Papiloma escamosoO papiloma escamoso é descrito como a lesão benigna mais frequentemente observada na mucosa oral, tanto em crianças quanto em adultos.11 Na histopatologia em pequeno aumento já se observa a arquitetura exofítica e papilomatosa. Um eixo central pode ser observado em alguns cortes, ou pode ser sugerido pelo espaço vago entre áreas papilomatosas recobertas por epitélio normal com tecido conjuntivo subjacente. Na camada basal e na área justa basal observam‐se figuras mitóticas dispersas, mas sem atipias. Na camada espinhosa superior, os coilócitos podem ser identificados.11
Verruga vulgarA apresentação histológica na mucosa é idêntica à do tecido cutâneo.11 Há projeções exofíticas com arquitetura verrucosa com aspecto em torre de igreja e cones epiteliais em direção ao centro da lesão. A camada celular granular é espessada; os coilócitos apresentam o núcleo em localização excêntrica e citoplasma vacuolado. Essas células são frequentemente identificadas nas camadas epiteliais superiores, na camada granulosa ou próximo a ela. Figuras mitóticas em áreas basais e justa basal podem estar presentes e ligeiramente aumentadas, mas formas atípicas não são identificadas.5,11
Condiloma acuminadoNo condiloma acuminado, à microscopia, as lesões são papilomatosas e exofíticas e, diferentemente do papiloma escamoso, a base é alargada. O epitélio mostra acantose e papilomatose moderada a acentuada. Paraceratose espessa é frequentemente identificada, com invaginações que preenchem as criptas entre as papilas. De modo semelhante ao que é descrito para o condiloma acuminado anogenital, os coilócitos são observados na parte superior da camada espinhosa e predominam nos vales entre as papilas.5,11
Hiperplasia epitelial focal (doença de Heck)Na hiperplasia epitelial focal, observa‐se hiperplasia epitelial irregular com paraceratose leve. O epitélio acantótico exibe cones epiteliais alongados, anastomosados e espessamento. Os ceratinócitos claros na camada superior e as células binucleadas em níveis médios são características histológicas observadas. A degeneração em balão pode ser proeminente. Muitas vezes, há um leve infiltrado linfocítico no corium. A microscopia eletrônica revela partículas dispostas em padrão cristalino.5,11
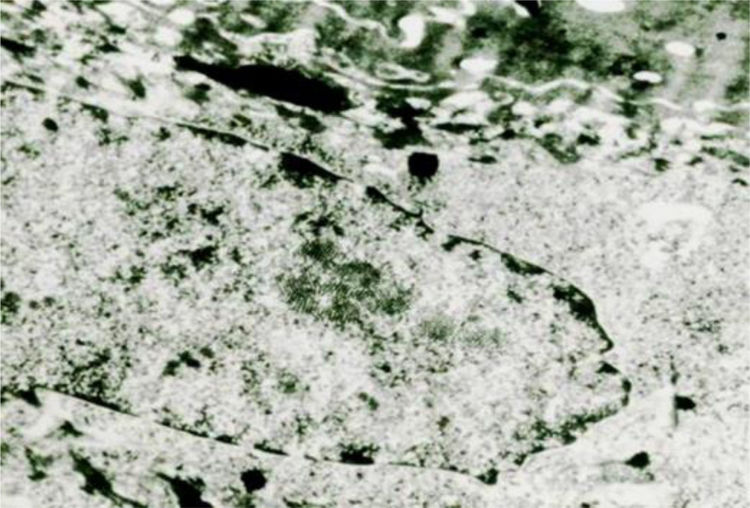
Microscopia eletrônicaA microscopia eletrônica (ME) é a técnica que possibilita a observação do vírus nos tecidos. Contudo, desde a introdução das técnicas de biologia molecular para detecção do DNA dos HPV, estas são preferidas quando há necessidade de se comprovar a presença do vírus. A ME tem grande importância em vários tipos de pesquisas – por exemplo, sobre a patogênese da infecção –, considerando‐se inclusive a necessidade de novas intervenções contra o vírus.12
Na ME, a quantidade de partículas virais é variável nos diferentes tipos de lesões, e frequentemente estão ausentes nas verrugas vulgares e em lesões que evoluíram para CIS ou mesmo carcinoma invasivo.13,14 Os resultados negativos não excluem a presença de HPV, que pode ser detectado por outros métodos.
A replicação do DNA viral ocorre com a proliferação de células basais. As proteínas estruturantes do capsídeo surgem na epiderme média, e na epiderme superior encontra‐se a estrutura viral madura do HPV. As partículas virais se mostram como corpos esféricos, com diâmetro de 50nm. Cada partícula consiste em um nucleoide elétron‐denso com aparência de um apêndice circundado pelo capsídeo menos denso.
Os vírus das verrugas multiplicam‐se no núcleo, onde se mostram como partículas em agregados cristaloides densos (fig. 7). Nas verrugas plantares, na parte superior do estrato de Malpighi, seu número aumenta, por vezes de maneira acentuada, nas células logo abaixo do estrato córneo. Nas verrugas planas, por HPV‐3, há acentuado edema citoplasmático, os tonofilamentos estão deslocados para a periferia das células, grânulos de cerato‐hialina são normais e há numerosas partículas virais no núcleo das células vacuoladas. Na EV, as partículas virais se mostram com aspecto semicristalino nos núcleos do estrato granuloso e, na camada de Malpighi, células edemaciadas podem apresentar, em alguns casos, pequenos agregados de vírions.14
Identificação do vírus por técnicas molecularesProcedimentos laboratoriais para a detecção do HPVA resposta imune humoral do hospedeiro em relação à infecção pelo HPV ocorre em cerca de 50% a 60% dos indivíduos com infecção comprovada por teste positivo de detecção do DNA do HPV. Considerando que o vírus não é capaz de ser isolado em métodos de cultura convencional, sua identificação se baseia em métodos moleculares.15
Segundo a Organização Mundial de Saúde (OMS), a pesquisa de anticorpos está indicada em estudos epidemiológicos de base populacional, destinados à definição de estratégias pré‐vacinação, para grupos e faixas etárias de maior exposição e na verificação de efetividade da vacina. A utilização da sorologia como ferramenta diagnóstica não é recomendada.15 O estudo do tipo do HPV, segundo a OMS, e excluindo‐se situações específicas, é indicado na identificação dos tipos associados ao surgimento de neoplasias.15 A maioria dos ensaios testa um pool de ácidos nucleicos de 12 HPV de alto risco (HPV‐AR) (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 e 59). Alguns também incluem os HPV‐66 e HPV‐68. Alguns testes de genotipagem conseguem distinguir os HPV‐16 e HPV‐18.16
O primeiro teste para pesquisa de HPV‐AR foi aprovado pela Food and Drug Administration (FDA) em 1999, com ênfase na avaliação do CCU. Desde então, vários testes têm sido introduzidos e aprovados, e diversos estudos envolvendo outras neoplasias anogenitais e da orofaringe têm sido realizados. Os seguintes testes são aprovados pelo FDA na avalição do CCU: o Qiagen Hybrid Capture‐2, aprovado em 2003, é um teste que identifica 13 tipos de HPV‐AR: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 e 68; o Cervista, aprovado em 2009, identifica os 14 tipos de HPV‐AR; o Cobas HPC, aprovado em 2011, identifica em uma única reação o HPV‐16, o HPV‐18 e os outros 12 tipos de HPV‐AR; e em 2014, o Cobas4800, um teste totalmente automatizado, foi o primeiro a ser aprovado pelo FDA como primeira linha de triagem para risco de CCU em mulheres com 25 anos ou mais; o Aptima HPVAssay, aprovado em 2011, foca na identificação dos oncogenes E6/E7 do HPV por meio da detecção de RNA mensageiro de 14 tipos de HPV‐AR; e, finalmente, o Onclarity, aprovado em 2018, que também detecta os oncogenes E6 e E7 de 14 tipos de HPV‐AR. Todos esses testes apresentam alta sensibilidade e especificidade.17,18 A Agência Nacional de Vigilância Sanitária (ANVISA) aprova a maioria desses testes, além de outros.19 Para consulta atualizada, acesse: https://consultas.anvisa.gov.br/#/saude/q/?nomeProduto=HPV.
Segundo a OMS, os testes de detecção do HPV‐AR são indicados para triagem de mulheres com idade ≥ 30 anos, de maneira isolada ou combinada à citologia cervical, na prevenção do câncer de colo. Esses testes são mais sensíveis que a citologia e têm maior valor preditivo negativo. São utilizados na triagem de mulheres com anormalidades citológicas mínimas para evitar acompanhamentos desnecessários, no monitoramento de mulheres com doença persistente/recorrente e como teste de cura pós‐tratamento. A OMS não indica a testagem de HPV de baixo risco (HPV‐BR).15
Não há, no momento, recomendação para uso de testes de triagem de infecções por HPV‐AR nas regiões anal, vulvar, vaginal, peniana e na orofaringe.16 A testagem de HPV é utilizada, de maneira restrita, em pacientes de alto risco para câncer anal. A pesquisa da proteína p16, por imuno‐histoquímica, é recomendada quando se encontra displasia moderada ou lesões pré‐cancerosas.16
A identificação do HPV nos CEC de cabeça e pescoço, por hibridização in situ ou PCR, principalmente nos da orofaringe (tonsila, base da língua e palato mole), pode ser útil, pois os associados ao HPV apresentam melhor resposta terapêutica, maiores taxas de sobrevida e menor risco de recorrência quando comparados aos pacientes HPV negativos.16,20,21
Nem todas as mulheres com infecção persistente por HPV‐AR ou lesões precursoras no colo do útero, mesmo sem tratamento, progredirão para câncer. Isso sugere que a identificação do HPV‐AR, por si só, não define a evolução.15 Desse modo, tem‐se estudado outros marcadores que sejam possíveis preditores de progressão. Um deles é a proteína p16. Após integração do genoma do HPV‐AR à célula infectada, a proteína E7 se liga à proteína retinoblastoma (pRb), bloqueando seu efeito inibidor sobre o ciclo celular. Como a pRb é regulada pela proteína p16, há um feedback negativo com aumento da expressão da proteína p16. No caso de CEC da orofaringe, a pesquisa de proteína p16 por imuno‐histoquímica em tecidos tumorais é considerada um excelente marcador e um substituto aceitável para a pesquisa do HPV.21
Ainda em relação aos carcinomas de cabeça e pescoço, a hibridização in situ do RNA é capaz de detectar mRNA E6/E7, possibilita detectar a atividade viral de transcrição nas células tumorais e parece ser o teste mais específico para HPV.21 Mutações nos genes NRF2, KEAP1 e CUL3, levando a ganho de função na via NRF2 e no gene Tp53, são mais prevalentes entre os carcinomas de cabeça e pescoço HPV negativos quando comparados aos HPV positivos. Esses biomarcadores moleculares também poderiam ser úteis na estratificação do paciente para o tratamento.20 Tecnologias recentes encontram‐se em estudo buscando detectar material genético do HPV no soro e na saliva como possíveis ferramentas não invasivas para o monitoramento e o acompanhamento do tratamento de pacientes com CEC da orofaringe.21
Sobre o CCU, biomarcadores emergentes incluem a identificação do mRNA para as proteínas E6/E7, pesquisa da proteína p16, marcadores de indução da fase S aberrante, detecção de anormalidades cromossômicas e de miRNAs, aliados a métodos avançados de genotipagem. Eles podem ser úteis para diferenciar as mulheres com condições pré‐cancerosas que necessitariam de um tratamento urgente ou colposcopia diagnóstica.22
Segundo as Diretrizes Brasileiras para o Rastreamento do Câncer do Colo do Útero, o exame citopatológico é o método de rastreamento indicado para a doença e suas lesões precursoras.23 Da mesma maneira, o Ministério da Saúde no Brasil não recomenda a pesquisa rotineira de evidência molecular de infecção por HPV no CEC da cabeça e pescoço, uma vez que não há mudança terapêutica com base nessa informação.24
TratamentoTratamentos empíricos para resolução de verrugas, em especial as verrugas cutâneas (VC), são bastante difundidos entre a população. Experiências leigas de sucessos são sugeridas com segurança absoluta como benzer, escoriar as lesões com sal grosso ou casca de banana verde, acupuntura, destruir a verruga “mãe” que as demais desaparecerão, entre outras. A busca por terapêuticas insólitas, em algumas situações, poderia ser por apelo estético. A manipulação das lesões pode causar um processo inflamatório e regressão das verrugas, mas pode também levar a crescimento rápido e disseminação das mesmas pelo traumatismo. O sucesso dessas abordagens pode se dever à regressão espontânea que é descrita em percentual expressivo de casos, fato que deve ser considerado na avaliação de qualquer método terapêutico.25
Várias modalidades terapêuticas têm sido utilizadas no tratamento das infecções pelo HPV. A escolha da opção deve levar em conta fatores como idade, local, número e tamanho das lesões, subtipo clínico e situação imunológica do paciente.26 Dependendo do local, expectativa do paciente e sua condição imunológica, uma abordagem expectante é perfeitamente aceitável. Entretanto, verrugas que não se resolvem em até um ano são menos propensas a fazê‐lo espontaneamente.25,27 O tratamento ideal não deve deixar cicatrizes, embora muitos pacientes se incomodem mais com as verrugas do que com cicatrizes permanentes.25
Os tratamentos tópicos englobam medicamentos cujos efeitos são, predominantemente, destrutivos, tais como crioterapia, cauterização química, métodos cirúrgicos e remoção a laser. Podem ser divididos em três categorias: destrutivos, agentes citotóxicos e imunoterapia.28 Entre os muitos tratamentos locais, verifica‐se que as evidências científicas ainda são escassas, mesmo para aqueles mais consagrados e que integram o arsenal terapêutico habitual.
Por outro lado, os tratamentos sistêmicos, em sua maioria, têm como princípio a tentativa de melhora da resposta imune do indivíduo ao HPV. No geral, os estudos são escassos e, em algumas situações, com resultados controversos. Soma‐se o fato de que a utilização desses tratamentos acaba sendo feita por meio de uma prescrição off label, para o qual o médico deve estar atento e seguir as orientações necessárias.
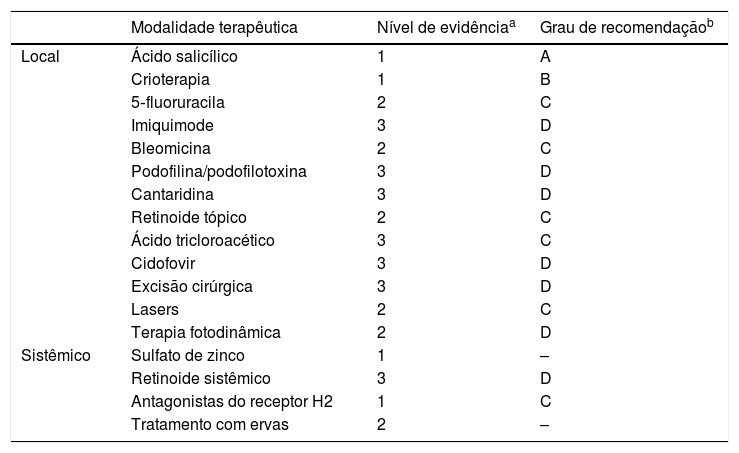
Diante deste cenário, a proposta não é esgotar o assunto, mas elencar parte das evidências disponíveis na literatura e oferecer aos dermatologistas um material que os auxilie na rotina dos ambulatórios e consultórios. A tabela 1 apresenta os níveis de evidência e grau de recomendação que serão discutidas a seguir.
Nível de evidência e grau de recomendação das principais modalidades terapêuticas para lesões cutâneas causadas por HPV
| Modalidade terapêutica | Nível de evidênciaa | Grau de recomendaçãob | |
|---|---|---|---|
| Local | Ácido salicílico | 1 | A |
| Crioterapia | 1 | B | |
| 5‐fluoruracila | 2 | C | |
| Imiquimode | 3 | D | |
| Bleomicina | 2 | C | |
| Podofilina/podofilotoxina | 3 | D | |
| Cantaridina | 3 | D | |
| Retinoide tópico | 2 | C | |
| Ácido tricloroacético | 3 | C | |
| Cidofovir | 3 | D | |
| Excisão cirúrgica | 3 | D | |
| Lasers | 2 | C | |
| Terapia fotodinâmica | 2 | D | |
| Sistêmico | Sulfato de zinco | 1 | – |
| Retinoide sistêmico | 3 | D | |
| Antagonistas do receptor H2 | 1 | C | |
| Tratamento com ervas | 2 | – |
Fonte: Elaborado pelos autores a partir das referências Sterling, 2014, Goldstein, 2019 e Camargos, 2010.
Nível de evidência: 1 – Ensaio clínico randomizado (ECR), revisões sistemáticas (RS)/metanálise de ECR; 2 – RS de estudos de coorte, coortes; 3 – RS de estudos caso‐controle, estudos de caso‐controle; 4 – Série de casos, coorte e caso‐controle de baixa qualidade; 5 – Opinião de especialistas.
Grau de recomendação: A – Estudos observacionais ou experimentais de maior consistência (metanálises ou ECR); B – Estudos observacionais de menor consistência (outros ensaios clínicos não randomizados ou observacionais ou caso‐controle); C – Relatos ou séries de casos (estudos não controlados); D – Opinião desprovida de avaliação crítica, baseadas em consensos, estudos fisiológicos ou modelos animais.
As formulações contendo ácido salicílico (AS) são consideradas a primeira linha de tratamento para VC por alguns autores.26 O AS é um agente ceratolítico tópico, fácil de aplicar e seguro, mas que pode causar irritação local. A irritação poderia iniciar a resposta imune responsável por erradicar o HPV.26 O AS mostrou‐se superior ao placebo na maioria dos estudos.26,27 Ainda existe controvérsia na literatura se o AS é mais eficaz para lesões palmoplantares em relação às localizadas em outros sítios anatômicos.27 No Brasil, existem diversas formulações e concentrações disponíveis, chegando até 27%, enquanto na literatura encontra‐se a descrição de concentrações entre 10% e 26%.25 Algumas formulações contêm apenas AS; outras têm associação com ácido lático.25 O paciente pode ser orientado e realizar a aplicação no domicílio, protegendo a superfície perilesional e repetindo o processo até que a lesão desapareça. Eventos adversos graves são raros.27
CrioterapiaA crioterapia geralmente é realizada com aplicação de nitrogênio líquido (NL) sobre a lesão. O congelamento causa dano tissular, lesando as células e seu suprimento sanguíneo.27 Não há consenso quanto ao tempo de congelamento ou tamanho do halo esperado. Um tempo entre 10 e 30 segundos, com halo de 1 a 2mm, é indicado por alguns autores. Esses parâmetros podem variar em função do tamanho, da localização da lesão e da tolerabilidade do paciente.25,26 Técnicas mais agressivas parecem fornecer melhores taxas de cura.27 As aplicações podem ocorrer com duas, três ou quatro semanas de intervalo. A taxa de resposta com o intervalo de duas a três semanas é maior nos três primeiros meses de tratamento, porém tende a se igualar ao intervalo de quatro semanas quando avaliado um período de seis meses.25,27
Embora vários estudos tenham falhado em mostrar sua superioridade em relação ao placebo e ao AS, a satisfação do paciente foi significativamente maior no grupo tratado com crioterapia.27 As lesões acrais apresentam melhor taxa de resposta quando a crioterapia é associada ao uso de AS.27 Verrugas ungueais e periungueais têm contraindicação relativa ao uso dessa modalidade de tratamento, pelo risco de lesão irreversível da matriz ungueal.26
5‐fluoruracilaO 5‐fluoruracila (5‐FU) tem propriedades antineoplásicas e antimetabólicas que inibem a síntese do DNA e RNA. Acredita‐se que este seja o mecanismo responsável por parar a proliferação epitelial aberrante.27 Alguns estudos mostraram eficácia superior ao placebo no tratamento de verrugas planas, vulgares, palmoplantares e genitais.27,29 O 5‐FU é comumente usados na concentração de 5% em creme, uma vez ao dia, com oclusão.25,27 Os efeitos adversos mais comuns incluem irritação local, ulcerações, dermatite de contato alérgica e fotossensibilidade.26 A onicólise também é um efeito colateral frequente durante o tratamento das lesões periungueais.27
BleomicinaA bleomicina é substância antineoplásica com indicações em bula para doença de Hodgkin e linfomas não Hodgkin, derrame pleural maligno, alguns tipos de carcinoma de testículo e CEC de orofaringe, genitais (incluindo colo uterino) e pele. Sabe‐se que grande parte dos CEC, especialmente de mucosas, têm associação com HPV.30 Contudo, a indicação para tratamento de verrugas não consta em bula, portanto seu uso no Brasil seria como medicação off label (ver comentários sobre prescrição off label a seguir). O mecanismo exato de ação da bleomicina no tratamento de verrugas ainda não está totalmente elucidado, mas parece estar ligado à inibição da síntese de DNA.26,27
As taxas de cura variam muito entre os trabalhos (16%‐94%). Essa variação não pôde ser associada a nenhuma concentração, método de aplicação ou dose total.27 Despigmentação e dor são os efeitos colaterais mais comuns; também podem ocorrer edema, hiperpigmentação, eritema e cicatrizes.26,27 Após injeção direta na lesão, uma escara enegrecida pode surgir no local.26
Alguns autores preferem aplicar a bleomicina sobre a verruga e realizar microagulhamento. Esse método é menos doloroso e também pode ser utilizado nas lesões acrais.25,31 Embora ainda não existam evidências robustas, a bleomicina pode ter lugar no tratamento das lesões refratárias.27 É contraindicada na gestação e amamentação.
ImiquimodeO imiquimode é substância imunomoduladora que atua na resposta inata e adaptativa, induz a produção e a liberação de interferon (IFN) alfa, fator de necrose tumoral alfa e interleucina 12, além de promover a ativação das células natural killer, propiciando a interrupção da replicação viral.25,27,28 Apesar de ter seu uso bem estabelecido para as verrugas genitais (VG), ainda não existem evidências suficientes sobre sua eficácia nas VC.27 A substância é utilizada na concentração de 5% com propostas de posologias variadas entre os estudos.27,28 Eritema, edema e erosões podem ocorrer.27 Pode ser utilizado em associação com métodos destrutivos como tentativa de reduzir a recorrência local.28
Retinoides tópicosA tretinoína é o principal retinoide utilizado no tratamento das VC, usualmente na dose de 0,05% em creme. Geralmente seu uso está reservado para casos com múltiplas lesões recalcitrantes ou pacientes com verrugas planas.25
Podofilina/podofilotoxinaA podofilina é um agente antimitótico que pode causar necrose tecidual. Deve ser aplicada pelo médico, em concentrações de 10% a 25%. Podem ocorrer efeitos sistêmicos se administrada em grandes superfícies corporais. É contraindicada na gestação. Embora seja usada nas VG, ainda não tem eficácia bem estabelecida nas VC. A podofilotoxina pode ser administrada pelo paciente, e é menos irritante do que a podofilina.25 Embora conste na relação dos insumos disponíveis para tratamentos de HPV na rede pública, a podofilotoxina não é encontrada no Brasil.1
CantaridinaA cantaridina é um agente vesicante que causa acantólise. Em virtude desse mecanismo de ação, apresenta risco reduzido de cursar com cicatrizes. A aplicação é praticamente indolor – o desconforto surge apenas 24 horas depois. É altamente tóxica se administrada sistemicamente; logo, deve ser aplicada apenas no consultório. A concentração mais utilizada é a de 0,7%.25 Vakharia et al. mostraram alta eficácia de uma formulação contendo cantaridina, AS e podofilotoxina para o tratamento de verrugas plantares em adultos e crianças. Entretanto, novos estudos são necessários para confirmar esse resultado.32
CidofovirO cidofovir é um análogo de nucleotídeo que atua inibindo a DNA polimerase viral. O tratamento é realizado com injeções intralesionais mensais. Estudos estão em andamento para avaliar o uso da medicação em creme. Apenas efeitos colaterais locais foram reportados: dor, queimação, prurido e eritema.28
ImunoterapiaImunoestimuladores tópicos são estudados há décadas na tentativa de elucidar seu papel terapêutico no tratamento das verrugas recalcitrantes. O dinitroclorobenzeno foi usado no passado com resultados promissores, porém não está mais indicado pelo potencial mutagênico.26,28 A difenciprona tem sido empregada com essa finalidade por ser mais potente e menos mutagênica. A aplicação da difenciprona 0,001% na pele glabra e 0,0001% nas outras regiões demonstrou boa resposta nos pacientes previamente sensibilizados.28
Diversas outras substâncias são descritas como possíveis imunoterápicos com aplicabilidade no tratamento das VC: PPD, antígeno de Candida sp., vacina tríplice viral (MMR), sulfato de zinco tópico, dentre outros. Entretanto, mais estudos são necessários para se determinar seu papel na condução dos casos.27,28
Métodos destrutivosA excisão cirúrgica é um método de retirada das VC com cureta, bisturi ou eletrocautério.33 É amplamente utilizado no tratamento das VC, apesar de muitos dermatologistas o contraindicarem, pela morbidade e altas taxas de recorrência.27 As verrugas filiformes na face parecem responder melhor a essa modalidade de tratamento.26
O uso da terapia fotodinâmica com ácido aminolevulínico para o tratamento de verrugas plantares já foi descrito, porém os estudos realizados mostraram resultados contraditórios quanto à eficácia da intervenção.27 O laser de CO2 está descrito como método destrutivo com potencial de uso nas VC, assim como o pulsed dye laser; entretanto, mais estudos são necessários para determinar a eficácia desses métodos.27
Lesões anogenitaisVerrugas genitaisO tratamento das VG pode ocorrer em sessão única, por métodos destrutivos como eletrocoagulação, excisão cirúrgica ou laser de CO2.1,34 Essas técnicas estão associadas à alta probabilidade de resolução total das lesões, porém com taxas de recorrência superiores às outras terapias.35
Ácido tricloroacético (ATA) (80%‐90%), podofilotoxina (0,5%), podofilina (10%‐25%) e crioterapia são opções para tratamentos que demandam múltiplas aplicações no consultório.1 A podofilotoxina parece ser o agente mais eficaz e com custos relativamente baixos, mas é contraindicada na gestação.1,34 O ATA é um agente cáustico que promove destruição por coagulação química. Deve ser aplicado apenas sobre as lesões 1 e está relacionado a menos efeitos colaterais do que a crioterapia nessa localização.35 O imiquimode e o 5‐FU são opções viáveis para o tratamento domiciliar.1
Lesões pré‐malignas e malignasPapulose bowenoideNa conduta terapêutica, deve‐se ter em mente que apesar da histopatologia com muitas atipias, sua evolução é favorável na maioria dos casos. A regressão espontânea ocorre muitas vezes, especialmente em indivíduos jovens e do sexo masculino. Pode ser mais agressiva nos pacientes idosos e nos imunocomprometidos.36,37 As modalidades de tratamento incluem excisão cirúrgica, eletrocoagulação, crioterapia com NL, laser de CO2 e, em casos selecionados, cirurgia micrográfica de Mohs. O imiquimode também parece ser uma opção viável. Não é recomendado o uso de radioterapia nas lesões malignas e pré‐malignas associadas ao HPV.38
Carcinomas verrucososA cirurgia minimamente invasiva, juntamente com a terapia local, é adequada para pacientes com lesões de pequeno porte ou alto risco intraoperatório. Do mesmo modo, a associação de crioterapia com quimioterapia tópica pode ser considerada. A cirurgia micrográfica de Mohs também pode ser indicada. O tratamento principal continua sendo uma cirurgia extensa, com ampla ressecção e muitas vezes reintervenções para concluir a excisão. A complementação do tratamento cirúrgico para lesões de pequeno porte pode ser feita com aplicação de lasers e tratamentos locais ou intralesionais com 5‐FU, bleomicina, associada a cisplatina e metotrexato; ATA, cidofovir e imiquimode são outras opções descritas. Além desses, a imunoterapia sistêmica com IFN‐alfa e quimioterapia sistêmica com vários esquemas de associação de drogas têm sido usadas em casos selecionados. A radioterapia é controversa.33,39
Situações especiaisGestantesO ATA é a opção de escolha para gestantes com lesões localizadas. A crioterapia com NL também é indicada. Para as pacientes com acometimento de áreas extensas, o tratamento cirúrgico é o de eleição.1 Podofilina, podofilotoxina e imiquimode são contraindicados em qualquer fase da gravidez.1
ImunossuprimidosO manejo dos pacientes imunossuprimidos é uma situação desafiadora. O tratamento pode não resultar em cura total das lesões, mas ajuda a reduzir o tamanho e o impacto estético. As opções terapêuticas são as mesmas relatadas anteriormente, porém o rodízio e a associação de métodos podem ser necessários.25
Tratamento sistêmicoCimetidinaA cimetidina, um anti‐histamínico antagonista dos receptores H2, tem sido usada em vários estudos clínicos para VC, com resultados conflitantes: alguns com melhora expressiva, e outros com resultados desapontadores.40 O uso da medicação também foi relatado no tratamento das lesões cutâneas do HPV, em pacientes com EV, com pouca melhora.41 Alguns efeitos colaterais descritos são: cefaleia, tontura, diarreia, erupção cutânea, urticária, alopecia, ginecomastia, mastalgia, artralgia e mialgia.40
LevamisoleO levamisole, que apresenta diversos efeitos imunomodulares, foi utilizado em poucos estudos controlados para o tratamento das VC com resultados também conflitantes. Apresenta como efeitos colaterais: náusea, alteração do paladar, erupção cutânea, alopecia e síndrome gripal símile.40
OligoelementosO zinco, um oligoelemento importante na função imune do organismo, foi comparado a placebo, na dose de 10mg/kg/dia, em poucos estudos para o tratamento das VC resistentes – alguns com bons resultados, mostrando melhora de até 87%, e outros com resultados semelhantes entre a substância e o placebo.40
Um estudo brasileiro prospectivo, duplo‐cego e randomizado, comparou a cimetidina 35mg/kg/dia (máximo 1.200mg/dia) e sulfato de zinco 10mg/kg/dia (máximo de 600mg/dia), por três meses, no tratamento de VC em 18 pacientes. O sulfato de zinco foi mais efetivo que a cimetidina, com resposta completa em 62,5% dos pacientes e parcial em 25%. A limitação do estudo é a pequena casuística.42 Os efeitos colaterais mais comuns são náusea, vômitos e dor epigástrica.40
O selênio foi estudado como profilaxia do surgimento de lesões relacionadas ao HPV em pacientes transplantados de órgãos sólidos (TOS), porém não demonstrou eficácia.41
EchinaceaA Echinacea, uma planta herbácea perene pertencente à família Asteraceae, apresenta três espécies com propriedades terapêuticas: E. purpurea, E. augustifolla e E. pallida. Usada para na prevenção e no tratamento de infecções das vias aéreas superiores, também foi testada para VC em poucos estudos, com resultados conflitantes.40
InterferonO IFN, uma citocina produzida pelos linfócitos T, fibroblastos e outras células, apresenta propriedades imunomoduladoras, antiproliferativas e antivirais e pode ser usado no tratamento de lesões por HPV, topicamente, de modo intralesional ou sistêmico. Uma revisão sistemática realizada em 2009 incluiu 12 estudos controlados e randomizados com 1.445 pacientes portadores de VG tratados com INF. Quando comparado com placebo, o uso tópico do IFN mostrou diferença estatística (RR=2,68; 95% IC 1,79‐4,02 e p<0,000001), porém o uso sistêmico, não (RR=1,25; 95% IC 0,80‐1,95 e p > 0,05).43 Há relatos do uso do IFN no tratamento de pacientes com verrugas e quadros de imunossupressão, tais como EV (IFN‐alfa‐2b peguilado e IFN‐alfa‐2a recombinante), linfocitopenia de células T CD4+idiopática (IFN‐gama‐1b e INF‐alfa‐2b) e pacientes HIV‐positivos (IFN‐alfa‐2b peguilado).41 O uso do IFN‐alfa no tratamento da papilomatose respiratória recorrente, como adjuvante, é controverso.44 O efeito colateral mais comum do uso sistêmico é uma síndrome gripal símile com febre, calafrios, cefaleia, mialgia e fadiga.40
RetinoidesA acitretina, um retinoide de uso sistêmico, tem seu uso relatado (de maneira isolada ou em combinação com o IFN) no tratamento de lesões cutâneas do HPV em pacientes portadores de EV. A resposta é variável: em alguns casos é boa, porém com recidiva após interrupção do tratamento. Em relação ao etretinato, os relatos são de uma resposta mínima ou transitória.41 Há relato de melhora de VG em paciente com lúpus eritematoso sistêmico utilizando a isotretinoina, em uso sistêmico, associada ao tratamento cirúrgico.41
CidofovirO cidofovir, um fosfonato nucleosídeo acíclico que age na DNA polimerase viral, aprovado para uso sistêmico em retinite por citomegalovírus (CMV) em pacientes HIV positivos, apresenta relatos de uso tópico e intralesional no tratamento de lesões anogenitais produzidas pelo HPV em pacientes transplantados. Ademais, há relatos da melhora de lesões cutâneas refratárias em pacientes HIV‐positivos com seu uso tópico, porém com altas taxas de recidiva.41
Na papilomatose respiratória recorrente, ele tem sido utilizado em diversas vias de aplicação: intralesional, sistêmica e inalatória. Apesar de amplamente empregado, os resultados aos tratamentos são variáveis e se referem ao seu uso combinado ao tratamento cirúrgico. O emprego sistêmico é limitado pelos efeitos de toxicidade renal e risco de oncogenicidade. Outras reações adversas descritas são: erupção cutânea, cefaleia e cicatriz na corda vocal.44
Outras consideraçõesO bevacizumabe, um anticorpo monoclonal cujos alvos são os receptores do fator de crescimento endotelial vascular (VEGF, do inglês vascular endotelial growth factor), apresenta vários relatos de uso, com melhora da papilomatose respiratória recorrente tanto por via intralesional quanto sistêmica. Ainda faltam estudos clínicos controlados, randomizados e estudos com séries maiores de casos para avaliação de sua eficácia e segurança.44
Um aspecto relevante a ser considerado diz respeito ao imunossupressor usado em pacientes transplantados: os inibidores de calcineurina, como ciclosporina, pimecrolimus e tacrolimus, estão associados ao desenvolvimento de verrugas, principalmente se associados à azatioprina, enquanto os inibidores de mTOR, tais como sirolimus, temsirolimus e everolimus, estão relacionados à melhora e diminuição das verrugas e das malignidades associadas. Há relatos de pacientes transplantados renais e de fígado com melhora das verrugas quando acontece a troca dessas medicações imunossupressoras.41
Novas drogas com alvos em vias moleculares têm sido estudadas no tratamento das doenças relacionadas ao HPV: inibidores moleculares direcionados às atividades de ligação ao DNA das proteínas E1 e E2 do HPV ou às atividades antiapoptóticas dos oncogenes E6 e E7; inibidores de proteassomas e histona deacetilase, além de vacinas terapêuticas das proteínas E6 e E7.45
A prescrição off label de medicamentos se caracteriza pelo emprego de uma medicação, por parte do médico, para uso não aprovado pelas agências sanitárias para situações que não constam em bula, exemplificando dose, intervalo entre as doses, faixa etária, doenças e até mesmo fases de uma mesma doença. As indicações de uso de uma medicação variam de um país para outro e ao longo do tempo, e novas indicações podem ser autorizadas pelas agências a partir de evidências científicas.
No Brasil, A ANVISA chama a atenção para o fato de que esse tipo de prescrição é feito por conta e risco do médico que o prescreve, podendo vir, eventualmente, a caracterizar um erro médico. Porém, também salienta que, na maioria das vezes, é um uso essencialmente correto, apenas não aprovado.
No que tange aos tratamentos das manifestações do HPV, muitos dos tratamentos serão utilizados por prescrição off label. Os médicos devem estar atentos para essa possibilidade, e sempre compartilhar essas informações com seus pacientes, preferencialmente solicitando a eles um termo de consentimento livre e esclarecido para o uso.46
PrevençãoVacinasA relação dos HPV‐AR com o CCU é bem estabelecida, e essa é uma das neoplasias mais frequentes nas mulheres de países de baixa e média renda.30,47 Esse contexto faz com que a vacina profilática contra o HPV possa ser considerada um dos mais importantes avanços no campo da saúde da mulher.48
Considera‐se que a quase totalidade dos casos de CCU sejam causados pela infecção por HPV, o que ocorre também com 90% das neoplasias anais. Além disso, o HPV tem relação com neoplasias de vagina, pênis, vulva e orofaringe, em percentuais variados, e é causa das VG e da papilomatose respiratória recorrente.30,47
Todas as três vacinas profiláticas atualmente disponíveis contra HPV são obtidas por tecnologia de DNA recombinante a partir da proteína L1 do vírus, que constituirão as partículas similares ao vírus (VLP, do inglês virus like particles).47 As vacinas disponíveis são a bivalente, quadrivalente e nonavalente, todas com os tipos 16 e 18 (HPV‐AR) – a quadrivalente inclui os HPV‐BR 6 e 11, e a nonavalente inclui, além desses, os tipos 31, 33, 45, 52, e 58.
No Brasil, a vacina quadrivalente foi introduzida na rede do Sistema Único de Saúde (SUS) para meninas entre 9 e 14 anos em 2014. Em 2017, o uso foi estendido para meninos, recomendada atualmente para a faixa etária entre 11 e 14 anos.1,49 Nessa faixa etária, independente do sexo, são recomendadas duas doses com intervalo de seis meses entre elas. Aqui, a vacina também é recomendada para pessoas vivendo com HIV/AIDS, TOS e de medula óssea e pacientes oncológicos de 9 a 26 anos, sob prescrição médica. Nesse último grupo são recomendadas três doses da vacina com intervalo de dois meses entre a primeira e a segunda dose e seis meses entre a primeira e a terceira dose (0, 2 e 6 meses).1
As três vacinas são consideradas seguras; entre os efeitos adversos associados, estão os episódios de síncope, atribuídos não aos componentes da vacina em si, mas ao processo da vacinação. Especialmente entre a população mais jovem, a síncope é descrita com a aplicação de outras vacinas, coleta de sangue e administração parenteral de medicação.49 As reações locais também são descritas, especialmente com a nonavalente.30 Os efeitos adversos graves notificados, como doenças neurológicas, autoimunes e tromboembolismo, não têm tido nexo causal atribuído às vacinas contra os HPV.47,49
Existem evidências robustas do benefício individual e populacional na redução tanto de lesões benignas quanto lesões causadas por HPV‐AR com a vacinação contra o HPV.1,30 A formação de anticorpos após a vacinação é maior entre os indivíduos que não iniciaram a vida sexual e, portanto, não foram expostos aos HPV, assim como entre os mais jovens. A duração da imunogenicidade não é conhecida; contudo, a persistência da proteção por até 10 anos com a vacina quadrivalente, e pelo menos seis anos com a nonavalente, já foi relatada.30,47
Um grande desafio é manter a cobertura vacinal em patamares considerados adequados, mesmo para a primeira dose. No Brasil houve redução de quase 23% na cobertura da população alvo (meninas) entre os anos de 2014 e 2015 para a primeira dose da vacina (92%×69,5%). Em 2017, os dados mostram percentuais abaixo de 80% para meninas na primeira dose (79,2%) e apenas 48,7% na segunda dose. Para os meninos, a cobertura na primeira dose ficou em 43,8% no mesmo período.48 Como não se sabe se uma única dose da vacina forneceria proteção suficiente, pode‐se considerar que a baixa cobertura vacinal possa comprometer futuramente não só o indivíduo, mas o coletivo, no sentido da não prevenção de doenças malignas ou pré‐malignas.47,48 A baixa cobertura vacinal em meninos é preocupante; mesmo considerando que homens heterossexuais poderiam se beneficiar da imunidade de rebanho resultante da vacinação em mulheres, o mesmo não se aplica para os homens que fazem sexo com homens (HSH). Desse modo, a cobertura vacinal em níveis adequados, independente de gênero, é necessária.47
A vacinação para pessoas com mais de 26 anos de idade não é recomendada para todos os indivíduos. Entretanto, alguns adultos com idade entre 27 e 45 anos podem decidir tomar a vacina contra o HPV com base na discussão com seu médico, caso não tenham sido vacinados adequadamente quando mais jovens. Nessa faixa etária, a vacinação oferece menos benefícios, por razões já mencionadas anteriormente. A vacinação evita novas infecções pelo HPV, mas não trata infecções ou doenças já existentes.50,51
A vacina é contraindicada durante a gestação. Caso ocorra gravidez após a primeira dose, ou se esta for inadvertidamente administrada durante a gestação, recomenda‐se suspender a dose subsequente e completar o esquema vacinal após o parto. A amamentação não contraindica a vacinação.50 Outras contraindicações são: para a vacina bivalente, histórico de alergia ao látex, pois quando previamente acondicionadas em seringas, estas podem ter componentes com resíduo de látex; para as vacinas quadri e nonavalentes, história de alergia a leveduras do tipo Saccaromyces cerevisiae presentes na composição. Pessoas com doenças agudas com quadros moderados a graves devem ter a vacinação adiada.51
As dificuldades para se implementar a vacinação contra o HPV são muitas, de características diversas e, às vezes, dinâmicas, com situações pontuais que requerem pronta intervenção a fim de que mitos e desinformação não se propaguem.48 Discute‐se, no tópico Educação em Saúde, alguns desses aspectos.
Educação em saúdeNa educação em saúde voltada para a prevenção do HPV, há que se considerar não apenas sua relevância pela prevalência/incidência nas populações, mas também sua transcendência. Deve‐se destacar a carga de sofrimento individual ligada à morbimortalidade, o que acarreta sentimentos de medo e vivência do estigma para muitos. Além disso, para a saúde pública, se traduz em custos elevados.52
Quando se considera a educação em saúde focada nas manifestações cutâneas, há que se ter em mente que nos pacientes imunocomprometidos o câncer de pele se desenvolve em idades mais precoces, é mais agressivo e com maior risco de metástase, o que implica em adoção de medidas preventivas eficazes para essa população.25 Embora seja tarefa de todos os profissionais de saúde, é inegável a relevância do dermatologista na prevenção, na identificação e no tratamento de lesões pré‐neoplásicas e de neoplasias nessa população. Do mesmo modo, a abordagem propedêutica, diagnóstica, terapêutica e preventiva de grande parte das manifestações clínicas do HPV nas mucosas e da própria infecção pelo vírus também é da prática dermatológica, juntamente com outros profissionais de saúde.
É essencial conhecer o comportamento sexual da população com a qual se pretende desenvolver atividades de educação em saúde. Em relação à sexualidade, inquérito populacional realizado no Brasil abrangendo 12.000 pessoas entre 15 e 64 anos para avaliar conhecimento, atitudes e práticas relacionadas às infecções sexualmente transmissíveis (IST) e hepatites virais, 25% delas informaram ter iniciado a vida sexual antes dos 15 anos: 34,9% dos homens e 15,4% das mulheres.53 Entre os jovens até 24 anos, 35% iniciaram antes dos 15 anos; 43,9% declararam ter tido mais de 10 parcerias ao longo da vida, especialmente entre os homens (56,6%×26,3%). Aproximadamente 10% dos homens e 6% das mulheres relataram algum sintoma de IST na vida. Apenas 71% das mulheres haviam realizado a citopatologia oncótica nos últimos três anos. Entre aqueles que tiveram relações sexuais nos últimos 12 meses, quase 28% tiveram mais de uma parceria e 12% mais de cinco. O uso de preservativo é baixo entre jovens de 15 a 24 anos; 61% usaram preservativos na última relação sexual, mas apenas 39% o fizeram quando se consideraram todos os entrevistados.53
Em relação ao HPV, a educação em saúde deve abranger a difusão do conhecimento sobre a infecção, as doenças relacionadas e seus possíveis desdobramentos, mais especificamente, o potencial oncogênico do vírus. Considerando a existência e a disponibilidade da vacina quadrivalente no SUS e as evidências de sua eficácia na redução de VG e lesões pré‐malignas relacionados ao HPV, é fundamental garantir também, nesse processo, a aceitação e o acesso à vacinação específica.1,48,54 No sentido mais amplo, a educação em saúde voltada para a prevenção do HPV e outras IST visa melhorar as ferramentas dos indivíduos com vistas a garantir sua autonomia em relação à própria saúde sexual e de seus parceiros.1
Os pontos fundamentais destacados nos estudos sobre o tema são o conhecimento, as atitudes e as práticas relacionadas à sexualidade, especialmente de adolescentes e adultos jovens, que constituem o grupo mais vulnerável para as IST/HPV, assim como para a gravidez precoce.52,55,56 Embora se considere que variáveis como faixa etária, sexo, ter recebido a vacina contra HPV e até o tipo de instrumento utilizado na pesquisa possam influenciar os resultados, é consenso que o conhecimento é a base para o estabelecimento de atitudes e práticas mais seguras.54,55,57
O conhecimento sobre o HPV se mostra insuficiente em vários estudos tanto no Brasil quanto em outros países.52,54,55,57 Por exemplo, não considerar que o uso do preservativo possa prevenir as IST e a gravidez e desconhecer a vacina contra o HPV foram referidos por quase metade dos investigados em dois estudos no Brasil.52,55 Sobre as atitudes, a crença de que não é preciso usar o preservativo em relacionamentos estáveis e mesmo se sentir ofendido(a) quando o uso é sugerido pelo(a) parceiro(a) coadunam com a prática de não fazer uso do mesmo em percentuais significativos de jovens entrevistados em nosso país.52,53,55
Como em vários outros agravos, a escolaridade mais baixa é relacionada a menos conhecimento e se traduz em maior vulnerabilidade, segundo Fontes et al.52 Em contrapartida, esses mesmos autores, ao definir uma escala de conhecimentos, atitudes e práticas, encontraram alguns determinantes sociais relevantes, no sentido de reduzir a vulnerabilidade – entre eles, o interesse em aprender, conversar com pais e mestres sobre sua sexualidade e ter alguma dessas figuras como referência, não fazer uso abusivo de álcool, ter lazer e participar de obras sociais, assim como o interesse em aprender e fazer uso consciente da internet.52
A adoção de comportamentos seguros nos relacionamentos sexuais implica em conhecimentos prévios sobre o que se configura como risco. Saber da importância do uso de preservativos, poder negociar seu uso com as parcerias, ou mesmo ter a opção de postergar ou se abster do envolvimento sexual são comportamentos, atitudes e práticas aprendidas e necessárias na prevenção de IST e gravidez.56,58
As intervenções para divulgar/consolidar conhecimentos sobre as IST e levar a atitudes e práticas mais seguras se mostram relevantes, e nos últimos anos ganharam um aliado com grande potencial de alcance, que são as tecnologias digitais.58,59 Estas são consideradas mais acessíveis e aceitáveis, e seus efeitos são comparáveis àquelas presenciais.58,59 Em metanálise que abrangeu 16 estudos e 11.525 jovens, não foram observadas diferenças nos desfechos avaliados em relação a atitudes e práticas entre intervenções por tecnologia e programas controle.58 O tempo de duração das intervenções por tecnologia permanece como motivo de discussão, mas seu custo/efetividade é um argumento forte.58,59 O desafio que permanece para as intervenções é prolongar seus efeitos nas atitudes e práticas ao longo do tempo.56,58
Outra metanálise que avaliou 63 estudos e abrangeu quase 60.000 indivíduos em diversos países mostrou que quase 75% das intervenções se basearam em teorias de promoção de saúde.56 No curto prazo, houve impacto significativo no conhecimento relacionado à saúde sexual, atitudes e práticas, conhecimento esse que se manteve com decréscimo significativo no médio prazo. No longo prazo, as intervenções melhoraram apenas o uso do preservativo.56 Esse estudo mostrou que as intervenções voltadas para prevenção das IST e gravidez na adolescência ampliaram o uso do preservativo quando realizadas em países com Índice de Desenvolvimento Humano (IDH) mais alto, em ambiente escolar, com embasamento teórico e não promovendo a abstinência sexual.56 Esse é um problema que se torna muito relevante e exige comprometimento dos profissionais de saúde diante de políticas públicas conservadoras vigentes, particularmente no Brasil.
O estigma relacionado às IST pode dificultar a busca por tratamento e métodos de proteção, além de aumentar a carga de sofrimento do indivíduo. Admite‐se que pessoas com pouco conhecimento se sintam mais estigmatizadas quando recebem um diagnóstico de infecção por HPV.60 Um estudo qualitativo realizado a partir de informações obtidas em um site (Experience Project) mostrou que a percepção negativa da própria imagem foi o tipo de estigma predominante nas pessoas.60 Esse fato poderia dificultar a busca de conhecimento em fontes adequadas sobre a infecção, levando as pessoas, na maioria das situações, a lidar com o foco no problema e não nas emoções, com dúvidas limitadas a sintomas e efeitos colaterais do tratamento da doença.60 Os autores recomendam que se utilize o ambiente virtual para realizar fóruns e debates com a finalidade de desmistificar conceitos errôneos sobre o HPV.60
Em relação à vacina, o conhecimento sobre o HPV extrapola a própria população alvo, pois a maior parte dela deverá ser vacinada ainda na infância ou nos primeiros anos da adolescência.1 Considera‐se que as barreiras para implementar uma cobertura vacinal adequada sejam multifatoriais. Entre elas, o baixo nível de conhecimento sobre o HPV e suas doenças, sobre os recursos oferecidos pela vacina, preocupações infundadas de pais e formuladores de políticas, barreiras culturais e custo para o sistema de saúde.48 Dificuldades adicionais seriam a falta de uma rotina de consultas preventivas para adolescentes, a ausência de benefício imediato para a criança/adolescente, a não exigência de comprovação vacinal para matrículas escolares.61
A falta de informação de pais e responsáveis sobre a importância da vacinação na fase pré‐puberal, aliada à crença de que a vacina poderia levar à iniciação sexual precoce ou a comportamentos promíscuos, pode levar ao adiamento da vacina ou mesmo à não vacinação. No entanto, são argumentos que sabidamente não têm embasamento científico.50,61 Apesar de toda a avaliação e experiência acumulada com as vacinas ao longo dos anos, sua segurança é frequentemente questionada, os efeitos colaterais são temidos e, às vezes, fantasiosamente relacionados à vacina.50,51
O movimento antivacinas não deve ser menosprezado. Estratégias de enfrentamento em várias frentes precisam ser trabalhadas permanentemente, considerando a multicausalidade dessas barreiras. A importância do papel das escolas e dos profissionais de saúde para o êxito da vacinação é reconhecido e precisa ser estimulado. O médico deve usar todas as oportunidades de atendimento para verificar e/ou indicar a vacinação contra o HPV.47,57,61
Suporte financeiroNenhum.
Contribuição dos autoresMarcelo Grossi Araújo: Concepção e desenho do estudo; levantamento de bibliografia e leitura crítica dos artigos; redação do artigo; revisão crítica do manuscrito e aprovação final da versão submetida.
Geraldo Magela Magalhães: Concepção e desenho do estudo; levantamento de bibliografia e leitura crítica dos artigos; redação do artigo; revisão crítica do manuscrito e aprovação final da versão submetida.
Lucas Campos Garcia: Concepção e desenho do estudo; levantamento de bibliografia e leitura crítica dos artigos; redação do artigo; revisão crítica do manuscrito e aprovação final da versão submetida.
Érica Cristina Vieira: Concepção e desenho do estudo; levantamento de bibliografia e leitura crítica dos artigos; redação do artigo; revisão crítica do manuscrito e aprovação final da versão submetida.
Maria de Lourdes Ribeiro de Carvalho Leite: Concepção e desenho do estudo; levantamento de bibliografia e leitura crítica dos artigos; redação do artigo; revisão crítica do manuscrito e aprovação final da versão submetida.
Antônio Carlos Martins Guedes: Concepção e desenho do estudo; levantamento de bibliografia e leitura crítica dos artigos; redação do artigo; revisão crítica do manuscrito e aprovação final da versão submetida.
Conflito de interessesNenhum.
Como citar este artigo: Araújo MG, Magalhães GM, Garcia LC, Vieira EC, De Carvalho‐Leite ML, Guedes ACM. Update on human papillomavirus – part II: complementary diagnosis, treatment and prophylaxis. An Bras Dermatol. 2021;96:125–38.
Trabalho realizado no Serviço de Dermatologia, Hospital das Clínicas, Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.