A dermatoscopia aumenta a sensibilidade do diagnóstico do melanoma, levando à sua identificação precoce e aumentando as chances de cura.
ObjetivoDescrever as características clínicas e dermatoscópicas de melanomas extensivos superficiais e detectar as diferenças entre melanomas in situ e invasivos.
MétodosEstudo transversal em que foram avaliadas imagens dermatoscópicas de 58 melanomas agrupados de acordo com sua espessura.
ResultadosForam avaliados 24 melanomas in situ, 28 invasivos com Breslow ≤ 1mm (0,50 ± 0,22mm) e seis com Breslow > 1mm (2,35 ± 2,02mm). Os melanomas in situ apresentaram tamanho menor que os invasivos. Os critérios dermatoscópicos mais encontrados foram assimetria (84,5%), três ou mais cores (81,0%) e rede atípica (79,3%). Padrão inespecífico foi mais comum nos melanomas in situ (p=0,028); rede atípica em melanomas invasivos com Breslow 1mm apresentaram rede invertida (p=0,018).
Limitações do estudoAmostra de conveniência, uma vez que era necessária foto pré‐operatória do tumor, o que pode ter levado à perda das lesões clinicamente menos expressivas e também daquelas muito sugestivas de melanoma.
ConclusõesMelanomas em estágios iniciais apresentaram, com maior frequência, padrão inespecífico e rede atípica, enquanto melanomas invasivos apresentaram padrão multicomponentes, três ou mais cores e rede invertida.
O melanoma representa apenas 5% dos tumores de pele, mas é responsável por cerca de 80% dos óbitos em decorrência de seu elevado potencial de metástase.1 Sua incidência vem crescendo em todo o mundo nas últimas décadas; no entanto, observa‐se uma tendência à estabilização da taxa de mortalidade,2 provavelmente pelo aumento no diagnóstico de melanomas iniciais.
O fator prognóstico mais importante do melanoma é a espessura, ou índice de Breslow.2,3 O sistema atual do American Joint Committee on Cancer (AJCC) utiliza o índice de Breslow para o estadiamento, selecionando o ponto de corte de 1mm de espessura para a definição de melanoma fino.4 O prognóstico está diretamente relacionado ao diagnóstico precoce, uma vez que pacientes com melanomas finos apresentam sobrevida de 93% em 10 anos.4,5 Por outro lado, a sobrevida é inversamente proporcional à espessura do tumor; pacientes com melanomas com índice de Breslow > 4mm apresentam sobrevida em 10 anos de apenas 39%.4
O melanoma é classificado em quatro subtipos principais, que se diferenciam quanto à epidemiologia, apresentação clínica, dermatoscopia, histopatologia, aspectos moleculares e evolução, e por isso devem ser estudados separadamente. O melanoma extensivo superficial (MES) é o subtipo mais comum em indivíduos de pele clara, correspondendo a 70% dos casos.2 Apresenta uma fase de crescimento radial, definida por crescimento limitado à epiderme ou focalmente na derme papilar, seguida por uma fase de crescimento vertical com presença de invasão.2
A dermatoscopia é um método propedêutico não invasivo que aumenta a acurácia do diagnóstico do melanoma em 20% a 30% quando realizada por examinadores treinados; aconselha‐se seu uso rotineiro pelo dermatologista na avaliação de lesões melanocíticas.6–8 O acompanhamento em centros especializados em dermatoscopia leva ao diagnóstico de melanomas com espessura menor, além de reduzir o número de biópsias desnecessárias.7,9–11
Quanto mais fino é o melanoma, maior a dificuldade na avaliação dermatoscópica, em decorrência do menor desarranjo estrutural presente nas lesões iniciais.12–14 Diversos trabalhos têm sido conduzidos a fim de identificar critérios dermatoscópicos associados à espessura do tumor, com o intuito de obter uma estimativa pré‐operatória do índice de Breslow, bem como auxiliar no diagnóstico precoce do melanoma, mas os resultados são variáveis e nenhum desses critérios mostrou‐se confiável para estabelecer a abordagem cirúrgica.15–18 Em razão da importância do diagnóstico precoce do melanoma, foram analisadas, neste estudo, imagens dermatoscópicas desses tumores com o objetivo de descrever e analisar aspectos clínicos e dermatoscópicos do MES, correlacionando‐os com a espessura do tumor, agrupando os tumores em in situ, invasivos com índice de Breslow ≤ 1mm e invasivos com índice de Breslow > 1mm.
MétodosTrata‐se de um estudo transversal, em que foram selecionados pacientes com melanomas diagnosticados no Ambulatório de Lesões Pigmentadas do Serviço de Dermatologia do Hospital das Clínicas da Universidade Federal de Minas Gerais (HC‐UFMG) e em clínica privada, no período de sete anos, com diagnóstico de MES confirmado por histopatologia, que apresentavam registro fotográfico dermatoscópico do tumor.19 Os dados foram coletados do banco de imagens e do banco de dados dos serviços, além de análise de prontuários médicos.
De acordo com a rotina dos serviços, os pacientes foram examinados com dermatoscópios Heine 20® ou DermLite DL3® (luz não polarizada) e gel como fluido de interface; as fotografias clínicas e dermatoscópicas das lesões suspeitas foram obtidas com câmeras fotográficas digitais Canon Power Shot 3,2® ou Nikon 1® sob Termo de Consentimento Livre e Esclarecido (TCLE). As lesões suspeitas de melanoma foram encaminhadas para excisão cirúrgica.
O diagnóstico de MES foi baseado em exame anatomopatológico realizado por dermatopatologistas experientes. Em casos de dúvida sobre o subtipo histológico, foi realizada revisão da lâmina. Os pacientes selecionados preencheram os seguintes critérios de inclusão: melanoma primário classificado histologicamente como MES e com registro fotográfico dermatoscópico de qualidade satisfatória. Os critérios de exclusão foram: demais subtipos de melanoma, melanomas recidivados e registro fotográfico de qualidade insatisfatória.
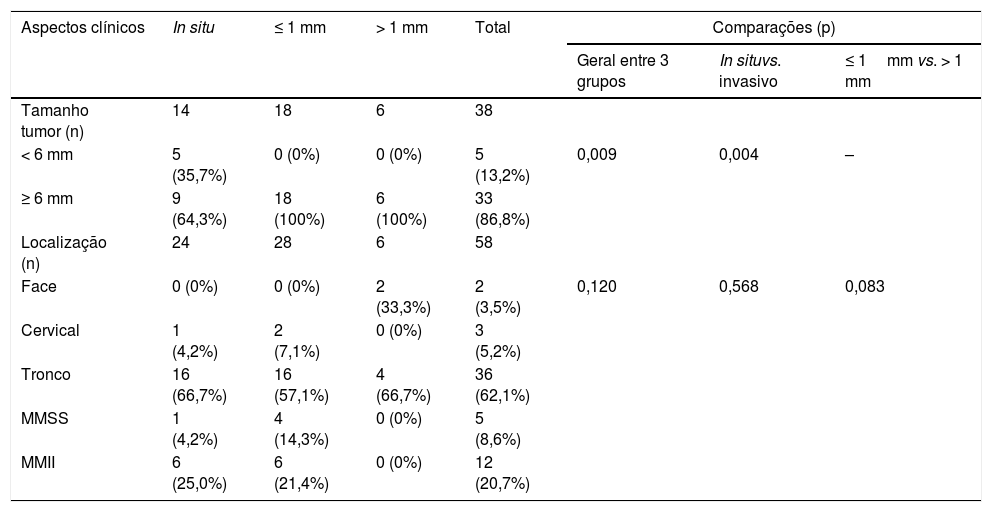
Os aspectos clínicos avaliados foram: tamanho do tumor (< 6 mm ou ≥ 6 mm) e localização (face, cervical, tronco, membros superiores ou membros inferiores). O aspecto histopatológico avaliado foi o índice de Breslow; os tumores foram classificados em MES invasivos com índice de Breslow ≤ 1 mm e MES invasivos com índice de Breslow > 1 mm, além de melanoma in situ (MIS), em que o índice de Breslow não é aplicado.
A análise das imagens foi realizada de forma cega, sem o conhecimento do índice de Breslow e demais variáveis, por duas observadoras (FVB e MLPF) com experiência na área de dermatoscopia que, em conjunto, concordaram quanto à presença ou ausência dos critérios avaliados.
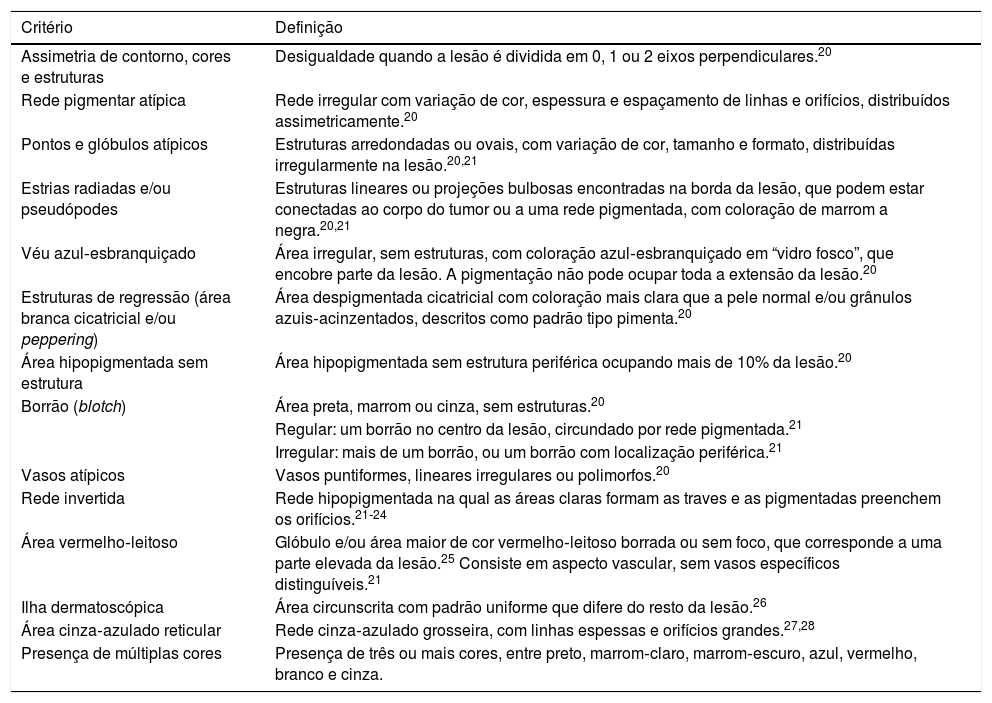
Os critérios e padrões dermatoscópicos registrados estão mostrados nas tabelas 1 e 2, respectivamente.20–28 Como muitas imagens não foram examinadas com dermatoscópio de luz polarizada, as crisálidas não foram incluídas no estudo, já que só podem ser observadas com esse tipo de aparelho.22,23
Definição dos critérios dermatoscópicos analisados nos melanomas extensivos superficiais
| Critério | Definição |
|---|---|
| Assimetria de contorno, cores e estruturas | Desigualdade quando a lesão é dividida em 0, 1 ou 2 eixos perpendiculares.20 |
| Rede pigmentar atípica | Rede irregular com variação de cor, espessura e espaçamento de linhas e orifícios, distribuídos assimetricamente.20 |
| Pontos e glóbulos atípicos | Estruturas arredondadas ou ovais, com variação de cor, tamanho e formato, distribuídas irregularmente na lesão.20,21 |
| Estrias radiadas e/ou pseudópodes | Estruturas lineares ou projeções bulbosas encontradas na borda da lesão, que podem estar conectadas ao corpo do tumor ou a uma rede pigmentada, com coloração de marrom a negra.20,21 |
| Véu azul‐esbranquiçado | Área irregular, sem estruturas, com coloração azul‐esbranquiçado em “vidro fosco”, que encobre parte da lesão. A pigmentação não pode ocupar toda a extensão da lesão.20 |
| Estruturas de regressão (área branca cicatricial e/ou peppering) | Área despigmentada cicatricial com coloração mais clara que a pele normal e/ou grânulos azuis‐acinzentados, descritos como padrão tipo pimenta.20 |
| Área hipopigmentada sem estrutura | Área hipopigmentada sem estrutura periférica ocupando mais de 10% da lesão.20 |
| Borrão (blotch) | Área preta, marrom ou cinza, sem estruturas.20 |
| Regular: um borrão no centro da lesão, circundado por rede pigmentada.21 | |
| Irregular: mais de um borrão, ou um borrão com localização periférica.21 | |
| Vasos atípicos | Vasos puntiformes, lineares irregulares ou polimorfos.20 |
| Rede invertida | Rede hipopigmentada na qual as áreas claras formam as traves e as pigmentadas preenchem os orifícios.21‐24 |
| Área vermelho‐leitoso | Glóbulo e/ou área maior de cor vermelho‐leitoso borrada ou sem foco, que corresponde a uma parte elevada da lesão.25 Consiste em aspecto vascular, sem vasos específicos distinguíveis.21 |
| Ilha dermatoscópica | Área circunscrita com padrão uniforme que difere do resto da lesão.26 |
| Área cinza‐azulado reticular | Rede cinza‐azulado grosseira, com linhas espessas e orifícios grandes.27,28 |
| Presença de múltiplas cores | Presença de três ou mais cores, entre preto, marrom‐claro, marrom‐escuro, azul, vermelho, branco e cinza. |
Definição dos padrões dermatoscópicos analisados nos melanomas extensivos superficiais
| Padrões | Definição |
|---|---|
| Padrão multicomponentes | Presença de três ou mais critérios.20 |
| Padrão inespecífico | Lesão pigmentada sem padrão específico.20 |
| Padrão reticular | Rede pigmentada cobrindo a maior parte da lesão.20 |
| Padrão globular | Numerosos glóbulos de tamanhos variados com tonalidade marrom e/ou cinza‐enegrecido.20 |
| Padrão starbust | Estrias radiadas e/ou pseudópodes em disposição radial na borda da lesão.20 |
| Padrão homogêneo | Pigmentação marrom, azul ou preto‐acinzentado difusa na ausência de outras estruturas locais.20 |
A análise estatística se fez, durante a parte descritiva, pelo cálculo de médias e proporções de variáveis contínuas e qualitativas, respectivamente. A análise univariada para comparação entre os grupos foi feita pelo teste do qui‐quadrado ou o teste exato de Fisher. O software usado foi o Stata versão 13. A qualificação da significância estatística foi feita usando o limite de valor de p=0,05.
O projeto foi aprovado pela Câmara do Departamento de Clínica Médica da Faculdade de Medicina da UFMG e pelo Comitê de Ética em Pesquisa da UFMG (parecer n° ETIC – 0005.0.203.000‐09).
ResultadosForam selecionados 76 MES em 62 pacientes, dos quais 18 foram excluídos por perda de qualidade das fotos. Logo, foram avaliados 58 MES em 52 pacientes: 31 eram provenientes do Ambulatório de Lesões Pigmentadas do HC‐UFMG e 21 da clínica privada. Foram avaliados 24 MIS, 28 MES invasivos com Breslow ≤ 1mm e seis MES invasivos com Breslow > 1mm.
Entre os 34 MES invasivos, o índice de Breslow médio foi de 0,82 ± 1,08. No grupo MES invasivo com Breslow ≤ 1mm, a média foi de 0,50 ± 0,22; no grupo MES invasivo com Breslow > 1mm, a média foi de 2,35 ± 2,02. Os aspectos clínicos estão apresentados na tabela 3.
Aspectos clínicos dos melanomas extensivos superficiais
| Aspectos clínicos | In situ | ≤ 1 mm | > 1 mm | Total | Comparações (p) | ||
|---|---|---|---|---|---|---|---|
| Geral entre 3 grupos | In situvs. invasivo | ≤ 1mm vs. > 1 mm | |||||
| Tamanho tumor (n) | 14 | 18 | 6 | 38 | |||
| < 6 mm | 5 (35,7%) | 0 (0%) | 0 (0%) | 5 (13,2%) | 0,009 | 0,004 | – |
| ≥ 6 mm | 9 (64,3%) | 18 (100%) | 6 (100%) | 33 (86,8%) | |||
| Localização (n) | 24 | 28 | 6 | 58 | |||
| Face | 0 (0%) | 0 (0%) | 2 (33,3%) | 2 (3,5%) | 0,120 | 0,568 | 0,083 |
| Cervical | 1 (4,2%) | 2 (7,1%) | 0 (0%) | 3 (5,2%) | |||
| Tronco | 16 (66,7%) | 16 (57,1%) | 4 (66,7%) | 36 (62,1%) | |||
| MMSS | 1 (4,2%) | 4 (14,3%) | 0 (0%) | 5 (8,6%) | |||
| MMII | 6 (25,0%) | 6 (21,4%) | 0 (0%) | 12 (20,7%) | |||
Houve uma perda de dados na variável tamanho da lesão, uma vez que o estudo foi retrospectivo e, na maioria das vezes, esse aspecto não foi registrado nos prontuários médicos. Em apenas 38 casos esse dado apresentou‐se disponível, e foi classificado em<6mm (5 [13,2%] – todos do grupo MIS) ou ≥ 6mm (33 [86,8%]). Os MIS apresentaram tamanho significativamente menor que os MES invasivos (p=0,004).
O tronco foi a localização mais frequente, comum a 62,1% dos tumores em geral, sem diferença entre os grupos, enquanto 20,7% dos melanomas foram localizados nos membros inferiores, 8,6% nos membros superiores, 5,2% na região cervical e 3,5% na face (tabela 3).
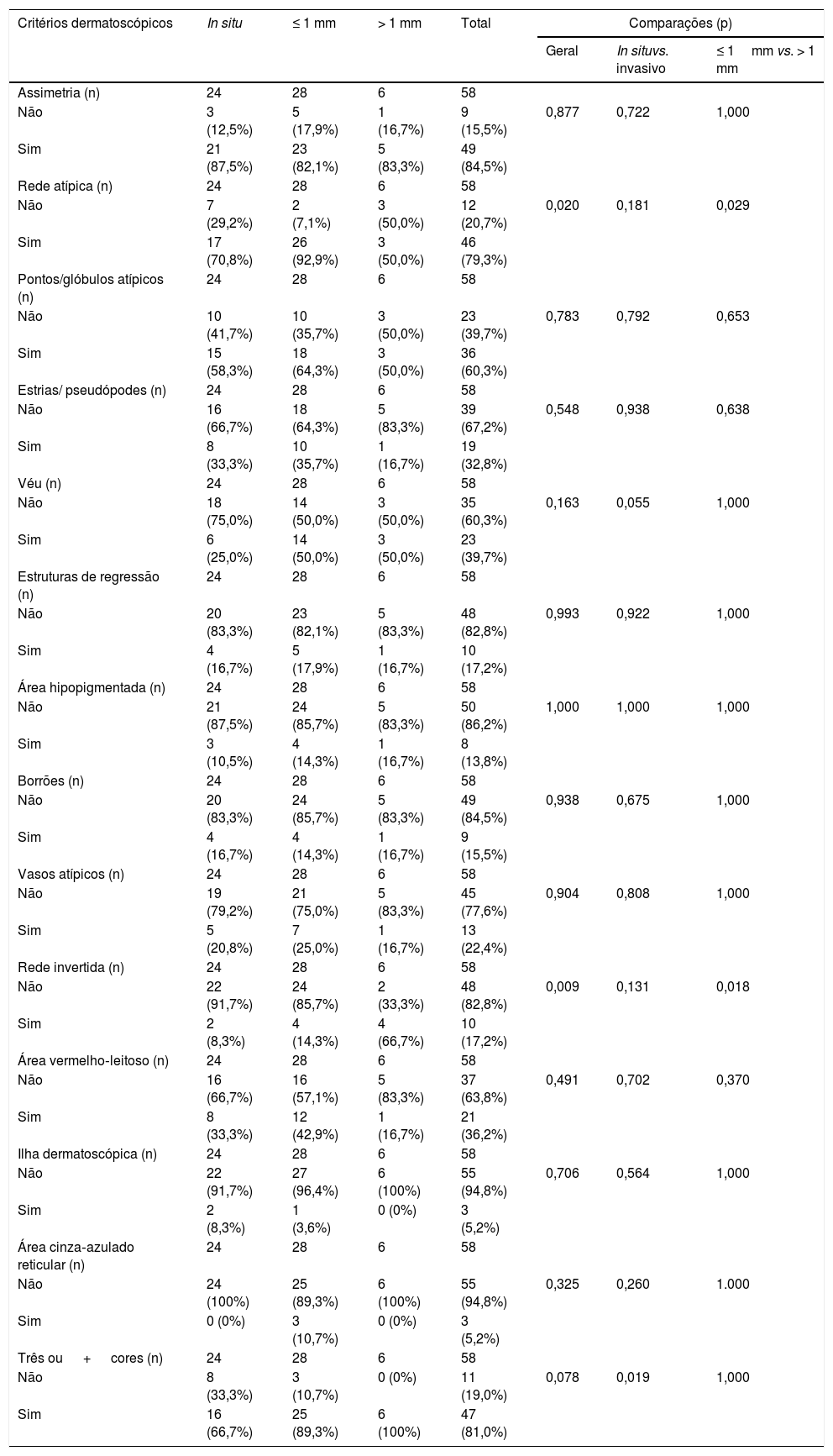
A tabela 4 apresenta a frequência dos critérios dermatoscópicos e as comparações entre os grupos. As características dermatoscópicas mais frequentemente encontradas foram: assimetria (84,5%), três ou mais cores (81,0%) e rede atípica (79,3%).
Critérios dermatoscópicos identificados em melanomas extensivos superficiais
| Critérios dermatoscópicos | In situ | ≤ 1 mm | > 1 mm | Total | Comparações (p) | ||
|---|---|---|---|---|---|---|---|
| Geral | In situvs. invasivo | ≤ 1mm vs. > 1 mm | |||||
| Assimetria (n) | 24 | 28 | 6 | 58 | |||
| Não | 3 (12,5%) | 5 (17,9%) | 1 (16,7%) | 9 (15,5%) | 0,877 | 0,722 | 1,000 |
| Sim | 21 (87,5%) | 23 (82,1%) | 5 (83,3%) | 49 (84,5%) | |||
| Rede atípica (n) | 24 | 28 | 6 | 58 | |||
| Não | 7 (29,2%) | 2 (7,1%) | 3 (50,0%) | 12 (20,7%) | 0,020 | 0,181 | 0,029 |
| Sim | 17 (70,8%) | 26 (92,9%) | 3 (50,0%) | 46 (79,3%) | |||
| Pontos/glóbulos atípicos (n) | 24 | 28 | 6 | 58 | |||
| Não | 10 (41,7%) | 10 (35,7%) | 3 (50,0%) | 23 (39,7%) | 0,783 | 0,792 | 0,653 |
| Sim | 15 (58,3%) | 18 (64,3%) | 3 (50,0%) | 36 (60,3%) | |||
| Estrias/ pseudópodes (n) | 24 | 28 | 6 | 58 | |||
| Não | 16 (66,7%) | 18 (64,3%) | 5 (83,3%) | 39 (67,2%) | 0,548 | 0,938 | 0,638 |
| Sim | 8 (33,3%) | 10 (35,7%) | 1 (16,7%) | 19 (32,8%) | |||
| Véu (n) | 24 | 28 | 6 | 58 | |||
| Não | 18 (75,0%) | 14 (50,0%) | 3 (50,0%) | 35 (60,3%) | 0,163 | 0,055 | 1,000 |
| Sim | 6 (25,0%) | 14 (50,0%) | 3 (50,0%) | 23 (39,7%) | |||
| Estruturas de regressão (n) | 24 | 28 | 6 | 58 | |||
| Não | 20 (83,3%) | 23 (82,1%) | 5 (83,3%) | 48 (82,8%) | 0,993 | 0,922 | 1,000 |
| Sim | 4 (16,7%) | 5 (17,9%) | 1 (16,7%) | 10 (17,2%) | |||
| Área hipopigmentada (n) | 24 | 28 | 6 | 58 | |||
| Não | 21 (87,5%) | 24 (85,7%) | 5 (83,3%) | 50 (86,2%) | 1,000 | 1,000 | 1,000 |
| Sim | 3 (10,5%) | 4 (14,3%) | 1 (16,7%) | 8 (13,8%) | |||
| Borrões (n) | 24 | 28 | 6 | 58 | |||
| Não | 20 (83,3%) | 24 (85,7%) | 5 (83,3%) | 49 (84,5%) | 0,938 | 0,675 | 1,000 |
| Sim | 4 (16,7%) | 4 (14,3%) | 1 (16,7%) | 9 (15,5%) | |||
| Vasos atípicos (n) | 24 | 28 | 6 | 58 | |||
| Não | 19 (79,2%) | 21 (75,0%) | 5 (83,3%) | 45 (77,6%) | 0,904 | 0,808 | 1,000 |
| Sim | 5 (20,8%) | 7 (25,0%) | 1 (16,7%) | 13 (22,4%) | |||
| Rede invertida (n) | 24 | 28 | 6 | 58 | |||
| Não | 22 (91,7%) | 24 (85,7%) | 2 (33,3%) | 48 (82,8%) | 0,009 | 0,131 | 0,018 |
| Sim | 2 (8,3%) | 4 (14,3%) | 4 (66,7%) | 10 (17,2%) | |||
| Área vermelho‐leitoso (n) | 24 | 28 | 6 | 58 | |||
| Não | 16 (66,7%) | 16 (57,1%) | 5 (83,3%) | 37 (63,8%) | 0,491 | 0,702 | 0,370 |
| Sim | 8 (33,3%) | 12 (42,9%) | 1 (16,7%) | 21 (36,2%) | |||
| Ilha dermatoscópica (n) | 24 | 28 | 6 | 58 | |||
| Não | 22 (91,7%) | 27 (96,4%) | 6 (100%) | 55 (94,8%) | 0,706 | 0,564 | 1,000 |
| Sim | 2 (8,3%) | 1 (3,6%) | 0 (0%) | 3 (5,2%) | |||
| Área cinza‐azulado reticular (n) | 24 | 28 | 6 | 58 | |||
| Não | 24 (100%) | 25 (89,3%) | 6 (100%) | 55 (94,8%) | 0,325 | 0,260 | 1.000 |
| Sim | 0 (0%) | 3 (10,7%) | 0 (0%) | 3 (5,2%) | |||
| Três ou + cores (n) | 24 | 28 | 6 | 58 | |||
| Não | 8 (33,3%) | 3 (10,7%) | 0 (0%) | 11 (19,0%) | 0,078 | 0,019 | 1,000 |
| Sim | 16 (66,7%) | 25 (89,3%) | 6 (100%) | 47 (81,0%) | |||
A rede atípica foi encontrada em 17 (70,8%) MIS, 26 (92,9%) MES invasivos com Breslow<1mm e três (50,0%) MES invasivos com Breslow > 1mm. Sua presença foi significativamente menor em MES invasivos com Breslow > 1mm quando comparados a MES invasivos com Breslow ≤ 1mm (p=0,029).
O véu azul‐esbranquiçado foi menos comum no grupo MIS (seis casos, 25,0%), quando comparado aos grupos MES invasivos com Breslow ≤ 1mm (14 casos, 50,0%) e MES invasivos com Breslow > 1mm (três casos, 50,0%), porém não o suficiente para atingir significância estatística (p=0,055).
A rede invertida foi mais frequente nos MES invasivos com Breslow > 1mm, nos quais os quatro casos representaram, proporcionalmente, 66,7% da amostra, enquanto o grupo MIS apresentou dois casos (8,3%) e o grupo MES invasivos com Breslow ≤ 1mm, quatro casos (14,3%). O fato de essa característica ser mais comum ao grupo > 1mm fez com que tanto a comparação geral entre os três grupos (p=0,009) quanto a comparação entre MES com Breslow ≤ e > 1mm (p=0,018) fosse estatisticamente significativa.
A presença de três ou mais cores, comum a 47 tumores (81,0% do total), foi proporcionalmente mais frequente no grupo MES invasivos com Breslow > 1mm, com 100% (seis casos), e diminuiu para 89,3% (25 casos) no grupo ≤ 1mm e 66,7% (16 casos) no grupo MIS. A diferença foi significativa na comparação entre MIS e MES invasivo (p=0,019).
Assimetria, pontos e glóbulos atípicos, estrias radiadas e/ou pseudópodes, estruturas de regressão, área hipopigmentada, borrões, vasos atípicos, área vermelho‐leitoso, ilha dermatoscópica e área cinza‐azulado reticular não apresentaram diferença significativa nas proporções encontradas entre os grupos.
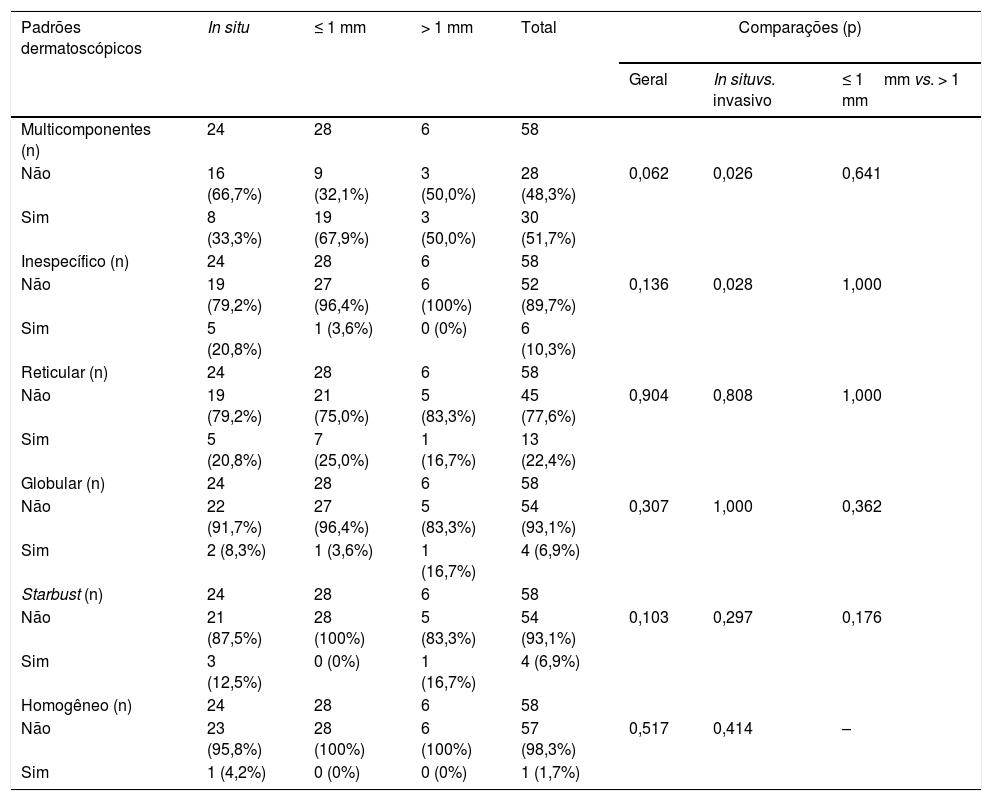
A tabela 5 apresenta os padrões dermatoscópicos e as comparações entre os grupos.
Padrões dermatoscópicos identificados em melanomas extensivos superficiais
| Padrões dermatoscópicos | In situ | ≤ 1 mm | > 1 mm | Total | Comparações (p) | ||
|---|---|---|---|---|---|---|---|
| Geral | In situvs. invasivo | ≤ 1mm vs. > 1 mm | |||||
| Multicomponentes (n) | 24 | 28 | 6 | 58 | |||
| Não | 16 (66,7%) | 9 (32,1%) | 3 (50,0%) | 28 (48,3%) | 0,062 | 0,026 | 0,641 |
| Sim | 8 (33,3%) | 19 (67,9%) | 3 (50,0%) | 30 (51,7%) | |||
| Inespecífico (n) | 24 | 28 | 6 | 58 | |||
| Não | 19 (79,2%) | 27 (96,4%) | 6 (100%) | 52 (89,7%) | 0,136 | 0,028 | 1,000 |
| Sim | 5 (20,8%) | 1 (3,6%) | 0 (0%) | 6 (10,3%) | |||
| Reticular (n) | 24 | 28 | 6 | 58 | |||
| Não | 19 (79,2%) | 21 (75,0%) | 5 (83,3%) | 45 (77,6%) | 0,904 | 0,808 | 1,000 |
| Sim | 5 (20,8%) | 7 (25,0%) | 1 (16,7%) | 13 (22,4%) | |||
| Globular (n) | 24 | 28 | 6 | 58 | |||
| Não | 22 (91,7%) | 27 (96,4%) | 5 (83,3%) | 54 (93,1%) | 0,307 | 1,000 | 0,362 |
| Sim | 2 (8,3%) | 1 (3,6%) | 1 (16,7%) | 4 (6,9%) | |||
| Starbust (n) | 24 | 28 | 6 | 58 | |||
| Não | 21 (87,5%) | 28 (100%) | 5 (83,3%) | 54 (93,1%) | 0,103 | 0,297 | 0,176 |
| Sim | 3 (12,5%) | 0 (0%) | 1 (16,7%) | 4 (6,9%) | |||
| Homogêneo (n) | 24 | 28 | 6 | 58 | |||
| Não | 23 (95,8%) | 28 (100%) | 6 (100%) | 57 (98,3%) | 0,517 | 0,414 | – |
| Sim | 1 (4,2%) | 0 (0%) | 0 (0%) | 1 (1,7%) | |||
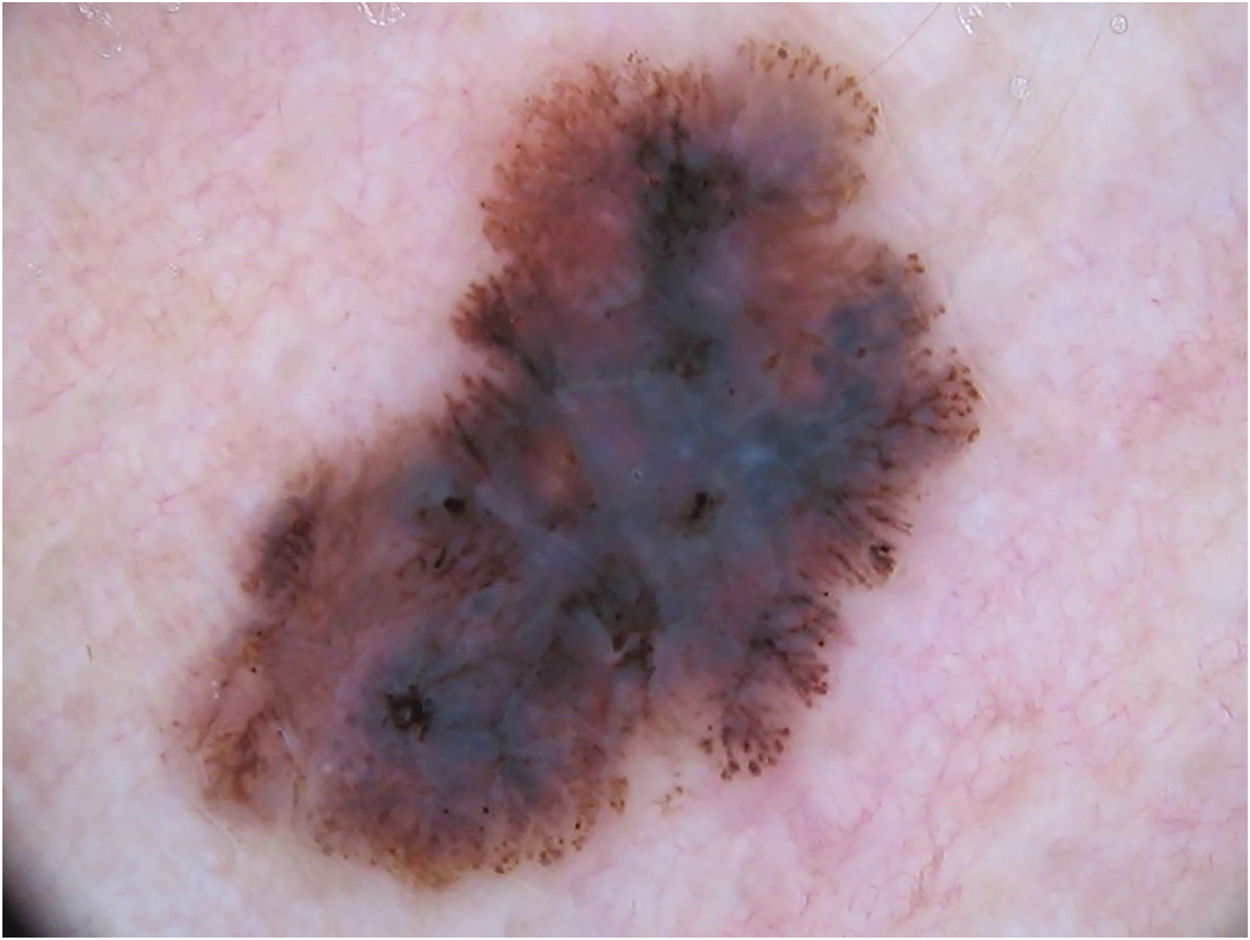
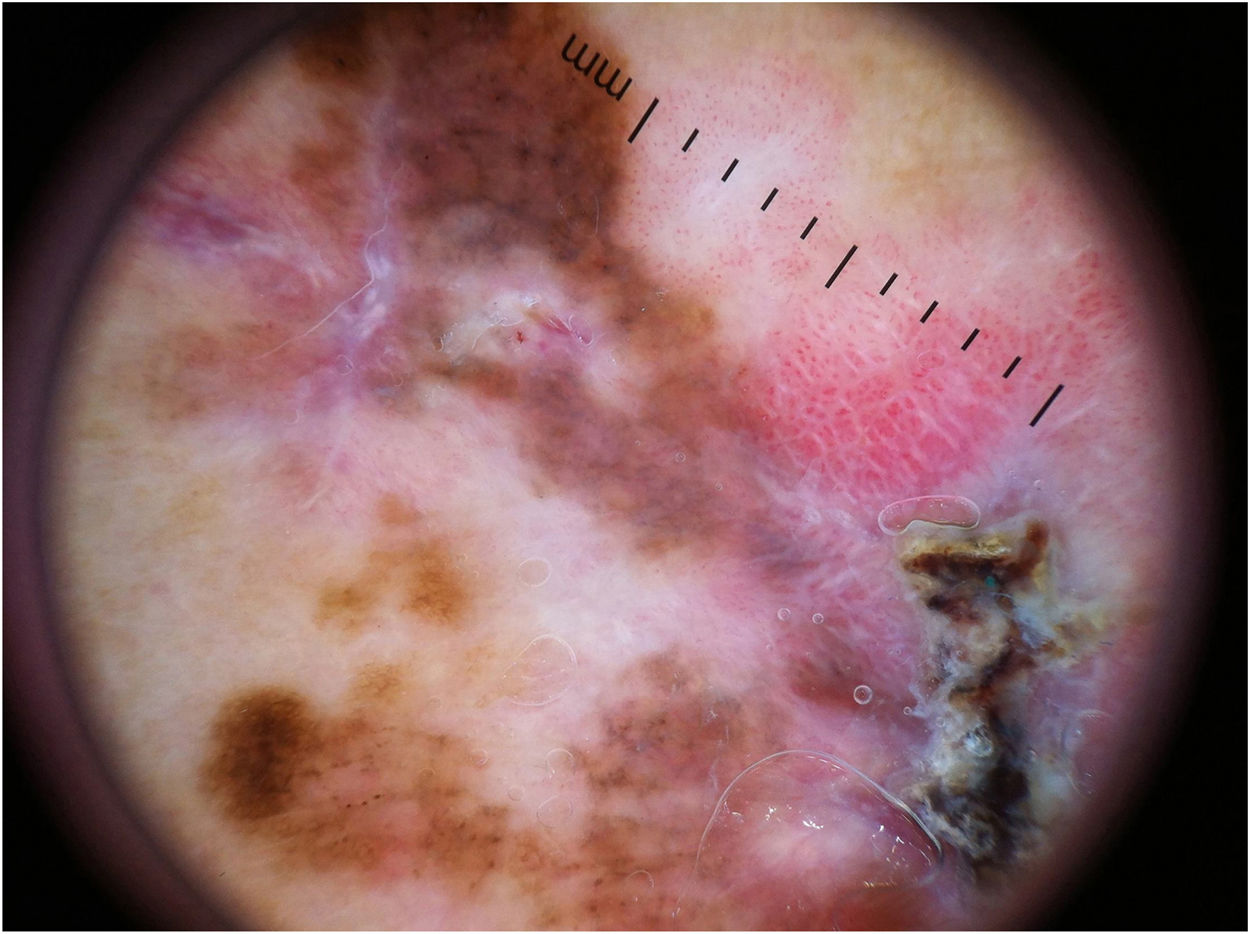
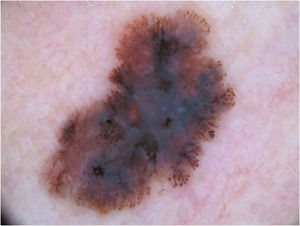
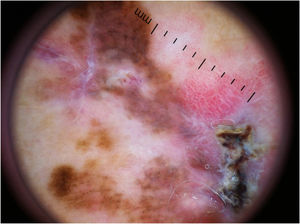
Padrão multicomponente (figs. 1 e 2) foi observado em 30 (51,7%) tumores. Foram oito casos (34,8%) no grupo MIS, 19 (67,9%) e 3 (50,0%) casos nos grupos MES invasivos com Breslow ≤ 1mm e > 1mm, respectivamente, tendo sido significativamente mais comum em MES invasivos do que em MIS (p=0,026).
Melanoma extensivo superficial com Breslow 0,5mm; localizado na região cervical. À dermatoscopia, observa‐se assimetria de contorno, cores e estruturas, rede atípica, pontos e glóbulos atípicos, estrias radiadas e pseudópodes e véu azul‐esbranquiçado, caracterizando padrão multicomponentes.
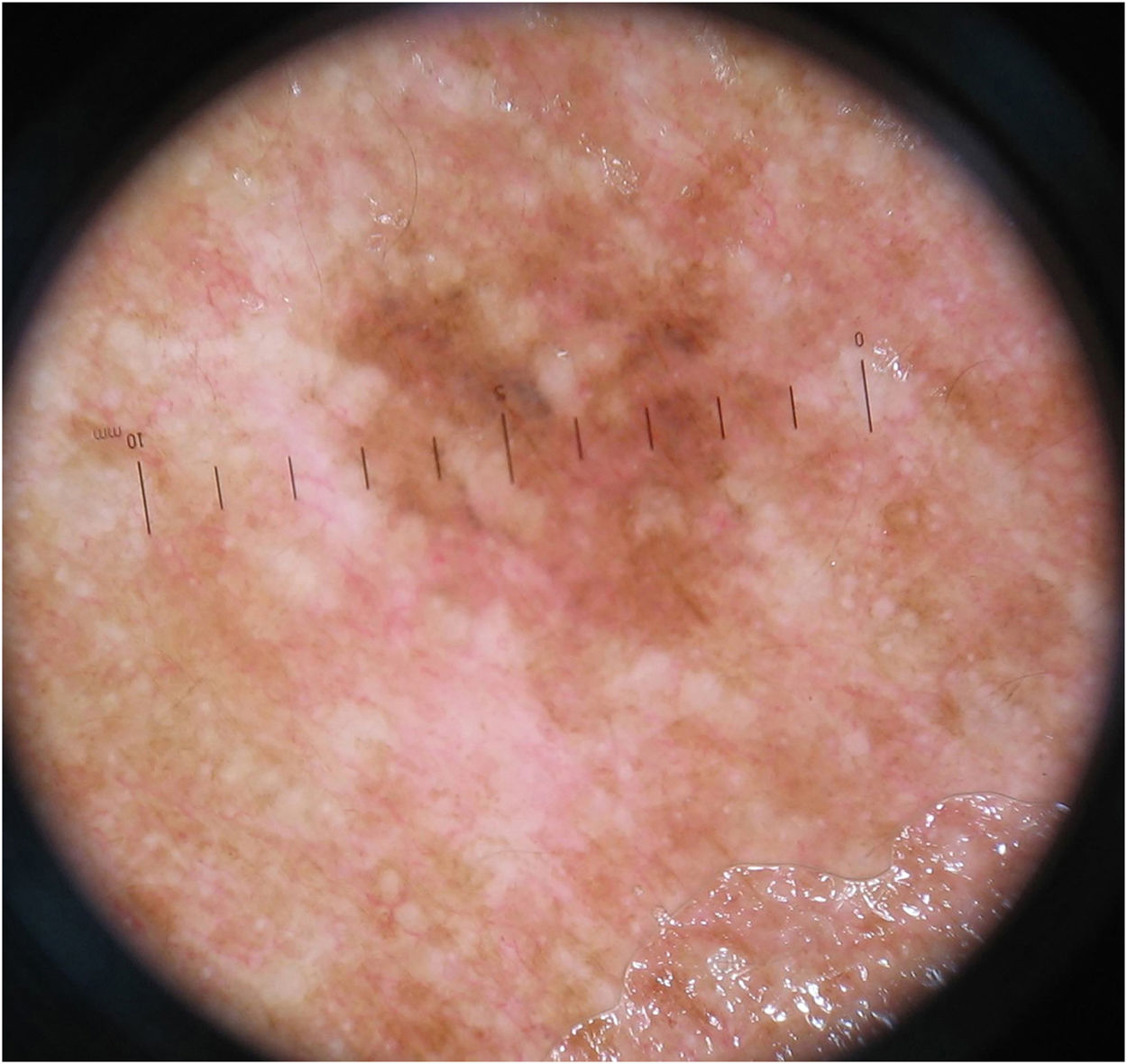
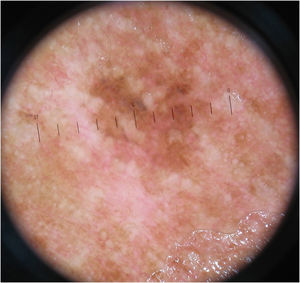
O padrão inespecífico (fig. 3), comum a seis (10,3%) dos tumores, foi mais frequente no grupo MIS (cinco tumores – 20,8%), quando comparado aos grupos MES invasivos com Breslow ≤ 1mm (um caso – 3,6%) e > 1mm (nenhum caso). A diferença encontrada foi estatisticamente significativa na comparação entre MIS e MES invasivos (p=0,028).
Os padrões reticular, globular, homogêneo e starbust não apresentaram diferenças entre os grupos.
DiscussãoA incidência do melanoma tem aumentado de modo alarmante nas últimas décadas em todo o mundo – entretanto, com tendência à estabilização da taxa de mortalidade.29 De fato, a literatura mundial reporta um aumento na incidência de melanomas finos, refletindo diagnóstico mais precoce, provavelmente em decorrência da dermatoscopia. Outra hipótese seria que a melhora no diagnóstico do melanoma resulte na detecção de um subgrupo de melanomas finos e de crescimento lento, chamados de “slow‐growing melanomas”, que poderiam progredir apenas eventualmente para melanomas espessos.30
A amostra de 58 melanomas foi obtida por conveniência, uma vez que para ser incluído no estudo o paciente precisava ter foto dermatoscópica pré‐operatória. Isso levou a uma perda de casos, pois lesões clinicamente pouco expressivas podem não ter sido fotografadas. Por outro lado, pacientes com lesões clinicamente muito sugestivas de melanoma podem ter sido encaminhados para a dermatologia após a remoção do tumor, levando a uma perda dos melanomas em estágios avançados. Por isso, acreditamos que o grupo de MES invasivos com Breslow > 1mm tenha contado com apenas seis casos, levando a média de espessura dos MES invasivos a ser de apenas 0,82mm. A amostra pode ser considerada expressiva quando comparada a estudos brasileiros.15,31
Os MIS apresentaram tamanho médio menor que os melanomas invasivos, com diferença estatisticamente significativa (p=0,04). Esse achado é esperado, já que na maioria das vezes os tumores menores tendem a ser menos invasivos, e está de acordo com a literatura.32
As características dermatoscópicas mais encontradas neste estudo foram assimetria, três ou mais cores, rede atípica e pontos e glóbulos atípicos.
A assimetria foi o critério mais comum (84,5%), com frequência semelhante entre os grupos, o que está de acordo com estudos anteriores.15,18,32 A assimetria é um achado mais frequente no MES quando comparado a outros subtipos de melanoma, e pode estar ausente nos tumores nodulares e amelanóticos, não incluídos neste estudo.33,34
A presença de três ou mais cores foi significativamente mais comum no MES invasivo que no MIS (p=0,019) – o que está de acordo com a literatura; é sugerido que o aumento do número de cores pode estar diretamente relacionado ao índice de Breslow.15,18,35
Na fase de crescimento radial do melanoma, observa‐se proliferação de melanócitos atípicos isolados ou agrupados em ninhos ao longo da junção dermoepidérmica e nas camadas suprabasais (disseminação pagetoide). Essa proliferação pode causar alterações na rede pigmentar, que se torna atípica, e é uma característica de melanomas do subtipo MES, podendo estar presente também em nevos atípicos. Alterações na rede pigmentar são mais facilmente visíveis em melanomas em estágios iniciais (MIS e MES invasivos com Breslow ≤ 0,75mm), uma vez que com a progressão da lesão há perda das cristas epiteliais, e a rede pode ser vista apenas focalmente.36–40 Neste estudo, a rede atípica foi mais comum em MES invasivos com Breslow ≤ 1mm quando comparados com Breslow > 1mm, com diferença estatisticamente significativa (p=0,029); entretanto, não houve diferença entre os grupos MIS e MES invasivo. Isso pode ser justificado pelo fato de que a grande maioria dos casos do grupo MES invasivo apresenta Breslow ≤ 1mm, com média de Breslow de apenas 0,50mm, apresentando características dermatoscópicas de melanomas finos.
As estrias radiadas e/ou pseudópodes também são mais encontradas em melanomas do subtipo MES, e foi sugerido por Argenziano et al. que sua presença indicaria fase de crescimento radial do tumor.38 Entretanto, em estudos mais recentes essas estruturas foram descritas com maior frequência nos melanomas invasivos.15,18,36
A fase de crescimento vertical é marcada pela invasão do tumor; véu azul‐esbranquiçado e vasos atípicos são mais comumente encontrados.41 O véu foi encontrado em 50% dos melanomas invasivos e em 25% dos MIS, porém não o suficiente para atingir significância estatística (p=0,055), tendo sido considerado um achado borderline. O véu é uma estrutura altamente específica para o diagnóstico de melanoma, com especificidade de até 97%, e é mais encontrado em melanomas com maior espessura.27,42–44 Acreditamos que esse critério poderia ter atingido significância estatística caso o tamanho da amostra fosse maior.
Área/glóbulos vermelho‐leitosos e vasos atípicos surgem em decorrência do polimorfismo vascular, que aumenta proporcionalmente ao aumento da espessura, e são mais frequentes em melanomas intermediários e espessos (> 1mm).44 Essas estruturas são mais facilmente visíveis em melanomas hipo/amelanóticos, nos quais podem ser a única pista para o diagnóstico.44 Acreditamos que o padrão vascular atípico pode ter sido subestimado neste estudo, uma vez que os vasos seriam mais bem visualizados com luz polarizada, e a dermatoscopia de contato pode comprimi‐los e prejudicar sua avaliação nas imagens.45
A rede invertida é característica, mas não exclusiva de melanomas, podendo ser vista no nevo de Spitz, nevo atípico ou dermatofibroma.24,46 No presente estudo, foi encontrada em 17,2% dos casos, com maior frequência no grupo MES com Breslow > 1mm (p=0,018), o que está de acordo com a literatura.47,48 A rede invertida foi encontrada com maior frequência em melanomas invasivos com Breslow > 1mm, surgindo em nevos, de localização no tronco e em pacientes jovens.48 Sua extensão e distribuição também foram avaliadas, de modo que sua presença em mais de 20% da lesão e com distribuição heterogênea foram mais comuns nos melanomas invasivos.48
A ilha dermatoscópica, descrita por Borsari et al., consiste em uma área circunscrita com padrão dermatoscópico diferente do restante da lesão e foi considerada característica de melanomas finos surgindo de nevos.26 Neste estudo, foi encontrada em apenas três casos (5,2%) – dois MIS e um MES invasivo com Breslow ≤ 1mm –, e não foi suficiente para atingir diferença estatisticamente significativa.
O padrão multicomponente é considerado o mais característico e mais associado ao melanoma, e é mais comum em melanomas invasivos. Já o padrão inespecífico, encontrado em 10,3% dos casos, foi significativamente mais comum no MIS (p=0,028). Esse achado, pelo nosso conhecimento, não foi descrito anteriormente na literatura, mas é esperado, uma vez que à medida que a espessura do tumor aumenta, são encontrados mais critérios dermatoscópicos específicos de melanoma. Pode‐se inferir que são necessários mais estudos sobre os melanomas incaracterísticos (featureless melanomas), com o intuito de estabelecer melhor os critérios para seu diagnóstico. A existência de melanomas com padrão inespecífico reforça a importância da história clínica, e deve‐se considerar biópsia de toda lesão pigmentada em que um diagnóstico benigno não puder ser feito, principalmente no caso de uma lesão de início recente e/ou com modificação e sintomas.
A avaliação dermatoscópica tem importância fundamental no diagnóstico precoce e na estimativa pré‐operatória do índice de Breslow do melanoma. São necessários outros estudos, sobretudo na população brasileira, com maior amostra e maior proporção de melanomas intermediários e espessos, para confirmação dos achados.
ConclusãoOs melanomas em estágios iniciais apresentaram com maior frequência padrão inespecífico (p=0,028) e rede atípica (p=0,029).
Os melanomas invasivos apresentaram com maior frequência tamanho ≥ 6mm (p=0,04), padrão multicomponentes (p=0,026) e três ou mais cores (p=0,019), enquanto os melanomas intermediários e espessos apresentaram com maior frequência rede invertida (p=0,018).
Véu azul‐esbranquiçado foi mais comum em MES invasivos, sem atingir significância estatística. Assimetria, pontos e glóbulos atípicos, estrias radiadas e/ou pseudópodes, estruturas de regressão, área hipopigmentada, borrões, vasos atípicos, área vermelho‐leitoso, ilha dermatoscópica, área cinza‐azulado reticular e os padrões reticular, globular, starbust e homogêneo não apresentaram diferença significativa nas proporções encontradas entre os grupos.
Suporte financeiroNenhum.
Contribuição dos autoresFernanda Marques Trindade: Análise estatística; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Flávia Vasques Bittencourt: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Maria Luiza Pires de Freitas: Obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Conflito de interessesNenhum.
Como citar este artigo: Trindade FM, Freitas MLP, Bittencourt FV. Dermoscopic evaluation of superficial spreading melanoma. An Bras Dermatol. 2021;96:139–47.
Trabalho realizado no Departamento de Dermatologia, Hospital das Clínicas, Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.