A infecção pelo papiloma vírus humano (HPV) resulta em grande número de manifestações clínicas na pele e nas mucosas. Seu espectro vai desde infecções subclínicas, passando por várias doenças benignas da pele e mucosas e culminando com lesões pré‐malignas e neoplasias francas. O registro de novos tipos do HPV cresce continuamente, e muitos deles são caracterizados como tipos de alto risco por seu potencial oncogênico. O conhecimento de sua epidemiologia e patogênese torna possível o entendimento não só do processo de infecção e doença, mas das medidas necessárias para o diagnóstico clínico e laboratorial, o tratamento e, antes disso, a prevenção. Nesta revisão não sistemática, buscou‐se por artigos que propiciassem uma atualização e discussão sobre esses aspectos. Aqui são abordados os principais aspectos da epidemiologia, da patogênese e das manifestações clínicas, com ênfase naquelas da competência do dermatologista. Discute‐se a distribuição da infecção e das doenças com destaque no panorama brasileiro, tanto das manifestações cutâneas presentes no cotidiano dos consultórios médicos quanto da condição de agravo de saúde pública como infecção sexualmente transmissível. São abordados, ainda, a oncogenicidade do vírus e seu desdobramento nas múltiplas manifestações clínicas, especialmente em imunossuprimidos.
A alta prevalência da infecção pelo papiloma vírus humano – HPV (do inglês, human papillomavirus) e sua relação com doenças, que vão desde os quadros benignos na pele e mucosas até a situação de infecção sexualmente transmissível (IST) mais frequente, configuram sua importância no cenário de saúde pública e o papel do dermatologista como um dos profissionais capacitados a diagnosticar e tratar muitas dessas doenças.1 Dentre os mais de 400 tipos de papilomavírus (PV) descritos, 218 estão relacionados a infecções em humanos.2 Seu potencial oncogênico é bem estabelecido em vários tipos de neoplasias e tem sido amplificado por situações de imunossupressão em segmentos cada vez mais numerosos da população, comprometendo a sobrevida e a qualidade de vida dos indivíduos afetados.3,4 Vacinas profiláticas que têm como alvo diversos tipos de HPV causadores de lesões benignas ou malignas em mucosas estão disponíveis em vários países do mundo, infelizmente ainda com coberturas abaixo do ideal.5
Por outro lado, avanços no tratamento são incorporados de maneira mais lenta no arsenal terapêutico, o que mostra a importância do diagnóstico precoce e da educação em saúde como medidas de prevenção. Nesta revisão não sistemática, buscou‐se por artigos que propiciassem atualização e discussão sobre aspectos da epidemiologia, da patogênese e das principais manifestações clínicas relacionadas ao HPV.
EpidemiologiaAtualmente, cerca de 218 tipos de HPV já foram isolados e identificados como causadores de infecções em humanos.2 Desses, 45 são capazes de infectar o trato genital, enquanto os outros causarão doença cutânea.6 Os HPV do gênero alfa produzem lesões clinicamente visíveis nas mucosas e na pele, enquanto os gêneros beta e gama são, principalmente, responsáveis por lesões subclínicas cutâneas persistentes secundárias a infecções adquiridas precocemente na infância.7 A infecção ocorre predominantemente por contato direto, embora as lesões cutâneas possam ser transmitidas indiretamente, via superfícies contaminadas.8 Microtraumas expõem os ceratinócitos da camada basal e facilitam o contágio.7
As verrugas cutâneas (VC) relacionadas aos tipos de HPV de transmissão não sexual têm características epidemiológicas completamente distintas e são causadas, principalmente, pelos tipos 1, 2, 4, 27 e 57.9,10 Embora esses sejam os tipos mais prevalentes em diversos estudos, a proporção de indivíduos afetados por cada um deles é bastante variável. Alguns autores especulam que as diferenças decorram de variações sociogeográficas.9 Um estudo realizado em escolas holandesas encontrou VC em cerca de um terço dos participantes; a prevalência aumentou com a idade, de cerca de 15% aos 4 anos para cerca de 44% aos 11 anos, sem diferença entre os sexos.10 A infecção pelo HPV 1 acomete uma faixa etária mais jovem, mais frequentemente a região plantar, tem menor número e menor duração das lesões, enquanto o HPV 2 seria responsável pelo segundo pico, na segunda e terceira décadas de vida.9,10
Os principais fatores de risco encontrados nos pacientes escolares foram familiares próximos com VC e famílias com múltiplos filhos. A transmissão via banheiros e vestiários públicos não foi estatisticamente relevante no estudo.10 A autoinoculação também é descrita, principalmente na presença de lesões digitais. Acredita‐se que a prevalência de VC na população geral gire em torno de 5% e seja resultante da infecção contínua e repetida por múltiplos tipos.11
A lesão genital pelo HPV é a IST mais prevalente no mundo.12 No Brasil, uma revisão sistemática recente, realizada por Colpani et al., mostrou prevalência de HPV em lesões mucosas: 36,21% na região peniana, 25,68% na região anal, 24,11% na região cervical uterina e 11,89% na oral.1 O estudo incluiu mais de 50.000 participantes de todas as idades; a prevalência foi superior à da América Central (13%) e da Europa Ocidental (9%).1 Outro estudo brasileiro, multicêntrico e de base comunitária em jovens não vacinados, detectou HPV de alto risco (HPV AR) em 35,2% dos indivíduos, com predomínio nas mulheres.13 Contudo, quando foram analisados jovens sexualmente ativos, esse percentual chegou a 53,5% para todos os tipos de HPV, independente do sexo.13 Estima‐se que 75% dos adultos sexualmente ativos terão pelo menos uma infecção por HPV durante a vida. Os tipos mais frequentemente envolvidos são o 6 e o 11, presentes em cerca de 80% das lesões orais e mais de 90% das lesões genitais.12 Os fatores de risco incluem número de parceiros e idade da primeira relação sexual, imunossupressão (incluindo HIV) e presença de outras IST, como herpes simples. A relação com tabagismo e uso de contraceptivos orais permanece controversa.12 O contágio pode ocorrer por qualquer forma de contato sexual, mesmo sem penetração.12 A incidência de infecção anal é alta entre homens que fazem sexo com homens (HSH).14 As lesões nos homens parecem ser menos persistentes do que nas mulheres.15
O pico de incidência da infecção ocorre aproximadamente 10 anos após a sexarca, geralmente entre os 24 e 30 anos de vida para ambos os sexos. Embora a prevalência diminua com a idade, estudos mostram um segundo pico de incidência tardio nas mulheres, na quinta década de vida.12,13 Os episódios de manifestação clínica têm duração média de dois meses e meio. Para cada um desses episódios, são realizadas, em média, três consultas médicas.16
Na região anogenital, o HPV, principalmente os tipos 16 e 18, está implicado na patogênese dos tumores malignos, com envolvimento em praticamente 100% dos casos de câncer de colo de útero,85% dos tumores anais e 50% dos tumores de pênis e vulva.1,12 No Brasil, o Programa Nacional de Vacinação contra o HPV foi instituído em 2014 para meninas entre 9 e 13 anos e, posteriormente, ampliado para meninos entre 12 e 13 anos.1 A vacinação pode prevenir mais de 90% dos casos de câncer de colo de útero.4
As taxas de infecção oral pelo HPV nos indivíduos saudáveis variam entre 0% e 20%, dependendo da população estudada.15 O envolvimento do HPV nos carcinomas espinocelulares (CEC) de orofaringe é de 36%. Quando todos os carcinomas de cabeça e pescoço são incluídos, a prevalência do HPV cai para 26%.15
A imunossupressão é importante fator de risco para as lesões de HPV. Estudos sugerem que as alterações temporárias na imunidade das gestantes podem ser a explicação para as maiores taxas de infecção pelo HPV nesse grupo em relação às pacientes que não estão grávidas.17 Pacientes que receberam transplantes de órgãos sólidos (TOS) e HIV positivos são especialmente suscetíveis. Estima‐se que aproximadamente 40% dos transplantados terão VC.6 A presença dos HPV cutâneos ubiquamente distribuídos pela pele desse grupo de pacientes é descrita.6 Estima‐se que a incidência de câncer de pele associado ao HPV nesses pacientes aumenta 5% ao ano, com um risco cumulativo de 44% após nove anos.6 O mesmo é descrito em relação à incidência de lesões malignas e pré‐malignas nas mucosas, onde a imunossupressão se destaca como fator de risco importante.4 Os riscos variam para as diversas localizações das neoplasias relacionadas ao HPV entre pacientes com TOS e indivíduos que vivem com HIV, podendo chegar a uma incidência de até 80 vezes maior do que na população geral no caso do câncer anal em algumas subpopulações.3,18–20
PatogêneseCaracterísticas do vírusOs PV evoluíram, ao longo de milhões de anos, em paralelo às espécies por eles infectadas e apresentam uma grande especificidade celular pelos tecidos epiteliais e enorme grau de adaptação. Eles constituem grupo de vírus com marcada espécie‐especificidade e são capazes de produzir infecções subclínicas, de longa evolução e com baixa replicação viral, infecções clínicas, por meio da evasão dos mecanismos imunes do hospedeiro, além de participarem do processo de carcinogênese de tumores das regiões cutânea, anogenital e oral.7
A família Papillomaviridae inclui duas subfamílias: Firstpapillomavirinae, com mais de 50 gêneros e 130 espécies, e Secondpapillomavirinae, com um gênero e uma espécie.21 A classificação se baseia na sequência de DNA do gene L1: gêneros compartilham mais de 60% da sequência de nucleotídeos, e espécies entre 71% a 89% dos nucleotídeos. Um novo tipo de PV deve ter sua sequência de DNA da região L1 diferenciada em pelo menos 10% de um tipo conhecido, enquanto a variante apresenta menos de 2% de diferença. Existem cerca de 429 tipos identificados, dos quais 218 foram isolados em humanos.2 Os PV que infectam humanos pertencem a cinco gêneros: o alfa‐papilomavírus (α‐HPV), com 14 espécies classificadas e 65 tipos, produz lesões visíveis macroscópicas e contempla vírus de baixo risco cutâneo e de baixo e alto risco mucoso – os últimos estão envolvidos em processos de carcinogênese; os beta‐papilomavírus (β‐HPV), com seis espécies classificadas e 52 tipos, produzem infecções subclínicas, principalmente na infância, e estão particularmente envolvidos no surgimento de tumores cutâneos em pacientes imunossuprimidos e portadores de epidermodisplasia verruciforme (EV); os gama‐papilomavírus (γ‐HPV), com 27 espécies classificadas e 97 tipos, produzem infecções subclínicas na infância e lesões clínicas em pacientes imunocomprometidos; os mu‐papilomavírus (μ‐HPV), com três espécies e três tipos, e os nu‐papilomavírus (ν‐HPV), com uma espécie e um tipo, estão relacionados a lesões cutâneas.2,21,22
O PV mede cerca de 50nm de diâmetro, apresenta capsídeo não envelopado e com simetria icosaédrica; seu DNA é constituído de dupla hélice com genoma que varia de 5.748 (Sparus aurata Papillomavirustype1; SaPV1) a 8.607 nucleotídeos (Canine papillomavirustype1; CPV1). O capsídeo viral é constituído por 72 pentâmeros da principal proteína L1 e 12 moléculas da proteína secundária L2. Eles infectam peixes, répteis, aves e, principalmente, mamíferos.21
Os PV são geneticamente estáveis. O genoma viral geralmente é dividido em uma região URR (upstream regulatory region – região reguladora proximal) ou LCR (long control region – região reguladora distal) e dois grupos de ORF (open read frames – unidades de tradução) que são designados como E (early – precoce) ou L (late – tardia). Os genes E1, E2, L1 e L2, do core, cumprem funções essenciais durante o ciclo de vida do vírus no epitélio. Os genes E5, E6 e E7 são considerados acessórios e evoluíram para facilitar a replicação viral no epitélio escamoso, não estando presentes em todos os tipos de PV. Os genes codificam proteínas com funções específicas durante o ciclo viral. A região URR ou LCR está localizada entre as regiões ORF L1 e E6 e contém a origem da replicação viral, assim como local para fatores de transcrição virais e celulares.
A proteína E1 é uma DNA helicase ATP‐dependente, importante na replicação e amplificação do genoma viral no núcleo das células infectadas. A proteína E2 regula o ciclo de vida viral, é um coativador da replicação do genoma viral por recrutar a proteína E1 e funciona como fator de transcrição para as proteínas E6 e E7. A proteína L1 é a principal formadora do capsídeo viral, enquanto a L2, além de compor o capsídeo, está envolvida na encapsidação do DNA viral e na entrada e no tráfego do vírus no núcleo.
A proteína L1 apresenta alta imunogenicidade e serve como base para as vacinas usadas na prevenção da infecção pelo HPV. A proteína viral E4 apresenta algumas características das proteínas do core e se expressa nos estágios tardios do ciclo viral, liga‐se às citoceratinas produzindo sua ruptura e contribuindo para a liberação e a transmissão do vírus. A E5 é uma proteína hidrofóbica transmembrana, presente no gênero alfa, com papel de evasão da resposta imune e apoptose. As proteínas E6 e E7 estão relacionadas à amplificação do genoma viral e à carcinogênese, em alguns tipos de HPV.7,21 As proteínas virais são expressas de maneira diversa durante a diferenciação epitelial e durante o ciclo de vida do vírus, o qual acompanha essa diferenciação (tabela 1).
Genoma e proteínas virais do papiloma vírus humano (HPV)
| Regiões do genoma | Proteína viral | Função |
|---|---|---|
| URRa/LCRb | Origem da replicação viral; local para fatores de transcrição virais e celulares | |
| ORF latec | L1 | Constituinte do capsídeo viral |
| L2 | Constituinte do capsídeo viral; encapsidação do DNA e entrada e tráfego do vírus no núcleo | |
| ORF earlyc | E1 | Replicação e amplificação do genoma viral no núcleo das células infectadas |
| E2 | Regula o ciclo viral e fator de transcrição para as proteínas E6 e E7 | |
| E4 | Liga‐se às citoceratinas, contribui para liberação e transmissão do vírus | |
| E5 | Papel na evasão da resposta imune e apoptosed | |
| E6 | Amplificação do genoma viral e carcinogênesee | |
| E7 | Amplificação do genoma viral e carcinogênesee |
A infecção pelo HPV ocorre quando as partículas virais atingem as células basais expostas, habitualmente, por um microtrauma no epitélio. Ele apresenta tropismo pelas células‐tronco de diferentes epitélios mucosos e cutâneos, cujas diferenças acredita‐se influenciar no padrão de expressão gênica do vírus. Os locais onde a infecção parece ser facilitada são: epitélio de transição na região do cérvix uterino e na região anal, epitélios especializados das glândulas salivares da cavidade oral e criptas tonsilares da orofaringe, folículos pilosos, glândulas écrinas e apócrinas, além da epiderme.7
O vírus se liga aos proteoglicanos de sulfato de heparano das células basais e membrana basal exposta, que serve como um receptor primário. Essa ligação acontece com a proteína L1, o que induz mudanças no capsídeo viral que o ligam a outro receptor ainda não identificado. A internalização do capsídeo, que acontece de modo semelhante a um mecanismo de macropinocitose, pode demorar de duas a quatro horas. A entrada do genoma viral no núcleo é mediada pela proteína L2. A partir daí, inicia‐se a infecção por meio da transcrição do genoma viral.22
O ciclo de replicação viral tem três fases: uma inicial de amplificação do DNA, com participação das proteínas E1 e E2; uma fase de manutenção da replicação viral, que ocorre nas células proliferativas infectadas; e uma de amplificação do genoma e formação de novos vírus, que ocorre quando as células completam sua diferenciação celular. A fase de manutenção pode ser mantida por meses e anos. As proteínas do capsídeo viral encapsidam o DNA viral, formando partículas virais que são liberadas à medida que as células epiteliais são desprendidas.21
O HPV, em geral, completa seu ciclo de vida nas células epiteliais, não produz viremia, lise celular ou inflamação e se mantém protegido do sistema imune por meio de mecanismos de evasão da resposta imune inata, além de retardar a resposta imune adaptativa. Em regra, esse fenômeno se correlaciona com as infecções persistentes pelo HPV e com o aumento da possibilidade de evolução para neoplasias.7
Os ceratinócitos são células sentinelas do sistema imune e podem iniciar uma resposta a patógenos virais. As proteínas E6 e E7 dos HPV AR (16, 18 e 31) interferem nessa resposta. A infecção pelo HPV não ativa, tampouco recruta, células de Langerhans, apresentadoras de antígeno presentes no epitélio escamoso. Elas não respondem ao capsídeo do HPV, ao contrário das células dendríticas dérmicas, que conseguem iniciar uma resposta imune à proteína L1 viral. Consequentemente, uma resposta imune antígeno específica não ocorre.21,23
As infecções iniciais de alguns tipos de HPV podem ser controladas pela imunidade inata, enquanto as lesões clinicamente evidentes necessitam de resposta imune local que envolva linfócitos T citotóxicos CD8+ e T auxiliar (helper) 1 CD4+, que produzem interleucina‐2 (IL‐2) e interferon‐gama (IFN‐γ) e que reconhecem as proteínas virais E6, E7 e E2. A completa eliminação do vírus pode não correr, o que leva à situação de latência do mesmo. A reativação do HPV é frequentemente observada em pacientes imunossuprimidos transplantados e portadores de HIV. Nas infecções mucosas, alguns outros fatores têm sido citados como capazes de interferir na resposta imune ao HPV, como a microbiota, produtos da secreção mucosa e as repostas hormonais.23
OncogenicidadeOs primeiros HPV associados ao câncer foram os HPV 5 e 8 em pacientes portadores de EV, doença genética que predispõe à infecção por HPV, principalmente do gênero beta, e que ainda, por um mecanismo não totalmente esclarecido, falham em eliminar o vírus e desenvolvem verrugas em diversas partes do corpo. Nesses pacientes, esses HPV estão relacionados ao surgimento de cânceres de pele não melanoma (CPNM) em áreas expostas ao sol. Os β‐HPV também contribuem para os CPNM em pacientes imunossuprimidos TOS, permanecendo dúvidas sobre seu papel em pacientes imunocompetentes.22,24 O principal CPNM encontrado nesses pacientes é o CEC cutâneo, cujo maior fator de risco é a radiação ultravioleta (RUV). Estudos sugerem que os β‐HPV funcionam como carcinógenos coadjuvantes, necessários no processo de iniciação do câncer, uma vez que o genoma viral não é detectado nos tumores. Eles facilitariam o acúmulo das mutações do DNA induzidas pela RUV.25
Os estudos mostram que eles têm como alvo as vias celulares envolvidas no apoptose, no reparo do DNA e na diferenciação celular. Os alvos celulares variam entre os diferentes tipos de β‐HPV. A proteína E6 dos HPV 5, 8 e 38, por exemplo, possibilita que a célula infectada acumule mutações genéticas necessárias ao processo de carcinogênese ao interferir nos mecanismos de defesa celular. Ela se liga à proteína p300, interfere no reparo do DNA em resposta ao dano produzido pela RUV e contribui para o acúmulo de mutações, anormalidades cromossômicas e imortalização celular. Ademais, induz a degradação da Bak, uma proteína que repara, por meio de apoptose, danos do DNA celular induzidos pela RUV. A proteína E7 dos β‐HPV 23, 38 e 49 também apresenta propriedades oncogênicas, similares ao do gênero alfa, que envolvem inibição de proteínas supressoras de tumor da família retinoblastoma.25
Os HPV do gênero alfa, especificamente 12 tipos filogeneticamente relacionados, de transmissão sexual, com destaque para o HPV 16, encontram‐se relacionados ao câncer cervical e, com crescente evidência, a outros cânceres da região anogenital (ânus, vulva, vagina e pênis) e orofaringe. Com base, principalmente, nos estudos sobre câncer do colo do útero, são considerados HPV carcinogênicos, de AR: HPV 16, HPV 31, HPV 33, HPV 35, HPV 52 e HPV 58, pertencentes à espécie alfa‐9; HPV 18, HPV 39, HPV 45 e HPV 59, da espécie alfa‐7; HPV 51, da espécie alfa‐5; e HPV 56, da espécie alfa‐6.23,26 Os HPV 16 e 18 são detectados em até 70% de todos os cânceres de colo do útero.
Existem outros fatores que contribuem para o desenvolvimento do câncer de colo uterino, tais como tabagismo, multiparidade, uso de contraceptivos orais e coinfecção pelo HIV.26 O mecanismo pelo qual os α‐HPV AR participam da oncogênese engloba uma desregulação na expressão gênica viral, causada pela integração do genoma viral nas lesões pré‐malignas de alto grau e coexpressão das proteínas E6 e E7. As proteínas E6 e E7 modificam o meio celular e tornam possível a amplificação do genoma viral nas células epiteliais diferenciadas, que normalmente seriam incompetentes para replicação do DNA. A proteína E7, da maioria dos HPV, liga‐se à proteína retinoblastoma (pRb), supressora de tumor e com proteínas relacionadas, p107 e p130. A proteína E6, dos HPV AR, inativa a proteína p53, supressora de tumor, inibindo suas atividades antiproliferativa e apoptótica.22
Esse avanço no conhecimento foi fundamental para que fossem estabelecidas estratégias de prevenção primária e secundária: desde 2014, a vacinação para prevenção de infecção pelo HPV foi introduzida no Programa Nacional de Imunização do Ministério da Saúde do Brasil, e testes moleculares para pesquisa de DNA do HPV têm sido estabelecidos em alguns países com o objetivo de identificar tipos de AR.22,26 Ainda se aguarda o desenvolvimento de medidas preventivas relativas aos tumores relacionados aos β‐HPV.
Manifestações clínicasAs diversas manifestações clínicas variam de acordo com o tipo de HPV envolvido na infecção, o sítio anatômico de predileção do vírus e a resposta imune do hospedeiro. Os HPV 1 e 63, do gênero mu, por exemplo, parecem ter como alvo os ductos écrinos das regiões palmoplantares: o HPV 1 causa verrugas tipo mirmécia nas palmas e plantas, e é raro em outras localizações; o HPV 63 produz verrugas pontuadas (0,5 a 2mm) na região plantar e é identificado nos ceratinócitos ao redor dos acrossiríngeos e na porção superior do ducto écrino. Os HPV 4 e 65, do gênero gama, produzem verrugas pigmentadas nas regiões palmoplantar e lateral das mãos e dos pés, enquanto o HPV 95, também do gênero gama, produz pápulas não pigmentadas na região plantar. O HPV 7, do gênero alfa, produz verrugas do tipo “açougueiro”, principalmente nas mãos. Essas considerações também valem para os HPV mucosos; os HPV 6 e 11, pertencentes ao gênero alfa, por exemplo, parecem apresentar distribuição epitelial mais limitada: o HPV 6 tem predileção pela região genital, enquanto o HPV 11 é encontrado mais frequentemente na região oral. Esses diferentes tropismos epiteliais refletem diferenças genéticas do vírus, além de padrões diferentes de expressão gênica e regulação epitelial em diversos sítios anatômicos7 (tabela 2).
Manifestações clínicas e principais tipos de HPV relacionados
| Manifestação clínica | HPV | Referências |
|---|---|---|
| Cutânea | ||
| Verruga vulgar | 2, 4, 7, 26, 27, 28, 29 e 57 | Vlahovic, 2016 |
| Verruga do açougueiro | 7 | Bacaj, 2018 e Egawa, 2015 |
| Verruga plana | 3, 10, 27, 28, 29 e 41 | Vlahovic, 2016 |
| Verrugas palmoplantar | 1, 2, 4, 7, 63, 65 e 95 | Egawa, 2015 e Abeck, 2019 |
| Verruga palmoplantar do tipo mirmécia | 1 | Vlahovic, 2016 e Bacaj, 2018 |
| Verruga palmoplantar do tipo mosaico | 2 | Vlahovic, 2016 e Bacaj, 2018 |
| Epidermodisplasia forma clássica | 5, 8, 3, 9, 10, 12, 14, 15, 17, 19 a 25, 28, 29, 36, 38, 46, 47, 49 e 50 | Przybyszewska, 2017 e Huang, 2018 |
| Epidermodisplasia HPV associados a malignidade | 5, 8, 17, 20 e 47 | Przybyszewska, 2017 |
| Epidermodisplasia forma não clássica (mutação RHOH) | 3, 12 e 20 | Przybyszewska, 2017 e Huang, 2018 |
| Epidermodisplasia forma não clássica (mutação MST‐1) | 5, 15 | Przybyszewska, 2017 e Huang, 2018 |
| Epidermodisplasia forma não clássica (mutação CORO1A) | 5, 17 | Przybyszewska, 2017 e Huang, 2018 |
| Epidermodisplasia forma não clássica (mutação IL‐7) | 3 | Przybyszewska, 2017 e Huang, 2018 |
| Epidermodisplasia forma adquirida – HIV | 5, 8, 14, 19, 20 e 21 | Przybyszewska, 2017 e Huang, 2018 |
| Epidermodisplasia forma adquirida iatrogênica | 5, 46 | Przybyszewska, 2017 e Huang, 2018 |
| β‐HPV associados ao risco de CEC | 5, 8, 15, 17, 20, 24, 36 e 38 | Rollison, 2019 |
| Imunossuprimidos – verruga vulgar | 2, 27, 57 | Martelli‐Marzagão, 2016 |
| Mucosa | ||
| Verruga genital ou condiloma acuminado | 6, 11, 16, 18 | Leto, 2011 |
| Papulose bowenoide | 16, 18, 31, 33, 39 e 52 | Yoneta, 2000 |
| Mucosa oral – verruga vulgar | 2, 4 | Betz, 2019 |
| Mucosa oral – hiperplasia epitelial focal ou doença de Heck | 13, 32 | Betz, 2019 |
| Mucosa oral, papiloma escamoso e condiloma acuminado | 6, 11, 16 e 18 | Betz, 2019 |
| Papilomatose respiratória recorrente | 6, 11, 16,18,31,33 | Fortes, 2017 |
| Verruga genital em crianças | 2 | Handley, 1997 |
| Condiloma acuminado gigante | 6, 11, 16,18,33 | Spinu, 2014 |
| Papilomatose oral florida | 2, 3, 6, 11 | Pãtrascu, 2016 |
| Imunossuprimidos – verruga genital | 6, 11 e 16 | Brasil, 2018 p.11; Burd, 2016 |
Entre as manifestações clínicas na pele, tem‐se um grupo que é frequente na prática médica, mas existem também manifestações mais raras, muitas delas relacionadas a defeitos genéticos, que repercutirão na resposta do hospedeiro à infecção pelo vírus. Paralelamente, destaca‐se a situação especial de imunossupressão, adquirida ou não, interferindo com a história natural da infecção, levando a quadros extensos, refratários ao tratamento e amplificando a oncogenicidade do HPV.
Lesões benignas na peleVerrugas cutâneasAs VC constituem condição benigna e de resolução espontânea, na maioria das vezes. Apesar disso, podem crescer, causar desconforto ou constrangimento aos pacientes e persistir por meses ou anos, aumentando a transmissão viral entre os indivíduos. A denominação das verrugas, em geral, leva em consideração a aparência da lesão (verruga plana e filiforme), a localização (palmoplantar, periungueal e genital) ou o grupo de indivíduos em que mais se encontra determinada verruga (como a verruga do açougueiro). Em relação às VC, em geral, três entidades são consideradas: verruga vulgar, verruga plana e verruga palmoplantar.27,28
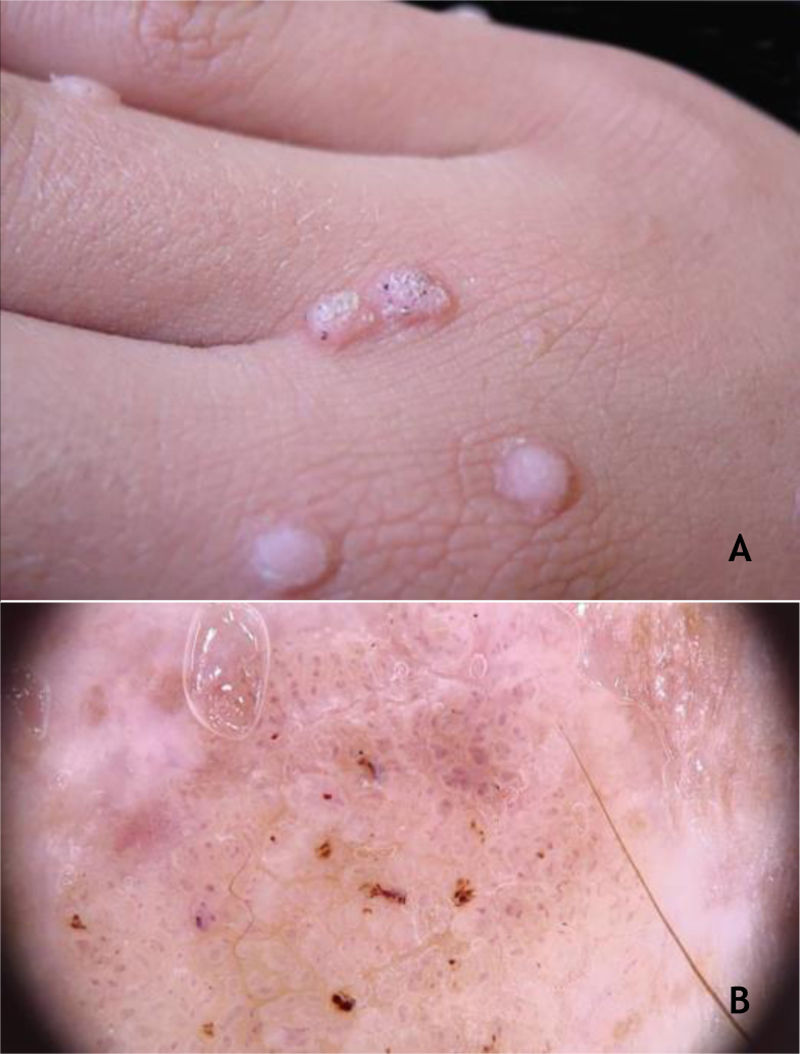
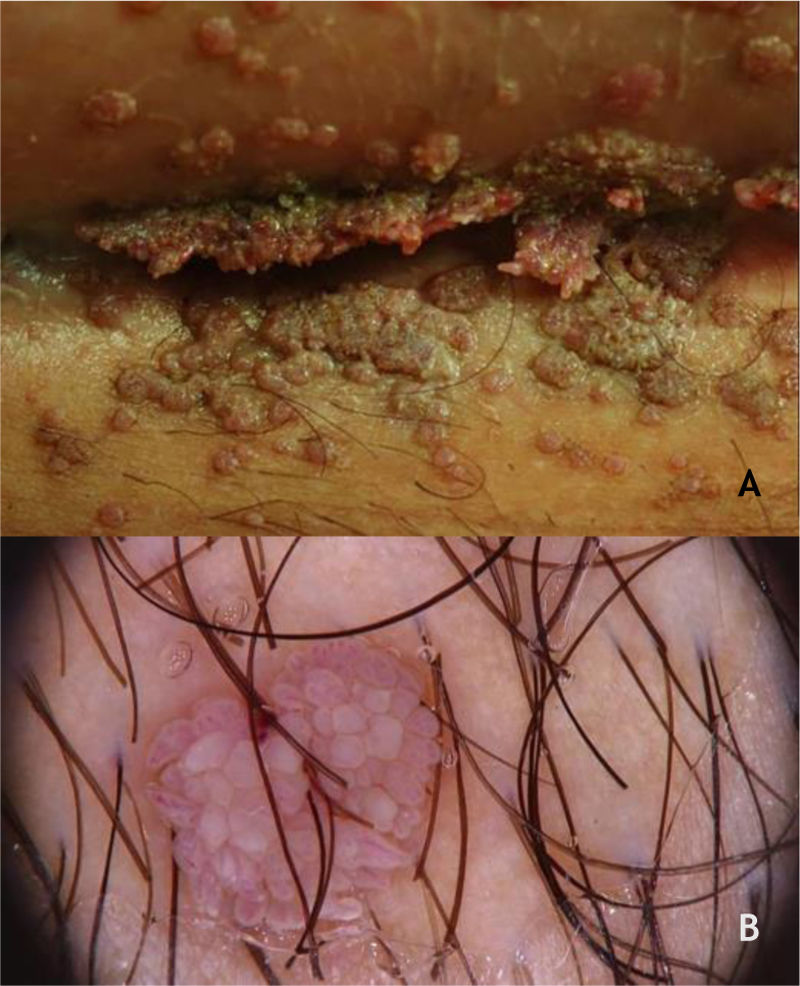
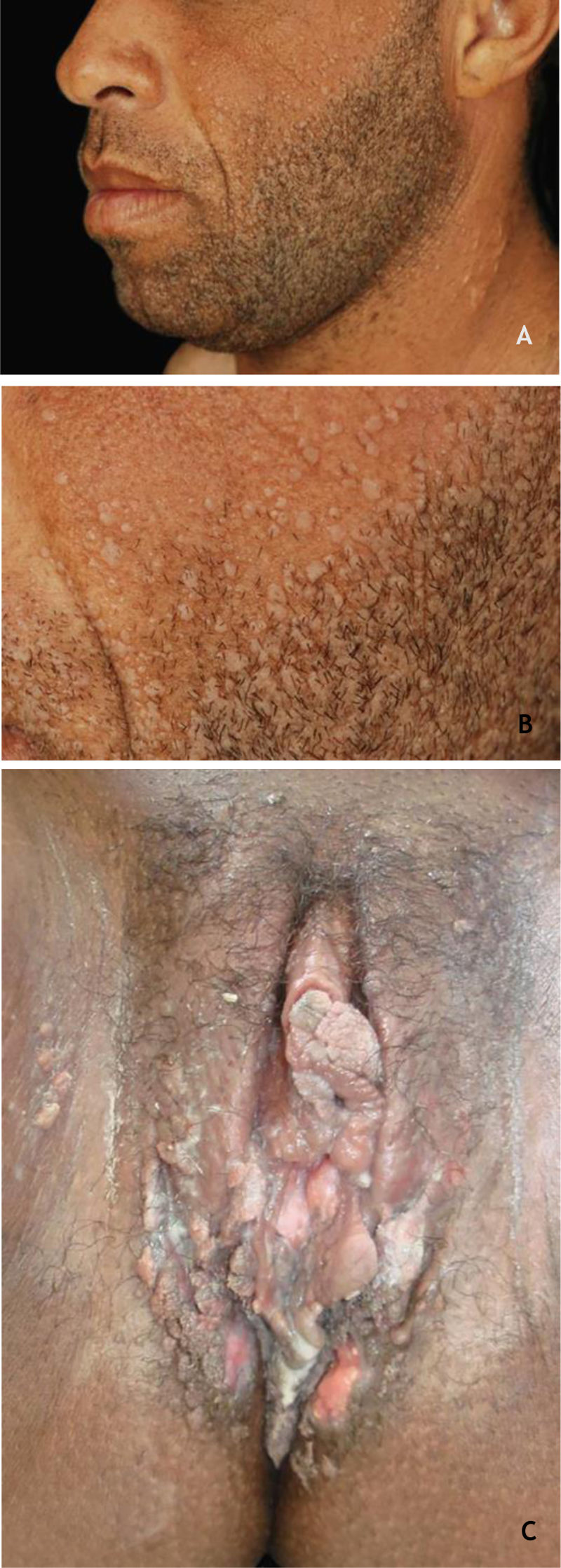
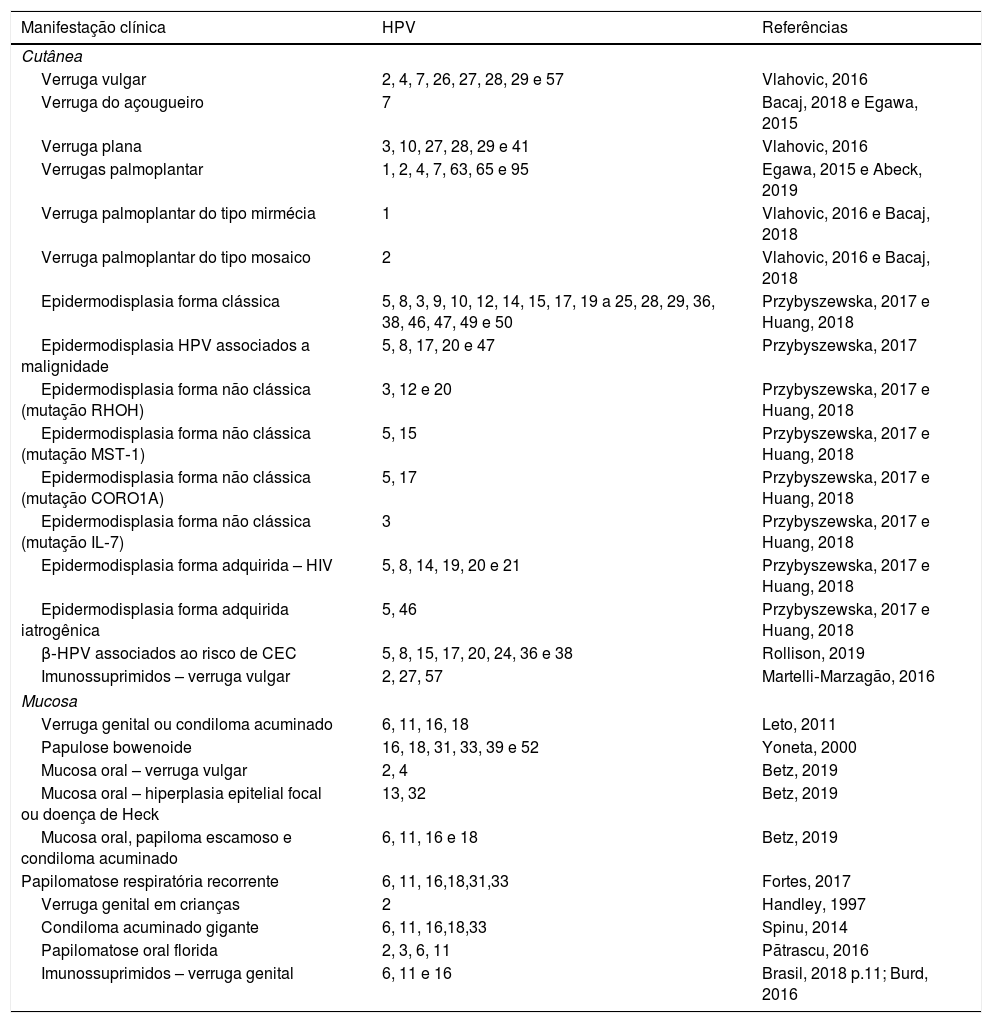
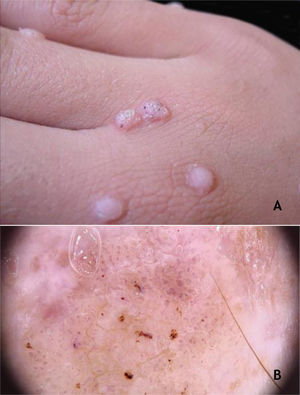
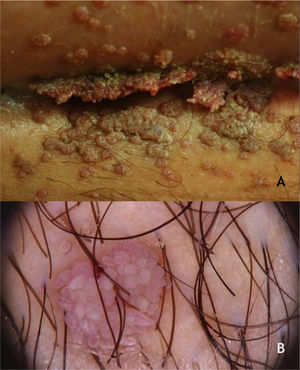
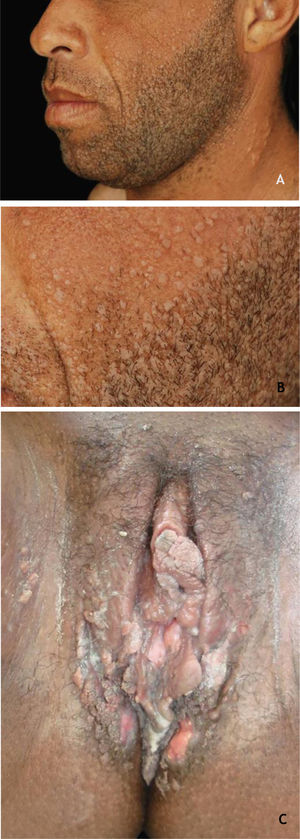
Verruga vulgarAs verrugas vulgares (VV) se apresentam clinicamente como pápulas ou nódulos elevados, de superfície áspera, cor da pele ou amarelados, únicos ou múltiplos, de tamanhos variados que podem confluir e formar grandes placas (fig. 1A). Um achado típico é a presença de pontos enegrecidos (do inglês, black dots) na superfície da lesão, que correspondem a hemorragia epidérmica ou alças capilares dilatadas no interior de uma papila dérmica alongada.28,29 Ocorrem em qualquer parte do tegumento. São mais comuns em áreas expostas: dorso das mãos, dedos, joelhos e cotovelos. Habitualmente, são assintomáticas e de evolução imprevisível, e podem permanecer inalteradas por meses ou anos, desenvolver um grande número de novas lesões num curto intervalo de tempo ou sofrer regressão espontânea.27,28 A verruga filiforme é variante morfológica distinta da VV que ocorre mais comumente na barba, no nariz e na região periocular, como projeções ceratósicas filiformes, de crescimento perpendicular ou oblíquo à superfície da pele. Elas podem ser isoladas ou múltiplas.28,29 A verruga do açougueiro é uma VV rara associada ao HPV 7; recebe essa denominação por ser encontrada nos açougueiros ou manipuladores de carnes e de peixes, e se apresenta clinicamente com aspecto de couve‐flor. A verruga de açougueiro ocorre principalmente nas mãos desses profissionais. Maceração e trauma parecem ser os fatores predisponentes.7,29
Os HPV mais encontrados nas VV são os tipos 2, 4, 7, 26, 27, 28, 29 e 57.8 À dermatoscopia, pode‐se observar papilas agrupadas com vasos puntiformes ou em alça e/ou pontos e linhas hemorrágicas circundadas, com frequência, por um halo branco. As verrugas filiformes apresentam dermatoscopia semelhante, com predomínio das papilas30 (fig. 1B). As VV devem ser diferenciadas de ceratose seborreica, líquen plano, prurigo nodular e também de lesões neoplásicas como carcinoma espinocelular.28,29
Verruga planaAs verrugas planas se apresentam como pápulas achatadas, cor da pele ou eritêmato‐amarelado, com superfície plana e lisa; medem poucos milímetros e têm tendência a coalescer. O fenômeno de Koebner acontece com relativa frequência. Em geral, as verrugas planas ocorrem na face e no dorso das mãos e são encontradas, principalmente, em crianças e adolescentes – daí a denominação verruga plana juvenil – e em pacientes imunodeprimidos, como os que vivem com HIV e os TOS.28,29 Os HPV mais frequentemente encontrados são os HPV 3, 10, 27, 28, 29 e 41.8 Os achados dermatoscópicos são vasos puntiformes pequenos, distribuídos em um fundo sem estruturas, amarelado.30 Como diagnósticos diferenciais, podem ser citados a ceratose seborreica plana na face e o molusco contagioso, que poderá ser diferenciado por apresentar umbilicação central.27,28
Verruga palmoplantarAs verrugas palmoplantares (VP) se apresentam como pápulas hiperceratósicas que, nas áreas de pressão, apresentam crescimento endofítico e, frequentemente, pontos de hemorragia. As lesões podem ser profundas ou superficiais e, quando localizadas nas áreas de pressão, muito dolorosas. Elas acometem com maior frequência crianças e adolescentes.27–29 Na verruga plantar, a infecção resulta de contato direto com o HPV, mas alguns autores consideram que esta possa ocorrer por fontes indiretas, como andar descalço em piscinas ou em banheiros coletivos ou compartilhar meias, sapatos, toalhas e equipamentos esportivos. A hiperidrose dos pés está associada ao aumento do risco de adquirir VP.31
A verruga tipo mirmécia é uma lesão mais profunda, que se apresenta com superfície áspera envolta por anel hiperceratósico. São comparadas a um iceberg, em que apenas pequena parte está visível clinicamente, enquanto a maior parte da lesão se encontra nas camadas mais profundas. Elas podem ser únicas ou múltiplas, além de apresentarem inflamação e serem dolorosas. A verruga palmoplantar do tipo mirmécia está associada ao HPV 1.8,29
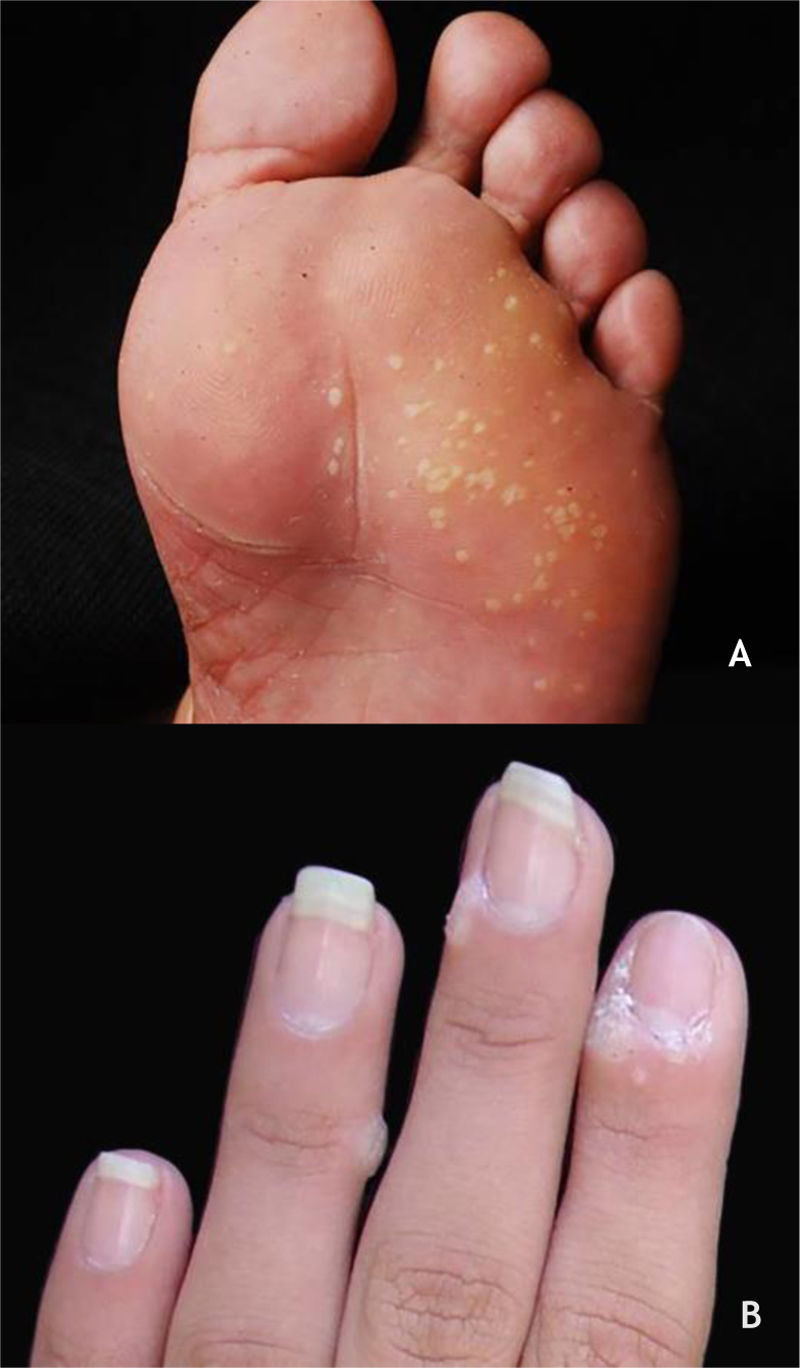
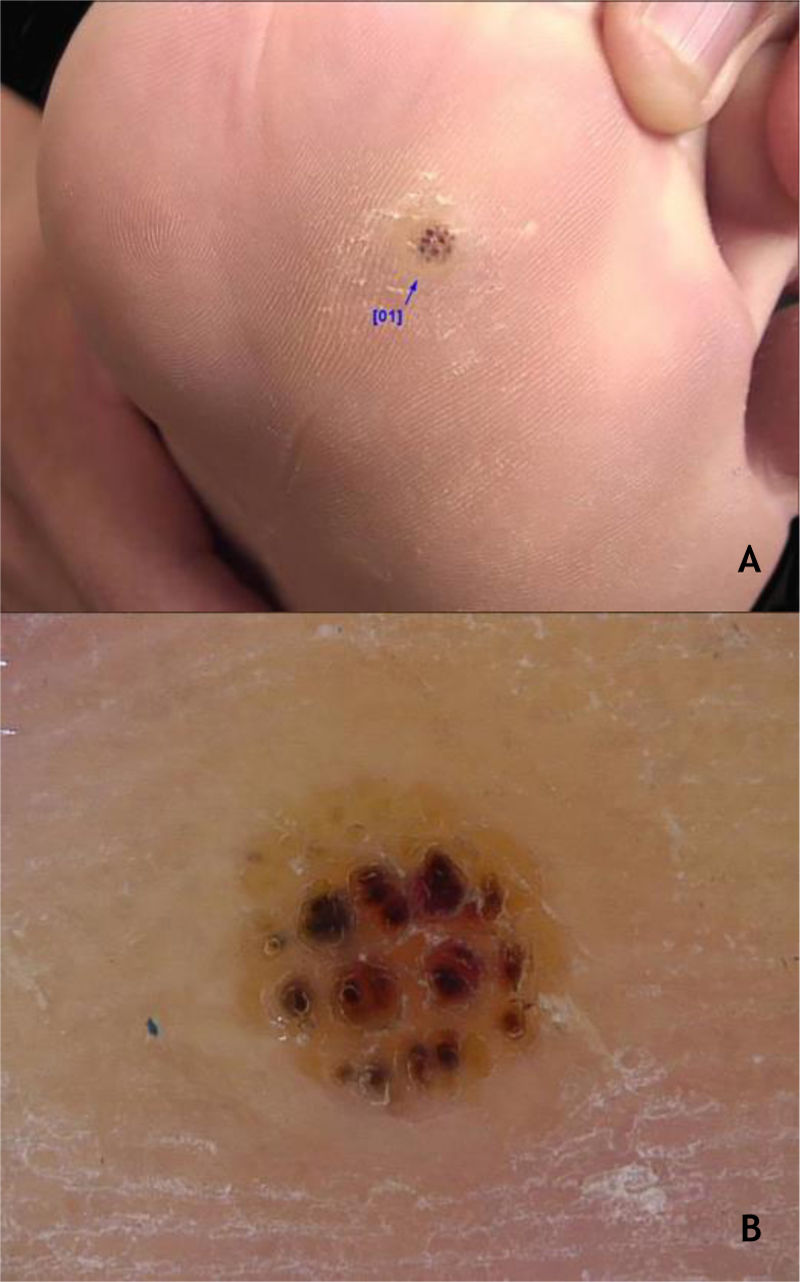
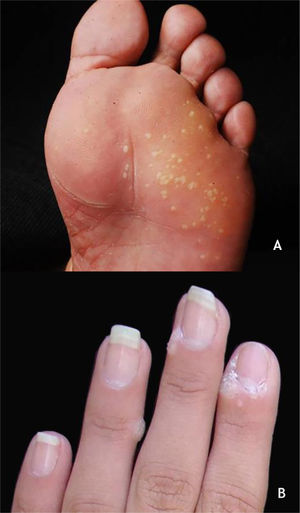
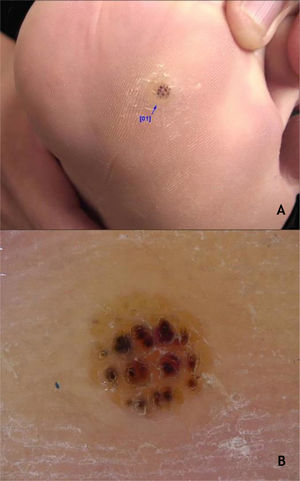
As verrugas em mosaico são lesões múltiplas que confluem e formam placas ceratósicas. Elas estão presentes na região plantar, são mais superficiais e não dolorosas, sendo causadas pelo HPV 28,29 (fig. 2A). A verruga periungueal, geralmente dolorosa, pode apresentar crescimento subungueal resultando em onicólise parcial28 (fig. 2B).
Os HPVS mais encontrados nas lesões de VP são os tipos 1, 2, 4, 7, 63, 65 e 95.7,28 À dermatoscopia nas VP, nota‐se um fundo sem estruturas, de cor amarelada ou branca, com pequenos pontos hemorrágicos que correspondem a vasos trombosados com interrupção das linhas da pele30 (fig. 3A e B).
Em relação aos diagnósticos diferenciais, devem ser considerados: ceratólise plantar sulcada e pontuada, ceratodermia palmoplantar pontuada, calosidade e CEC, especialmente o subtipo carcinoma verrucoso.8 A identificação de capilares trombosados e pontos hemorrágicos na verruga ajuda a diferenciar da calosidade plantar, que não contém esses elementos. Além disso, uma característica‐chave das VP é o desarranjo dos dermatóglifos no local da verruga, que é restabelecido com a resolução da lesão.8 Em relação à verruga periungueal, são possíveis diagnósticos diferenciais: paroníquia, cisto mucoso digital, ceratoacantoma subungueal e CEC.28,29
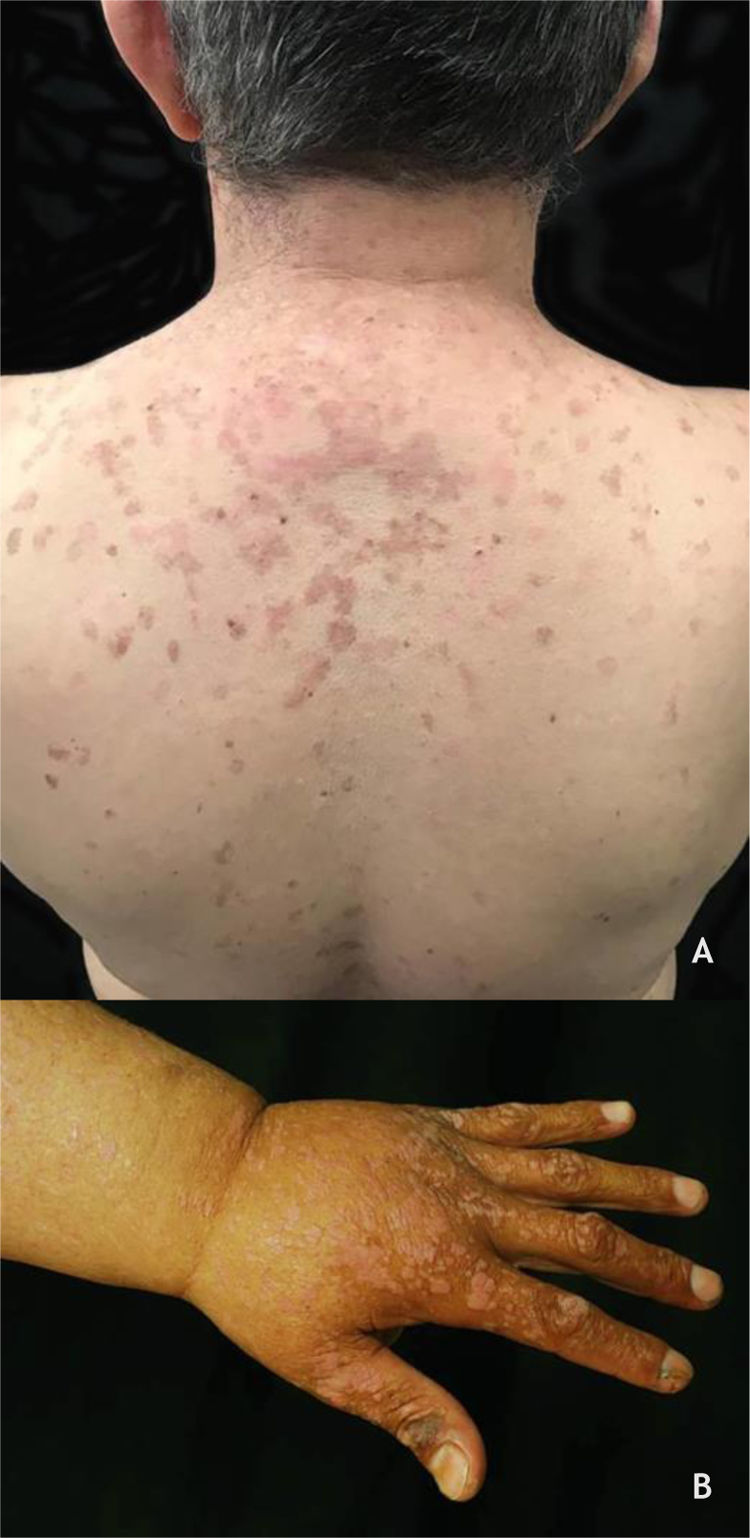
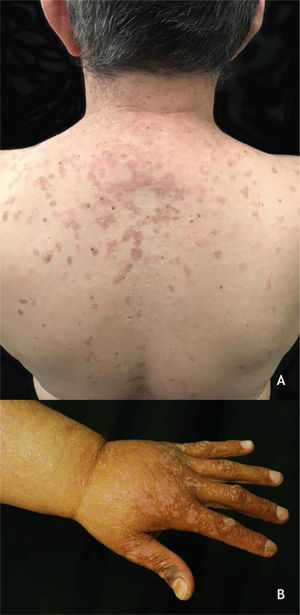
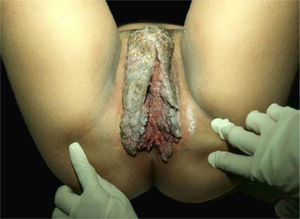
Epidermodisplasia verruciforme e verrucosidade generalizadaA EV, descrita por Lewandoswsky e Lutz em 1922, é doença genética de caráter autossômico recessivo caracterizada pela mutação nos genes TMC6 (EVER1) e TMC8 (EVER2), que cursa com infecção crônica por tipos específicos de HPV, principalmente do gênero beta.32 Na EV, forma clássica, além dos HPV 5 e 8, encontram‐se os HPV 3, 9, 10, 12, 14, 15, 17, 19 a 25, 28, 29, 36, 38, 46, 47, 49 e 50 e, também, o poliomavírus de células de Merkel.32,33 Os genes TMC6 e TMC8 codificam proteínas que inibem fatores de transcrição fundamentais para a expressão gênica do HPV.32 O quadro clínico clássico se inicia na infância ou no início da adolescência e se manifesta por meio de pápulas ou placas eritematosas semelhantes à verruga plana nas extremidades e placas eritematosas e/ou acastanhadas que lembram lesões de pitiríase versicolor e ceratose seborreica no tronco, pescoço e face. As lesões tendem a se disseminar pelo corpo (fig. 4A). A doença se associa a risco aumentado de surgimento de CPNM, principalmente o CEC, em cerca de 30% a 70% dos pacientes, habitualmente a partir da quarta década de vida, nas áreas expostas ao sol.32,33 Os HPV associados à transformação maligna são os tipos 5, 8, 17, 20 e 47.32 Os principais diagnósticos diferenciais são: verrugas planas, pitiríase versicolor, papilomatose confluente e reticulada de Gourgerot e Carteaud, poroceratose superficial disseminada e doença de Darier.
(A), Epidermodisplasia verruciforme, placas eritematosas e/ou acastanhadas que lembram lesões de pitiríase versicolor e ceratose seborreica no tronco. (B), Síndrome de WILD, numerosas pápulas eritematosas achatadas confluentes formando placas no dorso da mão e antebraço associadas à linfedema do membro superior. Arquivo: Serviço de Dermatologia do HC‐UFMG/EBSERH.
Recentemente, novas mutações têm sido descritas em pacientes com quadros clínicos semelhantes ao da EV, nos quais as mutações anteriormente relatadas foram descartadas: RHOH, MST‐1, CORO1A e IL‐7. Todos esses pacientes têm em comum deficiências da imunidade celular contra as infecções pelo HPV. Os pacientes portadores dessas novas mutações estão também predispostos a outras infecções e tumores.32 Em 2018, Huang et al. propuseram a seguinte classificação: EV genética clássica, na qual existe mutação dos genes TMC6 e TMC8; EV genética não clássica, quando ocorre a mutação de outros genes como RHOH, MST‐1, CORO1A e EV adquirida.33 Na EV adquirida, falta a história familiar da doença e encontra‐se uma causa definida secundária – p. ex., imunodeficiência por infecção pelo HIV – ou iatrogênica causada por medicamentos imunossupressores usados em: quimioterapia, pacientes transplantados, portadores de doença enxerto versus hospedeiro, dermatite atópica e lúpus eritematosos sistêmico.33 Na forma não clássica, na mutação RHOH encontram‐se os HPV tipo 3, 12 e 20; na mutação MST‐1, os tipos 5 e 15; na mutação CORO1A, os tipos 5 e 17; e na mutação da IL‐7, o HPV 3. Na forma adquirida, em associação ao HIV encontram‐se os HPV 5, 8, 14, 19, 20 e 21, e na forma iatrogênica, os tipos 5 e 4632,33 (tabela 3).
Epidermodisplasia verruficorme: classificação e tipos de HPV relacionados
| Tipo | Mutação | Tipos de HPV |
|---|---|---|
| EV genética clássica | TMC6 (EVER1) E TMC8 (EVER2) | 5, 8, 3, 9, 10, 12, 14, 15, 17, 19 a 25, 28, 29, 36, 38, 46, 47, 49 e 50 |
| EV genética não clássica | RHOH | 3, 12 e 20 |
| MST‐1 | 5 e 15 | |
| CORO1‐A | 5 e 17 | |
| IL‐7 | 3 | |
| Tipo | Imunodeficiência secundária | Tipos de HPV |
| EV adquirida | HIV | 5, 8, 14, 19, 20, 21 |
| Medicamentosa | 5 e 46 |
A verrucosidade generalizada (VGEN) foi recentemente descrita como infecção cutânea crônica e progressiva pelo HPV na qual os pacientes apresentam mais de 20 lesões localizadas em mais de uma região do corpo, com comprometimento dos dígitos e limitação de função. As manifestações clínicas se apresentam de acordo com o tipo de HPV envolvido, podendo variar desde lesões tipo verruga plana, VV, verruga periungueal ou genital, e são comumente encontradas em várias síndromes de imunodeficiência. Na síndrome WILD, o paciente cursa com verrugas, imunodeficiência, linfedema e displasia anogenital (fig. 4B); na síndrome WHIM, encontram‐se, além das verrugas, hipogamaglobulinemia, infecções e mielocatexia. A deficiência de GATA2, uma imunodeficiência autossômica dominante, cursa com monocitopenia, micobacteriose disseminada e infecções oportunistas fúngicas e virais, incluindo HPV. A síndrome causada pela deficiência de DOCK8, a linfocitopenia CD4 idiopática e as síndromes anteriormente descritas são consideradas tipos de VGEN. A VGEN se diferencia da EV por achados clínicos, histopatológicos e tipos de HPV envolvidos.32,34
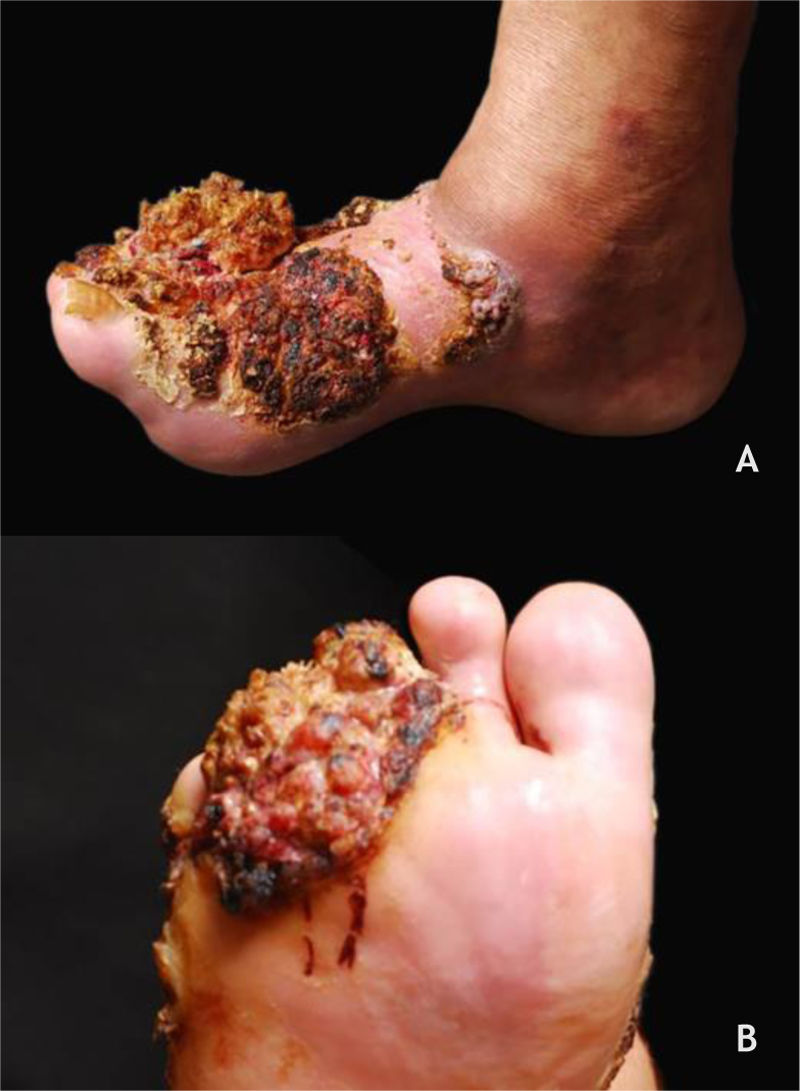
Lesões malignas na peleCarcinoma verrucoso da peleO carcinoma verrucoso, descrito por Ackerman em 1948, é considerado uma variante do CEC de evolução insidiosa, crescimento lento, porém recorrente. A forma cutânea, o epitelioma cuniculutam, ocorre, na grande maioria das vezes, nos pés, predomina em homens (2,3:1) e apresenta média de idade de surgimento da lesão por volta dos 55 anos. Sua apresentação clínica pode variar desde uma pequena pápula ceratósica, semelhante a VV, até tumores grandes, multilobulados com aspecto de couve‐flor, fazendo diagnóstico diferencial com verruga plantar, tumores ceratinocíticos como ceratoacantoma, carcinoma basocelular e espinocelular, micoses subcutâneas e outros (fig. 5A e B). O HPV é um potencial fator contribuinte para o surgimento do tumor; está descrita a associação com os tipos 2 e 16. O potencial metastático é baixo, e recomenda‐se excisão ampla da lesão ou cirurgia micrográfica.35
Manifestações clínicas nas mucosasAs infecções pelos HPV são subclínicas na maioria das vezes.36 Aproximadamente 1% a 2% da população apresenta verrugas anogenitais e 2% a 5% das mulheres mostram alterações no exame preventivo de colo do útero (Papanicolau), provocadas por infecção pelo HPV.37 As lesões causadas por HPV de baixo risco oncogênico (HPV BR) são geralmente associadas a lesões intraepiteliais escamosas de baixo grau, LSIL (do inglês, low grade squamous intraepithelial lesions), equivalendo ao quadro histopatológico de displasia leve ou neoplasia intraepitelial cervical grau 1 (NIC 1). Os HPV AR são em geral associados a lesões intraepiteliais escamosas de alto grau, HSIL (do inglês, high grade squamous intraepithelial lesions), correspondendo a displasia moderada (NIC 2) e grave ou carcinoma in situ (NIC 3). Outros epitélios podem sofrer a ação oncogênica do vírus, originando neoplasias intraepiteliais vaginais (NIVA), penianas (NIP), anais (NIA) e vulvares (NIV), atualmente denominadas HSIL da vulva quando relacionadas aos HPV e NIVd – diferenciada, quando ligada a outras lesões precursoras. As lesões planas com atipias da basal e coilocitose por efeito do HPV são denominadas LSIL.37,38
Lesões benignas na mucosa anogenitalAs verrugas genitais (VG) ou condiloma acuminado constituem a manifestação clínica mais comum das infecções por HPV na região anogenital. São relacionadas aos HPV BR 6 e 11, embora sejam descritas coinfecção com HPV AR (16, 18 e outros).39 Seu tamanho varia de milímetros até vários centímetros, portanto desde pápulas até placas, muitas vezes com vegetações levando ao aspecto descrito como couve‐flor. Sua coloração pode ser cor da pele, rósea ou acastanhada. Além da região anogenital, podem se localizar também em dobras inguinais e suprapúbicas e na cavidade oral por transmissão orogenital.
Sintomas como dor, prurido ou sangramento não são usuais.36,37 Na maioria das vezes, podem ser diagnosticadas a olho nu, mas precisam ser diferenciadas de várias dermatoses, tais como líquen plano, ceratose seborreica, molusco contagioso, pápulas perláceas penianas, acrocórdons e o condiloma plano da sífilis. Lesões tumorais também devem ser consideradas diagnóstico diferencial.38 A dermatoscopia pode ser útil; o padrão mais comum é o de mosaico, com presença de vasos glomerulares ou em pontos agrupados no centro, circundados por uma rede esbranquiçada. As lesões mais elevadas podem apresentar aspecto digitiforme (fig. 6A e B). As VG pigmentadas podem apresentar dermatoscopia com padrão cerebriforme ou com aparência de ceratose seborreica.30 Em alguns casos, a biópsia pode ser necessária.
(A), Condiloma acuminado, pápulas e placas com aspecto vegetante, de coloração cor da pele, rósea e acastanhada, localizada na dobra suprapúbica. (B), Condiloma acuminado, dermatoscopia, vasos circundados por halo branco em projeções digitiformes. Arquivo: Serviço de Dermatologia do HC‐UFMG/EBSERH.
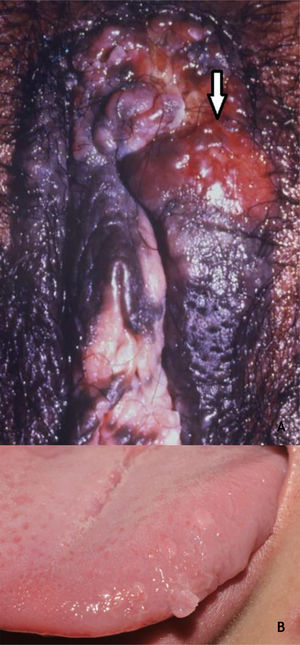
A papulose bowenoide (PB) ocorre em ambos os sexos, afetando preferencialmente pessoas jovens sexualmente ativas. De acordo com sua localização e quadro histopatológico, pode corresponder a LSIL ou HSIL da vulva e NIP ou NIA. Histologicamente, assemelha‐se ao CEC in situ (ver na parte II desta revisão). Clinicamente, é caracterizada por pápulas achatadas, hipercrômicas ou eritematosas, múltiplas, assintomáticas, localizadas na região anogenital, lembrando ceratose seborreica, VV, líquen plano ou nevo melanocítico.39 A dermatoscopia da PB revela um padrão sem estruturas, com vasos em pontos ou glomerulares, arranjados em linhas. Esse padrão é frequentemente combinado com áreas sem estruturas, de coloração branca, marrom ou cinza. Podem‐se observar escamas.27
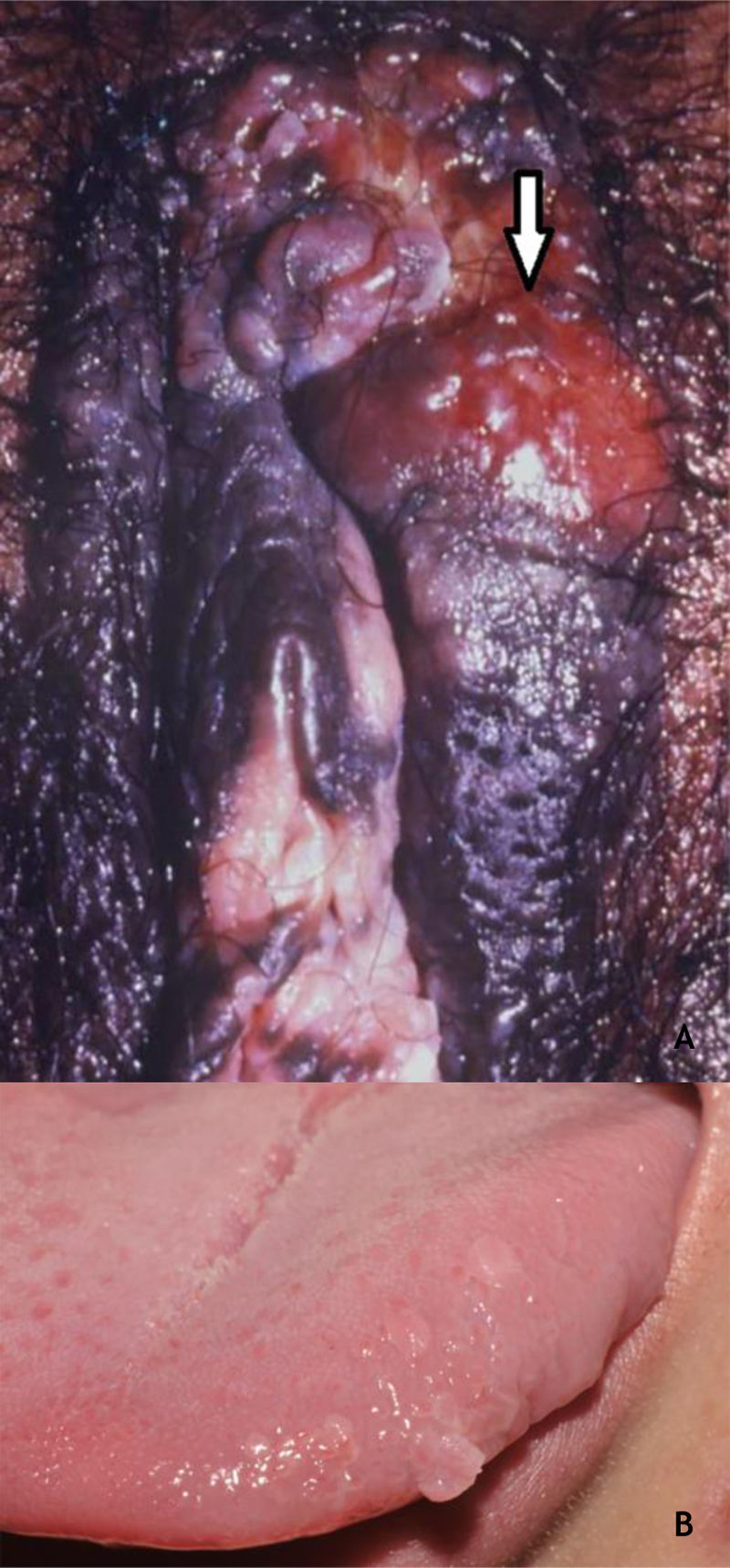
Embora o HPV 16 seja o mais implicado, outros HPV, como 18, 31, 33, 39 e 52, também foram reportados.40 A PB tem curso benigno, muitas vezes com regressão espontânea, especialmente nos indivíduos jovens e do sexo masculino. Pode ser mais agressiva em idosos e imunocomprometidos (fig. 7A). Na conduta terapêutica, deve‐se ter em mente que, apesar da histopatologia com muitas atipias, a evolução é favorável na maioria dos casos.39,40
(A), Papulose bowenoide, múltiplas placas hiperpigmentadas na região genital feminina em paciente imunocompetente, com tumoração infiltrativa e erodida (assinalada). (B), Condilomas orais, pápulas achatadas e lesão pedunculada na borda lateral da língua. Arquivo A: Serviço de Dermatologia do HC‐UFMG/EBSERH. Arquivo B: Disciplina de Dermatologia, Faculdade de Medicina de Botucatu – Unesp.
Como em outras localizações, a maior parte das infecções por HPV na cavidade oral é subclínica. Estima‐se em cerca de 3% a incidência de lesões clinicamente definidas. As lesões da mucosa oral causadas pelo HPV compreendem a VV, o condiloma acuminado, o papiloma escamoso (PE) e a hiperplasia epitelial focal (HEF). Essas lesões apresentam muitos aspectos clínicos e histopatológicos comuns a todas elas. Considera‐se que os HPV relacionados às VV da mucosa oral são os tipos 2 e 4; na HEF, os HPV 13 e 32; enquanto os tipos 6 e 11 são comuns ao PE e condiloma acuminado. Nessa última lesão são descritos ainda os HPV 16 e 18.36 A caracterização do PE e do condiloma acuminado como entidades clínicas distintas permanece controversa, considerando a clínica e tipos de HPV36 (fig. 7B). A VV é rara na mucosa oral e admite‐se que ocorra por autoinoculação especialmente em crianças; localiza‐se preferencialmente nos lábios e palato, geralmente únicas, róseas ou esbranquiçadas e exofíticas. Já o PE predomina em adultos, tem o palato e a língua como localizações preferenciais e é tipicamente uma lesão exofítica, com aspecto digitiforme ou em couve‐flor de tamanho até 5mm. O diagnóstico diferencial inclui VV, condiloma acuminado, xantoma verruciforme e CEC, entre outros. Desse modo, a biópsia para estudo histopatológico dessas lesões é mandatória. O condiloma acuminado na mucosa oral é mais raro e pode ocorrer associado ou não às lesões anogenitais. A transmissão preferencial é orogenital, mas pode se dar por contato com objetos. Habitualmente, são observadas múltiplas lesões, sésseis, esbranquiçadas ou róseas no lábio superior ou língua.36 A anamnese e o exame físico completo, incluindo as regiões genital e perianal, são fundamentais; mesmo assim, a biópsia pode ser necessária.
A HEF, ou doença de Heck, é uma condição assintomática pouco frequente que afeta a mucosa da boca e predomina em crianças e indivíduos jovens. Foi descrita inicialmente em índios e esquimós, mas existe em várias outras populações, inclusive em idosos e pacientes com AIDS. Clinicamente, são descritas múltiplas lesões com predomínio de pápulas rosadas ou brancacentas, planas e sésseis, mas também podem ser papilomatosas com superfície rugosa e proeminente. Essas últimas são mais raras e localizam‐se na língua e gengiva, enquanto as primeiras predominam na mucosa labial e jugal. As lesões são assintomáticas e tendem à regressão espontânea. Sua manifestação em crianças deve alertar para o diagnóstico diferencial com algumas síndromes, tais como neurofibromatose do tipo 1, Cowden e neoplasia endócrina múltipla do tipo 2B.36,39
Papilomatose respiratória recorrenteA papilomatose respiratória recorrente (PRR) é uma doença rara, mas potencialmente ameaçadora à vida e que atinge o trato respiratório com predileção pela laringe e traqueia. A forma juvenil se manifesta até os 20 anos de idade, e seu diagnóstico pode ser desafiador já que compartilha sintomatologia comum a várias doenças respiratórias frequentes na infância. É atribuída à infecção pelos HPV 6 e 11 em mais de 90% dos casos e, na infância, admite‐se que a contaminação para a maioria dos casos se dê pelo canal de parto, havendo ainda a possibilidade de infecção pela placenta. Outros HPV AR como 16, 18, 31 e 33 também podem estar implicados. Tem evolução imprevisível e raramente pode evoluir com malignização. O diagnóstico é dado pela histopatologia de lesões encontradas à broncoscopia na árvore respiratória. Nas manifestações da PRR, que caracterizam as formas com comprometimento difuso da árvore respiratória, o diagnóstico diferencial inclui a granulomatose de Wegener, policondrite recidivante, amiloidose, neurofibromatose, tuberculose e sarcoidose.41
Lesões malignas na mucosaCarcinomas in situEmbora com terminologia discutida, a doença de Bowen (DB) e a eritroplasia de Queyrat (EQ) correspondem a CEC in situ e podem estar associadas a HPV AR, especialmente o 16. A DB se caracteriza por placas eritematosas e descamativas localizadas nas áreas ceratinizadas da região anogenital. A EQ se apresenta como placas brilhantes, eritematosas, de aspecto aveludado em áreas de mucosa da vulva, glande e folheto interno do prepúcio. Ambas podem evoluir para CEC invasivo.39
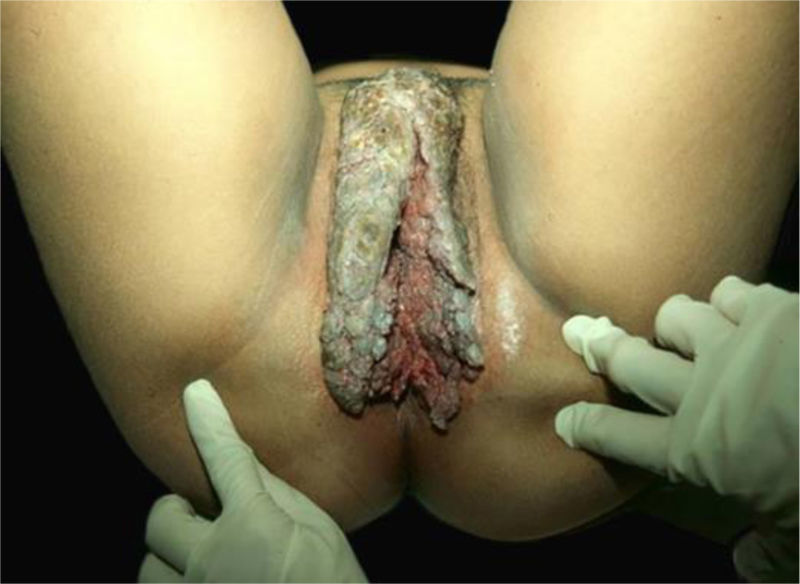
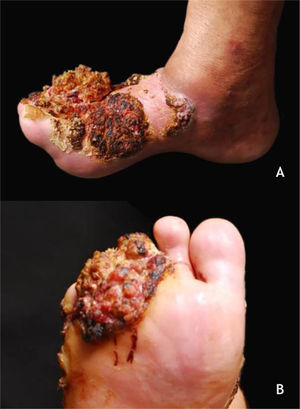
Carcinomas verrucosos da mucosaTumor de Buschke‐Lowenstein e papilomatose oral floridaO condiloma acuminado gigante, também chamado de Tumor de Buschke‐Lowenstein (TBL), é uma forma rara de apresentação do condiloma anogenital relacionado ao HPV, especialmente aos tipos 6 e 11, mas ocasionalmente HPV AR podem ser encontrados (16, 18 e 33).42 Juntamente com a papilomatose oral florida (POF), o TBL compõe os carcinomas verrucosos de mucosa.42,43
A descrição clássica do TBL é uma lesão tumoral vegetante ou verrucosa, de crescimento exofítico e endofítico, por vezes apresentando fístulas e sangramento (fig. 8). Seu crescimento é lento, mas, a despeito das características histopatológicas benignas, pode ter comportamento agressivo localmente e gerar metástases.42,43 As recidivas são frequentes. Predomina em homens; a ocorrência em crianças enfatiza a possibilidade de transmissão vertical ou no periparto. A incidência do TBL vem aumentando, associada a estados de imunossupressão, particularmente HIV/AIDS. Outros fatores de risco são tabagismo, múltiplos parceiros sexuais, infecções por anaeróbios, inflamação local crônica, presença de fimose e outras imunodeficiências.4,42,43
O diagnóstico é confirmado pela histopatologia típica e deve ser complementado por exames de imagem para definição do tratamento. A POF ocorre preferencialmente na região bucinadora, assoalho bucal, gengivas e mais raramente na língua, palato e comissuras labiais. É mais comum em homens a partir da sétima década de vida. O consumo de álcool e tabaco, esse último tanto na forma de cigarros como no hábito de mascar, higiene oral precária, traumas repetidos por próteses inadequadas, além de doenças inflamatórias crônicas como líquen plano e lúpus eritematoso são apontados como fatores de risco. Os HPV relacionados são os tipos 2, 3, 6 e 11. As recidivas são frequentes no seguimento dos pacientes, e raramente ocorrem metástases locorregionais.44
Manifestações clínicas em situações especiaisHPV na gravidezAdmite‐se que as mudanças hormonais que ocorrem na gestação interfiram temporariamente com a resposta imunológica, o que poderia impactar na replicação/clareamento do HPV. Desse modo, é esperado que ocorra um aumento da frequência e progressão das lesões genitais causadas pelo HPV durante o período gestacional.17,37 Em estudo realizado no Brasil, que comparou mulheres gestantes e não gestantes quanto à presença de HPV em material do colo de útero, Salcedo et al. encontraram diferença significativa entre os grupos estudados, mostrando maior positividade para o HPV entre as gestantes (25,3% × 13%). Embora nenhum caso de HSIL ou carcinoma tenha sido encontrado, os autores enfatizam a necessidade de monitorar as infecções por HPV nesse grupo.17
Em relação às VG, as lesões condilomatosas típicas podem ser normocromáticas, eritematosas ou acastanhadas com superfície rugosa, podendo ser achatadas, papulosas ou pedunculadas. Elas ocorrem mais frequentemente ao redor do introito vaginal, mas podem aparecer em múltiplos locais, como colo do útero, uretra, períneo ou intrarretal. As VG podem proliferar e se tornar friáveis durante a gestação. Nessas pacientes, as lesões podem ser maiores, mais numerosas, resistentes ao tratamento ou recidivantes.37 Seu manejo deve ser individualizado e será discutido no tópico “Tratamento”. Nas gestantes com condiloma acuminado, a via de parto é pautada pela condição obstétrica. No Brasil, a orientação é de que a via abdominal só estaria indicada nos casos de lesões volumosas que causem obstrução ao parto ou coloquem a parturiente em risco de hemorragias importantes.37
HPV na criançaVerrugas anogenitais em crianças têm tido sua incidência aumentada nas últimas décadas.45 Enquanto nos adultos e adolescentes a transmissão se dá quase exclusivamente por contato sexual, admite‐se que nas crianças existem três modos de transmissão: perinatal (intraútero e no parto), horizontal (auto e heteroinoculação, conhecida como “inocente”) e abuso sexual. Portanto, o diagnóstico de verrugas anogenitais em crianças requer uma investigação precisa para determinar o modo de contaminação e descartar a hipótese de abuso sexual. A transmissão por fômites não parece ser relevante.45,46
A abordagem de crianças com VG é um desafio na prática clínica, considerando a possibilidade de abuso sexual, cuja probabilidade cresce diretamente com o aumento da idade. Um estudo retrospectivo mostrou que o valor preditivo positivo relacionando à presença de infecção por HPV na região anogenital e o possível abuso sexual passa de 36% entre 4 e 8 anos para 70% após os 8 anos de idade.47 O risco para existência de abuso sexual é maior em meninas do que em meninos, na proporção de 3:1,7.45
As VG em lactentes e crianças geralmente se manifestam na região perineal e, com menor frequência, nas áreas vaginal, vulvar e no pênis. Estudos demonstram que o HPV 2, agente causal das verrugas das mãos em humanos, está comumente associado às verrugas anogenitais em crianças, um achado que sugere a autoinoculação e a heteroinoculação como formas comuns de adquirir verrugas anogenitais.48
Apesar disso, a presença de VG em uma criança deve alertar o cuidador/profissional de saúde para a possibilidade de abuso sexual.37 A tipagem do HPV não determina o modo de transmissão do vírus e não pode ser utilizada para determinar a presença ou não de abuso sexual. Qualquer tipo viral pode ser transmitido por abuso, contato inocente ou transmissão vertical.45 A melhor maneira de identificar possíveis abusos sexuais ainda é pela história, avaliação cuidadosa do contexto socioclínico, exame físico e trabalho em equipe interdisciplinar.45 A presença de lesões em membros da família não é prova de abuso, bem como a ausência de lesões em potencial abusador não descarta esta possibilidade. O manejo dessas situações deve ser individualizado e judicioso.37
O diagnóstico diferencial do condiloma acuminado em crianças inclui condiloma lata, molusco contagioso, acrocórdon, pseudoverrugas ou granuloma glúteo infantil. A resolução espontânea das VG ocorre na maior parte dos casos em poucos anos ou meses, assim a abordagem terapêutica na infância deve ser mais conservadora e menos agressiva.45
HPV nos imunossuprimidosPessoas imunossuprimidas, especialmente aquelas com coinfecção por HIV ou com imunossupressão decorrente de TOS, têm vivido com mais qualidade e maior expectativa de vida. A persistência da infecção pelo HPV é maior nesses indivíduos que na população geral, o que, somado à própria imunossupressão e à maior frequência de HPV AR, pode resultar em taxa aumentada de incidência de neoplasias.18,19
Doenças comuns e benignas associadas ao HPV, tais como as VG e extragenitais, também são mais prevalentes nessa população que na população geral.4,18,19,32 A falha do sistema imunológico em processar e efetivar respostas adequadas frente à infecção pelo HPV nos imunocomprometidos pode resultar em manifestações extensas, graves e persistentes das doenças relacionadas ao vírus.4
Verrugas cutâneasNos receptores de transplantes renal (RTR), a prevalência de VC aumenta com a duração da imunossupressão – no primeiro ano após o transplante, são encontradas em 15% dos pacientes, chegando a 92% após 15 anos.49 Além disso, as lesões são múltiplas e manifestam‐se em extensas áreas, especialmente nas regiões fotoexpostas (fig. 9A e B). Os principais tipos de HPV encontrados são os HPV 2, 27 e 57.49 As VC desses pacientes costumam ser refratárias ao tratamento.28 Os inibidores da calcineurina, como a ciclosporina, o pimecrolimus e o tacrolimus, estão associados ao desenvolvimento de VC, principalmente quando associados à azatioprina. Tem sido descrita a melhora das VC em TOS com a troca dessas medicações por inibidores de mTOR, tais como sirolimus, everolimus e temsirolimus.50
Em pessoas portadoras de HIV, as VC se apresentam mais numerosas e agressivas e podem estar associadas com novos tipos de HPV, inclusive aqueles mais tipicamente encontrados na mucosa genital.9
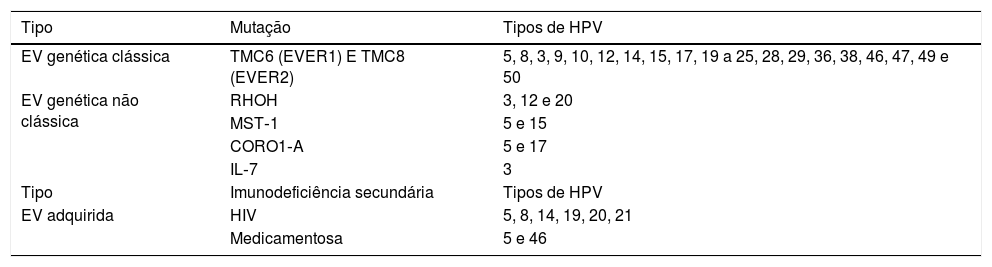
Verrugas genitaisAs VG estão entre as manifestações clínicas mais comuns da infecção pelo HPV tanto em indivíduos imunossuprimidos quanto em imunocompetentes. Os HPV 6 e 11 são os tipos mais frequentes encontrados nas VG nos dois grupos.51
Em relação aos RTR, coorte prospectiva realizada por Larsen et al. com 3.268 RTR e 162.910 não transplantados encontrou risco três vezes maior de VG entre os RTR. Ajustado por idade e sexo, o risco chegou a ser cinco vezes maior entre mulheres RTR.52
Pessoas vivendo com HIV são mais suscetíveis às IST, principalmente o HPV. Nesses pacientes, há maior prevalência de coinfecção com HPV AR, em especial o 16; os condilomas tendem a ser mais extensos, agressivos, recorrentes e persistentes51,53 (fig. 9C). Os HSH, especialmente os soropositivos para HIV, têm maior incidência de VG e complicações como lesões potencialmente malignas e neoplasias.37
O impacto do HPV no surgimento de neoplasias malignasCâncer de pele não melanoma na população imunocompetente e imunossuprimidaO CPNM representa o câncer mais frequente no Brasil, correspondendo a cerca de 30% dos tumores malignos registrados no país, com incidência estimada de quase 177.000 novos casos para o ano de 2020.54 O carcinoma basocelular (CBC) e o CEC são os representantes mais frequentes dos CPNM e ocorrem principalmente em áreas expostas ao sol.54,55
A relação entre os β‐HPV e o CPNM é controversa e tem sido avaliada nos últimos anos, e é mais bem estabelecida para os portadores de EV e imunossuprimidos. Nos pacientes imunocompetentes, essa associação é frágil, prejudicada pela heterogeneidade e onipresença em toda pele saudável desse grupo de vírus, o que dificulta a definição de infecções que possam ser clinicamente relevantes.24,25
Os pacientes imunocompetentes portadores de CEC apresentam positividade maior para o DNA viral de pelo menos um tipo de β‐HPV, na pele e/ou nos pelos da sobrancelha, reservatório comum dos vírus do gênero beta assim como para anticorpos contra a proteína viral L1, quando comparados com a população geral.56 Os principais tipos de β‐HPVs associados ao risco de CEC são: 5, 8, 15, 17, 20, 24, 36 e 38.56
Bernat‐Garcia et al. detectaram a presença, principalmente, dos β‐HPV nos CPNM e na pele normal perilesional de RTR e imunocompetentes. O vírus foi detectado mais frequentemente no primeiro grupo e na pele normal.24
Sichero et al., em artigo de revisão, relataram maior prevalência dos β‐HPV em amostras de lesões pré‐malignas e malignas de pacientes imunossuprimidos quando comparados aos imunocompetentes: lesões pré‐malignas (88% nos imunossuprimidos e 54% nos imunocompetentes), no CEC (84% vs. 27%) e no CBC (75% vs. 36%).25
A prevalência e a carga viral do β‐HPV são mais altas na ceratose actínica, displasia e CEC in situ que nos CEC propriamente ditos; os β‐HPV são encontrados com maior frequência nos pelos da sobrancelha em pacientes com ceratoses actínicas comparados aos portadores de CEC, e nas amostras de CEC não se encontra m‐RNA do β‐HPV. Esses achados sugerem que os β‐HPV atuariam somente numa fase inicial do processo de carcinogênese da pele e não seriam necessários na manutenção de um fenótipo mutado, conforme já discutido na patogênese.25
Em relação ao CBC, a associação com o HPV é, ainda, mais inconclusiva: a associação é mais fraca, se comparada ao CEC, e há maior divergência do tipo de vírus encontrado. Ramenazi et al. realizaram uma revisão sistemática acerca da infecção pelo HPV nos CBCs.55 De 1.087 estudos, 45 foram incluídos na revisão. Em sete estudos, a avaliação do HPV foi realizada no soro, e em 38, no tecido do CBC. Os achados mostraram maior risco de detecção dos γ‐HPV nos pacientes portadores de CBCs comparados aos controles saudáveis. Entre os α‐HPV, o HPV 6 foi o mais frequente; entre os HPV da espécie β1, o HPV 93; e entre os da espécie β2, o HPV 23. Algumas limitações desse estudo, tais como variações nos HPV, tipagem do HPV no soro e não no tecido e poucos estudos acabaram prejudicando a análise da relação entre HPV e CBC.55 Nos indivíduos imunossuprimidos, assim como nos imunocompetentes, os CPNM mais frequentes são os CBC e CEC. A infecção pelo HPV, em especial o β‐HPV, tem sido implicada na causa do CPNM nos imunossuprimidos, mas o processo de carcinogênese cutâneo ainda não está completamente elucidado.25
Em metanálise que comparou a incidência de cânceres nos portadores de HIV/AIDS com os TOS, Grulich et al. encontraram frequência aumentada de CPNM nas duas populações, embora mais elevada no grupo de transplantados.3
O DNA do HPV foi mais encontrado em amostras de CPNM em imunossuprimidos (73,3%) do que em imunocompetentes (53,3%); o gênero mais prevalente foi o β‐HPV em ambas as populações; e a ocorrência de diversos tipos de HPV numa mesma lesão foi maior nos imunocomprometidos.24
Em TOS, o risco de CPNM aumenta 40 vezes nos primeiros cinco anos de transplante, podendo chegar a 100 vezes ao longo da vida, após esse tempo.57 Ao contrário do que ocorre na população geral, onde predomina o CBC, o tipo mais prevalente de CPNM nos TOS é o CEC, numa razão de 2‐5:1.58 Nesse mesmo grupo, o CEC tende a manifestar‐se mais precocemente, mais exuberante e agressivo.57
Evidências que demonstram associação entre HPV e CPNM são a presença de verrugas e CEC nos pacientes com epidermodisplasia verruciforme,32 o aumento da prevalência da infecção por HPV e dos CPNM entre TOS49,57 e a ocorrência de CECs sobre extensas placas de verrugas virais em TOS.58 Além disso, ceratose actínica ou verruga viral foram associadas a risco aumentado de HPV nos pacientes imunocomprometidos.24
Nos imunocomprometidos, o fato de o câncer de pele se desenvolver em idades mais precoces, ser mais agressivo e apresentar maior risco de metástase implica na necessidade de adoção de medidas preventivas eficazes para essa população. Portanto, salienta‐se a relevância do papel do dermatologista na prevenção, especialmente com orientação sobre as medidas de fotoproteção, identificação e tratamento de lesões pré‐neoplásicas e de neoplasias nessa população.
Carcinomas da região anogenital na população imunossuprimidaNo Brasil, o câncer cervical é o terceiro em incidência nas mulheres.53 A infecção pelos HPV AR 16 e 18 é a principal causa dessa neoplasia e a imunossupressão se destaca como fator de risco importante.4,19 O risco de câncer cervical é de 2 a 10 vezes maior nas transplantadas e de 5 a 10 vezes maior para mulheres que vivem com HIV em relação à população geral.18 As mulheres vivendo com HIV apresentam taxas significativamente mais altas de HSIL e são mais suscetíveis à progressão para carcinoma cervical invasivo quando comparadas a mulheres sem o HIV.19
O termo carcinoma vulvar abrange tanto o carcinoma de células escamosas da vulva quanto suas lesões precursoras. Estima‐se que cerca de 29% a 43% dessas lesões sejam associadas à infecção por HPV, particularmente com os tipos 16 e 18.4,5 A NIV, atualmente denominada HSIL vulvar, designa lesões relacionadas ao HPV, precursoras do câncer de vulva.38 Nos imunossuprimidos, as HSIL vulvares geralmente se apresentam mais agressivas, extensas, multifocais e tendem a recorrer após o tratamento, e o câncer de vulva invasor ocorre em idades mais precoces.4
O carcinoma de pênis é uma entidade rara e tem incidência mais alta em países em desenvolvimento. O HPV é o responsável por aproximadamente 50% dos carcinomas dessa localização.14 Os TOS têm um risco ainda maior de desenvolver neoplasia do pênis, com uma taxa de incidência padronizada de 15,79 em comparação com 4,42 em homens com HIV.3 Os homens vivendo com HIV (HVHIV) têm risco duas a três vezes maior de desenvolver CEC no pênis e taxas mais altas de NIP (lesão precursora do câncer de pênis associada aos HPV AR) que homens HIV negativos.4
O câncer anal é relativamente incomum na população geral. A persistência da infecção por HPV AR é responsável por 88% dos cânceres anais, e um fator de risco significativo é a coinfecção com HPV AR e HIV.20,51 A prevalência de HPV no trato anogenital é de cerca de 60% dentro da população sexualmente ativa, mas em HVHIV que fazem sexo com homens, essa prevalência pode chegar próximo de 100%.20 A incidência de câncer anal nos HSH e que são HVHIV é 80 vezes maior que em homens na população geral e é influenciada pelo nível de CD4 desses indivíduos.20 Pessoas vivendo com HIV apresentam incidências muito mais altas de câncer anal que TOS.3 Estudos epidemiológicos mostraram que 20% a 50% dos receptores de órgãos sólidos apresentam HPV na região anal e um aumento de 10 vezes no risco relativo de desenvolver CEC anal.51
Carcinoma de orofaringe na população imunossuprimidaO HPV é detectado aproximadamente de 25% dos cânceres de orofaringe.51 Essa neoplasia está associada à transmissão orogenital, em especial do HPV 16. A infecção oral por HPV tem incidência aumentada em até três vezes nos indivíduos infectados pelo HIV e ainda está associada ao número de parceiros de sexo oral ao longo da vida.51 Os TOS também têm maior incidência desse tipo de câncer.3 Os tumores de orofaringe HPV positivos apresentam melhor prognóstico que os negativos – admite‐se que em parte porque eles têm melhor resposta ao tratamento.4
Em próximo artigo serão abordados aspectos histopatológicos, diagnóstico complementar, tratamento e medidas para a prevenção da infecção pelo HPV, incluindo vacinação e educação em saúde.
Suporte financeiroNenhum.
Contribuição dos autoresGeraldo Magela Magalhães: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Érica Cristina Vieira: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Lucas Campos Garcia: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Maria de Lourdes Ribeiro de Carvalho Leite: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Antônio Carlos Martins Guedes: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Marcelo Grossi Araújo: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
GABARITO
Donovanose. An Bras Dermatol. 2020;95(6): 675‐683.
Como citar este artigo: Magalhães GM, Vieira EC, Garcia LC, De Carvalho‐Leite MLR, Guedes ACM, Araújo MG. Update on human papilloma virus ‐ part I: epidemiology, pathogenesis, and clinical spectrum. An Bras Dermatol. 2021;96:1–16.
Trabalho realizado no Serviço de Dermatologia do Hospital das Clínicas da Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.