Dermatoses parasitárias são afecções cutâneas causadas por insetos, vermes, protozoários ou celenterados que tenham vida parasitária ou não. Nesta revisão serão estudados os principais agentes etiológicos, aspectos clínicos, exames laboratoriais e tratamentos das doenças dermatológicas englobadas nesse contexto.
Nesta revisão serão discutidos os principais aspectos clínicos e terapêuticos da escabiose, pediculose, miíase, tungíase, larva migrans, doença de Lyme e oncocercose.
Essas diferentes enfermidades são, basicamente, afecções cutâneas ocasionadas por insetos, vermes, protozoários ou celenterados que tenham vida parasitária ou não. O conhecimento desses agravos tem importância cada vez maior, face aos deslocamentos, relativamente fáceis, das pessoas para diferentes regiões do planeta.
EscabioseA escabiose ou sarna é doença reconhecidamente contagiosa. O agente etiológico é um ácaro, o Sarcoptes scabiei var. hominis. Estudos epidemiológicos moleculares recentes demonstraram que a escabiose ocasionada pelo S. scabiei var. hominis é exclusivamente humana; não afeta animais e a transmissão ocorre através do contato pessoal, não tem preferência por idade, etnia ou gênero. A transmissão por fômites é excepcional.1,2
A epidemiologia da escabiose tem caráter cíclico, principalmente nos países desenvolvidos. O intervalo entre os ciclos são de, aproximadamente, 10 a 15 anos.
De acordo com estudos em amostras da poeira de casas de pacientes infectados, fora do hospedeiro, em condições ambientais normais, o S. scabiei sobrevive por 24 a 36 horas.1,2
Biologia e morfologia do ácaroDepois do acasalamento, o macho morre e as fêmeas penetram na epiderme, cavam sulcos onde depositam ovos e fezes.
Em 4 a 6 semanas, as fêmeas podem liberar 40 a 50 ovos. Após a eclosão, as larvas, hexápodes, deixam os sulcos. O número de ácaros adultos em indivíduo infectado é estimado em 12 parasitas.
Manifestações clínicasO prurido é o principal sintoma da escabiose, é mais intenso à noite. Esse começa, na maioria dos casos, de maneira insidiosa, intensifica‐se progressivamente e pode acometer quase todo o corpo; raramente a face é afetada.
A lesão característica é linear, “serpiginosa”, elevada, mede alguns milímetros; numa das extremidades pode‐se observar lesão pápulo‐vesiculosa, descrita por alguns autores como “ponto preto”. Essas lesões são encontradas com maior frequência na face lateral de dedos, regiões palmares, mãos, punhos e pés.
A escabiose do couro cabeludo não é comum em adultos; porém, pode acompanhar ou assemelhar‐se à dermatite seborreica.
Sem tratamento, surgem lesões eritemato‐papulosas, localizadas em axilas, mamas, pênis, nádegas, espaços interdigitais, cintura e pés.
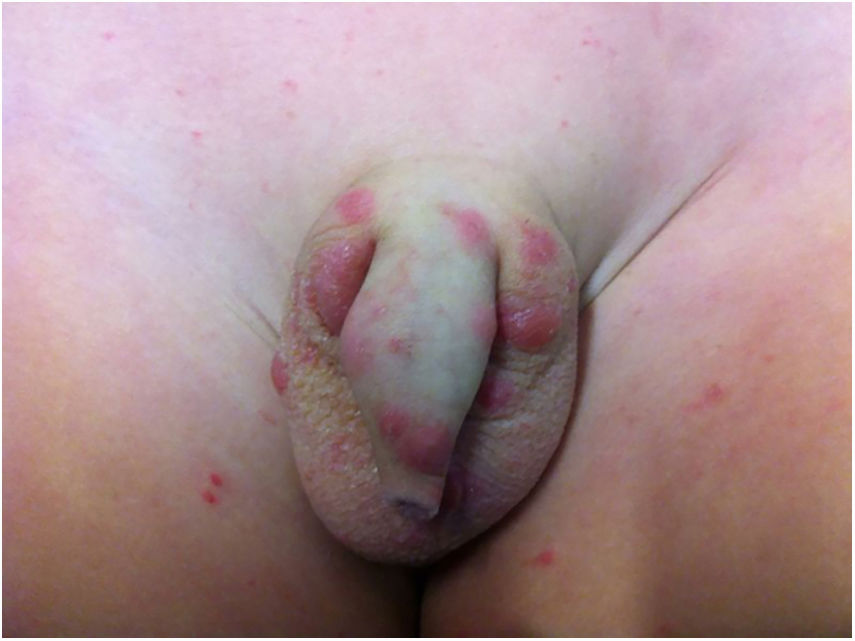
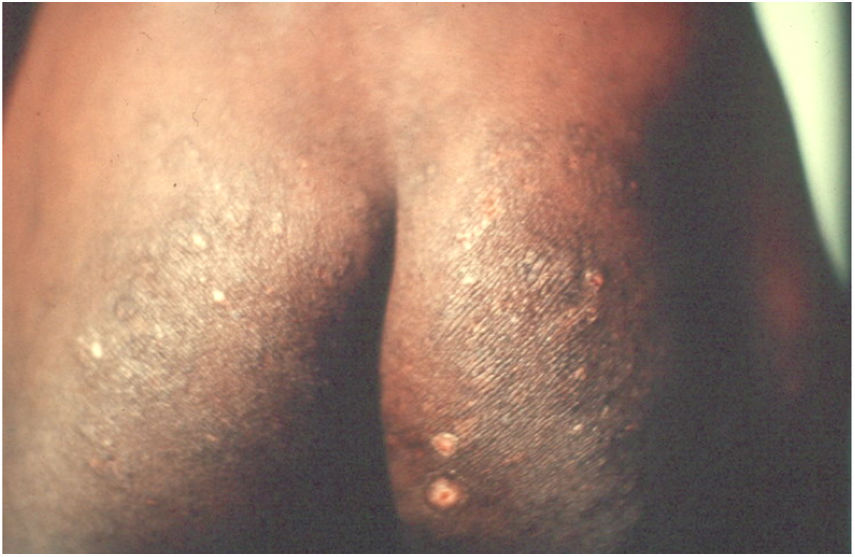
Em pacientes com longa evolução podem surgir lesões pápulo‐nodulares, de coloração vermelho‐acastanhada, que se localizam principalmente na genitália, nas axilas, no tronco e nos cotovelos; são muito pruriginosas e regridem lentamente, mesmo após tratamento adequado. Essas manifestações são denominadas sarna, ou escabiose nodular (fig. 1). Admitia‐se que não houvesse ácaro nessas lesões. Porém, em trabalhos recentes tem‐se demonstrado a presença do S. scabiei.3,4 Em crianças, a sarna nodular pode simular mastocitose.5
Em recém‐nascidos e crianças de baixa idade, a face e o couro cabeludo podem ser acometidos, até com aparecimento de micropoliadenopatias cervicais. Lesões eczematizadas ou urticadas podem dificultar o diagnóstico, principalmente em lactentes.6
Nos idosos, a reação cutânea à presença do ácaro pode ser menor e ocasionar quadros atípicos. Lesões na região dorsal podem ser confundidas com prurido senil. Lesões vésico‐bolhosas, similares clínica e histologicamente ao penfigoide bolhoso, foram relatadas em pacientes com mais de 6 anos, sem doenças debilitantes.
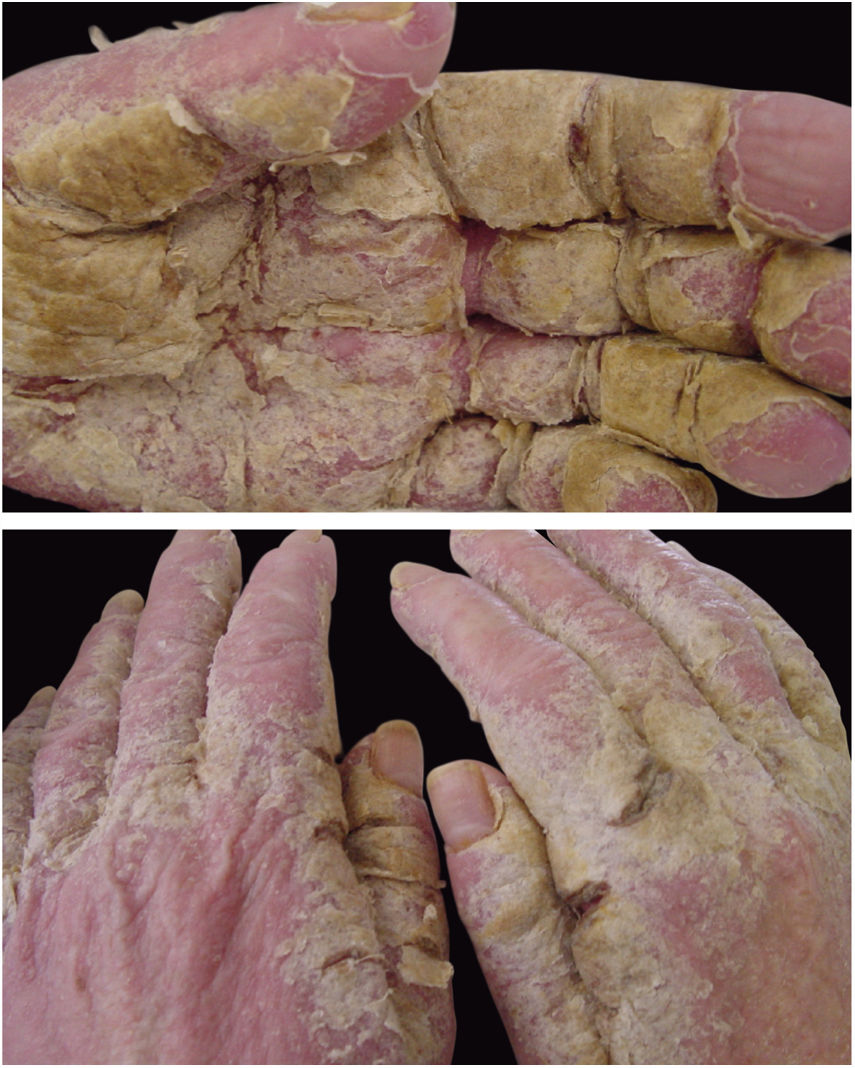
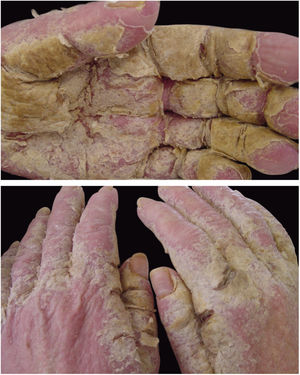
A sarna crostosa, ou norueguesa, é variedade clínica da escabiose que ocorre devido à hiperinfestação de ácaros; mais de um milhão de parasitas podem ser encontrados nesse quadro. Atualmente, é observada principalmente em doentes imunodeprimidos, sob tratamento quimioterápico, neoplasias malignas e transplantadas. A frequência dessa forma clínica tem aumentado em pacientes HIV‐positivos.7,8 Aborígenes australianos e portadores do vírus HTLV1 também são acometidos com relativa frequência.9 Clinicamente, caracteriza‐se por lesões hipercetatósicas, crostosas, com fissuras cutâneas, unhas espessadas e distróficas (fig. 2). Infecções secundárias podem ocorrer nesses pacientes. Na grande maioria dos casos o prurido é muito intenso. O diagnóstico diferencial é feito, principalmente, com doença de Darier e psoríase.
Diagnóstico diferencialO diagnóstico diferencial é feito com a maioria das doenças pruriginosas, tais como dermatite atópica, erupção medicamentosa, urticária papulosa, picadas de insetos e piodermites.
DiagnósticoO exame direto das lesões deve ser feito rotineiramente, principalmente nos casos atípicos. Colocam‐se duas gotas de óleo mineral sobre as lesões e depois escarifica‐se com lâmina de bisturi, ou cureta, remove‐se o teto do sulco, que é colocado sobre a lâmina de vidro. A seguir, examina‐se ao microscópio com aumento de 10×e 40×. Podem‐se encontrar o ácaro, ovos e/ou fezes. Pode‐se, também, colocar algumas gotas de hidróxido de potássio a 30% sobre o material coletado e examinar ao microscópio.
A reação de PCR pode ser útil em casos clinicamente atípicos.10
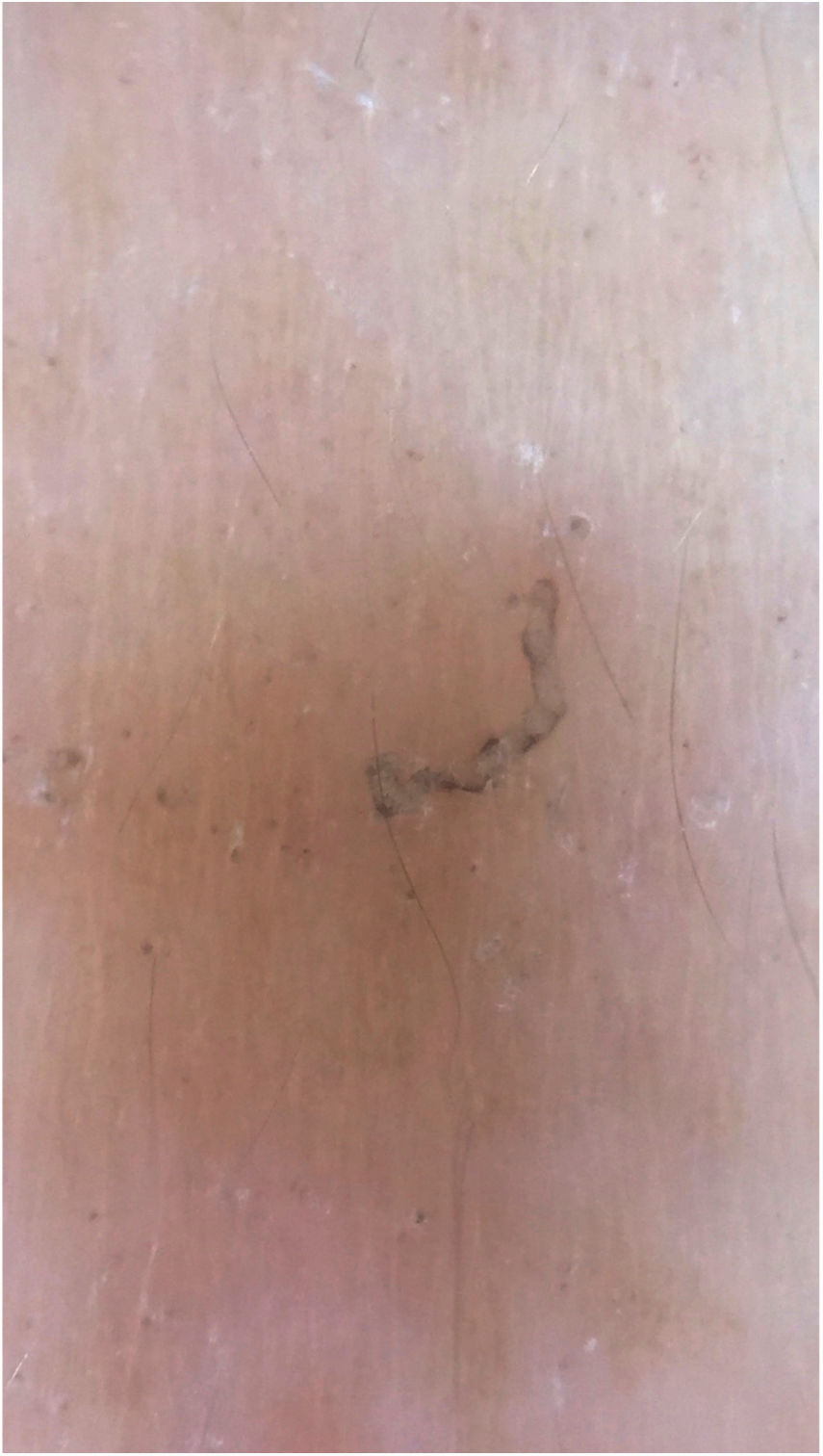
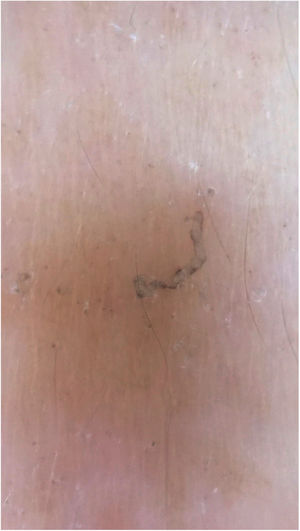
A dermatoscopia também pode ser empregada para o encontro do parasita (fig. 3).11 A microscopia de epiluminescência é outro método recomendado para a visualização do ácaro.12 A microscopia confocal e tomografia de coerência óptica também podem ser usadas.13
TratamentoNo tratamento da escabiose é importante que todos os moradores do domicílio sejam tratados para evitar reinfestações.
Permetrina - É um piretroide sintético, eficaz e atóxico. É empregado na forma de creme ou loção 5%. Pode ser usado em crianças, adultos, gestantes e nutrizes. Deve ser usado em todo o corpo, do pescoço aos pés. Nas crianças deve ser aplicado também no couro cabeludo e sulcos retroauriculares. O medicamento deve ser aplicado à noite, por duas noites consecutivas. No terceiro dia de manhã, toda a roupa de cama deve ser removida e lavada.
Enxofre precipitado – É recomendado em concentrações de 5% a 10%, em vaselina. Não provoca reações colaterais. Pode ser usado em crianças, gestantes e nutrizes. Deve ser aplicado em todo corpo, quatro noites seguidas e removido durante o dia.
Ivermectina - Usada por via sistêmica. É uma lactona macrocíclica, semissintética, indicada para adultos e crianças acima de 5 anos. A dose empregada é 200 μg/Kg de peso, administrada em dose única, pode ser repetida após 7 dias. Nos imunodeprimidos devem‐se aplicar duas doses com intervalo de uma semana. É considerado o padrão‐ouro no tratamento da sarna crostosa, na qual é associada com queratolíticos tópicos, tais como vaselina salicilada a 5%. A ivermectina pode ainda ser usada topicamente, diluída a 1%, em propilenoglicol ou loção cremosa. Deve ser aplicada em todo o corpo e repetida após uma semana.14
Novos medicamentos estão em estudos. O uso da loção de tinospora cordifolia mostrou eficácia semelhante à permetrina, sem efeitos colaterais no tratamento.15 A moxidectina é outra medicação promissora, com eficácia e segurança já comprovadas.16
Na sarna nodular usa‐se corticoide tópico, potente, 2 a 3 vezes ao dia. Pode‐se, também, fazer oclusão ou mesmo infiltrar triancinolona 3 a 4 mg por mL.17Pimecrolimus e tracolimus tópicos foram usados em casos de resistência ao corticoide, com bons resultados.18 Em casos recalcitrantes, em obediência às restrições legais, pode ser usada a talidomida, na dose de 100 mg ao dia, por via oral.
PediculoseOs humanos podem ser parasitados por três espécies da subordem Anoplura: Pediculus humanus capitis, agente etiológico da pediculose da cabeça; Pediculus humanus, que infesta o corpo; e Pthirus pubis, piolho da região pubiana. Todos se alimentam de sangue.
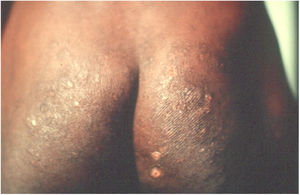
Etiologia e patogeniaPediculose do couro cabeludoO agente etiológico é o Pediculus humanus capitis (fig. 4A). A saliva do piolho é provavelmente o indutor do prurido que ocorre no couro cabeludo.
As ninfas e os adultos são difíceis de ser visualizadas, porém as lêndeas ou ovos que se prendem aos cabelos são facilmente identificados (fig. 4B).
A lâmpada de Wood e o dermatoscópio podem ser usados no auxílio ao diagnóstico.
Quando um paciente referir prurido no couro cabeludo, a pediculose não deve ser descartada.19
Pediculose do corpoAo picar a pele, o Pediculus humanus provoca coceira de intensidade variável, surgem máculas eritematosas, pápulas, crostas e escoriações, observadas principalmente no tronco, nas axilas e nádegas. Infecção secundária, hiperpigmentação e liquenificação podem ocorrer. A enfermidade também é chamada de “doença do vagabundo”.
O diagnóstico é confirmado através do achado do pedículo ou lêndeas, nas pregas das roupas.
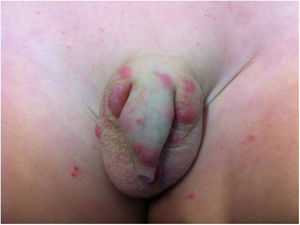
Pediculose do púbis ou ftiríaseO agente causal é o Pthirus pubis, que parasita os pelos da região genitoanal e, eventualmente, os pelos de coxas, tronco, axilas, barba, cílios, supercílios e margens do couro cabeludo.
A manifestação clínica principal é o prurido. O diagnóstico é feito por meio do encontro do parasito na pele, geralmente com a parte da cabeça introduzida no folículo piloso, ou lêndeas presas na base dos pelos.
Além das escoriações, as maculae caerulae (manchas cinza‐azuladas) podem ser encontradas nas coxas e tronco, do mesmo modo que na pediculose do corpo.
TratamentoPediculose do couro cabeludoOs pediculocidas tópicos permanecem como principal tratamento.
A permetrina a 1%, sob forma de xampu, deve ser deixada no couro cabeludo durante 10 minutos e depois enxaguada. O piperonil‐bútoxi a 15% também pode ser usado como xampu.
Também pode ser usada a permetrina a 5%. É aplicada no couro cabeludo à noite e removida no dia seguinte. O tratamento deve ser repetido após 7 a 10 dias, pois nesse período as lêndeas eclodem. O malathion (0,5%) é um organofosfarado muito usado no Reino Unido.
Face à crescente resistência aos piretoides, novos produtos têm sido desenvolvidos para o tratamento da pediculose.
O Spinosad é um inseticida composto pela mistura natural de macrolídeos tetracíclicos, spinosyn A e D. Interfere nos receptores nicotínicos de acetilcolina, produz excitação neuronal e consequente paralisia dos piolhos, por fadiga neuromuscular, após longos períodos de hiperexcitação. O Spinosad mata as populações de piolhos suscetíveis e resistentes à permetrina. Também é ovicida, inviabiliza os ovos. O Spinosad é usado na concentração de 0,9% em suspensão. Foi aprovado pelo FDA em 2011 para crianças a partir dos 4 anos. Não foi detectada absorção sistêmica nos estudos feitos com o produto. Deve ser aplicado por 10 minutos, enxagua‐se a seguir. Recomenda‐se repetir o tratamento depois de 7 dias.20,21
O álcool benzílico a 5%, em óleo mineral, foi o primeiro produto não neurotóxico aprovado pelo FDA. Age, aparentemente, ao impedir que o piolho feche seus espiráculos respiratórios e possibilita que o veículo penetre e os obstrua, asfixia os parasitas. Por não ser ovicida, devem ser feitas duas aplicações com 7 dias de intervalo, durante 10 minutos. É aprovado pelo FDA (categoria B) e pode ser usado a partir dos 6 meses de idade.22
Outro produto, denominado dimeticone (loção a 4%), foi aprovado em 2006; posteriormente, foi comercializado em gel líquido. O modo de ação ainda é discutível. Haveria obstrução dos espiráculos respiratórios do piolho e morte por asfixia. A inibição da excreção de água, que causa estresse fisiológico e morte por paralisia ou ruptura dos órgãos internos, é outra hipótese.23 O modo de aplicação varia de acordo com o produto: o gel deve ser aplicado durante 10 a 15 min.; a loção durante 8 horas. A aplicação deve ser repetida em 7 a 10 dias. Tem ação ovicida.24–26
A ivermectina tópica, em loção a 0,5%, foi aprovada pelo FDA em 2012, para tratamento de crianças, a partir de seis meses. Deve ser aplicada durante 10 minutos e logo após enxaguada. Apresenta ação ovicida.27
Também se mostrou eficaz o uso de que tem por base óleo mineral e azeite de oliva saponificado.28
A ivermectina 200 μ/kg de peso, em dose única, também é eficaz. Recomenda‐se repetir o medicamento após 7 a 10 dias.
Trabalho recente preconiza o uso do levamisol como pediculocida.29
As lêndeas devem ser removidas. A aplicação de solução de vinagre a 50%, para molhar os cabelos, facilita sua remoção.
O uso da solução de ácido fórmico a 8% também facilita a remoção das lêndeas.
As escovas e os pentes devem ser colocados em contato com os pediculocidas durante 10 a 15 minutos e depois lavadas com água quente.
Pediculose do corpoA melhoria da condição de higiene e a lavagem das roupas promovem a cura.
Pediculose do pubis ou ftiríaseTrata‐se com permetrina a 5% ou deltametrina a 0,02%, em creme, aplicado à noite e removido no dia seguinte. Recomenda‐se usar durante dois dias consecutivos e repetir após 7 a 10 dias. Os contatos sexuais também devem ser tratados. Tem havido diminuição dos casos devido ao hábito de depilação dessa região.
Quando há lesões nos cílios pode‐se usar a vaselina, aplicada duas vezes ao dia, durante 8 dias, removem‐se as lêndeas mecanicamente.
Dermatoses causadas por pulgas ou pulicoseAs picadas provocam pápulas urticadas nos indivíduos não sensibilizados. Quando há sensibilização, principalmente em crianças, o antígeno salivar é capaz de provocar lesões no local e a distância, causa o prurido agudo infantil e o prurido de Hebra.30
Algumas espécies podem transmitir bactérias que causam doenças, tais como peste, doença da arranhadura do gato e angiomatose bacilar.
Para o tratamento das picadas de pulga são indicados cremes de corticoide e, se necessário, anti‐histamínicos por via oral.31,32
Para a profilaxia, deve‐se colocar inseticida nos alojamentos e tratar os animais domésticos para eliminar as pulgas.
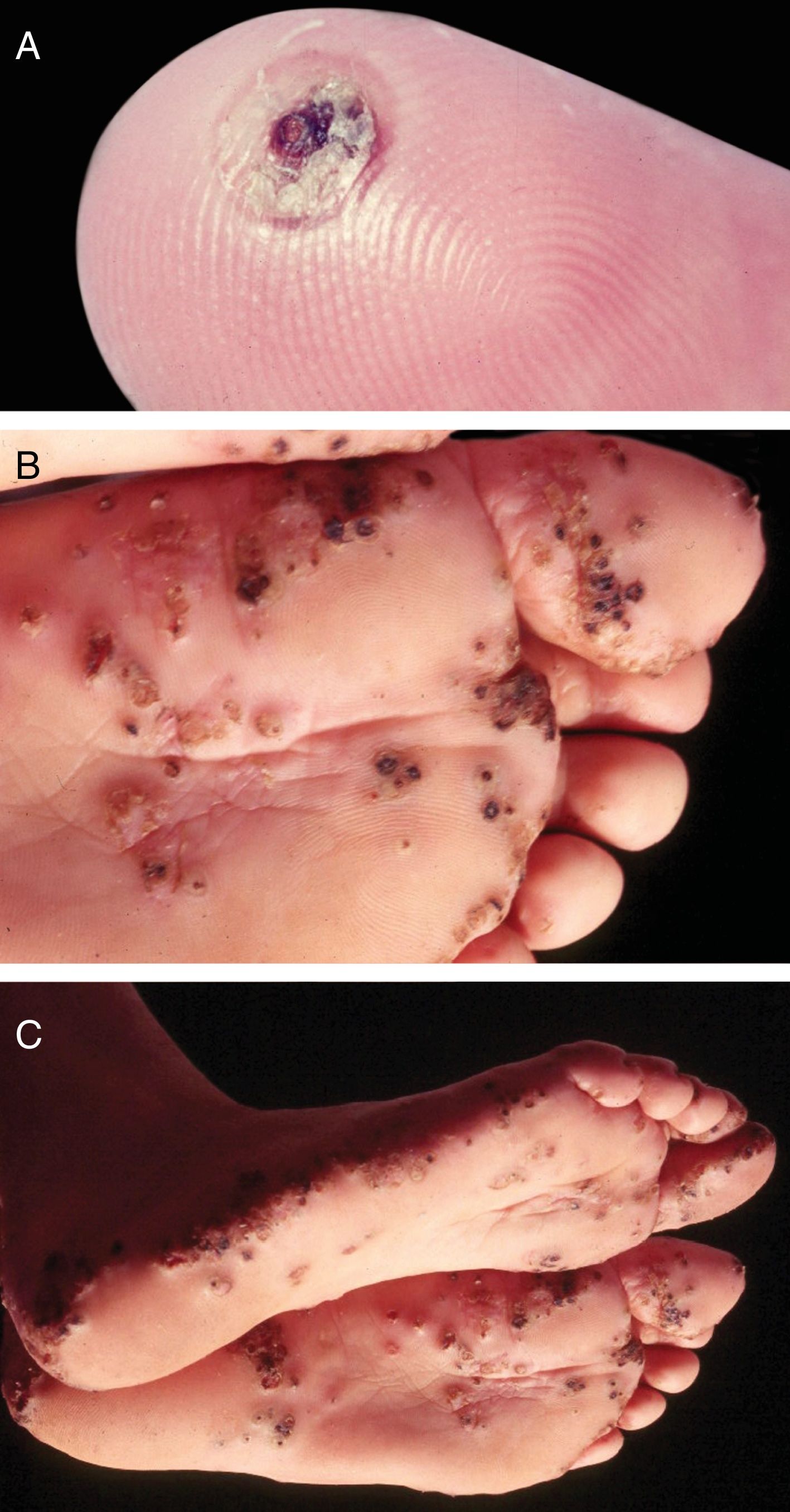
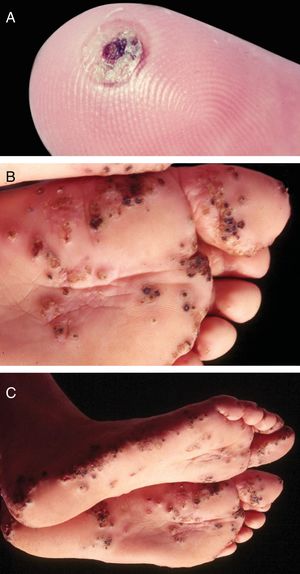
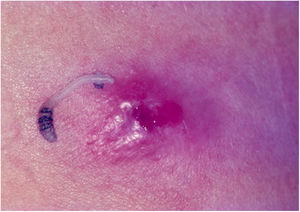
Tungíase ou tunguíaseÉ ocasionada pela Tunga penetrans, a menor das pulgas; mede, em média, 1 mm; vive em lugares secos e arenosos, principalmente em zonas rurais, nos chiqueiros e currais. Seus principais hospedeiros são os porcos e o homem. São hematófagas. Após alimentar‐se, o macho deixa o hospedeiro; a fêmea fecundada penetra na pele, introduz a cabeça e o tórax na epiderme, deixa de fora os estigmas respiratórios e o orifício ovopositor.33 Os ovos desenvolvem‐se e o abdômen dilata‐se, surge nódulo amarelado com ponto enegrecido no centro (fig. 5A). Há prurido e, eventualmente, dor. São encontrados geralmente nas pregas ungueais dos dedos dos pés, espaços interdigitais e regiões plantares.34–36 Quando ocorrem muitas lesões próximas dão o aspecto de favo de mel (fig. 5B e 5C). Podem ocorrer infecções secundárias e as lesões servir de porta para outras doenças.37 Após o desenvolvimento dos ovos, a pulga começa a expulsá‐los no período de duas semanas; na sequência, ocorre a morte da fêmea.
A pulga é retirada com agulha e aplica‐se antisséptico no ferimento. Nos casos generalizados usa‐se tiabendazol 25 mg/kg de peso, por via oral, durante 10 dias.38
A profilaxia é feita com o uso de calçados.
Recentes estudos mostraram que a dimeticona de baixa viscosidade (NYDA), aplicada durante 7 dias, é eficaz e segura.39
CimicidíaseTodos os cimicídeos (percevejos) são parasitas sugadores de sangue de aves e mamíferos. Dois terços das espécies são parasitas de morcegos. O gênero Cimex, com as espécies Lectularius e hemíptera, parasitam os seres humanos. Também chamados bed bugs, esses insetos têm hábitos noturnos e vivem nas fendas e nos buracos dos moveis e colchões. À noite, principalmente na madrugada, picam as pessoas. Durante o repasto injetam saliva, que contém anticoagulante e anestésico.
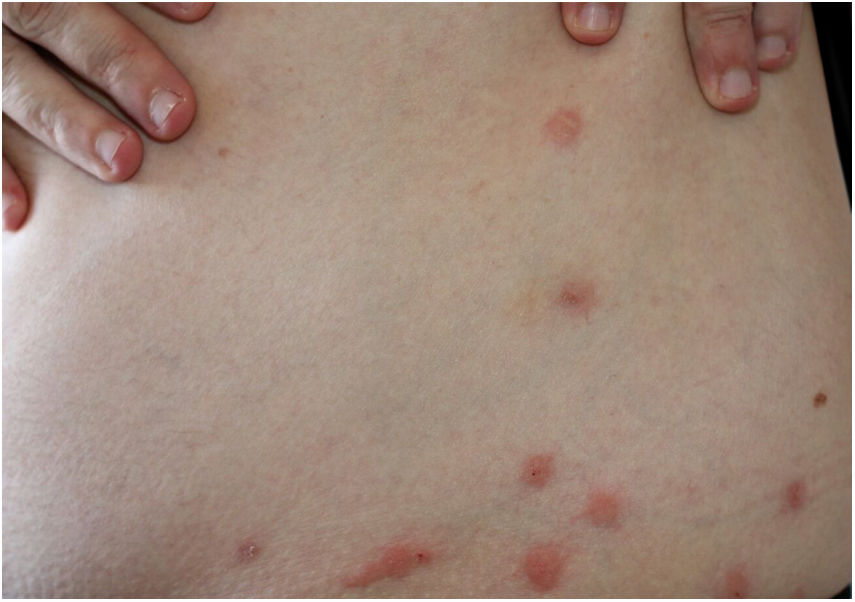
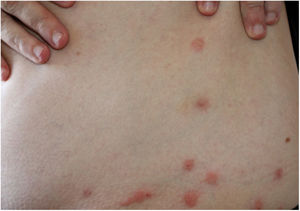
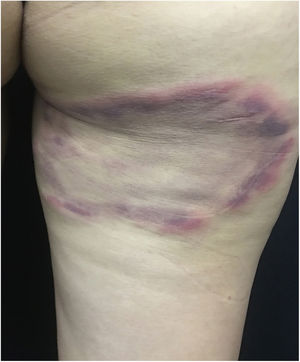
As picadas ocorrem mais comumente em face, pescoço, braços e mãos. Provocam lesões urticadas, pruriginosas (fig. 6), muitas vezes em disposição linear. Podem ocorrer lesões a distância, por sensibilização, inclusive lesões bolhosas.40,41
Os bed bugs compartilham traços importantes com insetos triatomíneos, mas ainda não está claro se essas semelhanças incluem a capacidade de transmitir o Trypanosoma cruzi, causador da doença de Chagas.
Estudo recente mostrou a transmissão eficiente e bidirecional de T. cruzi entre hospedeiros e bed bugs. A maioria dos bed bugs alimentados em camundongos infectados adquiriu o parasita; a maioria dos camundongos foi infectada após período de coabitação com bed bugs expostos. O T. cruzi também foi transmitido para camundongos depois que as fezes de percevejos infectados foram aplicadas diretamente à pele do hospedeiro. Os achados sugerem que os bed bugs podem ser um vetor de T. cruzi.42
O tratamento é feito com creme de corticoide e, a depender do prurido, anti‐histamínicos. Os percevejos devem ser erradicados com o uso de inseticidas.
Vários relatos sugerem o aumento do número de casos em todo mundo, inclusive Europa e Estados Unidos.43,44
MiíaseA miíase é caracterizada pela invasão de larvas de dípteros na pele, mucosas e órgãos, de homens e animais.
Entre as diversas famílias de dípteros destacam‐se as moscas que, entre outras enfermidades, ocasionam as miíases.
De acordo com o ciclo evolutivo dos dípteros, as miíases são classificadas em primárias e secundárias.
Nos pacientes com miíase primária, as larvas invadem os tecidos sadios. Essa variedade é denominada miíase furunculoide. Na forma secundária, conhecida como miíase cavitária, as moscas colocam os ovos sobre ferimentos cutâneos ou nas mucosas.45,46
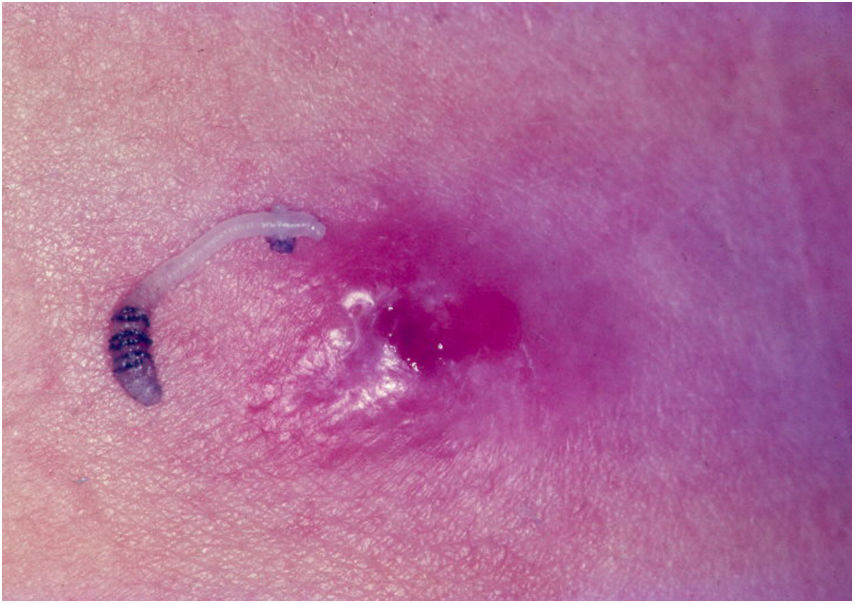
Miíase furunculoideÉ observada em regiões tropicais do continente americano, estende‐se do sul do México ao norte da Argentina. O ciclo de vida da D. hominis é único. A fêmea, após a cópula, voa e captura um díptero hematófago. Coloca 10 a 50 ovos no abdômen de sua presa, sem afetar sua capacidade de voar.47 Ao pousar na pele do homem ou de algum animal, ocorrerá a eclosão dos ovos e liberação das larvas, que penetrarão no hospedeiro, através dos folículos pilosos ou do orifício da picada do inseto. A penetração da larva, geralmente, não é notada. No local de entrada da larva surge lesão eritêmato‐papulosa, pruriginosa, dolorosa. A pápula aumenta de tamanho, evolui para o aspecto furunculoide, com pequena ulceração e saída de exsudato seroso. Nessa abertura, é possível observar a cauda da larva. As larvas alimentam‐se de material da hipoderme, em média, durante 5 a 12 semanas. Depois desse período, as larvas abandonam o hospedeiro e caem no solo, transformam‐se em pupa. Entre 60 e 80 dias, a pupa evolui para inseto alado. Ao pressionar a lesão, pode‐se expor a larva (fig. 7).47,48
A larva move‐se ativamente, e os pacientes referem “dor em ferroada” no local. Eventualmente, pode ocorrer infecção secundária, com abscesso, celulite e adenopatias.
Quando a larva deixar o nódulo haverá regressão e cicatrização da lesão.47,48
O tratamento consiste na retirada da larva, que pode ser feita por meio da compressão do nódulo, depois de pequena incisão no orifício da lesão. A obstrução do orifício com vaselina e a colocação de esparadrapo, que impedem a respiração da larva, facilitam a sua remoção. Há, também, um tratamento leigo, no qual se coloca toucinho aquecido sobre o orifício da lesão – para respirar, a larva penetra no toucinho.
Miíase secundáriaÉ causada por larvas de moscas que não são parasitas obrigatórios. A depender do local onde os ovos são depositados, recebem as denominações cutânea e cavitária. Quando os ovos são ingeridos, acidentalmente, pode ocorrer a forma intestinal.
Na forma cutânea, a mosca deposita os ovos sobre ulcerações cutâneas. Os ovos eclodem e as larvas desenvolvem‐se. Os principais agentes etiológicos são as larvas das moscas Cochliomya macellaria, C. hominivorax e outras espécies da família Sarcophagidae e gênero Lucilia.49
O diagnóstico é clínico, pois as larvas são facilmente visualizadas. Tradicionalmente, o tratamento é feito com a retirada das larvas, após a aplicação tópica de éter. O emprego da ivermectina a 1% em propilenoglicol é outro método que tem sido usado – duas horas depois da aplicação, faz‐se a limpeza da lesão e retirada das larvas.50
Miíase cavitáriaNesses casos, a mosca deposita os ovos em cavidades naturais, tais como narinas, ouvido, órbitas oculares e vagina. Os quadros mais graves são ocasionados pela espécie C. hominivorax.
O tratamento de escolha consiste no uso de ivermectina 200 μg/Kg de peso em dose única.
Antes da ivermectina, empregava‐se o oxcianureto de mercúrio a 1%.
DemodecidoseÉ ocasionada pelo Demodex folliculorum, um ácaro, parasita obrigatório do folículo piloso. Esses ácaros têm predileção pelas áreas com grande produção sebácea, tais como face e tórax.
Frequentemente, o Demodex tem sido implicado na etiopatogênese da rosácea.51–54 No entanto, a resistência do ácaro a altas concentrações de metronidazol, demonstrada in vitro, coloca em dúvida o papel do parasita na patogenicidade da rosácea.55
É possível que por meio da obstrução dos óstios foliculares, o Demodex contribua para a reação inflamatória observada na rosácea, possibilita a proliferação bacteriana ou induz mecanismos de hipersensibilidade aos antígenos do ácaro.
Tem sido atribuído ao D. folliculorum papel patogênico na Pitiryasis folicullorum, quadro dermatológico que ocorre, predominantemente, em mulheres de meia‐idade. Essa dermatose é caracterizada pela presença de eritema difuso e foliculite na face. No exame microscópico, evidencia‐se grande número de ácaros. O tratamento é feito com acaricidas tópicos.53
Erupções papulosas ou pápulo‐pustulosas em face, tronco e membros, observadas em indivíduos imunodeprimidos (pacientes HIV positivos, crianças com leucemia e um caso de micose fungoide), também têm sido atribuídas ao Demodex.56,57
O tratamento sistêmico com ivermectina (200 μg/kg de peso, em dose única), ou metronidazol 250 mg ao dia, com duração variável, depende da resposta, é eficaz.
Larva migrans cutâneaÉ também denominada dermatite linear serpiginosa, bicho geográfico ou de praia e verme da areia.
O indivíduo adquire a doença quando entra em contato com a areia ou solo contaminado com fezes de cães e gatos.
Na época das chuvas, o número de pessoas infectadas aumenta, provavelmente pela dissolução das fezes dos cães e gatos, que facilita a eclosão dos ovos e a penetração das larvas na pele das pessoas.
A doença ocorre pela penetração na pele das formas larvárias de nematódeos de cães e gatos que estão aptos a penetrar na pele provavelmente pela secreção de hialuronidase.58
O Ancylostoma brasiliensis é o agente etiológico mais frequente. O A. caninum, Uncinaria (vermes dos cães da Europa), Bunostomum (verme do gado) e Phebotumum stenocephala também podem ocasionar a doença.
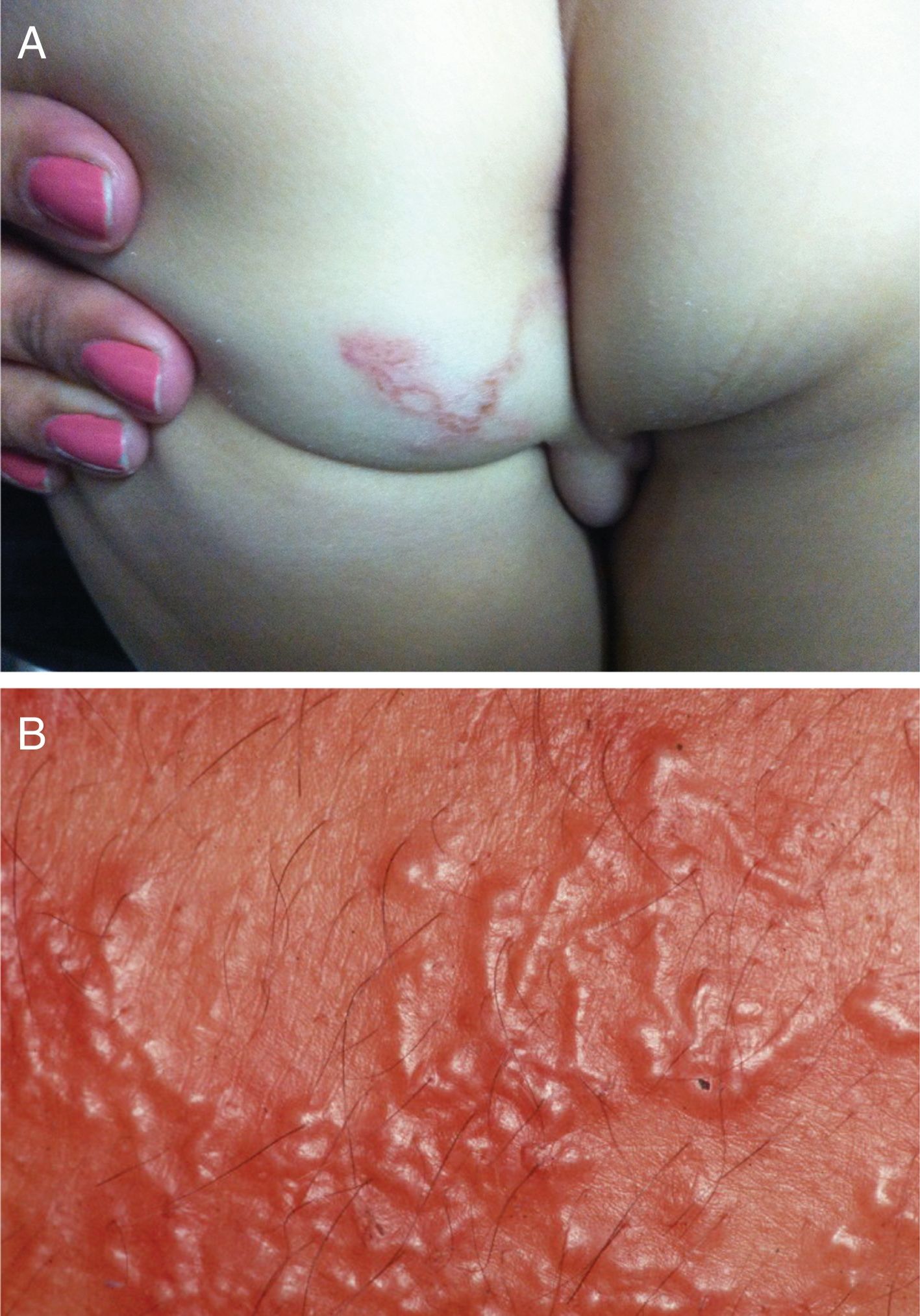
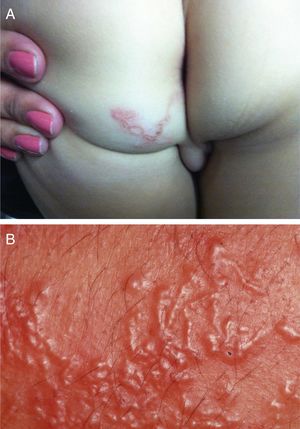
Manifestações clínicasEm geral, as lesões são lineares, salientes, eritematosas e serpiginosas (fig. 8A). Também podem surgir vesículas e até bolhas. As áreas mais afetadas são pés, pernas, nádegas e, menos frequentemente, outras regiões, tais como face, axilas e pênis. Há caso descrito com lesões na mucosa oral. O deslocamento das larvas desencadeia intenso prurido.59
Quando ocorre eczematização e infecção secundária, o diagnóstico pode ser muito difícil. Nesses casos, recomenda‐se, primeiro, usar pomadas para o quadro alérgico e, se necessário, antibiótico. Assim, o aspecto clínico da larva migrans fica mais evidente.
Quando os espaços interdigitais são afetados pode ocorrer maceração; esse aspecto clínico pode ser confundido com dermatofitose dos pés.
Também pode ocorrer alteração hematológica, com eosinofilia, que, em alguns casos, chega a 30%. Nas infestações intensas (fig. 8B), as larvas podem invadir a corrente sanguínea e desencadear a síndrome de Loeffler, caracterizada por pneumonia eosinofílica, associada à eosinofilia sanguínea.60
TratamentoDe acordo com o número de lesões e sua localização, o tratamento pode ser tópico ou sistêmico. Nos pacientes com múltiplas lesões, ou acometimento de áreas hiperceratósicas, como as regiões palmo‐plantares, recomenda‐se o tratamento sistêmico.
O albendazol, na dose de 15 mg/kg/dia, durante 3 dias é ótima opção terapêutica. O seu uso não impede o aleitamento e o risco fetal é categoria C. A taxa de cura é variável, de 77% a 100%.61,62
A ivermectina, na dose de 200 μg/kg de peso, em dose única, é também eficaz. A depender da evolução, a mesma dose pode ser repetida depois de 7 dias.63
Quando o número de lesões for reduzido, e com localização na pele glabra, o tratamento tópico com pomada de tiabendazol a 5% pode ser indicado.
A neve carbônica ou nitrogênio líquido também são usados.64,65
Doença de LymeA doença de Lyme (DL), também denominada borreliose de Lyme, é uma zoonose transmitida por carrapatos, principalmente do gênero Ixodes, infectados com espiroquetas pertencentes ao complexo Borrelia burgdorferisensu lato.66 Atualmente, já foram reconhecidas 20 espécies dentro do complexo sensu lato, seis relacionadas à doença, em humanos: B. burgdorferistrictu sensu e B. mayonii (Estados Unidos), B. bavariensis, B. garinii, B. afzelli e B. spielmanii (Europa).67
Afzelius, na Suécia, em 1909, e Lipschutz, na Áustria, em 1913, descreveram os primeiros casos de pacientes com placas eritematosas, de crescimento centrífugo, aos quais denominaram eritema crônico migratório (ECM).68,69 Em 1977, Steere et al. verificaram a associação de ECM e artrite. Os casos foram estudados na cidade de Lyme, Connecticut (EUA). A partir dessa publicação, surgiram as denominações artrite de Lyme e DL. Além da associação com artrite, Steere et al. observaram sintomas inespecíficos (mal‐estar, fadiga, cefaleia, febre e outras manifestações), alterações cardíacas, oftalmológicas e neurológicas.70 Devido à evolução, nem sempre crônica, das lesões cutâneas, Detmar et al., em 1989, propuseram o nome eritema migratório (EM), denominação que tem sido muito usada.71 No Brasil, os primeiros casos foram relatados, em Manaus, por Talhari et al.72,73 Filgueira, Azulay e Florião74–76 também descreveram casos clinicamente compatíveis no Rio de Janeiro. Em 1992, foram descritos os primeiros casos de pacientes brasileiros com manifestações articulares associadas à infecção por B. burgdorferi.74
PatogeniaO agente etiológico do EM/DL, um espiroqueta, foi isolado pela primeira vez por Burgdorfer, em 1982, no intestino de carrapatos da espécie Ixodes dammini.75 Atualmente, esse espiroqueta é denominado Borrelia burdorgerisensu lato. Já foi identificado em biópsias de lesões cutâneas, sangue, líquor, tecido sinovial, miocárdio e olhos de pacientes com DL.12
Nos Estados Unidos, camundongos e cervos são reservatórios importantes desse espiroqueta. Títulos sorológicos elevados para Borrelia foram observados em cavalos, vacas, carneiros e gatos. No Brasil, roedores silvestres e outros mamíferos, tais como gambás, parecem participar do ciclo epidemiológico da DL.76
Os principais transmissores da doença são carrapatos do gênero Ixodes. No continente europeu, predomina o Ixodes ricinus. Nos Estados Unidos, o Ixodes dammini, também conhecido como I. scapularis. No Brasil, acredita‐se que o carrapato responsável pela transmissão da DL seja o Ambylomma cajannense. No entanto, não se exclui a participação de outras espécies de carrapato. As formas evolutivas dos carrapatos mais associadas com a transmissão da Borrelia são as ninfas e carrapatos adultos. As picadas das ninfas desses carrapatos são indolores, o que explicaria o fato de muitos pacientes infectados não se lembrarem de terem sido picados por carrapatos.77
Quadro clínicoAs manifestações cutâneas da DL são divididas em localizadas, iniciais (eritema migrans e linfocitoma cutis), disseminadas (EM e linfocitomas múltiplos, que podem ser acompanhados de alterações em outros órgãos) e tardias (acrodermatite crônica atrófica).78
Manifestações dermatológicasO EM é a principal manifestação clínica inicial da DL. Três a 30 dias após a picada do carrapato aparece no local de inoculação uma pápula ou pequena placa eritematosa que aumenta de tamanho, forma placa com bordas descontínuas e centro claro, cianótico e/ou descamativo, que se expande centrifugamente, pode atingir grande diâmetro (fig. 9). É comum a progressão rápida das lesões, as quais podem atingir 20 a 30 cm ou mais, em dias ou semanas. Na maioria dos pacientes, essas lesões são assintomáticas. EM com diferentes dos aspectos clínicos já foram descritos: erisipeloides, eritemato‐edematosas, liquenoides.79 Os casos europeus de EM tendem a apresentar‐se com pequeno número de lesões e sem tendência à disseminação cutânea.80
Além do EM, outra manifestação cutânea importante da fase inicial da DL é o linfocitoma cutis, também denominado linfadenose benigna cutis, que simula pseudolinfoma de linfócitos B. Clinicamente, caracteriza‐se por nódulo ou placa eritematosa, única, de um a cinco centímetros de diâmetro, localizado, geralmente, em face, pavilhão auricular, bolsa escrotal ou aréola mamária. O linfocitoma está frequentemente associado à infecção pelas B. afzelli e B. garinii.81 Em 2007, foi publicado caso de linfocitoma cútis em associação com DL, no Brasil.82
Nessa fase aguda, podem aparecer também manifestações sistêmicas, tais como astenia, artralgia, mialgia, rash cutâneo, adenopatia, esplenomegalia e sinais de irritação meníngea. As lesões iniciais da DL podem desaparecer sem tratamento e as manifestações do segundo e terceiro estágios podem surgir meses ou anos após a infecção inicial. Entre as principais alterações, encontram‐se comprometimentos articulares, cardíacos, neurológicos, oftalmológicos e cutâneos. Mais raramente, alterações tardias podem ocorrer na vigência de lesões de EM.83 Entre as manifestações das fases tardias, cutâneas, destaca‐se a acrodermatite crônica, também denominada acrodermatite crônica atrófica (ACA) ou doença de Pick‐Herxheimer, mais associada com infecção por B. afzelii, é geralmente descrita na Europa. A ACA é mais comum em adultos e pode manifestar‐se de seis meses a oito anos após a picada do carrapato. Clinicamente, começa com placa eritematosa, evolui com atrofia cutânea e vasos sanguíneos bem proeminentes, localiza‐se, em particular, nos membros inferiores. A face e o tronco também podem ser afetados.84
Outras doenças dermatológicas associadas à infecção por BorreliaA infecção pela B. burgdorferi tem sido associada a outras doenças dermatológicas, tais como esclerodermia em placa, líquen escleroso, atrofodermia de Pasini‐Pierini, linfoma de células B cutâneo e granuloma anular.85 Em trabalho feito em Manaus, em 2009, pacientes com esclerodermia e atrofodermia de Pasini‐Pierini foram analisados com a técnica de imuno‐histoquímica com anticorpo policlonal anti‐B. burgdorferi e a presença da espiroqueta foi confirmada em amostras de ambas as doenças.86
DiagnósticoO diagnóstico da doença baseia‐se nos aspectos epidemiológicos, clínicos e laboratoriais. O diagnóstico laboratorial fundamenta‐se nas provas sorológicas (detecção de anticorpos específicos) e/ou no encontro do agente etiológico. Além da sorologia, são importantes os exames histopatológico e imuno‐histoquímico, cultura e, se disponível, PCR.87
A detecção de anticorpos IgM ou IgG anti‐B. burgdorferi é comumente usada para o diagnóstico sorológico e investigação epidemiológica. São mais usados os exames de ELISA (Enzime‐Linked Immunosorbent Assay) e imunofluorescência indireta (IFI), que, no entanto, apresentam resultados falso‐positivos, em vista da reação cruzada com outras enfermidades, tais como colagenoses, leishmaniose e sífilis. Assim, em áreas não endêmicas, para o diagnóstico definitivo necessita‐se de exame confirmatório que demonstre a presença do agente.88
No exame histopatológico das lesões de EM podem‐se observar, na derme, proliferação e dilatação dos vasos sanguíneos associados a infiltrado inflamatório central constituído por macrófagos, mastócitos, neutrófilos, plasmócitos, linfócitos e raros eosinófilos. Vasculite predominantemente linfocítica pode ser evidenciada. Em lesões mais antigas, pode ocorrer atrofia da epiderme e derme, além de diminuição do infiltrado inflamatório dérmico.89
A técnica de reação em cadeia da polimerase (PCR) tem sido usada para detectar sequências de ácido nucleico da Borrelia, apresenta alta especificidade. No entanto, a sensibilidade desse método diagnóstico é variável (20% a 81%). Cerar et al., em 2008, demonstraram que a nested‐PCR, com o uso do gene flagelina, apresentava sensibilidade maior do que a PCR (64,6% vs. 24%). A positividade da PCR é maior quando são usados fragmentos de lesões cutâneas ou de membrana sinovial. É menos sensível quando feita a partir de blocos parafinados, sangue, líquido sinovial e líquor.90
A cultura, com o meio BSK (Barbour, Stroenery, Kelly) ou variações dele, apresenta especificidade de 100%, mas sua sensibilidade é relativamente baixa. Diante das dificuldades de execução da técnica e da contaminação do material, os resultados são positivos em aproximadamente 45% dos casos.91
Eisendle et al., em 2007, por meio do exame de imuno‐histoquímica específica para a detecção de Borrelia sp., associado à técnica de microscopia de focagem flutuante (FFM), obtiveram resultados superiores à nested‐PCR na identificação de Borrelia (96% vs. 45,2%), com especificidade similar (99,4% vs. 100%). A FFM consiste em examinar a lâmina em vários planos, simultaneamente horizontal e vertical, aproxima‐se e distancia‐se a objetiva do microscópio, com aumentos de até 400×, sob forte iluminação. Segundo os autores, esses movimentos simultâneos facilitam a observação da Borrelia.92 Com essa mesma técnica, em 2010, Talhari et al. demonstraram, pela primeira vez no Brasil, a presença de Borrelia em pacientes com EM procedentes de Manaus, com o uso de imuno‐histoquímica com anticorpo policlonal anti‐Borrelia e observação pela técnica de microscopia de focagem flutuante, originalmente denominada Focus Floating Microscopy ? FFM.93
TratamentoO tratamento da doença é feito de acordo com o estágio e a manifestação clínica apresentada. Em pacientes adultos com DL localizada, inclusive os casos de EM que não apresentam manifestações neurológicas específicas, o tratamento recomendado é a doxiciclina (100 mg, 2×por dia), amoxicilina (500 mg, 3×por dia) ou cefuroxima axetil (500mg, 2×por dia) durante 14 dias. Para crianças e pacientes com hipersensibilidade à doxiciclina, usa‐se a amoxicilina na dose de 500 mg ou 50 mg/Kg de peso/dia, 3×ao dia; ou cefuroxima 500 mg ou 30 mg/kg/dia, 2×ao dia, pelo mesmo período. As manifestações articulares e os casos de acrodermatite atrófica são tratados com os mesmos antibióticos, durante 28 dias. Nos casos de meningite e outras manifestações da DL neurológica precoce, recomenda‐se ceftriaxona, 2 g/dia, por via intravenosa, ou penicilina G cristalina, na dose de 18 a 24 milhões de UI, intravenosa, diariamente, por 14 dias. Para o tratamento da artrite erosiva crônica recomenda‐se sulfasalazina, cloroquina, metotrexate e corticoide.80,94
OncocercoseA oncocercose, também conhecida como oncocercíase, oncocerquíase e “cegueira dos rios”, é doença parasitária crônica, não contagiosa, caracterizada pela presença de lesões cutâneas e, muitas vezes, graves lesões oftalmológicas. É causada pelo nematoide filariano Onchocerca volvulus.95
Segundo a Organização Mundial de Saúde (OMS), 198 milhões de pessoas apresentam risco de infecção em 31 países endêmicos.96 A oncocercose é a segunda causa de cegueira infecciosa no mundo. Aproximadamente, 99% das pessoas infectadas pela O. volvulus habitam países da África sub‐sahaariana, os demais pacientes encontram‐se no Iêmem, Sudão e continente americano. No último, a oncocercose já foi endêmica em seis países: Brasil, Colômbia, Equador, Guatemala, México e Venezuela.96
Atualmente, o único foco de oncocercose no continente americano, reconhecido pela OMS, continua a ser a região limítrofe entre a Venezuela e os estados de Roraima e Amazonas, no Brasil, habitada pelos índios Yanomami.96
Desde 1974, o Programa de Controle da Oncocercose, desenvolvido pela OMS e financiado pelo Banco Mundial e pelas Nações Unidas, promove o controle de vetores e tratamento da oncocercose com invermectina (usada pelo programa a partir de 1987) em 33 países africanos.95 Em 2016, mais de 133 milhões de pessoas que viviam em áreas de risco receberam tratamento para oncocercose.97
Em 1990, o Programa de Eliminação da Oncocercose nas Américas, semelhante ao modelo africano, foi implantado para eliminação da doença nas 13 regiões endêmicas do continente americano.96 Desde então, os doentes são tratados com invermectina, 2 ou 4 vezes durante o ano. Até novembro de 2017, em 11 das 13 áreas com transmissão ativa de O. volvulus a doença foi considerada eliminada.96
PatogeniaA transmissão da O. volvulus ocorre através da picada de insetos do gênero Simulium (“borrachudo” ou “pium”); esses são encontrados, em maior abundância, próximo das margens de rios encachoeirados (daí a denominação “cegueira dos rios”).95 As microfilárias podem ser transmitidas por diferentes espécies de Similium. No Brasil, as principais espécies são o S. guyanense, S. incrustatum e S. oyapockense.98
O principal hospedeiro da doença é o homem. Ao picar o homem infectado, as fêmeas hematófagas ingerem as microfilárias, as quais, após 2 a 3 semanas, transformam‐se em larvas infectantes. Após período de 6 a 12 meses, essas larvas evoluem para vermes adultos; os machos medem 2‐4 cm de comprimento e as fêmeas, 40 a 50 cm de. Os vermes adultos, machos e fêmeas, tendem a se alojar nos espaços intersticiais e no tecido adiposo, formam os oncocercomas. Acasalam‐se nesses locais. Após o acasalamento, as fêmeas dão origem às microfilárias, que migram para o tecido conjuntivo, a derme superficial e o globo ocular. Cada fêmea pode gerar aproximadamente um milhão de microfilárias por ano, as quais vivem até dois anos e meio. As fêmeas, adultas, podem viver entre 9 e 16 anos.99
Quadro clínicoNo tegumento, a manifestação mais comum e precoce da oncocercose é o prurido crônico, constante, pode simular escabiose (fig. 10A). Áreas com escoriações, liquenificação e hiperpigmentação são frequentes. Esse quadro é conhecio como lizard skin (pele de lagarto).100,101
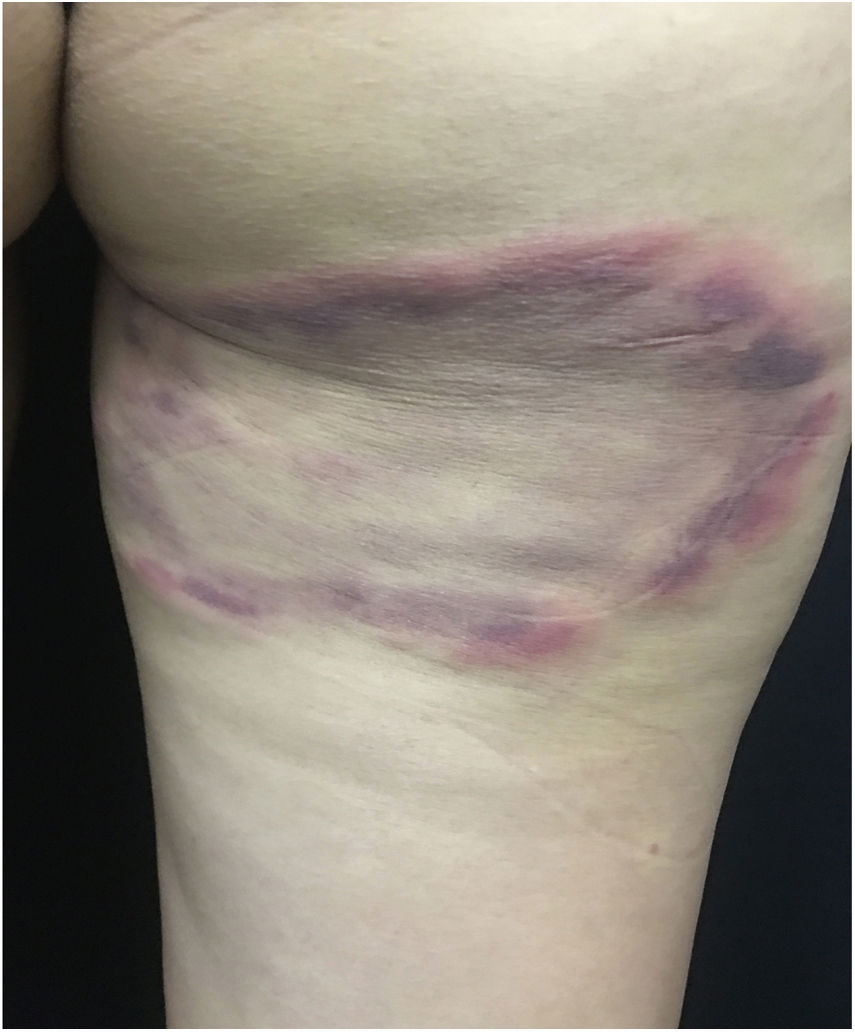
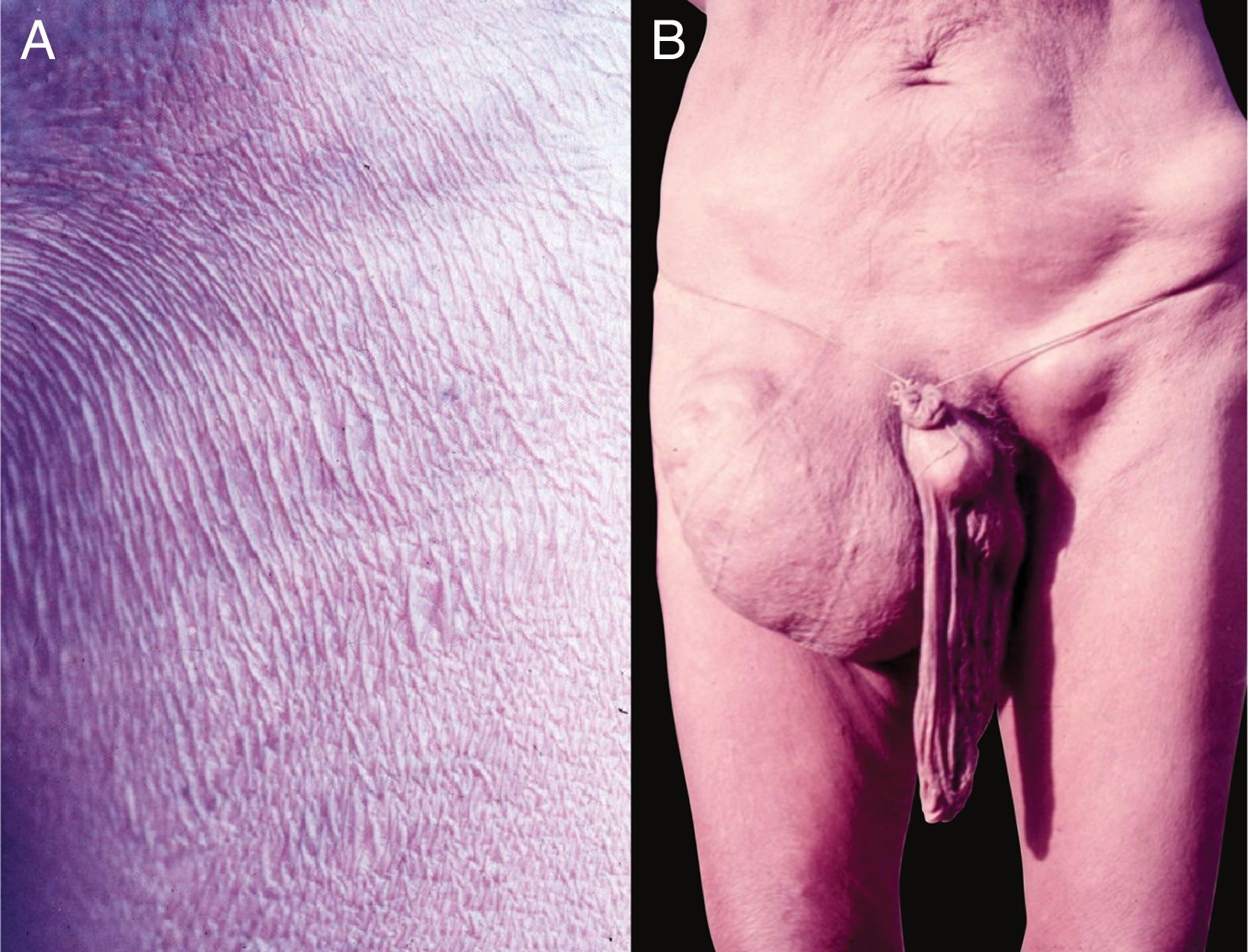
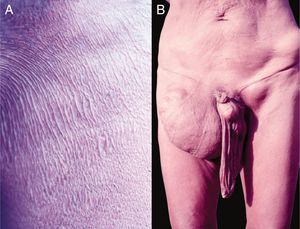
A despigmentação tardia e acromia secundária ao prurido crônico são frequentes, principalmente nos membros inferiores (denominada leopard skin, ou seja, pele de leopardo). Atrofia pode ocorrer nas fases tardias da doença, a qual pode ser discreta (fig. 10B) ou muito acentuada, ocasiona o aumento da bolsa escrotal e da hérnia inguinal. As hérnias inguinais recebem a denominação de hanging groin (virilha caída) (fig. 11).101,102 Em alguns casos, as lesões encontram‐se limitadas a determinada área cutânea, principalmente na perna, coxa e região glútea. Esse quadro clínico é conhecido como sowda. Os oncocercomas são indolores, de consistência firme, arredondados ou alongados e apresentam tamanho variável (0,5 a 10 cm de diâmetro). Essas lesões localizam‐se, geralmente, na pelve, nas faces laterais do tórax e nos membros inferiores em pacientes africanos; nas Américas, os oncocercomas são observados, principalmente, no couro cabeludo, nos braços e no tórax.100
A. Oncocercose. Presença de áreas atróficas em pacientes com longa evolução. B. Oncocercose. Observar o aspecto clássico da “virilha caída” (conhecida como hanging groin) decorrente de longa evolução. Há, também, alongamento da bolsa escrotal (secundário à atrofia cutânea), nódulos na crista ilíaca e virilha esquerda – provavelmente, oncocercomas. (Arquivo pessoal: Prof. Sinésio Talhari). Indígena Yanomami.
As principais lesões oftalmológicas são as ceratites, as iridociclites, a catarata, as lesões coroidorretinais, a atrofia óptica pós‐neurítica e a amaurose. A amaurose produzida pela oncocercose é extremamente comum na África e acarreta grandes prejuízos socioeconômicos.95,101
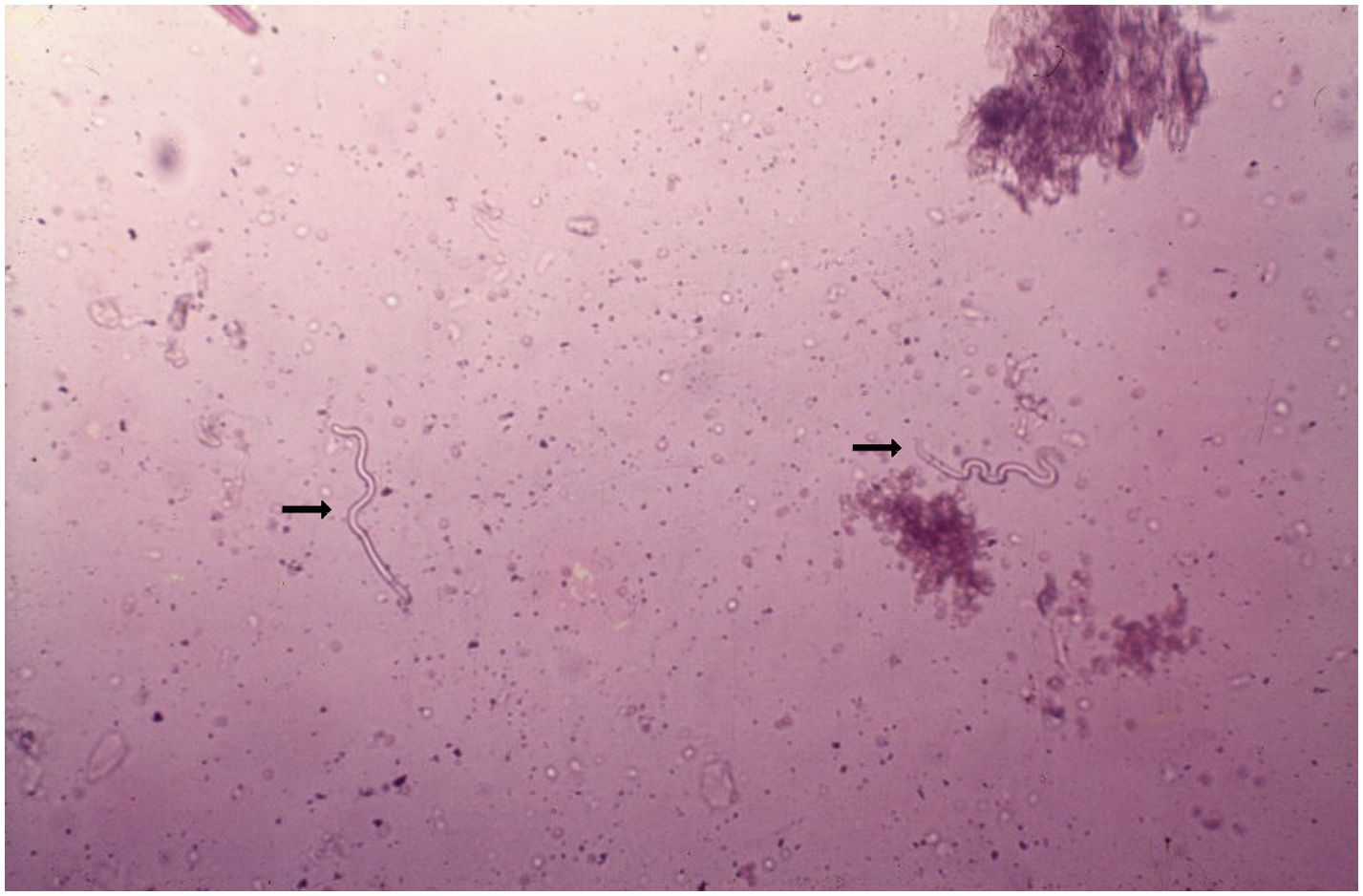
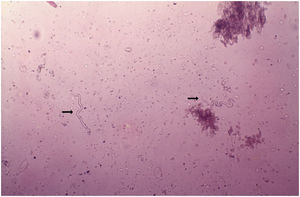
DiagnósticoO diagnóstico da oncocercose é baseado na observação das microfilárias ou do verme adulto, através do exame direto. O procedimento é simples e feito sem anestésico, pregueia‐se a pele entre o polegar e o indicador, para evitar o sangramento durante a colheita do material. Colhe‐se fragmento superficial de pele. A amostra de pele obtida é colocada em soro fisiológico e dividida em pequenos pedaços, com o auxílio de dois estiletes. A pesquisa de microfilárias faz‐se ao microscópio, sem qualquer coloração e aumento de 40?50 vezes (fig. 12).101 A O. volvulus também pode ser visto por meio do exame histopatológico das lesões cutâneas e exame oftalmológico. As técnicas habituais de biópsia, fixação em formol a 10% e a coloração pela hematoxilina‐eosina são empregadas.101,102 As microfilárias podem ser identificadas através do exame com a lâmpada de fenda.101,102 Recentemente, métodos imunológicos para identificar anticorpos antioncocerca, específicos (ELISA e imunofluorescência) e DNA de oncocerca (PCR) têm sido empregados.103
TratamentoO tratamento é feito, principalmente, com a ivermectina, por via oral, na dose de 150 μg/kg de peso, em dose única, a cada 6 meses. Essa droga é microfilaricida e não elimina os vermes adultos, os quais permanecem vivos, produzem novas microfilárias.95 Estudo controlado e randomizado sugere que o uso da invermectina, de 3 em 3 meses, eliminaria mais parasitas adultos fêmeas, diminuiria, ainda mais, a transmissão da O. volvulus.104
Suporte financeiroNenhum.
Contribuição dos autoresAlberto Eduardo Cox Cardoso: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Alberto Eduardo Oiticica Cardoso: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; revisão crítica da literatura; revisão crítica do manuscrito.
Carolina Talhari: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Monica Santos: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Questões EMC| 1. A ivermectina, quando usada no tratamento sistêmico da escabiose, deve ser empregada na seguinte dose: |
| a) 100 mcg/kg em dose única. |
| b) 200 mcg/kg em dose única. |
| c) 200 mcg/kg durante 7 dias. |
| d) 20 mcg/kg durante 7 dias. |
| 2. Os indivíduos imunossuprimidos quando infectados pelo S. scabieivar. hominis tendem a desenvolver: |
| a) Escabiose nodular. |
| b) Escabiose bolhosa. |
| c) Escabiose crostosa. |
| d) Escabiose clássica. |
| 3. Na pediculose do couro cabeludo, o principal sintoma e os achados clínicos são: |
| a) Escoriações no couro cabeludo e prurido. |
| b) Prurido e visualização de ovos (lêndeas) nos cabelos. |
| c) Prurido e crostículas sanguíneas no couro cabeludo. |
| d) Prurido e adenopatia cervical. |
| 4. Na miíase furunculoide, o tratamento consiste em: |
| a) Ivermectina ? 200 mcg/Kg, via oral, 3 vezes por semana. |
| b) Albendazol ? dose única de 400 mg. |
| c) Tiabendazol ? 25 mg/kg de peso, durante 5 dias. |
| d) Retirada da larva. |
| 5. Dentre os medicamentos abaixo, qual deles não é usado no tratamento da larva migrans cutânea: |
| a) Ivermectina ‐ 200 mcg/Kg. |
| b) Albendazol ‐ 400mg, em dose única, ou 15 mg/kg de peso/dia, durante 3 dias, quando o paciente pesar mais de 60 kg. |
| c) Azitromicina ‐ 500 mg/dia, durante 5 dias. |
| d) Tiabendazol ‐ 25 mg/kg de peso, durante 5 dias. |
| 6. Na pediculose do púbis ou fitiríase, qual o principal achado para confirmar o diagnóstico: |
| a) Prurido na região genital. |
| b) Adenopaita dos gânglios da região inguinal. |
| c) Encontro do parasita na pele com a parte da cabeça introduzida no folículo piloso ou pelas lêndeas presas próximas a base dos pelos. |
| d) Encontro de manchas cinza azuladas na região genital. |
| 7. As formas evolutivas de carrapato mais frequentemente associadas com a transmissão da Borrelia budorgeri são: |
| a) Larvas e carrapatos adultos. |
| b) Ninfas e carrapatos adultos. |
| c) Ovos e ninfas. |
| d) Ninfas e larvas. |
| 8. Em relação ao eritema migratório, assinalar a assertiva correta: |
| a) Aparece de 3 a 5 dias após a picada do carrapato. |
| b) As lesões progridem lentamente e podem atingir até 30cm de diâmetro. |
| c) Na maioria dos pacientes, o eritema migratório é assintomático. |
| d) O exame histopatológico é típico e confirma o diagnóstico. |
| 9. Em relação às manifestações clínicas da oncocercose, as expressões sowda e lizard skin referem‐se, respectivamente a: |
| a) Depigmentação e acromia tardia. |
| b) Depigmentação e liquenificação. |
| c) Lesões limitadas aos membros superiores e liquenificação. |
| d) Lesões limitadas aos membros inferiores e liquenificação. |
| 10. Em relação ao tratamento da oncocercose com ivermectiva, assinalar a assertiva correta: |
| a) A droga é microfilaricida. |
| b) Deve ser administrada semanalmente, durante 6 meses. |
| c) Deve ser administrada semestralmente, durante 3 anos. |
| d) Elimina os vermes adultos. |
| GABARITO: Queratoses actínicas: revisão dos aspectos clínicos, dermatoscópicos e terapêuticos. An Bras Dermatol. 2019;94(6):637‐57. | ||||
| 1. b | 3. d | 5. a | 7. b | 9. a |
| 2. c | 4. b | 6. c | 8. b | 10. c |
Como citar este artigo: Cardoso AEC, Cardoso AEO, Talhari C, Santos M. Update on parasitic dermatoses. An Bras Dermatol. 2020;95:1–14.
Trabalho realizado na Universidade Federal de Alagoas e Universidade Federal de Ciências da Saúde de Alagoas, Maceió, AL, Brasil; Universidade do Estado do Amazonas e Fundação Alfredo da Matta de Dermatologia, Manaus, AM, Brasil.