Os inibidores de checkpoint imunológico (ICI) foram recentemente estabelecidos como ferramenta terapêutica essencial para vários tipos avançados de câncer, incluindo melanoma e outras neoplasias malignas cutâneas. Os eventos adversos imunorrelacionados (irAES, do inglês immune‐related adverse events) são complicações frequentes desses tratamentos, em que a pele é um dos órgãos mais afetados.1 Em geral, de 25% a 50% dos pacientes que recebem ICI (incluindo inibidores de CTLA‐4, PD‐1 e PD‐L1) desenvolvem irAES cutâneos.2,3
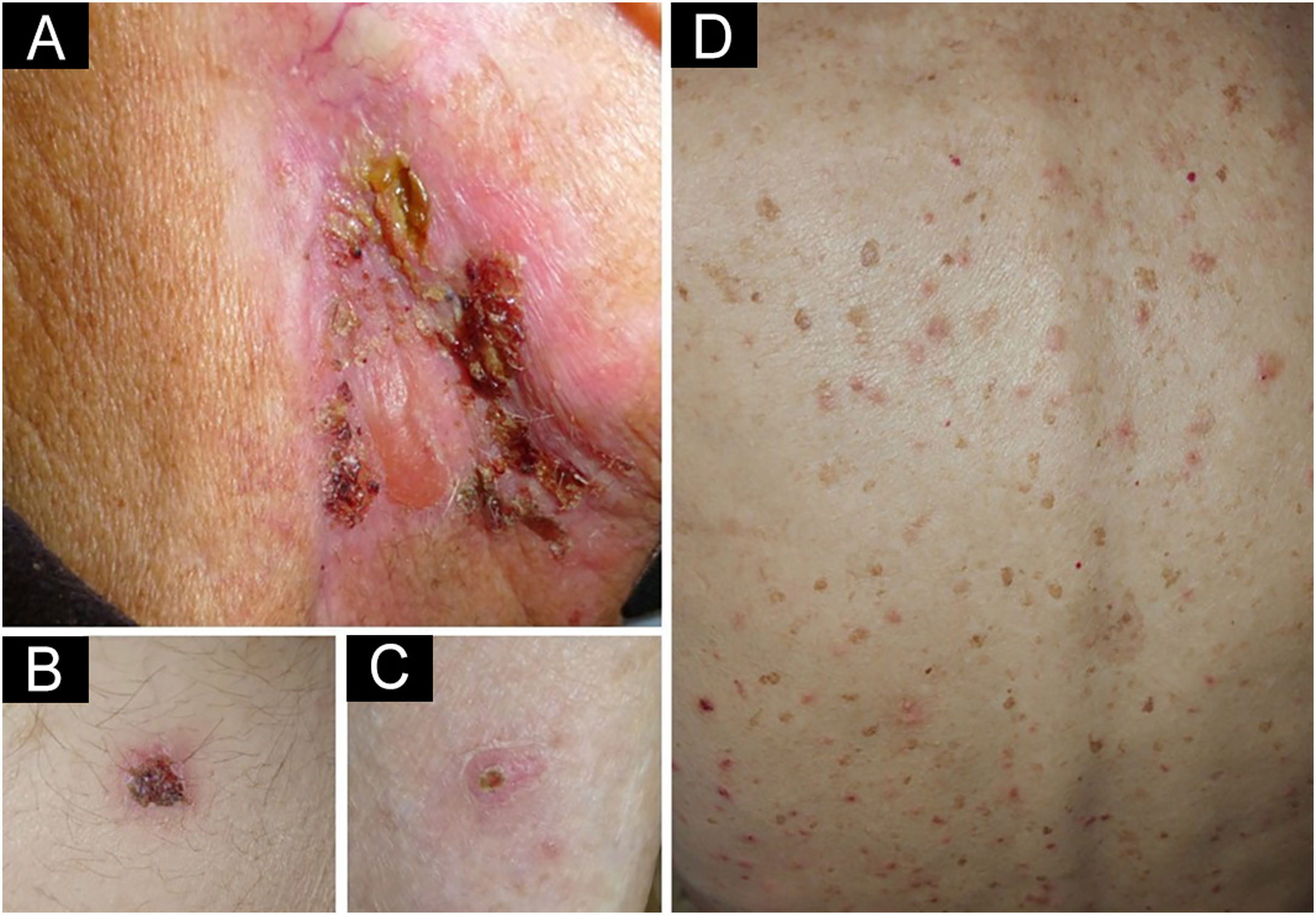
Apresentamos o caso de um homem de 90 anos tratado com pembrolizumabe (inibidor de PD‐1) em virtude de um carcinoma espinocelular avançado do lóbulo da orelha (pT2pN2bM0). Dois meses após iniciar o tratamento com pembrolizumabe, o paciente queixou‐se de bolhas e erosões crostosas pruriginosas localizadas nas regiões cervical e abdominal. Um mês depois, notou o aparecimento de outras lesões cutâneas pruriginosas no dorso, com persistência de bolhas e erosões que agora acometiam também os membros inferiores. O exame cutâneo mostrou pápulas eritematosas de 3 a 5mm, distribuídas por toda a região dorsal. Na região cervical lateral direita havia grande placa eritematosa com bolha serosa e diversas erosões crostosas. Outras pequenas lesões erosivas crostosas foram observadas nas regiões hipogástrica e lombar e em ambas as pernas (fig. 1).
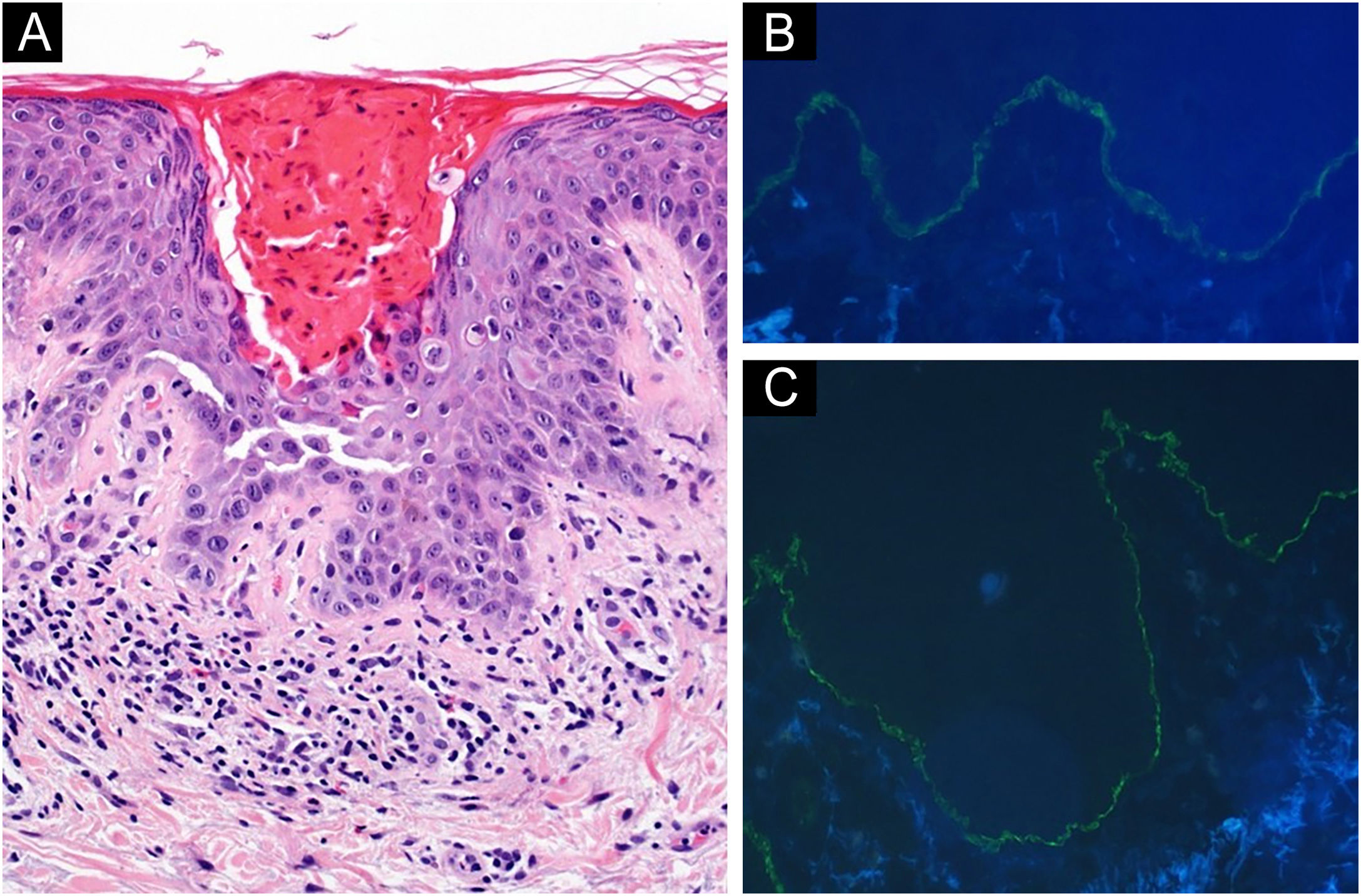
Duas biopsias de pele de 4mm foram obtidas da região dorsolombar. A histopatologia mostrou hiperceratose paraceratótica, acantólise suprabasal e células disceratóticas. A derme superficial apresentava infiltrado inflamatório linfocitário com alguns eosinófilos (fig. 2A). A imunofluorescência direta (IFD) mostrou forte positividade linear para C3 e IgG ao longo da membrana basal (figs. 2B, 2C). Achados histopatológicos e clínicos sugeriram a simultaneidade de doença de Grover (DG) e penfigoide bolhoso (PB). Apesar do tratamento tópico com propionato de clobetasol, as lesões cutâneas e o prurido pioraram. Por isso, o pembrolizumabe foi descontinuado e iniciada prednisona oral (dose reduzida de 20mg/dia), resultando na eliminação das lesões cutâneas.
(A) Histopatologia de uma das pápulas eritematosas na região dorsolombar esquerda do paciente. (A) Observam‐se hiperceratose paraceratótica, acantólise suprabasal e células disceratóticas. Discreto infiltrado inflamatório linfocitário com alguns eosinófilos é observado na derme superficial (Hematoxilina & eosina, 20×). Imunofluorescência direta da pele normal da região dorso‐lombar esquerda, adjacente à erosão crostosa: depósitos lineares de IgG (B) e C3 (C) são observados ao longo da zona da membrana basal.
Entre os pacientes que recebem ICI, a incidência relatada de PB é de 0,3%‐1%1,3 e de 0,2% para DG. Incidências significantemente mais altas foram encontradas em relação à coorte de controles que não utilizou essas terapias.3 O desenvolvimento concomitante de ambas as doenças em pacientes submetidos à imunoterapia foi relatado até o momento em três casos. Todos receberam nivolumabe, outro inibidor da PD‐1, e eram masculinos. O tempo de início foi três, nove e 18 meses após o início do ICI. Em contraste com o presente paciente, eles primeiro desenvolveram características de DG e depois de DG e PB.4,5
A ocorrência concomitante de DG e PB em pacientes que não estão recebendo ICI também foi descrita. Em todos eles, a DG precedeu o PB ou surgiu ao mesmo tempo.6,7 Portanto, uma das hipóteses propostas é que o ato de coçar frequentemente em virtude do prurido da DG favorece a destruição celular e, assim, aumenta a exposição a antígenos como o BP320, alterando a resposta imunológica e favorecendo o desenvolvimento do PB.7 Entretanto, isso não explicaria a sequência temporal do presente paciente. Outra hipótese é que ambas as doenças sejam desencadeadas pelo mesmo fator.7 Apesar de não ser possível provar com certeza a causalidade, consideramos que, no presente caso, o desenvolvimento de ambas as entidades foi desencadeado pelo pembrolizumabe, pois foi observado dois a três meses após seu início, foi resolvido após a retirada do ICI e ambas as doenças foram anteriormente associadas com inibidores de PD‐1 (Naranjo Adverse Drug Reaction Probability Scale 4, possível). A concordância de dados clínicos e histopatológicos de ambas as doenças no presente caso e naqueles relatados anteriormente sugere que os mecanismos pelos quais esse medicamento desencadeou ambas as doenças podem estar relacionados entre si.
Ao encontrar lesões cutâneas clínica e histopatologicamente atípicas, deve‐se considerar a possível simultaneidade de duas dermatoses diferentes. Em pacientes com ICI, essa possibilidade é maior, pois foi demonstrada incidência de diversas doenças cutâneas.
Suporte financeiroNenhum.
Contribuição dos autoresElena Lucía Pinto‐Pulido: Obtenção dos dados; revisão da literatura; participação efetiva na orientação da pesquisa; elaboração e redação do manuscrito.
Isabel Polo‐Rodríguez: Obtenção dos dados; revisão da literatura; participação efetiva na orientação da pesquisa; revisão do manuscrito; leitura e aprovação da versão final do manuscrito.
Marta González‐Cañete: Revisão de literatura; participação efetiva na orientação da pesquisa; elaboração e redação do manuscrito; leitura e aprovação da versão final do manuscrito.
Ileana Medina‐Expósito: Obtenção dos dados; revisão da literatura; participação efetiva na orientação da pesquisa; leitura e aprovação da versão final do manuscrito.
María Dolores Vélez‐Velázquez: Obtenção dos dados; revisão da literatura; participação efetiva na orientação da pesquisa; leitura e aprovação da versão final do manuscrito.
Susana Medina‐Montalvo: Obtenção dos dados; revisão da literatura; participação efetiva na orientação da pesquisa; revisão do manuscrito; leitura e aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Pinto‐Pulido EL, Polo‐Rodríguez I, González‐Cañete M, Medina‐Expósito I, Vélez‐Velázquez MD, Medina‐Montalvo S. Association of bullous pemphigoid and Grover disease induced by immune checkpoint therapy. An Bras Dermatol. 2024;99:775–7.
Trabalho realizado no Hospital Universitario Príncipe de Asturias, Universidad de Alcalá, Madri, Espanha.