O emprego crescente das imunoterapias trouxe questões relativas às alterações da resposta imune frente à ocorrência da sífilis em pacientes recebendo essas terapêuticas.
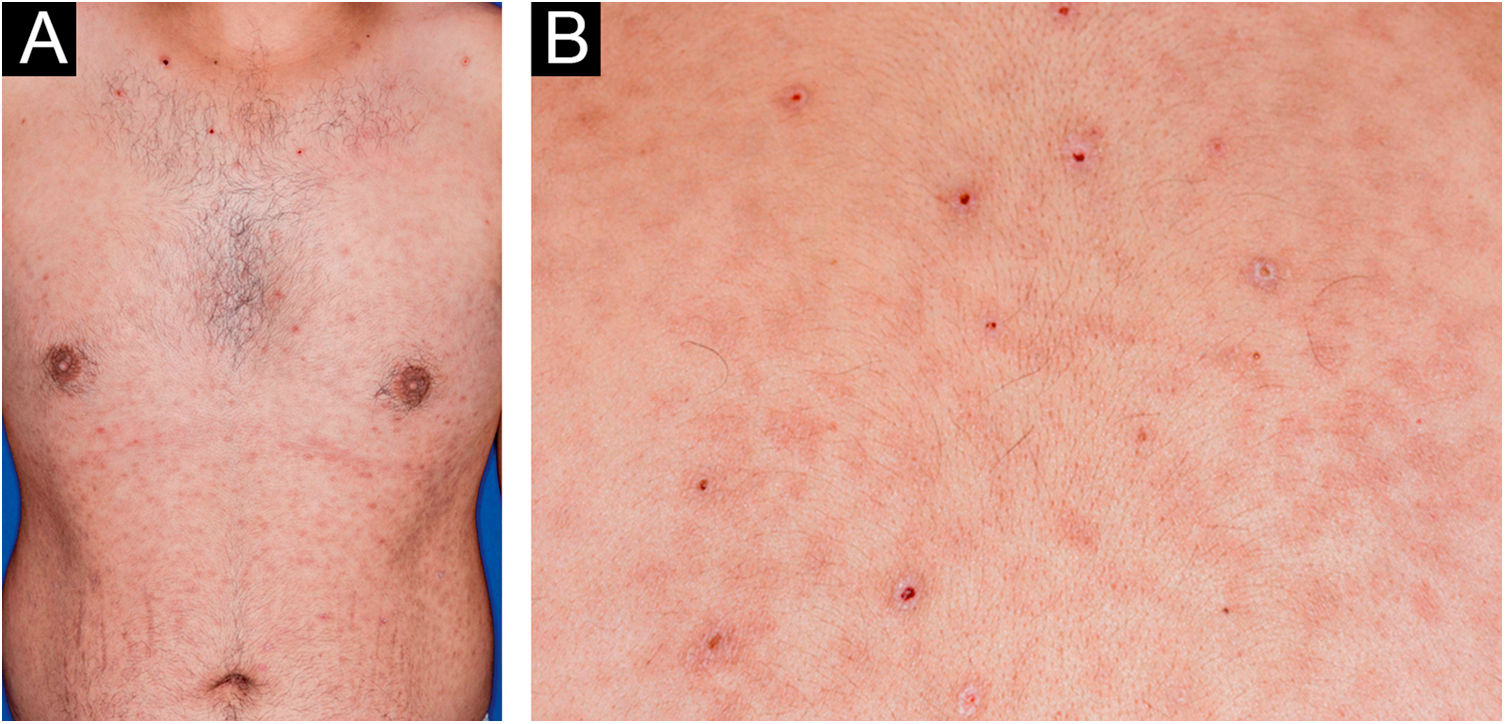
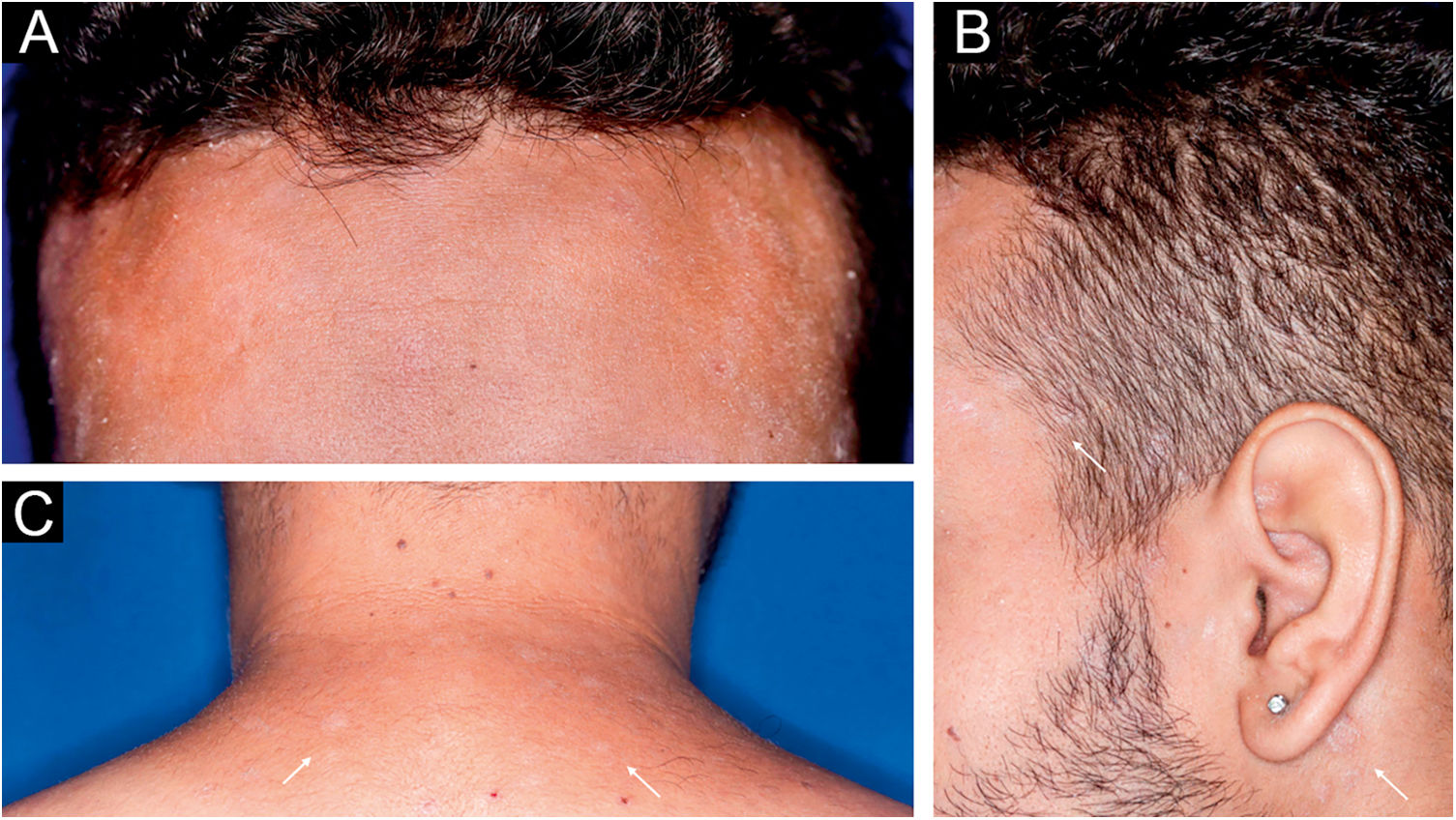
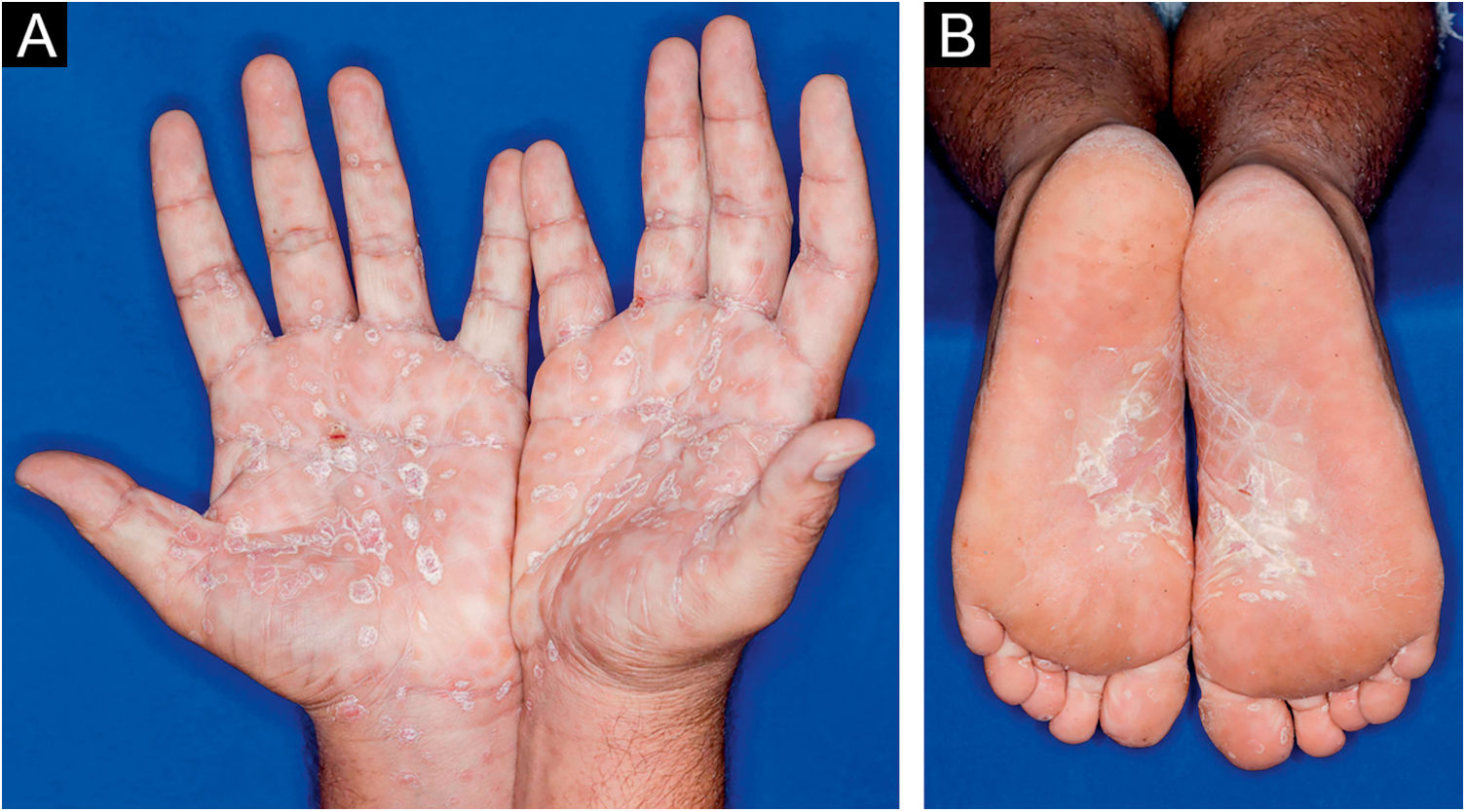
Homem de 22 anos em uso de ocrelizumabe (anti‐CD20) para esclerose múltipla, apresentou erupção cutânea não pruriginosa, e dois episódios febris há 20 dias. Quando foi questionado, referiu lesões descamativas nas mãos; eritema e descamação, sem ulceração na glande, de resolução espontânea, cerca de 4 semanas após relação sexual desprotegida. Ao exame, foram observadas lesões maculopapulares eritematosas‐acobreadas no tronco, algumas com crosta hemática central na parte superior (fig. 1A‐B); lesões finamente descamativas circundando a fronte, regiões temporais, periauriculares e cervical posterior, no formato de coroa (corona veneris) (fig. 2), e com descamação periférica exuberante (colarete de Biett) nas palmas das mãos, plantas dos pés e punhos (fig. 3A‐B). O conjunto dessas manifestações cutâneas e sistêmicas indicaram sífilis secundária. A investigação laboratorial mostrou o teste VDRL (Venereal Disease Research Laboratory) com título sérico baixo (1/2), e negativo no líquor, com hiperproteinorraquia, 56 mg/dL (15‐45 mg/dL); positividade no teste confirmatório de quimioluminescência para anticorpos treponêmicos, e negatividade no teste para o Vírus da Imunodeficiência Humana (HIV). A dosagem de IgM foi reduzida, 24 mg/dL (50‐300 mg/dL), e as de IgA e IgG, normais. Foi indicada penicilina benzatina intramuscular 2,4 milhões de unidades semanais, durante 3 semanas consecutivas, seguida de ceftriaxona endovenosa, 2g diários por 14 dias.
O Treponema pallidum penetra através de microabrasões nas membranas mucosas ou pele, genital ou extragenital, com formação de úlcera indolor com base endurecida (cancro primário). Seis a dez semanas após a infecção primária, a sífilis secundária se manifesta por erupção polimórfica cutânea e/ou mucosa, linfadenopatia e outros sintomas sistêmicos inespecíficos.
Testes sorológicos de triagem não‐treponêmicos (VDRL, RPR ‐ Rapid Test Reagin) e testes confirmatórios treponêmicos (FT‐ABS, TPHA ‐ Treponema Pallidum Hemaglutination Assay, TPPA ‐Treponema Pallidum Particle‐Agglutination assay) são amplamente utilizados para o diagnóstico da sífilis, e o ensaio molecular de PCR e a imunohistoquímica devem ser considerados na investigação de casos atípicos, ou condições em que a resposta humoral e os testes sorológicos possam estar prejudicados.1,2
Ocrelizumabe e rituximabe são anticorpos monoclonais contra o marcador CD20 em linfócitos B. A sua depleção envolve um risco de diminuição dos níveis de imunoglobulinas e, consequentemente, da resposta humoral aos neoantígenos. Após a terapia anti‐CD20, a recuperação das células B é lenta e não uniforme, e as células B de memória podem permanecer depletadas. Comparado ao ocrelizumabe, o rituximabe foi um preditor independente de hipogamaglobulinemia, o que pode reduzir a resposta humoral.1
Prévio relato de paciente tratado com rituximabe para esclerose múltipla e erupção cutânea típica da sífilis secundária, apresentou os testes sorológicos VDRL e TPPA negativos em repetidas dosagens e a soroconversão retardada em mais de 3 semanas após o início dos sintomas e manifestações cutâneas, mas PCR e imunohistoquímica positivas para T. pallidum.2
A redução da resposta humoral resultando em negatividade, soroconversão retardada ou baixa titulação nos testes sorológicos para sífilis deve ser esperada em pacientes sob a terapêutica de classe anti‐CD20. Tais condições podem dificultar o diagnóstico, e as manifestações clínicas tornam‐se cruciais indicadores para a suspeição e a persistência na investigação da sífilis, com testes confirmatórios, imunohistoquímicos ou moleculares, e de um possível envolvimento de outros sistemas.
Em adição aos seis casos da revisão Iglesias‐Plaza,3 foram identificados mais sete casos da ocorrência de sífilis em pacientes sob terapêutica imunobiológica. A maioria de homens (9), entre 16 anos e 66 anos, com psoríase e/ou artrite psoriásica (4), artrite reumatóide (2), artrite idiopática juvenil (1), espondilite anquilosante (1), doença de Chron/retocolite ulcerativa (2) e esclerose múltipla (1), em uso de infliximabe (3), adalimumabe (3), etanercepte (2), ustequinumabe (1), golimumabe (1), tocilizumabe (1), secuquinumabe (1) e rituximabe (1), em acordo com as respectivas indicações. Dentre sete casos investigados (7/13), cinco casos (71,43%) tiveram confirmação de neurossífilis, e três eram sintomáticos. Todos os pacientes sob terapêuticas anti‐TNF apresentaram testes sorológicos positivos, entretanto, a imunossupressão é um fator de risco para o curso acelerado da doença, e potencialmente para a neurossífilis (tabela suplementar 1).3‐8 A confirmação de neurossífilis, sífilis ocular ou otossífilis exige o uso endovenoso da penicilina G cristalina 18 a 24 milhões de unidades por dia, por 10‐14 dias, ou alternativamente ceftriaxona 1g a 2g diários (via intravenosa ou intramuscular) por 10 a 14 dias.9
Estratégias de redução de risco em pacientes imunocomprometidos incluem educação e aconselhamento preventivo para as infecções sexualmente transmissíveis, além das sorologias de triagem e de rotina para o uso de imunobiológicos.
O mimetismo da sífilis pode impor dificuldades para suspeição, ainda, naqueles com imunossupressão pode ocorrer rápida progressão e desafios na comprovação, exigindo investigação e interpretação criteriosas, e o uso de diversos métodos diagnósticos.
Suporte financeiroNenhum.
Contribuição dos autoresLuiz Augusto Fabricio de Melo Garbers: levantamento dos dados, obtenção ou análise e interpretação dos dados; redação e preparação do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica do caso estudado; aprovação final da versão final do manuscrito.
Tissiana Marques de Haes: Levantamento dos dados, obtenção ou análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica do caso estudado; aprovação final da versão final do manuscrito.
Cacilda da Silva Souza: Concepção e o desenho do estudo de caso; levantamento dos dados, obtenção ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual; participação intelectual em conduta propedêutica e/ou terapêutica do caso estudado; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Garbers LAFM, Haes TM, Silva Souza C. Secondary syphilis occurring under anti‐CD20 therapy: risks, progression and approach. An Bras Dermatol. 2024;99:639–41.
Trabalho realizado no Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, SP, Brasil