A alopecia induzida por quimioterapia tem um impacto importante em pacientes com câncer e seu risco de persistência é atualmente uma questão a se considerar nos sobreviventes de câncer. Das várias intervenções propostas para a prevenção da alopecia induzida por quimioterapia, o resfriamento do couro cabeludo surge como uma estratégia eficaz e segura. Este artigo tem como objetivo proporcionar uma visão geral sobre o resfriamento do couro cabeludo e a prevenção da alopecia induzida por quimioterapia.
A alopecia induzida por quimioterapia (AIQ), um dos eventos adversos (EA) imprevisíveis mais relatados na literatura, ocorre em pacientes com câncer e naqueles que sobrevivem1, com uma incidência geral de 65%2. Foi descrita como a condição mais perturbadora do tratamento do câncer pela maioria (88%) das mulheres que receberam quimioterapia perioperatória1. Os pacientes podem recusar a quimioterapia, que pode prolongar a vida, para evitar o desenvolvimento de alopecia1,3,4. Além disso, a AIQ tem uma forte influência sobre como as pessoas percebem os pacientes com câncer, a visibilidade da doença, as relações sociais e a sexualidade1,3,5. Além do comprometimento físico e psicossocial, a AIQ pode ter um impacto financeiro, em decorrência dos gastos com produtos cosméticos caros, como perucas e tratamentos de regeneração capilar6.
Muitas estratégias têm sido testadas para minimizar a AIQ, entre as quais o resfriamento do couro cabeludo, que provou ser o mais eficaz7,8. Devido às publicações recentes sobre sua eficácia e segurança como método preventivo contra a AIQ7–9, esse procedimento tem sido cada vez mais empregado no Brasil e no mundo. As Diretrizes de Prática Clínica em Oncologia da National Comprehensive Cancer Network (NCCN) recentemente passaram a recomendar o tratamento de resfriamento do couro cabeludo para prevenção da AIQ (categoria 2A) para pacientes com câncer de mama10.
O presente artigo tem como objetivo fornecer uma visão geral da AIQ e do resfriamento do couro cabeludo, para que os dermatologistas possam se familiarizar com esses tópicos, que têm se tornado mais comuns na prática clínica.
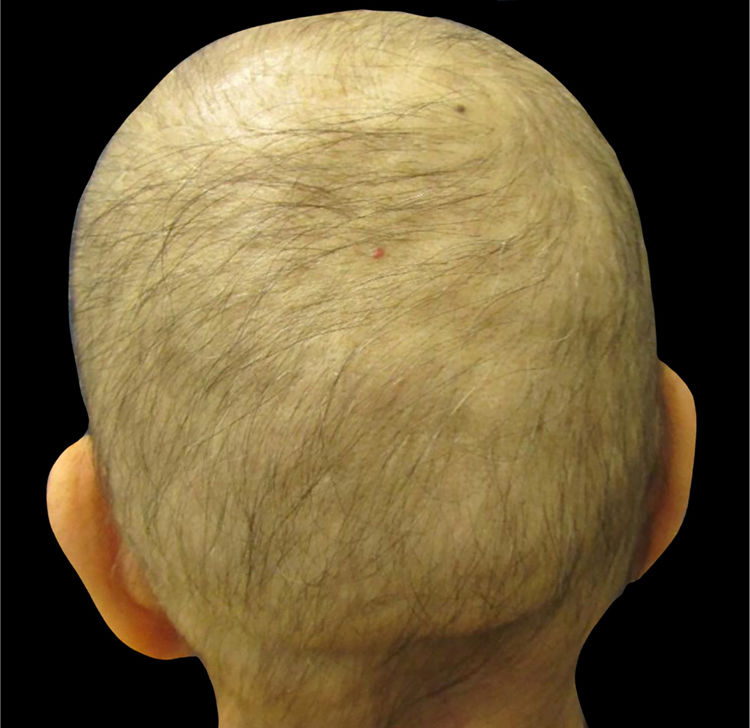
A alopecia induzida por quimioterapiaA maioria dos agentes quimioterápicos são fármacos citotóxicos que afetam as células cancerígenas em proliferação. Outras células em seu ciclo normal de proliferação, por exemplo, as células da matriz dos pelos (na fase anágena 90% do tempo) e da medula óssea, são alvos não intencionais da quimioterapia. Pacientes que recebem, entre outros medicamentos, antraciclinas (como doxorrubicina e epirrubicina), taxanos (como docetaxel e paclitaxel) ou etoposídeo desenvolvem alopecia, geralmente denominada eflúvio anágeno (fig. 1)8,11–14.Clinicamente, a alopecia é mais perceptível no couro cabeludo, que tem a maior densidade de folículos pilosos terminais em fase anágena e geralmente aparece dias ou semanas após o início do tratamento com muitos agentes quimioterápicos14. A interrupção da atividade mitótica do folículo piloso contribui para a fragilidade da porção proximal da haste capilar e, consequentemente, sua ruptura dentro do canal capilar2. Após a interrupção da quimioterapia, na maioria dos casos, o crescimento começa dentro de um a três meses; no entanto, podem ser observadas alterações na textura, cor e/ou espessura13–15. A depender do grau de dano das células‐tronco do folículo piloso, a regeneração capilar pode levar até seis meses após a interrupção da quimioterapia8,14.
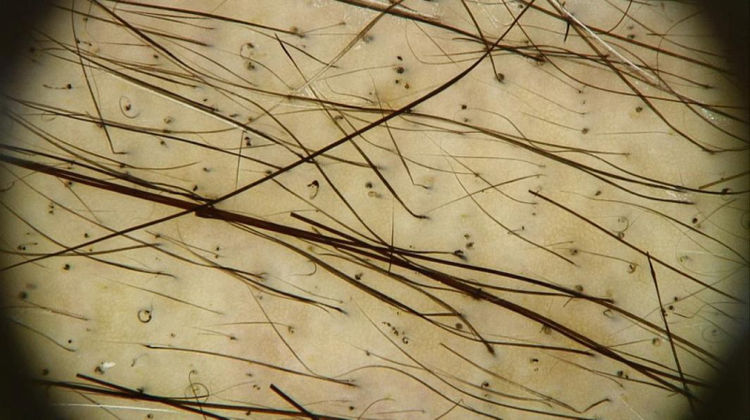
Os achados tricoscópicos da AIQ mostram as alterações sofridas pela haste capilar ao longo da quimioterapia, que varia de acordo com a fase do tratamento. Pelos quebrados, pontos pretos, pelos em forma de chama e constrições de Pohl‐Pinkus podem ser observados nos primeiros meses da quimioterapia. Além disso, pelos regenerados, raros pelos terminais e pelos em círculo são geralmente observados no fim do tratamento (fig. 2)16.
Achados tricoscópicos na região do vértice do couro cabeludo da paciente na Figura 1: múltiplos pontos pretos, pelos em círculo e pelos em regeneração. Poucos pelos terminais, alguns mostram pontos de constrição (Pohl‐Pinkus) em sua extensão, relacionados a ciclos anteriores de quimioterapia (Foto cortesia de Lívia Nicoletti Ariano).
Considerando o tipo de agente quimioterápico, a incidência de AIQ pode variar de 60% a 100% com inibidores da topoisomerase (como irinotecano, etoposídeo, doxorrubicina),> 80% com taxanos (como docetaxel, paclitaxel) e> 60% com agentes alquilantes (como ciclofosfamida, ifosfamida), enquanto antimetabólitos (como 5FU, metotrexato, gencitabina) apresentam menor risco17,18.
Além do tipo de quimioterápico, fatores de risco comuns para AIQ incluem dose, perfil farmacocinético e tratamentos combinados que empregam vários agentes citotóxicos de forma concomitante14. O grau de perda de cabelo também pode variar de acordo com a idade, comorbidades e estado nutricional/hormonal14.
Alopecia induzida por quimioterapia persistente: uma preocupação crescenteEm alguns casos, a perda de cabelo pode ser persistente (AIQ persistente [AIQP]), definida como a ausência ou crescimento subótimo de cabelo que persiste além de seis meses após a interrupção da quimioterapia13. A incidência de AIQP pode variar de 14% em sobreviventes de câncer infantil a 30% em sobreviventes de câncer de mama19. Na década de 1990, os primeiros casos relatados de AIQP ocorreram após regimes de quimioterapia em altas doses (bussulfano e ciclofosfamida) recebidos antes do transplante de medula óssea20. Protocolos de tratamento que combinam radioterapia e quimioterapia com taxano também foram envolvidos na AIQP21. Em uma coorte recente de pacientes com câncer de mama na Ásia, 42% apresentavam AIQP após três anos de conclusão da quimioterapia. O maior risco ocorreu com o uso de taxanos, que parecem ser mais citotóxicos para as células‐tronco do folículo piloso15. Foi relatado um impacto relevante na autoimagem nesses pacientes15,22.
Estratégias para prevenção da alopecia induzida por quimioterapiaConsiderando o impacto em pacientes com câncer, vários medicamentos e procedimentos foram testados para reduzir ou prevenir a AIQ. Um grande número de estudos usou modelos animais, com resultados variáveis e ainda não clinicamente comprovados23–28. Alguns produtos foram testados em seres humanos em pequenos estudos com resultados positivos, mas faltam mais evidências, exceto o resfriamento do couro cabeludo, cuja segurança e eficácia têm sido frequentemente descritas nos últimos anos (tabela 1). Alguns medicamentos tópicos, como minoxidil ou bimatoprosta, mostraram‐se eficazes na estimulação da regeneração capilar após a quimioterapia, sem efeito preventivo na AIQ29–44. Desde a década de 1970, várias técnicas de resfriamento do couro cabeludo – como bolsas de criogel, toucas de resfriamento e máquinas de resfriamento – têm sido usadas para a prevenção da AIQ12,25–28. As toucas de resfriamento (por exemplo, Elasto‐gel, Penguin) e as máquinas de resfriamento eletrônico (por exemplo, Paxman, Dignitana) são as mais usadas em todo o mundo.
Estratégias preventivas para alopecia induzida por quimioterapia em modelos animais e em ensaios em humanos
| Estudado em modelos animais | Estudado em ensaios em humanos: não eficaz | Estudado em ensaios em humanos: eficaz |
|---|---|---|
| Antidoxorrubicina29 | Minoxidil tópico23 | AS101a30 |
| Epinefrina tópica e norepinefrina31 | Ligantes do receptor de hormônio paratireoide (PPR)32 | Resfriamento do couro cabeludo9,33,34 |
| N‐acetilcisteína tópica35 | Torniquete de couro cabeludo36 | |
| Antioxidantes tópicos (resveratrol, aminotiol)31 | Calcitriol tópico37 | |
| Ciclosporina A tópica38 | DHL‐HisZnNA39 | |
| Imunomoduladores (Il‐1,40 imuvert41) | ||
| FCF ácido, EGF40 | ||
| Inibidores da CDK242 | ||
| Inibidores da caspase‐343 | ||
| Quelante de ferro multialvo M3044 |
No Brasil, três dispositivos foram aprovados pela Agência Nacional de Vigilância Sanitária (Anvisa) para o resfriamento do couro cabeludo durante a quimioterapia: Elasto‐gel, Paxman e Capelli. Este último é um dispositivo fabricado no Brasil, usa ar frio, e cujos estudos sobre sua eficácia estão prestes a ser publicados.
Mecanismo de atuaçãoOs efeitos benéficos do resfriamento do couro cabeludo são causados por vasoconstrição na pele, diminuição da taxa metabólica intrafolicular e diminuição da captação de medicamentos foliculares, o que, em teoria, reduz a exposição folicular aos efeitos citotóxicos nocivos em suas concentrações plasmáticas máximas3,11,45–48.
EficáciaA eficácia do resfriamento do couro cabeludo foi recentemente confirmada por Nangia et al. em um estudo controlado randomizado com pacientes com câncer de mama em estágio inicial que receberam pelo menos quatro ciclos de quimioterapia à base de taxano e/ou antraciclina. O grupo experimental usou o equipamento Paxman para resfriamento do couro cabeludo, iniciado 30 minutos antes da infusão da quimioterapia e mantido durante toda a infusão e por mais 90 minutos após a infusão. No grupo de resfriamento do couro cabeludo, foi relatado sucesso em 50,5% das mulheres (50,5%; IC95% 40,7%‐60,4%) em comparação com 0% no grupo controle (0%; IC95% 0%‐7,6%)9. Em recente revisão sistemática e metanálise, que incluiu dez ensaios clínicos randomizados (dois com o equipamento Paxman e os outros com toucas ou bolsa de criogel), Rugo et al. endossaram o efeito positivo do resfriamento do couro cabeludo na redução da AIQ em pacientes com tumores sólidos (RR=0,54; IC95% 0,46±0,63; I2¼=11%; p <0,00001)7. Shah et al. analisaram ensaios clínicos controlados e randomizados (CCT e ECR, respectivamente) e avaliaram a hipotermia do couro cabeludo para prevenção da AIQ, com redução na incidência de AIQ de 2,7 (na CCT) e de 3,9 vezes (na ECR) em pacientes submetidos a resfriamento do couro cabeludo. Essa revisão incluiu 18 ensaios com diferentes técnicas de resfriamento do couro cabeludo – variou de toucas de resfriamento mais antigas e menos complexas a máquinas controladas digitalmente49. Os equipamentos de refrigeração do couro cabeludo da Paxman e Dignitana foram aprovados pela Food and Drug Administration (FDA) e foram incorporadas às diretrizes da NCCN para pacientes com câncer de mama.
Tempo de resfriamento pré‐ e pós‐infusãoA duração do resfriamento do couro cabeludo parece ser um fator influente na preservação dos cabelos50. O resfriamento geralmente é iniciado 30 minutos antes da infusão (tempo de pré‐resfriamento [TPR]), para que a temperatura da pele do couro cabeludo atinja seu ponto mais baixo no momento em que o medicamento entra nos folículos pilosos. Durante o resfriamento do couro cabeludo, a temperatura intradérmica ou subcutânea do couro cabeludo tende a ficar em média em torno de 22°C, que é a temperatura‐alvo sugerida por Gregory et al.51 No entanto, por razões desconhecidas, o nível de redução da temperatura do couro cabeludo pode variar de um paciente para outro. Pode ser devido a diferenças na ação isolante das estruturas do couro cabeludo (cabelos, derme e tecido subcutâneo), dissipação de calor, anatomia do crânio e reação térmica reflexa à vasoconstrição. Aqueles com temperatura intradérmica do couro cabeludo menor do que 18°C têm maior probabilidade de ter melhor proteção capilar com o resfriamento do couro cabeludo49,52.
O procedimento de resfriamento é mantido durante a infusão da quimioterapia e por um certo período após o término (tempo de resfriamento pós‐infusão [TRPI]), dependendo do protocolo de quimioterapia.
Alguns estudos que envolveram toucas de resfriamento relataram que elas foram incapazes de manter baixas temperaturas por todo o período planejado para o tratamento. Por isso, foi sugerido que as toucas fossem trocadas três a quatro vezes, ou a cada 25 minutos, durante a infusão da quimioterapia e durante o TRPI, para garantir uma temperatura estável48. Por outro lado, as máquinas de resfriamento com gerenciamento de termostato mantêm uma temperatura estável e requerem menos intervenções da enfermagem18.
Até o momento, a duração exata do TRPI não foi estimada. Idealmente, o TRPI deve considerar a farmacocinética da exposição ao agente citotóxico e/ou seus metabólitos ativos, que correspondem às concentrações plasmáticas máximas, meia‐vida do medicamento e interações potenciais28,50. Considerando os pacientes tratados com protocolos de docetaxel, TRPIs de 90’ e 45’ apresentaram resultados semelhantes na prevenção da queda de cabelos (79% vs. 95% dos pacientes com sucesso, respectivamente; p=0,04)53. Komen et al. estudaram TRPIs de 20 ‘e 45’, também em pacientes que tomavam docetaxel, com taxas comparáveis de retenção dos cabelos (73% vs. 79% dos pacientes com sucesso, respectivamente; p=0,5)54. Em protocolos de tratamento com antraciclina, TRPIs de 90’ ou mais são frequentemente usados; no entanto, prolongar o TRPI não mostrou redução na necessidade de cobertura do couro cabeludo55. Mais estudos são necessários para determinar a TRPI mais eficaz para cada protocolo de quimioterapia.
Resultados da avaliação da queda de cabelos e do resfriamento do couro cabeludoOs Critérios Comuns para Terminologia de Eventos Adversos (CCTEA) são amplamente usados em oncologia para sistematizar os EA do tratamento do câncer. De acordo com o CCTEA v. 5.0, a alopecia grau 1 corresponde à perda de menos de 50% dos cabelos, não exige o uso de peruca ou implante; na alopecia grau 2, a queda de cabelos é superior a 50% e é necessário o uso de peruca ou lenço56. A escala de Dean modificada para queda de cabelos também é usada para quantificar a gravidade da AIQ (grau 0: sem perda de cabelos; grau 1: 0 a ≤ 25% de perda de cabelos; grau 2:> 25% a ≤ 50% de perda de cabelos; grau 3:> 50 a ≤ 75% de perda de cabelo; grau 4:> 75% de perda de cabelos). Na literatura, o resfriamento do couro cabeludo é geralmente considerado bem‐sucedido quando a alopecia é inferior a 50% (CCTEA v. 5.0, grau 0 ou 1; escala modificada de Dean, grau 0.1 ou 2)9,34,57.
Fatores que influenciam o sucesso do resfriamento do couro cabeludoO sucesso do resfriamento do couro cabeludo pode variar de acordo com o quimioterápico, a dose e a combinação, além da temperatura alcançada no couro cabeludo, duração do resfriamento e ajuste adequado da touca33,48,58. Na literatura, há variabilidade nas taxas de sucesso do resfriamento do couro cabeludo para o mesmo protocolo e dose de quimioterapia. Devem‐se considerar o desenho do estudo, características da população, técnica aplicada, TPR/TRPI, escala de avaliação de queda de cabelos e os critérios de sucesso selecionados. Em um estudo do registro holandês com 1.411 pacientes no qual o resfriamento do couro cabeludo foi feito com o equipamento Paxman, os protocolos com baixa dose de docetaxel (75mg/m2) e paclitaxel (70‐90mg/m2) apresentaram melhores taxas de sucesso com o resfriamento do couro cabeludo (94% e 81%, respectivamente). Já entre os pacientes tratados com antraciclina e ciclofosfamida, a taxa de sucesso foi de 39%33. Rugo et al. relataram sucesso em 66,3% dos pacientes que receberam taxanos com resfriamento do couro cabeludo com o equipamento Dignitana34. Nangia et al. relataram que pacientes submetidos ao resfriamento do couro cabeludo com o equipamento Paxman em protocolos baseados em taxano apresentaram maior probabilidade de taxas mais altas de preservação dos cabelos (sucesso de 59%; paclitaxel usado semanalmente é mais eficaz que docetaxel usado a cada três semanas) do que quimioterapia à base de antraciclina (taxa de sucesso de 16%)9.
Resfriamento do couro cabeludo e metástases cutâneas na pele do couro cabeludoDesde os primeiros relatos de estudos de resfriamento do couro cabeludo, foram levantadas preocupações de segurança com relação à possibilidade da quimioterapia não tratar suficientemente as metástases subclínicas preexistentes da pele do couro cabeludo59. A incidência de metástases em pacientes com câncer de mama submetidas a resfriamento do couro cabeludo parece ser inferior a 1,1%, o que é comparável com as taxas (0,03% a 3%) relatadas em pacientes com câncer de mama tratadas sem resfriamento do couro cabeludo46,60. Em um estudo que envolveu 442 pacientes em uso de touca de resfriamento, a incidência geral de metástases na pele do couro cabeludo foi de 0,45% (2/442), foi observada em 0,88% (2/227) das pacientes com câncer de mama59. Taxas baixas semelhantes de metástases cutâneas no couro cabeludo (7/640, 1,1%) também foram observadas em um estudo de coorte retrospectivo de mulheres com câncer de mama, no qual a maioria (86,4%) havia sido submetida a resfriamento do couro cabeludo em algum momento durante o tratamento. É importante ressaltar que em nenhum dos casos as metástases no couro cabeludo se manifestaram como o primeiro local isolado de recorrência – mulheres que apresentavam alto risco de recorrência do câncer de mama, como as em estágio III, eram mais propensas a ter metástases no couro cabeludo, além de outros órgãos61. Embora sejam necessárias pesquisas adicionais com seguimento mais longo para estabelecer uma associação clara, os dados disponíveis indicam que não há risco aumentado de um desfecho ruim com o resfriamento do couro cabeludo em pacientes com câncer de mama7,62.
Também foi relatada regressão das metástases cutâneas do couro cabeludo, apesar do resfriamento do couro cabeludo (dois casos). Tal achado sugere que a distribuição da quimioterapia nesses locais não é completamente interrompida59,63. No entanto, em pacientes com neoplasias malignas de células sanguíneas que apresentam células cancerígenas em todo o corpo (por exemplo, leucemia, linfoma), o resfriamento do couro cabeludo não é recomendado no momento46,64. Witman et al. relataram um caso de micose fungoide que desapareceu com a quimioterapia de consolidação, mas recorreu no couro cabeludo64. Outro caso de recidiva foi descrito em um paciente do sexo masculino de 17 anos cuja leucemia mieloblástica aguda se manifestou com vários nódulos subcutâneos no couro cabeludo, mas sem evidência de recidiva hematológica sete anos após o uso do resfriamento do couro cabeludo durante seus dois cursos de quimioterapia65.
Eventos adversos e contraindicações para o resfriamento do couro cabeludoO resfriamento do couro cabeludo demonstrou ser um tratamento de suporte bem tolerado49,66. Os EA mais comumente relatados são de baixo grau e incluem dores de cabeça, náuseas, tonturas, queixa de friagem e claustrofobia. A queimadura por congelamento foi relatada em alguns casos com touca de resfriamento, que geralmente estão abaixo de ‐25°C antes de ser aplicadas na cabeça do paciente; nenhum caso foi relatado com os equipamentos de refriamento9,33,50,58,67,68. As áreas sem pelos (por exemplo, fronte, orelhas, zonas de alopecia no couro cabeludo) devem ser protegidas durante o resfriamento do couro cabeludo com um curativo simples.
O resfriamento do couro cabeludo não é indicado para pacientes com doença de aglutinina do frio, crioglobulinemia, criofibrinogenemia ou sensibilidade ao frio50. Não é recomendado para pacientes com neoplasias hematológicas, com maior risco de metástases cutâneas.
Resfriamento do couro cabeludo e impacto na qualidade de vida e no bem‐estarEmbora o uso do resfriamento do couro cabeludo esteja cada vez mais difundido na prevenção da AIQ, há estudos que mostram evidências inconsistentes de melhoria na qualidade de vida (QV) dos pacientes, devido a avaliações não específicas da QV (a maioria dos estudos usou EORTC QLQ‐C30 e ‐BR23), diferenças nos métodos e resultados que relatam a QV e os custos e encargos financeiros globais do resfriamento do couro cabeludo47. Quando o resfriamento do couro cabeludo não funciona conforme o esperado, o impacto na QV é pior do que o observado nos controles, ou seja, pacientes que não usam o resfriamento do couro cabeludo33. Portanto, um instrumento adequado para avaliação da QV ainda está sendo buscado. Em um dos primeiros estudos prospectivos multicêntricos projetados para investigar o impacto no bem‐estar em pacientes com câncer de mama submetidos ao resfriamento do couro cabeludo (98/266), 52% das pacientes submetidas a um procedimento eficaz relataram maior bem‐estar quando comparadas às pacientes nos quais o procedimento não foi eficaz69.
Considerações finaisO resfriamento do couro cabeludo é uma opção aprovada e geralmente bem tolerada para prevenir a AIQ e pode minimizar a carga do tratamento do câncer e possíveis prejuízos na QV e no bem‐estar psicossocial dos pacientes. Embora o método de resfriamento do couro cabeludo possa não ser decisivo, é essencial manter baixas temperaturas estáveis na pele do couro cabeludo. Pacientes que recebem protocolos à base de antraciclina têm taxas mais baixas de retenção dos cabelos em comparação com quimioterapias à base de taxano. Pacientes com neoplasias hematológicas e doenças precipitadas pelo frio não devem ser submetidos à terapia de resfriamento do couro cabeludo. O resfriamento do couro cabeludo não parece aumentar o risco de metástases cutâneas no couro cabeludo em pacientes com câncer de mama em estágio inicial, nem parece comprometer o desfecho do câncer, embora sejam necessários estudos de seguimento a longo prazo.
Suporte financeiroNenhum.
Contribuição dos autoresGiselle de Barros Silva: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; redação e edição do manuscrito; coleta, análise e interpretação de dados; participação no desenho do estudo; revisão crítica da literatura; revisão crítica do manuscrito.
Kathryn Ciccolini Hernandez: Aprovação da versão final do manuscrito; redação e edição do manuscrito; participação no desenho do estudo; revisão crítica do manuscrito.
Aline Donati: Aprovação da versão final do manuscrito; revisão crítica do manuscrito.
Corina van den Hurk: Aprovação da versão final do manuscrito; revisão crítica do manuscrito.
Conflitos de interesseNenhum.