Atezolizumabe (ATZ) e bevacizumabe (BVZ) são utilizados na imunoterapia de alguns tumores avançados.1,2 ATZ é um inibidor de checkpoint imune, antagonista de PDL1, expressa nas células tumorais que possibilita tanto a evasão das células tumorais do sistema imune quanto a redução na proliferação de células‐T.1 Essa classe pode causar diversos efeitos adversos cutâneos, principalmente imunomediados, como dermatoses neutrofílicas, bolhosas e vitiligo.1 BVZ é um anti‐VEGF; portanto, com ação antiangiogênica,2 e também estão descritos efeitos colaterais cutâneos, como exantema e dificuldade na cicatrização tecidual.3
Apresentamos evento adverso cutâneo raro, a psoríase pustulosa, após início da associação terapêutica acima.
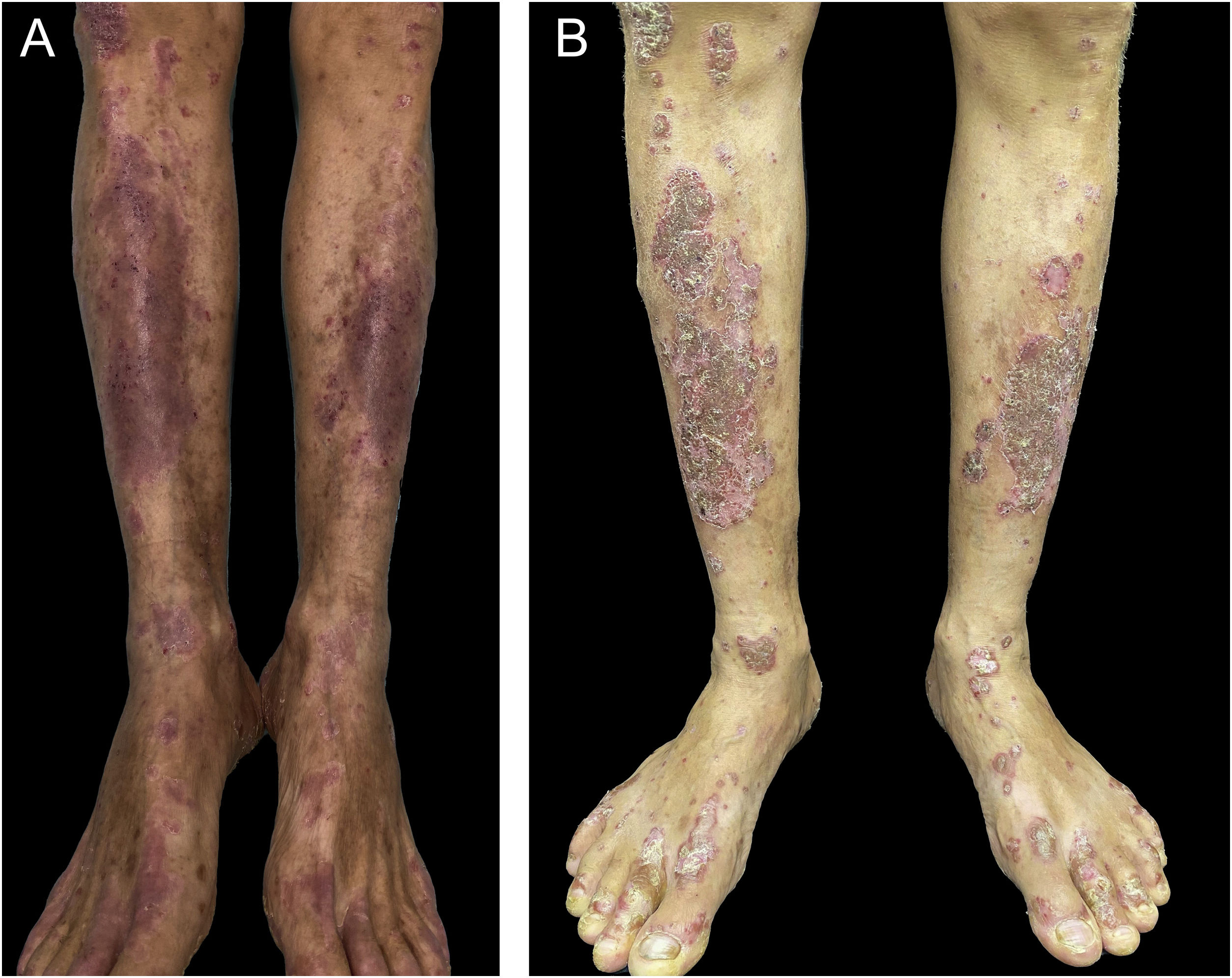
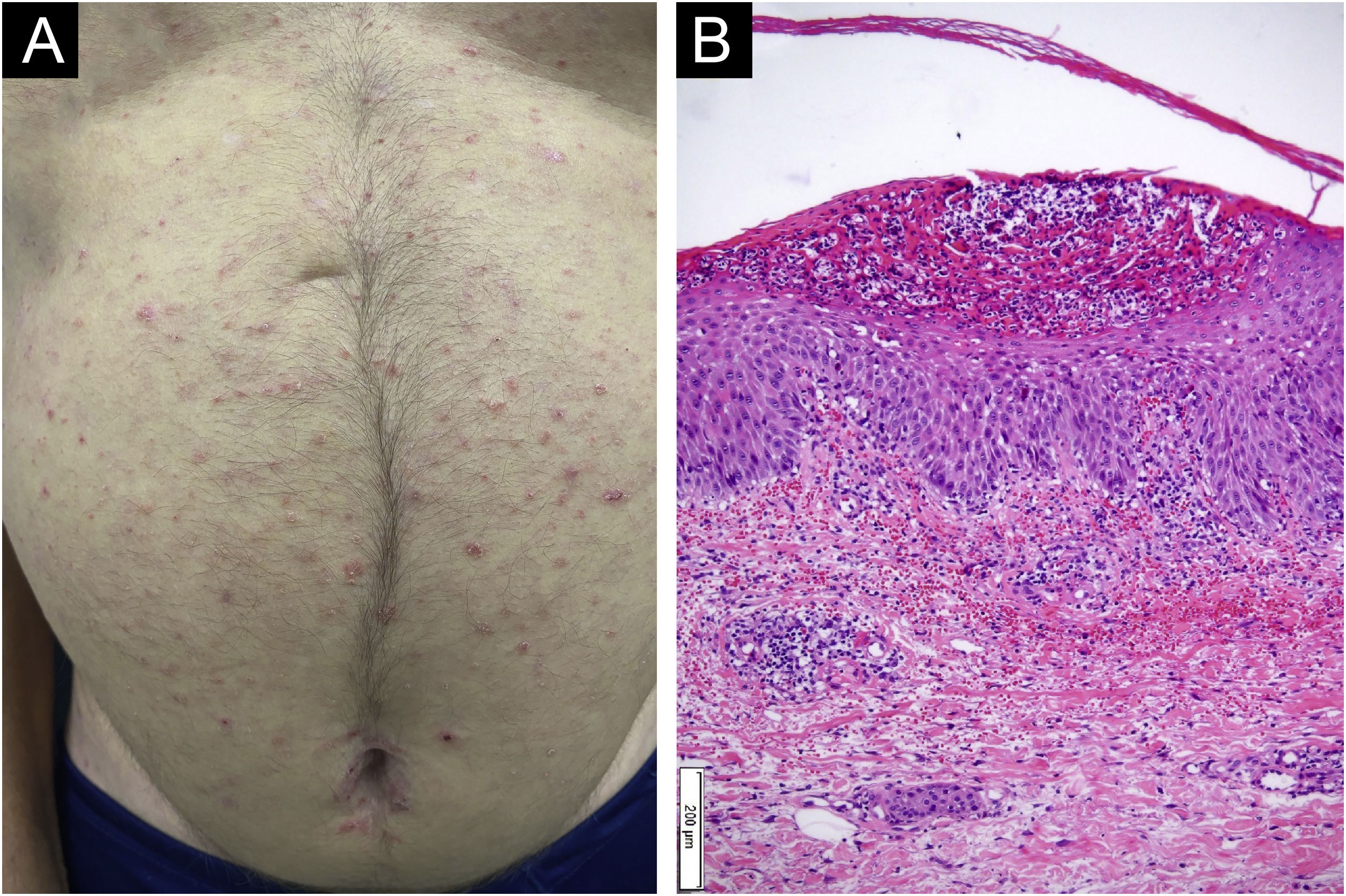
Paciente do sexo masculino, 55 anos, com história de psoríase leve com controle apenas com tópicos, iniciou com placas eritematoescamosas com pústulas em dorso de mãos, cotovelos, pernas e pés após iniciar terapia com ATZ+BVZ para hepatocarcinoma. A administração dessas medicações ocorria a cada 21 dias, infundidas no mesmo dia. Durante o acompanhamento, houve supressão da infusão em virtude de internação por quadro gripal. Na ocasião, houve melhora rápida das lesões, em quatro semanas (fig. 1A). Após esse período, as infusões foram retomadas e houve recidiva da psoríase (fig. 1B), reforçando a associação do quadro cutâneo com os fármacos. A apresentação do paciente, na forma de placas eritematoescamosas com pústulas (fig. 2) e generalização das pústulas para tronco (fig. 3A), associada ao anatomopatológico (fig. 3B) com pústulas intraepidérmicas e infiltrado psoriasiforme, possibilitou o diagnóstico de agudização psoriásica, sob forma de psoríase pustulosa, desencadeada pela imunoterapia antineoplásica. O caso constituiu desafio terapêutico, visto que o paciente é portador de hepatocarcinoma desenvolvido em vigência de cirrose por hepatite C crônica. Portanto, apresenta contraindicação ao uso de fármacos como acitretina e metotrexato, pelo risco de toxicidade hepática grave (incluindo estado de insuficiência), e ao uso de anti‐TNF diante do diagnóstico de hepatite C. Além disso, o paciente desenvolveu artrite em interfalangeanas, reforçando a escolha por terapêutica sistêmica. Considerando‐se essas limitações, optou‐se por inibidor de interleucina (IL), o ustekinumabe (anti‐IL 12/23).
Interessante ressaltar que há relatos de melhora de psoríase com o uso de BVZ.4,5 Sabe‐se que a proliferação vascular na derme papilar tem importante papel na fisiopatologia da psoríase.2 Ademais, constatou‐se que os níveis de VEGF são maiores nas lesões psoriásicas, quando se compara com pele sadia. Também se observou que os níveis plasmáticos do fator são maiores nos pacientes com psoríase do que nos hígidos.2
Por outro lado, o ATZ parece induzir estado pró‐inflamatório, ocorrendo mudança no perfil de citocinas, com aumento de TNF‐α e IL‐17, o que justificaria surgimento ou piora de quadros de psoríase.1 As alterações cutâneas com o ATZ geralmente ocorrem dentro de cinco a nove semanas após seu início.1 Neste caso, ocorreu piora da psoríase nove semanas após iniciar a terapêutica, em concordância com a literatura. Foram descritas exacerbações de psoríase sob as apresentações gutata, invertida e palmoplantar com o uso de ATZ.1 Portanto, o caso destaca‐se pela combinação relacionada com erupção e também pela apresentação incomum, na forma pustulosa.
Suporte financeiroNenhum.
Contribuição dos autoresMariani Magnus Andrade: Levantamento de dados; análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; revisão crítica de literatura.
Guilherme Ladwig Tejada: Levantamento de dados; análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; revisão crítica de literatura.
Juliano Peruzzo: Análise e interpretação dos dados; revisão crítica do conteúdo intelectual importante; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica de literatura.
Renan Rangel Bonamigo: Análise e interpretação dos dados; revisão crítica do conteúdo intelectual importante; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica de literatura.
Conflito de interessesNenhum.
Como citar este artigo: Andrade MML, Tejada GL, Peruzzo J, Bonamigo RR. Pustular psoriasis triggered by therapy with atezolizumab and bevacizumab. An Bras Dermatol. 2024;99:153–5.
Trabalho realizado no Hospital de Clínicas de Porto Alegre, Porto Alegre, RS, Brasil.