O vitiligo é a mais comum das desordens pigmentares, considerado doença crônica, cumulativa e multifatorial. Em sua patogênese, tem sido demonstrado o papel crucial dos linfócitos TCD8+ citotóxicos e do eixo IFNγ/CXCL10.
ObjetivoAvaliar o perfil clínico e os marcadores imunoinflamatórios nos pacientes com vitiligo em um serviço de referência.
MétodosEstudo de corte transversal no qual foram avaliados todos os pacientes com vitiligo do serviço no período de 2019 a 2022, para traçar o perfil clínico. Além disso, foram dosados biomarcadores de risco cardiovascular (relação neutrófilo/linfócito e proteína C reativa), assim como citocinas e quimiocinas (TNFα, IFNγ, IL‐10, IL‐15 e CXCL10) no soro de um subgrupo de 30 pacientes.
ResultadosEntre os pacientes, houve predomínio do sexo feminino, com média de idade de 43 anos. A maioria apresentou fototipos IV ou V (71,3%), sem comorbidades (77,55%) e sem histórico familiar de vitiligo (70,41%). Níveis mais elevados da relação neutrófilo/linfócito, proteína C reativa e citocinas/quimiocinas inflamatórias foram documentados nos pacientes com vitiligo em comparação com o grupo controle (não significante). Como dado relevante, os maiores valores de CXCL10 foram detectados nos pacientes com vitiligo em comparação com os controles, assim como nos pacientes com menor tempo de doença (p<0,05).
Limitações do estudoO número de pacientes avaliados foi reduzido em virtude das dificuldades de recrutamento decorrentes da pandemia de COVID‐19.
ConclusãoNossos dados contribuem para confirmar o papel relevante do eixo IFNγ/CXCL10 na patogênese do vitiligo, destacando o CXCL10 como possível marcador de atividade.
O vitiligo acomete 0,5% a 2% da população mundial e tem como evento‐chave a destruição dos melanócitos na pele lesada. A média de idade do surgimento é de 20 anos; 95% dos casos costumam ocorrer antes dos 40 anos de idade.1–3
A patogênese do vitiligo tem como principais hipóteses as teorias neural, autoimune e do estresse oxidativo. Nenhuma dessas teorias, de maneira isolada, consegue explicar a doença em sua totalidade.4 O vitiligo vem sendo descrito como doença autoimune com fatores genéticos e ambientais, em associação com fatores metabólicos e oxidativos. O mais provável é que haja uma soma dos fatores de maneira heterogênea, contribuindo para as diferentes apresentações.5
O vitiligo caracteriza‐se clinicamente pela despigmentação da pele e dos folículos pilosos; é comum o surgimento em áreas de trauma (fenômeno de Koebner).6 Em geral, a doença poupa os melanócitos residentes dentro do folículo piloso em virtude do do contexto imunológico nesse local, semelhante a outros locais que contêm melanócitos, como cérebro, olhos e ouvido interno. Áreas com pelos brancos ou sem pelos apresentam maior dificuldade de recuperação.7
O vitiligo pode ser classificado em segmentar e não segmentar.2 Os segmentares costumam surgir na infância e caracterizam‐se por manchas acrômicas unilaterais em padrões lineares ou em blocos, com leucotriquia precoce e pouca resposta aos tratamentos.5,6,8,9 As formas não segmentares podem ser localizadas, generalizadas, universais e mistas. As localizadas são subdivididas em focais e mucosos. O vitiligo focal é caracterizado por uma pequena mancha acrômica (10–15 cm2); o vitiligo mucoso ocorre quando pelo menos um local de acometimento é a mucosa oral ou genital. As variantes acrofaciais são formas localizadas mais resistentes aos tratamentos. As formas generalizadas apresentam máculas acrômicas em diversas partes do corpo (área corporal acometida <80%) e, nas formas universais, há despigmentação completa ou quase completa da pele (acometimento >80% da área corporal). A forma mista pode apresentar lesões compatíveis com vitiligo segmentar e não segmentar.2,6
O impacto psicológico é importante;10,11 a ansiedade é um sintoma comum, o que afeta a vida social e sexual desses pacientes.1 Embora se trate de doença com acometimento predominantemente cutâneo, novos estudos mostram envolvimento sistêmico com maior frequência de resistência à insulina, síndrome metabólica, doenças cardiovasculares e autoimunes.11‐14
Estudos recentes têm salentado o papel das quimiocinas inflamatórias como CXCL9, CXCL10 e CXCL12.15,16 Essas quimiocinas estão relacionadas com a resposta Th1, e se mostraram importantes no processo de recrutamento e ativação dos linfócitos TCD8+ citotóxicos.17,18 Nos tecidos inflamados, os linfócitos otimizam a produção de interferona gama (IFNγ) e de fator de necrose tumoral alfa (TNFα), que, por sua vez, estimulam a secreção de CXCL10. Essa quimiocina se liga ao seu receptor nas células (CXCR3) e desencadeia uma cascata inflamatória com ativação e maior recrutamento de linfócitos T, contribuindo para a destruição dos melanócitos. A CXCL10 também está aumentada em outras doenças autoimunes, como líquen escleroso e atrófico, tireoidite autoimune, doença de Graves, alopecia areata e artrite reumatiide.19
A teoria autoimune vem sendo reforçada pelos seguintes achados mais recentes:13,14 1) os linfócitos T CD8+ e o eixo da IFNγ parecem desempenhar papel crucial na inibição da melanogênese e na indução da apoptose dos melanócitos;20 e 2) quimiocinas como CXCL10 podem exercer papel na progressão e manutenção do vitiligo.21
No entanto, ainda existem muitas lacunas com relação a parâmetros imunológicos e inflamatórios que possibilitem melhor entendimento de sua patogênese e o desenvolvimento de estratégias terapêuticas mais eficazes.
MétodosEstudo de corte transversal com portadores de vitiligo do serviço de dermatologia, com o objetivo de avaliar perfil clínico, citocinas e parâmetros inflamatórios. Para a caracterização do perfil clínico, foram avaliados, entre fevereiro de 2019 e janeiro de 2022, todos os pacientes entre 18 e 60 anos cadastrados (total de 98). O banco de dados de pacientes incluiu informações sobre identificação, dados da doença (tempo de surgimento, histórico pessoal ou familiar de vitiligo ou outras doenças autoimunes, tratamentos prévios), tipo de vitiligo, extensão da doença e tratamentos prescritos. Para a avaliação dos parâmetros inflamatórios e imunológicos, foram recrutados 30 pacientes no período de março de 2021 a janeiro de 2022. A seleção foi realizada por demanda espontânea de pacientes que compareciam ao serviço e que estavam cadastrados previamente no banco de dados, de maneira aleatória e sob consentimento.
Avaliação clínicaOs pacientes foram avaliados por um único dermatologista, que classificou a forma clínica do vitiligo, assim como a extensão da doença, de acordo com o Vitiligo Extent Tensity Index (VETI).22 Cálculo do VETI: (porcentagem de envolvimento da cabeça × estágio de despigmentação) + (porcentagem de envolvimento do tronco × estágio de despigmentação) 4 + (porcentagem de envolvimento dos MMSS × estágio de despigmentação) 2 + (porcentagem de envolvimento dos MMII × estágio de despigmentação) 4 + (porcentagem de envolvimento da genitália × estágio de despigmentação) 0,1. O valor máximo do VETI é de 55,5.
Avaliação laboratorialOs dados do hemograma e de proteína C reativa (PCR) do subgrupo de 30 pacientes foram obtidos do prontuário da última consulta, com o prazo de no máximo três meses antes da dosagem de citocinas/quimiocinas. A razão neutrófilo linfócito (RNL) foi calculada por meio da divisão do número absoluto de neutrófilos pelo de linfócitos, obtidos do hemograma. Foram dosadas as citocinas e quimiocinas de 10 controles saudáveis, como grupo de comparação.
Para dosagem de citocinas/quimiocinas (TNFα, IFNγ, IL10, IL15, CXCL10) foram coletados 10mL de sangue processados pela técnica de ELISA. Para todas as aferições, foram usados os kits BD Bioscience (BD OptEIATM Set). Os resultados foram calculados no programa InStat (GraphPad, San Diego, CA, EUA) e expressos em pg/mL. Foram excluídos pacientes que se recusaram a participar do estudo, portadores de doenças virais ou bacterianas em atividade, uso de terapia imunossupressora sistêmica nos últimos 30 dias e portadores de outras doenças autoimunes, como tireoidopatias, artrite reumatoide e lúpus eritematoso sistêmico.
Análise estatísticaOs dados clínicos e laboratoriais foram analisados pelo software livre R (R version 4.1.1 [2021‐08‐10]). O valor de p foi considerado significante quando <0,05. As variáveis quantitativas foram resumidas em tabelas descritivas utilizando média e desvio‐padrão. Para comparação das variáveis entre os grupos, foram utilizados os testes Anova de uma via e o teste t de Student para as variáveis categóricas que seguiam a distribuição normal. Para comparação das variáveis categóricas que não seguiram o padrão da normalidade, foram utilizados os testes de Kruskal Wallis e de Mann Whitney. A correlação de Spearman foi usada para comparação das variáveis quantitativas intervalares que não seguiram esse padrão.
Aspectos éticosO estudo foi conduzido de acordo com as diretrizes da Resolução 466/2012, tendo aprovação do Comitê de Ética e Pesquisa (parecer n° 4.886.709).
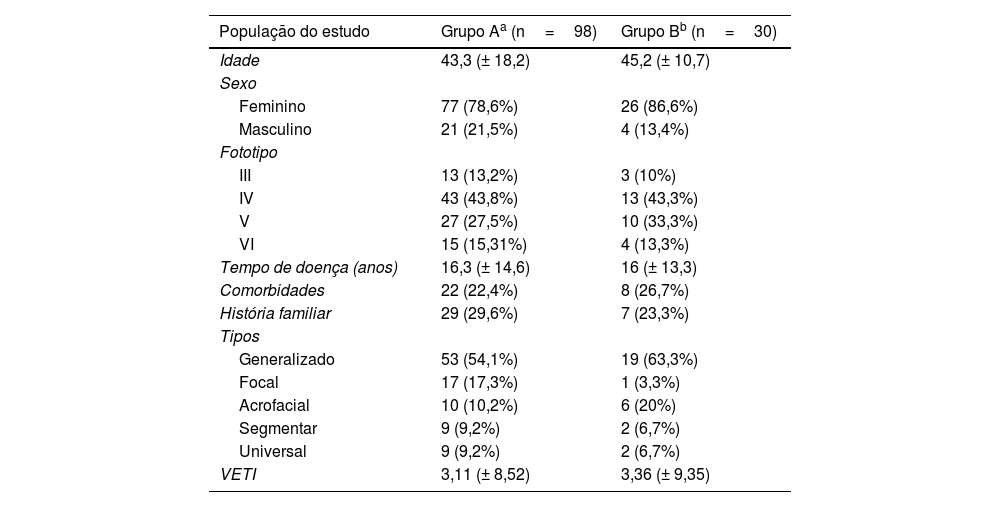
ResultadosConforme tabela 1, pode‐se observar que a média de idade dos pacientes foi de 43,3 anos, com predomínio do sexo feminino (78,6%). Fototipo IV ou V esteve presente em 71,3%; o fototipo IV (43,8%) foi o mais comum. O subtipo de vitiligo mais comum foi o generalizado (54%), seguido pelo focal (17,3%) e acrofacial (10,2%). Na avaliação da extensão da doença, observou‐se VETI médio de 3,11.22 Na amostra de 30 participantes, a média de idade foi de 45,2 anos. Prevaleceram o sexo feminino (86,6%), fototipo IV (43,3%) e o subtipo generalizado (63,3%), dados semelhantes ao grupo de 98 participantes, sem diferenças estatisticamente significante entre os grupos. Mais de 70% dos entrevistados não apresentavam comorbidades nem histórico familiar de vitiligo. Dentre as doenças autoimunes associadas mais comuns estavam o hipotireoidismo, seguido pelo hipertireoidismo.
Perfil clínico dos pacientes portadores de vitiligo do ambulatório de dermatologia
| População do estudo | Grupo Aa (n=98) | Grupo Bb (n=30) |
|---|---|---|
| Idade | 43,3 (± 18,2) | 45,2 (± 10,7) |
| Sexo | ||
| Feminino | 77 (78,6%) | 26 (86,6%) |
| Masculino | 21 (21,5%) | 4 (13,4%) |
| Fototipo | ||
| III | 13 (13,2%) | 3 (10%) |
| IV | 43 (43,8%) | 13 (43,3%) |
| V | 27 (27,5%) | 10 (33,3%) |
| VI | 15 (15,31%) | 4 (13,3%) |
| Tempo de doença (anos) | 16,3 (± 14,6) | 16 (± 13,3) |
| Comorbidades | 22 (22,4%) | 8 (26,7%) |
| História familiar | 29 (29,6%) | 7 (23,3%) |
| Tipos | ||
| Generalizado | 53 (54,1%) | 19 (63,3%) |
| Focal | 17 (17,3%) | 1 (3,3%) |
| Acrofacial | 10 (10,2%) | 6 (20%) |
| Segmentar | 9 (9,2%) | 2 (6,7%) |
| Universal | 9 (9,2%) | 2 (6,7%) |
| VETI | 3,11 (± 8,52) | 3,36 (± 9,35) |
VETI (Vitiligo Extent Tensity Index), score que avalia extensão da doença.
Na tabela 2 encontram‐se a média e o desvio‐padrão dos valores obtidos dos marcadores imunoinflamatórios dosados na amostra de 30 participantes e 10 controles sadios. Dentro do grupo localizado foram incluídas as formas focais, acrofaciais e segmentares; no grupo generalizado, as formas generalizadas e universais. Foram realizados os testes t de Student e Anova de uma via para os marcadores que seguiram o padrão da normalidade (RNL e CXCL10) e, para os demais, os testes de Mann Whitney e o de Kruskal Wallis (valores de p na tabela 1).
Marcadores imunoinflamatórios e tipo de vitiligo (subgrupo de 30 participantes e 10 controles sadios)
| Marcador | Controles(n=10) | Vitiligo localizado(n=9) | Vitiligo generalizado(n=21) | Valor de p |
|---|---|---|---|---|
| RNL (n=30) | ||||
| Média (DP) | ‐ | 2,1 (± 0,8) | 2,33 (± 0,9) | 0,5 |
| PCR (n=24) | ||||
| Média (DP) | ‐ | 2,3 (± 3,43) | 3,2 (± 5,3) | 0,4 |
| TNFα | ||||
| Média (DP) | 6,1 (± 6,8) | 10,6 (± 11,7) | 3,9 (± 6,5) | 0,2 |
| IFNγ | ||||
| Média (DP) | 23,7 (± 15,5) | 16,7 (± 4,4) | 22,4 (± 12,8) | 0,4 |
| IL‐10 | ||||
| Média (DP) | 23,1 (± 1,2) | 25,6 (± 5,4) | 24,3 (± 3,3) | 0,7 |
| IL‐15 | ||||
| Média (DP) | 13,1 (± 3,78) | 14,1 (± 7,4) | 12,6 (± 4,1) | 0,7 |
| CXCL10 | ||||
| Média (DP) | 131,2 (± 77,4) | 186,3 (± 110,5) | 182,6 (± 94) | 0,3 |
RNL, relação neutrófilo linfócito; PCR, proteína C reativa.
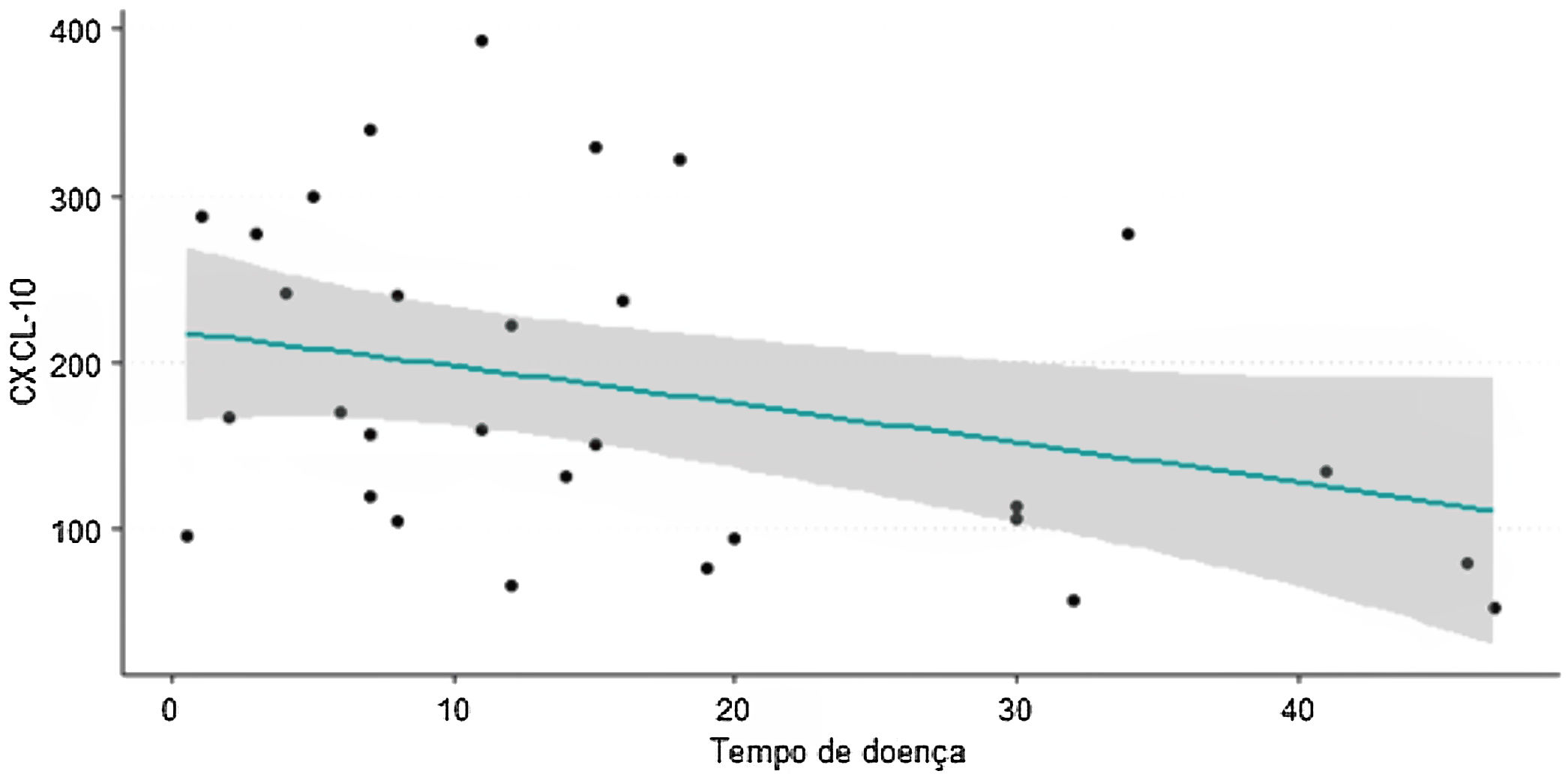
Na figura 1, observam‐se níveis mais elevados da quimiocina CXCL10 em pacientes com menor tempo de vitiligo. Realizado teste de correlação de Spearman com valor de p<0,05, indicando relação inversa entre as variáveis.
Foram feitas análises entre RNL, PCR, níveis de TNFα, IFNγ, IL10 e IL15 e o tempo da doença. Todas demostraram tendência de valores mais altos em pacientes com menor tempo da doença; entretanto, o valor de p não foi estatisticamente significante.
DiscussãoO estudo demonstra maior prevalência de vitiligo entre mulheres (78,5%), achado compatível com a metanálise realizada por Zhang et al.,23 mas diferente de outros estudos prévios, em que a prevalência entre homens e mulheres se demonstrou igualitária.24,25 Esse resultado provavelmente se deve à maior preocupação cultural com a despigmentação cutânea no gênero feminino. A média de idade encontrada em nosso estudo, de 43 anos, difere da metanálise de Zhang et al., na qual a prevalência foi mais comum em pacientes acima de 60 anos.23 Essa divergência pode ter ocorrido em virtude do menor acesso dos idosos durante a vigência da pandemia de COVID‐19. Pela escala de Fitzpatrick, a maioria dos pacientes apresentaram fototipos IV e V (71,3%). No estudo brasileiro de Cerci et al.,26 houve predominância do fototipo IV. Já o tempo médio de doença foi maior que 15 anos, demonstrando a cronicidade da doença.
A maioria dos pacientes não apresentava comorbidades nem histórico familiar de vitiligo. Estudos epidemiológicos mostram que os casos de vitiligo tendem a ser mais comuns em um mesmo núcleo familiar; entretanto, o risco genético não é absoluto.5 Quando há histórico em parente de primeiro grau, o risco de desenvolvimento de vitiligo é de 6%.27
Dados mais recentes vêm demostrando que o vitiligo pode estar associado a maior risco cardiovascular, resistência à insulina e síndrome metabólica,12,28 como revela o estudo com 96 pacientes de Karadag et al.,29 no qual os pacientes com vitiligo tinham maior prevalência de resistência à insulina, maiores níveis de LDL e níveis mais baixos de HDL. Associação de vitiligo com diabetes mellitus juvenil, diabetes mellitus tipo 2, acantose nigricans e como componente da síndrome hiperandrogenismo, resistência à insulina e acantose nigricante (HAIR‐NA) tem sido descrita.30‐32 Fato interessante é que os melanócitos presentes no tecido adiposo parecem desempenhar papel importante na neutralização de radicais livres de oxigênio.12,28,33 Desse modo, questiona‐se o conceito de doença puramente cutânea que traz impactos psicológicos em decorrência da desfiguração cosmética, em favorecimento de uma tese mais ampla, que a posiciona como autoinflamatória e com repercussões sistêmicas.
Poucos estudos avaliaram marcadores inflamatórios sistêmicos no vitiligo. A RNL vem sendo considerada marcador de maior risco cardiovascular. Solak et al.12 concluíram que a RNL é relacionada à disfunção endotelial, tem valor prognóstico e poderia prever desfechos cardiovasculares independentes. Nossos dados mostraram que a média da RNL dos pacientes foi de 2,24, semelhante à média encontrada nos pacientes de vitiligo do estudo de Solak et al..12 Observaram‐se maiores valores de RNL em pacientes com vitiligo generalizado em comparação àqueles com vitiligo localizado. Contudo, como a amostra foi pequena, nosso dado não foi significante, porém coerente com a hipótese que vincula doença extensa com repercussão sistêmica.
No presente estudo, a média da PCR foi de 2,92mg/dL. Badimon et al.34 mostraram que dosagens acima de 1mg/dL eram consideradas de médio risco cardiovascular, e acima de 3mg/dL, de alto risco. Em relação aos níveis de PCR e tipo de vitiligo, também observamos tendência para valores mais altos nos casos generalizados, conforme demonstrado por Solak et al.12
Embora os valores de citocinas e quimiocinas no sangue periférico dos controles saudáveis e dos portadores de vitiligo subdivididos de acordo com o tipo não apresentem diferenças estatisticamentes significantes (talvez em virtude do tamanho amostral), apenas o CXCL10 está nitidamente aumentado nos portadores de vitiligo em comparação com os controles.
Um achado relevante deste estudo é a correlação inversa entre os níveis da quimiocina CXCL10 com o tempo da doença, na qual os valores mais elevados se encontram nos pacientes com menos tempo de doença – ou seja, na fase mais inicial e aguda, corroborando os resultados de Wang et al.35 Vitiligo ativo e em progressão costuma ser mais comum em pacientes com menor tempo de evolução.17 Essa foi uma tendência também observada nas dosagens das outras citocinas (TNFα, IFNγ, IL10 e IL15), apesar da ausência de significância estatística. Também foram observados maiores níveis de CXCL10 em pacientes com as formas acrofaciais e generalizadas em relação aos pacientes com formas universais, compatíveis com os resultados do estudo de Gharib et al.17 É possível que a estabilidade clínica do vitiligo universal explique esse achado.
O recrutamento dos pacientes foi dificultado pela pandemia da COVID‐19, pois a acessibilidade e o atendimento ficaram reduzidos por um período de dois anos. Dessa maneira, a amostra foi pequena para as análises comparativas, mas permitiu traçar um perfil clínico dos portadores de vitiligo do serviço de referência e obter dados importantes, corroborando o papel da CXCL10 na patogênese da doença.
O vitiligo é doença autoimune com participação importante dos linfócitos TCD4+ e TCD8+ citotóxicos.17,36,37 Tanto no sangue periférico quanto nas lesões cutâneas, há aumento de linfócitos T citotóxicos que infiltram a epiderme e se acumulam ao redor dos melanócitos.17 A literatura salienta o papel das quimiocinas inflamatórias como CXCL9, CXCL10 e CXCL12, com destaque para o CXCL10.15,16 A produção de CXCL10 é regulada pela IFNγ (secretada por linfócitos CD8+), que induz a transcrição de fatores via NF‐kB, Janus Kinase e STAT1 (JAK/STAT), ativando a cascata de sinalização.38 Essa ativação estimula maior produção de CXCL10, levando a um ciclo que se autoalimenta. Essa via da IFNγ também é importante na manutenção das lesões já existentes.7 Isso sugere que os tratamentos mais promissores devem envolver não só o bloqueio de CXCL10 e da via da IFNγ, mas também o controle ou a destruição das célula T residentes de memória. Nessa linha, os inibidores da JAK que bloqueiam a via de sinalização da IFNγ têm se mostrado promissores para algumas doenças dermatológicas como dermatite atópica, alopecia areata e vitiligo.39 Mais recentemente, inibidores da JAK tópicos têm sido usados com algum sucesso no vitiligo, a exemplo do tofacitinibe (inibidor da JAK1/3) e ruxolitinibe (inibidor JAK1/2).40
ConclusãoNosso trabalho contribui para confirmar papel relevante do eixo IFNγ/CXCL10 e, consequentemente, da via JAK/STAT na patogênese do vitiligo, destacando o CXCL10 como possível marcador para atividade da doença.21,36
Suporte financeiroNenhum.
Contribuição dos autoresMarta Regina Machado Mascarenhas: Análise estatística; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Mariana de Castro Oliveira: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados
Luise Fonseca de Oliveira: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados
Andréa Santos Magalhães: Obtenção, análise e interpretação dos dados;
Paulo Roberto Lima Machado: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Mascarenhas MRM, Oliveira MC, Oliveira LF, Magalhães AS, Machado PRL. Clinical profile of vitiligo patients and relationship with immuno‐inflammatory markers. An Bras Dermatol. 2024;99:196–201.
Trabalho realizado no Hospital Universitário Professor Edgard Santos, Salvador, BA, Brasil.