O termo micobacteriose não tuberculosa, anteriormente conhecido como micobacteriose atípica, anônima, oportunística ou não classificada, refere‐se a outras micobacterioses patogênicas que não as causadas por Mycobacterium tuberculosis e M. leprae. Essas micobactérias são conhecidas por sua distribuição ambiental, principalmente na água e no solo. A incidência das micobacterioses não tuberculosas vem aumentando em todos os países e as infecções de pele são cada vez mais estudadas, principalmente com o aumento de condições imunossupressoras e com o desenvolvimento de novas medicações que afetam a função imunológica. No presente artigo, faz‐se detalhada revisão narrativa da literatura voltada para o estudo das principais micobacterioses não tuberculosas que geram doenças da pele e anexos. O artigo visa, ainda, apresentar contexto histórico, seguido por características epidemiológicas, microbiológicas e clínicas das referidas doenças. Considerações práticas sobre o diagnóstico e o tratamento das micobacterioses não tuberculosas são pormenorizadas.
As micobactérias são patógenos de suma importância para a saúde humana. O gênero Mycobacterium é composto por grupo de actinobactérias aeróbias que causam, principalmente, a tuberculose e a hanseníase.1 Apesar da reduzida atenção científica e social dada às duas principais micobacterioses, essas são ainda as doenças mais conhecidas desta classe. Outros tipos de micobacterioses, apesar da crescente incidência, são pouco estudadas. Estas doenças resultam em um considerável impacto na qualidade de vida de populações vulneráveis e de grupos de risco tais como os imunossuprimidos.
As micobacterioses não tuberculosas (MNT), anteriormente conhecidas como micobacterioses atípicas, anônimas, oportunísticas ou não classificadas, são micobacterioses patogênicas não causadas por Mycobacterium tuberculosis e M. leprae.2,3 As MNT são conhecidas por sua distribuição ubíqua ambiental, principalmente na água e no solo.1 O comportamento patogênico do gênero Mycobacterium é extremamente variável; alguns representantes se comportam como patógenos obrigatórios, outros como patógenos oportunistas, e outros são considerados não patogênicos.4 Existem, ainda, diversos animais que são colonizados ou infectados por micobactérias e que podem agir como reservatórios.5 Nos últimos anos, a atenção ao estudo das MNT vem aumentando, face ao melhor reconhecimento desses patógenos, advento de técnicas mais sensíveis de identificação, advento de doenças e medicamentos imunossupressores.4 É notório o aumento do número de publicações sobre o tema.6
No presente artigo faz‐se revisão das MNT responsáveis por diversos agravos à pele e anexos. São abordados o contexto histórico e os principais aspectos epidemiológicos, microbiológicos e clínicos das referidas doenças. O diagnóstico e tratamento das MNT também são abordados.
HistóriaA evolução das micobacterioses está relacionada à história da Medicina e a descobertas na área da microbiologia. Após a descrição dos microrganismos por Antonie van Leeuwenhoek e estudos que levaram à criação dos postulados de Kock, muito se evoluiu no conhecimento das infecções micobacterianas, mas a totalidade dessa interação está longe de ser conhecida.7
Acredita‐se que as micobactérias tenham se originado há mais de 150 milhões de anos.8 A epidemiologia da infecção por M. ulcerans é uma evidência deste histórico, pois a presença em locais específicos do continente africano e da América do Sul indica sua existência antes das divisões dos continentes.1 Inicialmente, o gênero Mycobacterium enquadrou os agentes causais da tuberculose e da hanseníase. Em 1959, Ernest Runyon elaborou a classificação das micobactérias de acordo com a geração de cromóforos e a velocidade de replicação.9 O advento da biologia molecular, com a amplificação do ácido nucleico desenvolvida por Kary Banks Mullis, possibilitou estudo detalhado da carga genética dos organismos vivos e o desenvolvimento de métodos diagnósticos mais sensíveis que o exame direto, histopatológico ou cultivo.
EpidemiologiaDados sobre o comportamento epidemiológico das MNT são escassos por sua característica ambiental e extrema negligência com a situação. A cada década, infecções por MNT são mais frequentes.6 Isso se dá em parte pela maior capacidade de detecção desses patógenos, e em parte pelo advento de novas doenças e medicações imunossupressoras. No entanto, esse aumento no número de infecções vem sendo observado mesmo em regiões nas quais a tuberculose pulmonar está diminuindo, o que evidencia que esse efeito não é apenas consequente de maior poder de detecção.10
Epidemiologia das micobacterioses cutâneas não tuberculosas na América do SulDados referentes à epidemiologia das MNT na América do Sul e no Brasil também não propiciam conclusões precisas sobre o comportamento regional. Fatores locais e semelhança com outros ambientes podem atuar como pistas importantes para previsão e ações de controle. Relatos de casos, cada vez mais frequentes, demonstram que as principais fontes de infecção pelas MNT são ambientais e hospitalares após procedimentos cirúrgicos.
A maior parte da porção sul do continente americano situa‐se nas regiões tropical e subtropical. Essa distribuição favorece a transmissão de micobactérias ambientais de vida aquática.11 Casos suspeitos de infecção pelo M. ulcerans em países como Peru e Brasil chamam atenção pelos fatores ambientais semelhantes aos países endêmicos e serão pormenorizados em seções posteriores.12 O desenvolvimento econômico dessa região também pode ser um fator para a transmissão que ocorre durante procedimentos cirúrgicos ou estéticos.13
Taxonomia, microbiologia e caracterização genéticaAs micobactérias pertencem à ordem Actinomycetaceae, família Mycobacteriaceae.2 O gênero Mycobacterium é considerado relativamente homogêneo taxonomicamente, e seus componentes apresentam características genotípicas e fenotípicas que facilmente os diferenciam dos outros gêneros.3 As micobactérias são bacilos aeróbios obrigatórios, álcool‐ácido resistentes que apresentam estrutura de ácidos micólicos.1
As micobactérias estão amplamente distribuídas no meio ambiente, incluindo fontes de água, animais e o ser humano. O gênero é composto por mais de 170 espécies, a maioria sem interesse clínico.2 As micobactérias apresentam comportamento peculiar na análise laboratorial, que consiste em crescimento lento e na necessidade de meios de cultura complexos para replicação.2 É importante mencionar que M. leprae ainda não foi cultivado em meios artificiais.14 Isso dificulta o estudo de características naturais dos patógenos, bem como o desenvolvimento de testes diagnósticos.
Em 1959, Ernest Runyon propôs uma classificação para as MNT associadas a infecções pulmonares (tabela 1).9 Nessa classificação, ainda hoje adotada, são consideradas a velocidade de crescimento da micobactéria e a produção de cromógenos. Quanto ao crescimento, são classificadas em micobactérias de crescimento lento (> 7 dias) e crescimento rápido (< 7 dias). É importante salientar que mesmo as micobactérias de crescimento rápido têm multiplicação muito mais lenta que outros tipos de bactérias. Quando considerada também a produção de cromógenos, as micobactérias são divididas em tipo I – fotocromógenas (produzem colônias de coloração amarelada à exposição à luz), tipo II – escotocromógenas (independente da exposição à luz, também produzem colônias de coloração amarelada), tipo III – acromógenas (produzem discreta ou nenhuma pigmentação). O tipo IV é classificado apenas por também representar o crescimento rápido. Dependendo da pigmentação e das características genotípicas, as MNT são classificadas por alguns autores em cinco grupos: M. fortuitum, M. chelonae/abscessus, M. mucogenicum, M. smegmatis e MNT de crescimento rápido e pigmentação precoce.15 A divisão fenotípica, baseada nos meios de cultura, não encontra relação com o comportamento clínico das micobacterioses.
Classificação das micobactérias não tuberculosas segundo sua velocidade de crescimento e segundo a sua característica cromogênica (classificação de Runyon)
| Crescimento lento (> 7 dias) |
| Tipo I – Fotocromógenas |
| M. kansasii, M. simiae, M. marinum, M. asiaticum |
| Tipo II – Escotocromógenas |
| M. scrofulaceum, M. gordonae, M. flavescens, M. szulgai |
| Tipo III – Acromógenas |
| M. avium complex, M. ulcerans, M. terrae, M. haemophilum |
| Crescimento rápido (< 7 dias) |
| Tipo IV |
| M. abscessus, M. chelonae, M. fortuitum |
A expressão clínica das micobacterioses depende de complexa interação entre o patógeno e o hospedeiro desde a infecção inicial até os estágios mais avançados da doença. Inicialmente, a micobactéria envolvida tem papel importante na infectividade e patogenicidade. Os antígenos micobacterianos modulam, de modo importante, a resposta imune. Como exemplo, podemos citar moléculas como o glicolipídeo fenólico I (PGLI), presente no M. leprae que é importante e específico fator de escape imunológico. Cepas de M. bovis que expressaram PGLI por engenharia genética demonstraram capacidade aumentada de interação com o receptor do complemento 3 (CR3) e consequente maior evasão da resposta imunológica feita por macrófagos humanos e de outras respostas pró‐inflamatórias.16 A quantidade de patógenos exposta ao sistema imune também é fator modulador importante de infecção e patogenicidade. Estudos feitos com citometria de fluxo mostram que quanto maior a exposição aos antígenos de micobactéria, maior a diferenciação das células T.17
Apesar de a imunidade gerada pela diferenciação de células T ser a resposta mais amplamente estudada na infecção por micobactérias, a imunidade inata, barreira imune inicial, tem extrema importância protetora.18 Macrófagos, células dendríticas, neutrófilos e células natural killer são os principais envolvidos nesse tipo de resposta.19 Outras células também têm importância reconhecida nesse processo, tais como as células epiteliais e os mastócitos.19 Nessa fase, mecanismos celulares como fagocitose, apoptose e autofagia são utilizados na luta contra a micobactéria infectante.19
Diversos sinalizadores e receptores representam papel importante na resposta imune inata contra as micobactérias. O reconhecimento dos patógenos é o primeiro passo na luta contra a infecção. Receptores como toll‐like receptors (TLRs), nod‐like receptors (NLRs), C‐type lectin receptors (CLRs), scavenger receptors (como MSR1, MARCO e CD36), receptores CD14, AIM2 e AhR.67–71 são muito importantes para o reconhecimento da micobactéria e o início do processo de fagocitose.19 Além disso, esses receptores constituem o passo inicial para a produção de citocinas pró‐inflamatórias e o início da complexa cascata imunológica. É interessante ressaltar também que faz parte dessa cascata imunológica a ativação de inflamassomas. Essa resposta serve como gatilho na resposta imune mediada pela interleucina (IL) 1β.19
A resposta adaptativa é o ramo da resposta imunológica mais estudado no caso de infecções crônicas como as causadas por micobactérias. Os linfócitos T são essenciais para o controle das micobacterioses.20 Nesse ramo, as células apresentadoras de antígenos, como as células dendríticas, ativam e induzem a proliferação de linfócitos TCD4+naive que, por sua vez, iniciam o processo de fagocitose.20 Estudos com murinos demonstraram também que as células apresentadoras de antígenos migram para órgãos linfáticos mediastinais resultando, finalmente, na produção de linfócitos T CD4+específicos.20
A clássica dicotomia entre a resposta imune celular efetiva e a resposta imune humoral, também descrita como o balanço T helper (Th)1‐Th2 ainda explica muito da cinética imune do hospedeiro, apesar de estudos recentes demonstrarem que este é apenas um dos braços de resposta imunológica. A minoria dos indivíduos que entra em contato com micobactérias desenvolverá doença clínica. Aqueles que desenvolvem a doença e resposta imune Th1 baseada na resposta celular efetiva terão infecção localizada, com intensa resposta granulomatosa. No outro polo do espectro, os pacientes que, por motivos genéticos ou ambientais, não conseguem desenvolver resposta imune celular efetiva terão infecções disseminadas e lesões ricas em micobactérias.21 Nesse polo, a resposta imune humoral é intensa, mas inefetiva para defesa contra os patógenos. A hanseníase é um dos mais clássicos exemplos clínicos desse balanço entre resposta Th1‐Th2.14 Em parte, esse balanço também pode ser esperado para as outras micobacterioses.
Como exemplo, pacientes transplantados ou com doenças genéticas que alteram a expressão de interferon (IFN)‐γ e IL‐12 demonstram maior risco de infecção por micobactérias, demonstrando a importância dessas citocinas na patogênese das MNT.2 O papel central do IFN‐γ, da IL‐12 e do fator de necrose tumoral (TNF)‐α na patogênese das infecções por MNT é bem evidenciado pela elevada incidência em crianças com deficiências nesse eixo, bem como em pessoas que fazem uso de agentes neutralizantes do TNF, mas não em pacientes que utilizam imunobiológicos inibidores da IL‐17 e IL‐23. Uma característica importante da interação imune entre o hospedeiro e as micobactérias já é bem descrita em infecções causadas por M. tuberculosis. As micobactérias podem ficar latentes por vários anos em indivíduos saudáveis.20 Isso implica na possibilidade de quadros clínicos graves em pacientes imunossuprimidos ou que utilizam agentes imunossupressores. Protocolos de profilaxia para a tuberculose latente reduziram de maneira importante casos de tuberculose reativada. Essa latência e a chance de reativação não estão bem definidas ou estudadas no caso das MNT.
TransmissãoA forma de contágio e transmissão das MNT é ainda objeto de debate. Por seu comportamento ambiental, meios de contágio como traumas e contato com vetores são frequentemente advogados nos casos de infecções cutâneas. Em geral, a transmissão entre humanos, se existente, não é considerada fonte relevante. Não há estudos que comprovem a possibilidade de a infecção poder ser transmitida de um indivíduo para outro, ou entre animais. Estudos com biologia molecular mostram que cepas de M. abscessus que infectam pacientes com fibrose cística podem ser inalados por meio de fômites ou aerossóis.10 As doenças da pele e dos tecidos moles são causadas por traumas ou procedimentos cirúrgicos.10 Recentemente, Drummond et al. revisaram diversos fatores de risco para a infecção por MNT.10 Além do contato com ambientes secos e aquáticos que podem conter micobactérias, fatores relacionados aos hospedeiros também devem ser observados. A imunossupressão relacionada a fatores genéticos ou associada a agentes imunossupressores sempre devem ser consideradas fatores de risco.
Aspectos clínicosManifestações clínicas segundo os agentes patogênicosAs micobactérias causadoras da MNT são consideradas bactérias com baixo poder patogênico. No entanto, elas podem se apresentar com formas clínicas diversas, principalmente em pacientes imunossuprimidos. Das doenças ocasionadas por MNT, 90% resultam em doença pulmonar crônica.10 As manifestações clínicas são geralmente divididas em quatro principais síndromes clínicas: doença pulmonar, doença cutânea e dos tecidos moles, linfadenite e doença disseminada.10 Outras manifestações, como otite média crônica, otomastoidite e infecções osteomusculares, também são descritas.
Se considerarmos a apresentação das formas tegumentares e a forma de contágio que originou a lesão, é importante descrever as seguintes manifestações clínicas: linfadenite, manifestações do tipo corpo estranho, infecção relacionada a cateter venoso central e infecção disseminada. Essas apresentações podem mudar com o tempo ou apresentarem‐se associadas.
Infecção por Mycobacterium ulcerans, um grave problema de saúde públicaA infecção por M. ulcerans é a terceira micobacteriose mais frequente no mundo e tem alto impacto na saúde pública de países em desenvolvimento, além de ser considerada uma doença negligenciada.11 Esses fatores justificam atenção especial a essa condição. A doença também é reconhecida por outros nomes, como úlcera de Buruli, úlcera de Bairnsdale, de Tora, doença de Searls e Daintree. Porém, essas denominações devem ser evitadas.11
A doença é mais prevalente em países da costa ocidental da África e na Austrália, mas países localizados na América do Sul e no oeste no Oceano Pacífico já registraram casos.1 Há registro de caso no Brasil, e as características ambientais do país são semelhantes às de países que reportam ativamente a infecção por M. ulcerans.12 No entanto, a endemicidade da doença não foi confirmada nem reproduzida. Vale lembrar, inclusive, que a identificação precisa das espécies de micobactérias não é uma tarefa fácil.
Essa micobacteriose acomete principalmente crianças que residem em áreas rurais, úmidas, com pântanos e áreas alagadas com fontes de água de baixa movimentação. Alguns prováveis fatores de risco já descritos incluem: jardinagem, picadas de insetos, proximidade com região lacustre. Mycobacteriumulcerans é uma micobactéria de crescimento lento do tipo III de Runyon. Como característica importante, a micobactéria produz a toxina denominada micolactona, provavelmente associada à grave destruição tecidual observada nos casos com longa duração.1
As lesões iniciais caracterizam‐se por pápulas ou nódulos, geralmente em áreas expostas dos membros inferiores.11 A necrose tecidual evolui para úlcera relativamente indolor, apesar da destruição tecidual evidente e visível. A lesão pode permanecer relativamente estável ou evoluir para necrose dos tecidos adjacentes e resultar em infiltração óssea. Em média, 60% dos casos ocorrem nos membros inferiores; porém, qualquer outra área cutânea pode ser acometida. Apesar da baixa mortalidade, casos mais graves não tratados podem cursar com osteomielite e sequelas com perda da função de membros.
No caso de pequenas úlceras, a excisão cirúrgica é o tratamento de escolha. O tratamento recomendado consiste na associação de antibióticos para evitar resistência medicamentosa, principalmente rifampicina associada a claritromicina ou estreptomicina por oito semanas.22 As quinolonas podem ser usadas em substituição à claritromicina (moxifloxacino ou ciprofloxacino).22 Se houver envolvimento de estruturas profundas, o tratamento pode ser prolongado. Em casos de necrose significativa, pode ser necessário desbridamento cirúrgico, calor local e outros procedimentos.
Mycobacterium avium complexDoenças causadas por M. avium complex (MAC) têm sido cada vez mais comuns com o advento e a persistência de condições imunossupressoras. O complexo é formado por M. avium e M. intracellulare. Essas micobactérias estão entre as causas mais frequentes de micobacterioses em países desenvolvidos.23 As infecções cutâneas são causadas por trauma.24 Diversos tipos de apresentações clínicas podem ser encontrados, incluindo placas, pústulas, paniculites, linfadenite, dentre outros.23 Em pacientes imunossuprimidos, pode ocorrer doença disseminada associada a sintomas sistêmicos inespecíficos como febre, sudorese noturna, perda ponderal, dor óssea, hepatoesplenomegalia e linfadenopatia. Nesses casos, o envolvimento cutâneo é incomum, mas quando presente apresenta‐se na forma de lesões papulopustulosas e úlceras necróticas, principalmente em membros inferiores. O tratamento antimicrobiano das infecções por MAC consiste na associação de claritromicina ou azitromicina com etambutol e rifampicina ou rifabutina, por tempo prolongado a depender da apresentação clínica da infecção.
Mycobacterium marinumEssa é micobactéria associada à vida aquática, inclusive causando doença aparente em animais como peixes ornamentais,25 e tem apresentado crescente relevância e frequência para a infecção de pele e tecidos moles. Apesar de ser uma micobactéria do grupo I, segundo a classificação de Runyon, M. marinum pode crescer em menos de sete dias em meios ideais de cultivo. No entanto, sua carga genética é mais semelhante às micobactérias de crescimento lento.25
Mycobacterium marinum acomete principalmente a pele e as mucosas, uma vez que seu crescimento é lento em temperaturas acima de 30°C, características de regiões mais centrais do corpo. A maioria dos casos apresenta lesão cutânea localizada, papulonodular, em alguns casos com disseminação. Em pacientes imunossuprimidos pode ocasionar forma esporotricoide ou rapidamente disseminada – essa última extremamente rara.25
O tratamento pode ser feito com monoterapia por aproximadamente três meses. Para infecções mais graves, recomenda‐se a combinação de antibióticos como claritromicina, etambutol, rifampicina e sulfametoxazol+trimetoprima. Minociclina e doxiciclina são alternativas viáveis.1 O tempo de terapêutica é variável, e recomenda‐se manutenção do tratamento por um a dois meses após a resolução dos sintomas. Desbridamento cirúrgico pode ser necessário.
Mycobacterium fortuitumMycobacterium fortuitum é encontrado no solo e em biofilmes aquáticos em diversas regiões geográficas.26 É micobactéria de crescimento rápido, pertencente ao grupo IV de Runyon. Surtos de doenças hospitalares têm sido relatados e incluem infecções de feridas operatórias, abscessos pós‐injeção e infecções após endoscopia com escopos contaminados. Existem casos descritos após diversos procedimentos como piercings, tatuagens, mesoterapia, acupuntura, pedicures, implante mamário e laser de CO2.1 Caracteristicamente, manifesta‐se pela presença de múltiplos nódulos subcutâneos dolorosos, mas também pode causar doença pulmonar (pneumonia unilateral não cavernosa). Doença disseminada pode ocorrer em pacientes imunocomprometidos.
Para o tratamento, recomenda‐se combinação de antibióticos incluindo macrolídeos, fluoroquinolonas, doxiciclina, sulfametoxazol+trimetoprima por, no mínimo, quatro meses, além de excisão cirúrgica, quando necessário.1 No caso de doença grave ou disseminada, deve‐se iniciar o tratamento parenteral com dois a três antimicrobianos sensíveis, seguido de tratamento oral por seis a 12 meses.
Mycobacterium abscessus complexO complexo M. abscessus consiste em grupo de micobactérias classificadas no grupo IV de Runyon, de crescimento rápido, com alta frequência de resistência microbiana e que causam grande variedade de lesões cutâneas.27 Infecções disseminadas e de outros órgãos também são descritas. Existem três subespécies: M. abscessus subsp. abscessus, M. abscessus subsp. massiliense e M. abscessus subsp. bolletii.27 Casos contraídos após cirurgia funcional ou cosmética, bem como procedimentos de mesoterapia, acupuntura, tatuagens e tratamento das unhas, podem ser encontrados na literatura.1,13
Não há consenso para o tratamento das infecções por M. abscessus, que deve ser estabelecido com base na sensibilidade dos isolados in vitro. A antibioticoterapia consiste no uso combinado de macrolídeos (claritromicina como fármaco de escolha), associados na fase inicial com antibiótico parenteral (amicacina, cefoxitima, tigeciclina ou imipenem). Outras opções consistem na associação de claritromicina com linezolida ou clofazimina. Recomenda‐se tempo de tratamento superior a quatro a seis meses. Desbridamento e excisão cirúrgica podem ser necessários.1
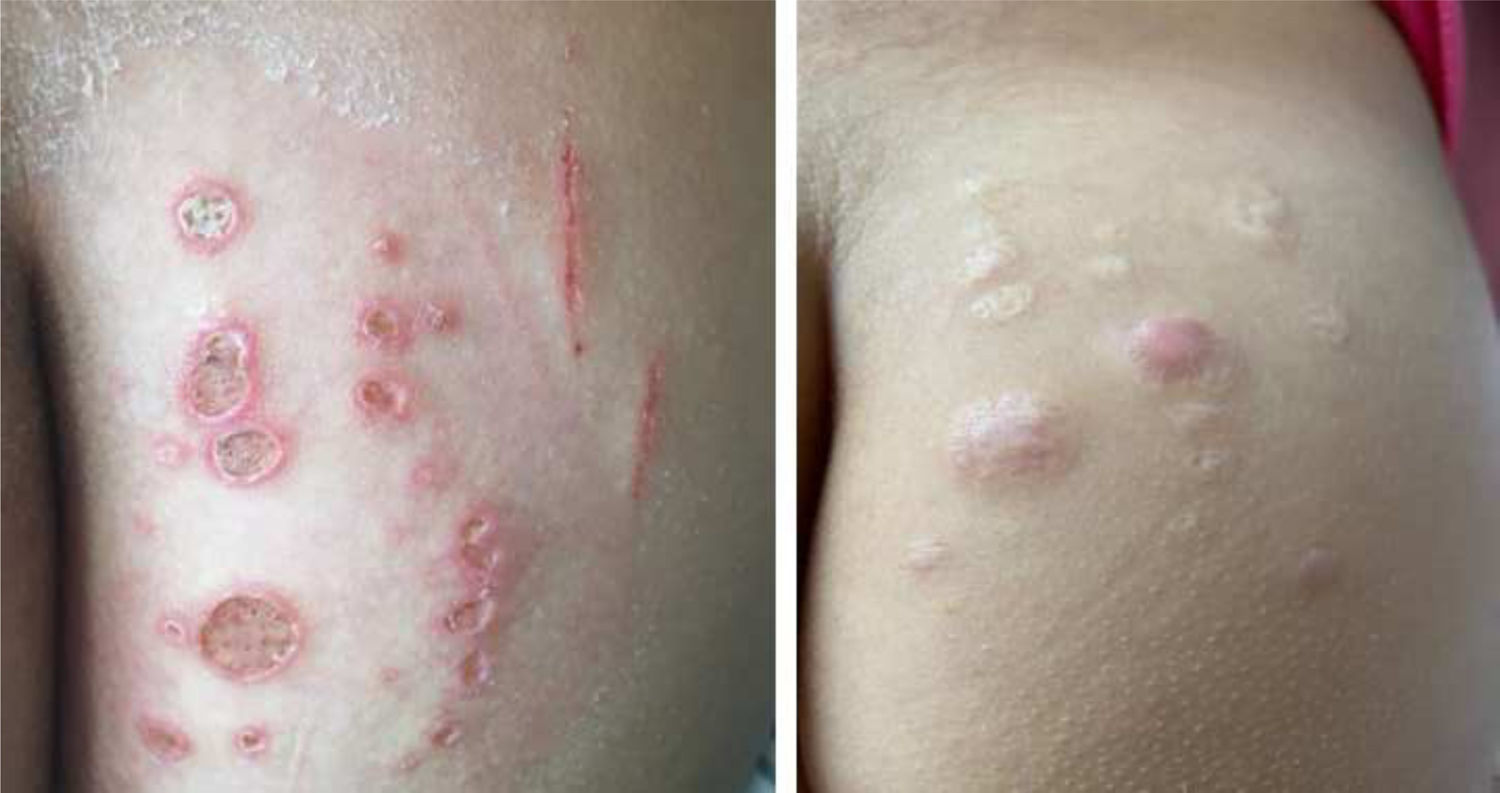
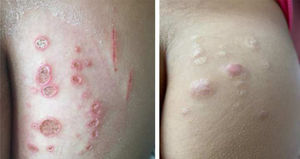
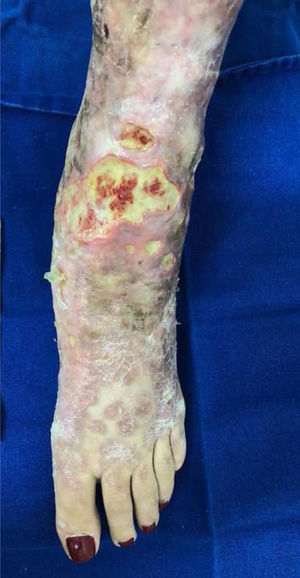
Mycobacterium chelonaeTrata‐se de micobactéria presente em ambientes aquáticos, solo e instrumentos cirúrgicos, que pertence ao complexo M. fortuitum, do grupo IV de Runyon.28 São micobactérias com baixa virulência que acometem, principalmente, pacientes imunossuprimidos.28 Procedimentos como tatuagens, mesoterapia e acupuntura podem ser portas de entrada para o agente infeccioso (fig. 1). Tratamentos combinados com macrolídeos, cefoxitina, imipenem, fluoroquinolonas e amicacina, além da abordagem cirúrgica, estão indicados.1 A apresentação clínica é amplamente variável, com infecção cutânea disseminada, nódulos eritematosos, com tendência a drenar e ocasionar úlceras crônicas. Também pode ocorrer celulite, abscessos localizados ou osteomielites e infecções relacionadas a cateter central.15
Tratamentos combinados com macrolídeos, cefoxitina, imipenem, fluoroquinolonas, linezolida, clofazimina, tobramicina, imipenem e amicacina, além da abordagem cirúrgica, estão indicados.1 Face às observações de resistência adquirida à claritromicina, principalmente em adultos, a monoterapia deve ser evitada.15
Mycobacterium haemophilumMycobacterium haemophilum é raramente associado a infecções em humanos, ocorre mais frequentemente na Ásia e é associado a comorbidades graves.29 Há relatos de casos adquiridos após procedimentos cosméticos. Há também associação com imunossupressão por medicamento ou uso de agentes bloqueadores de TNF.1 O tratamento deve ser combinado, incluindo abordagem cirúrgica e poliquimioterapia com macrolídeos, fluoroquinolonas e rifampicina ou rifabutina.1
Mycobacterium kansasiiTrata‐se de micobactéria de crescimento lento, fotocromogênica, do grupo I de Runyon. Geralmente descrita em pacientes imunossuprimidos. Pode causar infecções em feridas operatórias, inclusive com acometimento de tecidos profundos e ósseos.30 O tratamento consiste em uma combinação de isoniazida, rifampicina, etambutol e claritromicina por 12 meses.1
Doença vacinal por BCG (bacilo de Calmette‐Guérin)A vacina BCG (bacilo de Calmette‐Guérin) é composta por organismo vivo atenuado (M. bovis) e tem como principal objetivo a prevenção de formas graves (meníngea e miliar) de tuberculose.31 Sua administração também é recomendada para contatos domiciliares de hanseníase como forma de prevenir a doença.32 Alguns estudos mostram que a BCG também confere algum grau de proteção contra MNT.31
No Brasil, recomenda‐se dose única de BCG, preferencialmente nas primeiras 12 horas após o nascimento, ainda na maternidade.33 No caso de contato domiciliar de paciente com hanseníase, o esquema de vacinação deve considerar a história vacinal do contato. Se o contato tiver menos de 1 ano de idade e já foi vacinado, não há necessidade de outra dose de BCG. Aqueles com mais de 1 ano de idade, caso não tenham cicatriz vacinal ou apresentem apenas uma cicatriz, devem receber uma dose de BCG. Aqueles que receberam duas doses ou apresentem duas cicatrizes não necessitam de dose adicional.33
Depois de uma a duas semanas forma‐se pústula com consequente ulceração. Entre seis e 12 semanas, forma‐se crosta seguida de cicatriz característica em cerca de 95% dos vacinados. Pode haver recorrência da lesão, mesmo depois de sua completa cicatrização.
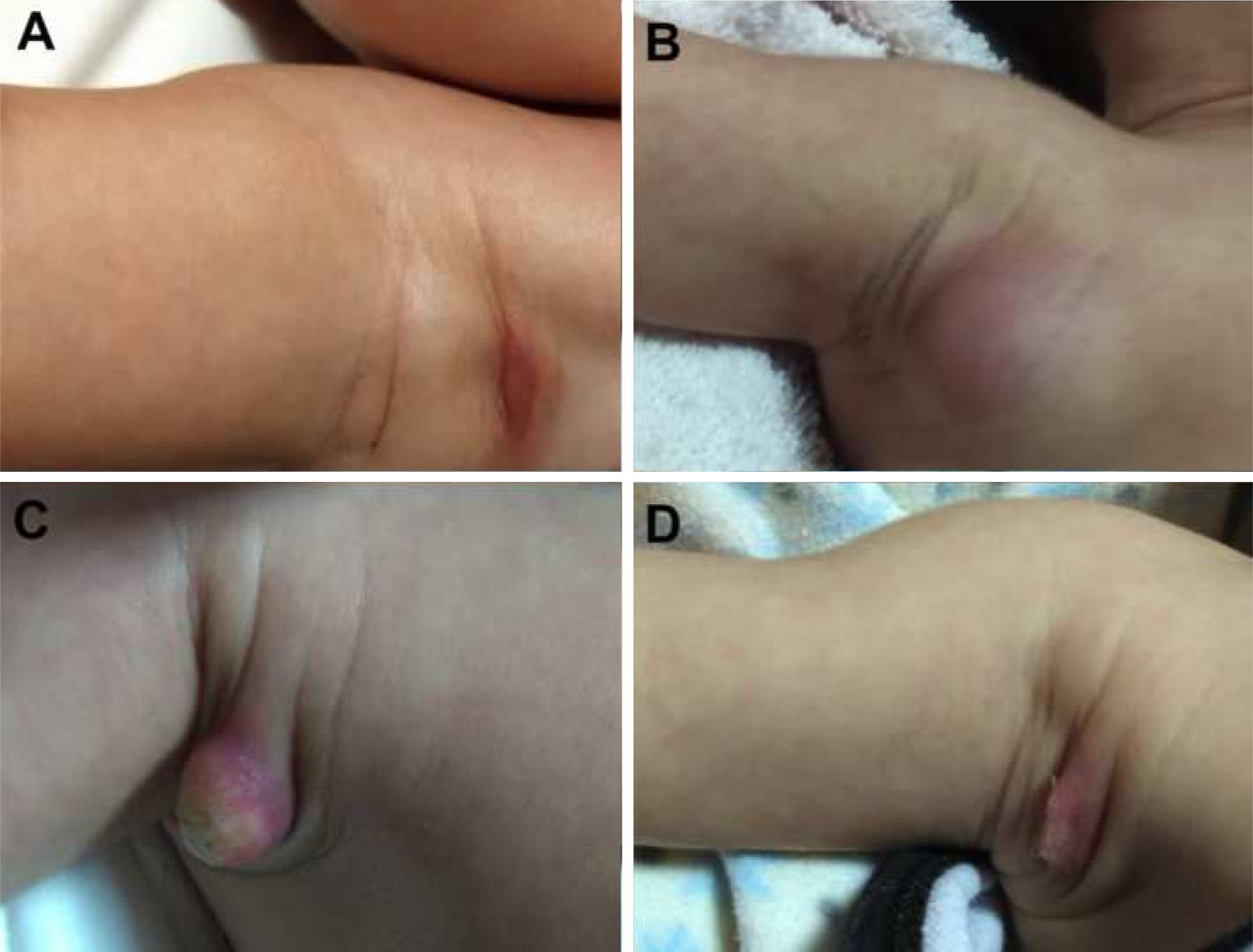
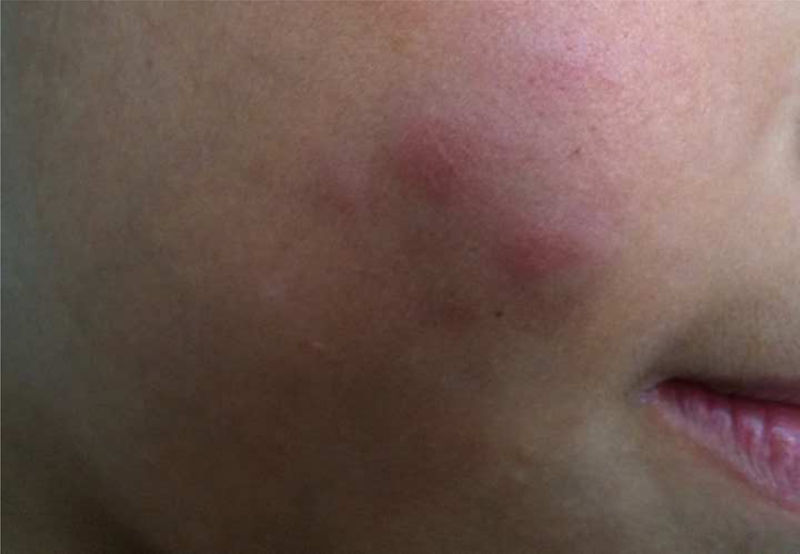
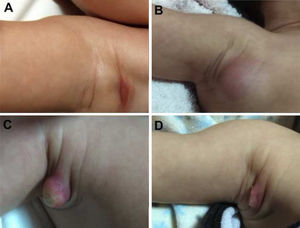
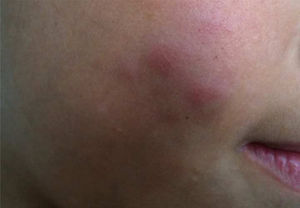
Durante a evolução normal da lesão vacinal pode ocorrer adenopatia axilar, supra ou infraclavicular, sem supuração, medindo até 3cm de diâmetro sem sintomatologia geral, com resolução espontânea. No entanto, efeitos adversos locais ou sistêmicos podem ocorrer. Esses podem ser resultantes da presença de imunodeficiência, do tipo de cepa utilizada, da técnica de aplicação e da quantidade de bacilos administrados. As lesões locais e regionais são mais frequentes e respondem melhor ao tratamento (fig. 2).
Reação adversa à vacinação com bacilo Calmette‐Guérin (BCG). (A), Três meses após aplicação da vacina, com adenomegalia axilar regional. (B), Quatro meses após aplicação da vacina, com aumento da linfonodomegalia. (C), Cinco meses após aplicação, com formação de abscesso. (D), Seis meses após aplicação da vacina, com supuração.
Raramente ocorre disseminação ou acometimento sistêmico. Lesões decorrentes da disseminação são aquelas que ultrapassam a topografia locorregional e podem acometer pele e linfonodos a distância, sistema osteoarticular e vísceras, evoluindo com lesões semelhantes à tuberculose nos pulmões, rins e órgãos genitais. Casos generalizados são representados por febre persistente, hepatomegalia, esplenomegalia e linfadenite múltipla. Nesses casos, é essencial a investigação de imunodeficiência.
Os eventos adversos sempre devem ser notificados (tabela 2). A maioria dos efeitos adversos à BCG requerem apenas observação clínica. Quando o quadro é local e persistente, como úlcera> 1 cm, abscesso frio e granuloma de difícil cicatrização, é indicada isoniazida 10mg/kg/dia (dose máxima de 400mg) até regressão completa da lesão.33 Nos abscessos quentes, pode‐se considerar o uso de antimicrobiano sistêmico para processo infeccioso agudo, inespecífico de pele (piodermite). Em casos com linfadenopatia> 3cm não supurada, não está indicado puncionar, excisar ou iniciar isoniazida, fazendo‐se apenas acompanhamento. Quando ocorre supuração do linfonodo, há indicação de prescrever isoniazida na dose de 10mg/kg/dia (dose máxima de 400mg) até regressão do quadro.34 Na reação lupoide, um evento raro e tardio, é preconizado tratamento com esquema tríplice (isoniazida 10mg/kg/dia, rifampicina 10mg/kg/dia e etambutol 25mg/kg/dia), por dois meses, seguido de isoniazida na dose de 10 mg/kg/dia e rifampicina 10mg/kg/dia por quatro meses.34
Conduta frente aos efeitos adversos após aplicação da vacina bacilo de Calmette‐Guérin (BCG)
| Evento adverso | Conduta |
|---|---|
| Locais e regionais | |
| Úlcera>1 cm | Observação clínica |
| Na ausência de cicatrização: isoniazida (10 mg/kg/dia, dose máxima de 400 mg) até a regressão completa. Manter acompanhamento por até três meses após tratamento | |
| Abscessos subcutâneos frios | Observação clínica |
| Isoniazida (10 mg/kg/dia, dose máxima de 400 mg) até a regressão completa. Manter acompanhamento por até três meses após tratamento | |
| Abscessos subcutâneos quentes | Observação clínica |
| Considerar a presença de infecção secundária e tratar com antibioticoterapia para piodermites | |
| Granulomas | Observação clínica |
| Na ausência de cicatrização: isoniazida (10 mg/kg/dia, dose máxima de 400 mg) até a regressão completa. Manter acompanhamento por até três meses após tratamento | |
| Linfadenopatia regional não supurada | Observação clínica |
| Linfadenopatia regional supurada | Observação clínica |
| Isoniazida (10 mg/kg/dia, dose máxima de 400 mg) até redução significativa. Manter acompanhamento por até três meses após tratamento | |
| Queloide | Observação clínica |
| Reação lupoide | Observação clínica |
| Esquema tríplice com isoniazida 10 mg/kg/dia, rifampicina 10 mg/kg/dia, etambutol 25 mg/kg/dia por dois meses, seguido de isoniazida 10 mg/kg/dia e rifampicina 10 mg/kg/dia por quatro meses | |
| Disseminados | |
| Pele | Observação clínica |
| Esquema tríplice com isoniazida 10 mg/kg/dia, rifampicina 10 mg/kg/dia, etambutol 25 mg/kg/dia, por dois meses, seguido de isoniazida 10 mg/kg/dia e rifampicina 10 mg/kg/dia por quatro meses | |
| Osteoarticulares | Observação clínica |
| Esquema tríplice com isoniazida 10 mg/kg/dia, rifampicina 10 mg/kg/dia, etambutol 25 mg/kg/dia, por dois meses, seguido de isoniazida 10 mg/kg/dia e rifampicina 10 mg/kg/dia por quatro meses | |
| Linfonodos e acometimento de único órgão | Observação clínica |
| Esquema tríplice com isoniazida 10 mg/kg/dia, rifampicina 10 mg/kg/dia, etambutol 25 mg/kg/dia, por dois meses, seguido de isoniazida 10 mg/kg/dia e rifampicina 10 mg/kg/dia por quatro meses | |
| Lesões generalizadas acometendo mais de um órgão | Observação clínica |
| Esquema tríplice com isoniazida 10 mg/kg/dia, rifampicina 10 mg/kg/dia, etambutol 25 mg/kg/dia, por dois meses, seguido de isoniazida 10 mg/kg/dia e rifampicina 10 mg/kg/dia por, no mínimo, quatro meses |
Fonte: Ministério da Saúde Secretaria de Vigilância em Saúde Departamento de Vigilância das Doenças Transmissíveis B. Manual de Vigilância Epidemiológica de Eventos Adversos Pós‐Vacinação, 2014.
Nos casos em que há disseminação cutânea, osteoarticular, linfonodal ou visceral é indicado o mesmo tratamento da reação lupoide, além de ser recomendada biópsia, hemocultura e/ou mielocultura e avaliação imunológica do paciente.34
DiagnósticoO diagnóstico laboratorial das MNT depende de condições apropriadas de coleta, armazenamento e processamento das amostras. Como essas bactérias estão presentes no ambiente, a contaminação das amostras pode ser frequente. Resultados falso‐positivos podem levar a tratamentos desnecessários.
Quanto maior for o tempo entre a coleta, o transporte e o processamento da amostra, maior a chance do crescimento de contaminantes em meios de cultivo. O uso de antibióticos com comprovada ação micobactericida, como os macrolídeos e as quinolonas, pode gerar negatividade dos exames.35 A antibioticoterapia deve ser suspensa, no mínimo, 15 dias antes da coleta do material.
Exame de reação em cadeia da polimerase (PCR) é o melhor método diagnóstico. Agentes micobactericidas devem, sempre, ser evitados antes da coleta de material para PCR. É importante ressaltar que água de torneira, ou mesmo água filtrada, pode levar à contaminação do material a ser examinado. O transporte das amostras deve ser feito em recipiente à prova de vazamentos, selado, certificado e, idealmente, sem meio de transporte. Se o envio do material levar mais de uma hora, o mesmo deve ser mantido em refrigeração a 4°C.
Exame direto e exame histopatológicoDe acordo com Griffith et al., a coloração mais recomendada para visualização de MNT é o método de fluorocromo.35 Os métodos de Ziehl‐Neelsen ou Kinyoun também são importantes, porém menos sensíveis. Alguns patógenos, como as MNT de crescimento rápido, podem ser sensíveis ao processo de descoloração. A imuno‐histoquímica ainda precisa de mais estudos para o emprego rotineiro na identificação das MNT.36
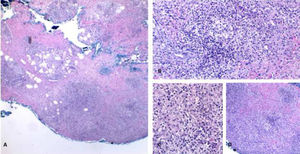
Estudos com casos de tuberculose que apresentem menos de 1.000 bacilos/mL têm, em média, chance de 10% de ser positivo no exame direto. O cultivo é muito mais sensível.37 Recentemente, Li et al. revisaram as características histológicas de 13 casos confirmados de acometimento cutâneo por MNT. Nos casos imunocompetentes, observou‐se hiperplasia pseudoepiteliomatosa, abscessos intraepiteliais, eliminação transepidérmica e granulomas com necrose e supuração, mas em pacientes imunossuprimidos o granuloma, quando presente, tende a ser mal formado6 (figs. 3 e 4). É possível observar que essas características são semelhantes em outras doenças encontradas em nosso meio, como a paracoccidioidomicose, a leishmaniose, a esporotricose e a cromomicose; no entanto, a visualização das microbactérias na pele é mais difícil do que nas doenças fúngicas.
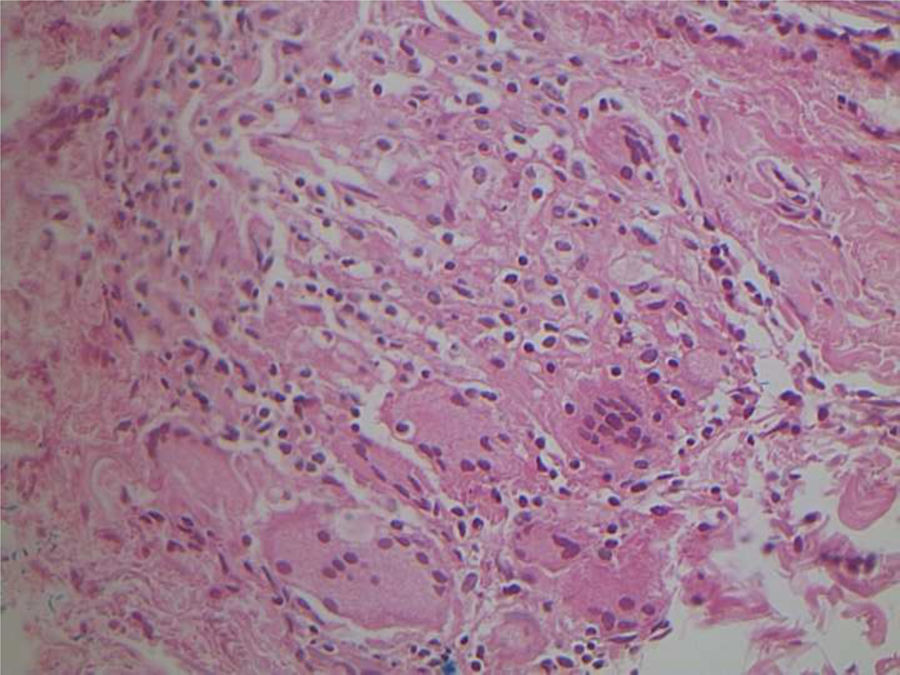
Reação granulomatosa não específica causada pelo Mycobacterium fortuitum em paciente imunocompetente (Hematoxilina & eosina, 40×). Diagnóstico realizado por amplificação e por sequenciamento genético parcial do gene rpoB. A visualização da micobactéria pode ser dificultada pela intensa reação granulomatosa gerada.
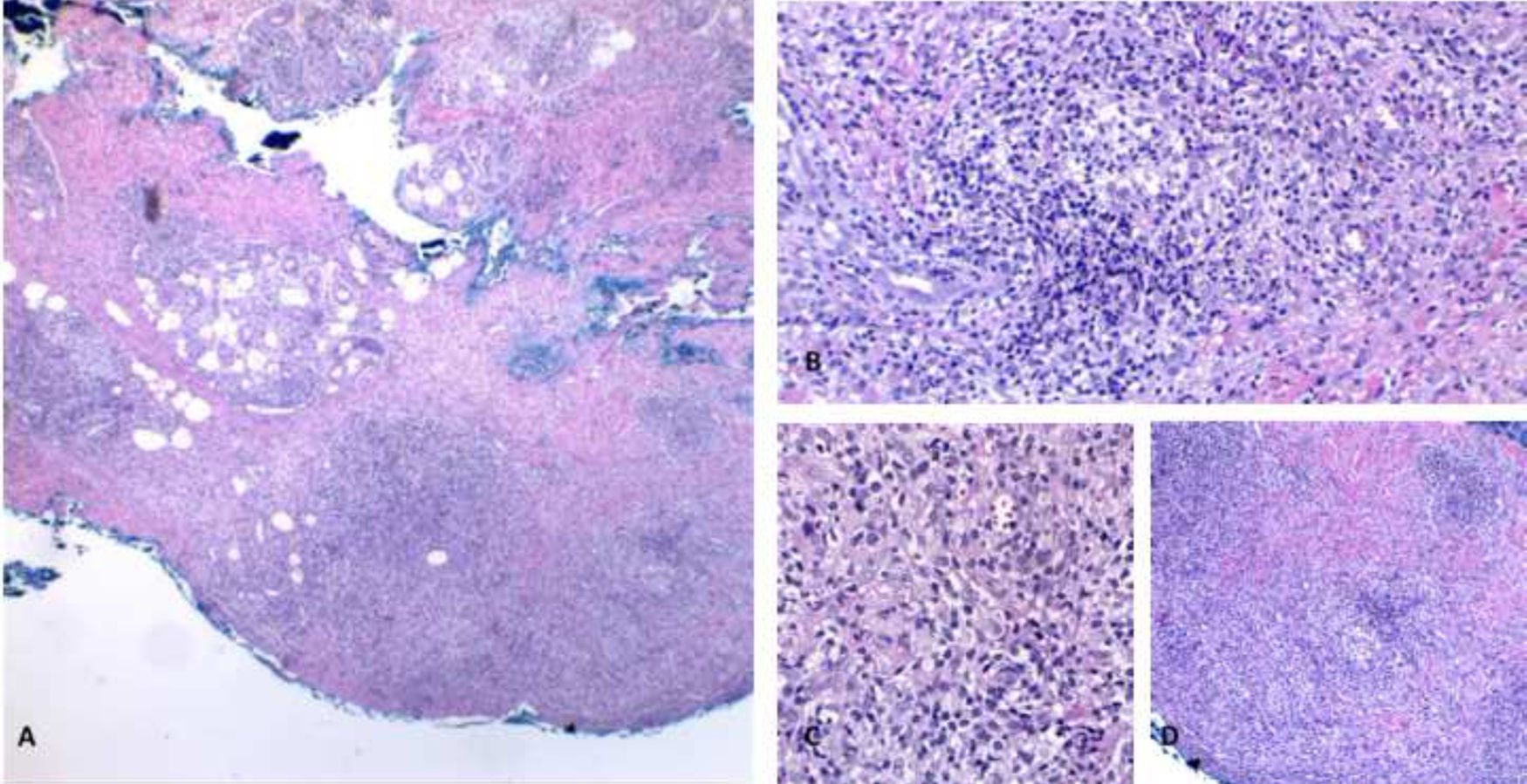
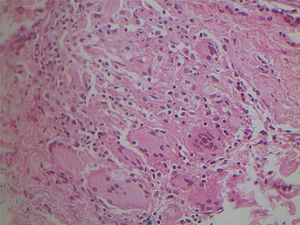
Micobacteriose cutânea causado por Mycobacterium marinum em paciente imunossuprimido por uso de infliximabe por 15 anos. Observa‐se, no limite dermo‐hipodérmico, intenso infiltrado predominantemente de histiócitos, permeado por linfócitos e neutrófilos, mas sem formar halos, nódulos, focos supurativos. Coloração: Hematoxilina & eosina; diagnóstico realizado por amplificação e por sequenciamento genético parcial do gene rpoB. (A), Paniculite, 4×; (B), granuloma malformado, 20×; (C), detalhe do infiltrado linfo‐histiocítico, 40×; (D), paniculite com esboços nodulares, 10×.
O cultivo de fragmentos de pele ou líquidos corporais ainda é considerado um dos exames mais importantes para diagnóstico e estudo das micobactérias. O uso de swabs deve ser evitado. A especificidade não é de 100%, pois pode ocorrer o crescimento de micobactérias contaminantes. Meios líquidos e sólidos devem ser empregados para esse objetivo.38 Recentes avanços foram descritos, mas esforços para tornar esse método mais rápido e simples nunca devem ser abandonados. Por causa do longo tempo necessário para o cultivo das MNT, procedimentos que eliminem contaminação por outras bactérias e por fungos devem sempre ser observados.39 A pele é considerada uma amostra possivelmente contaminada; antes da semeadura, alguns laboratórios recomendam utilizar meios para descontaminação.39
A combinação de meios líquidos, que possibilitam crescimentos mais rápidos, e de meios sólidos, que propiciam o crescimento de micobactérias mais raras, deve ser utilizada para o diagnóstico das micobacterioses. Meios sólidos à base de ovo, o clássico Löwenstein‐Jensen ou sua forma modificada podem ser utilizados. Meios com base de ágar incluem Middlebrook 7H10, Middlebrook 7H11, os meios seletivos de ágar Mitchison 7H10 e 7H11 e cultivo em camada delgada contendo ágar (tabela 3).39 Outra vantagem importante dos meios de cultivo é a possibilidade de testes de resistência antimicrobiana, extremamente necessário considerando‐se os diversos tipos de micobactérias que podem estar envolvidos.
Aspectos clínicos, diagnósticos e sugestão de tratamento para adultos com micobacterioses não tuberculosas segundo a espécie isolada
| Aspectos clínicos | Cultivoa | Tratamentob |
|---|---|---|
| Mycobacterium marinum | ||
| Infecção após contato com ambientes aquáticos. A maioria dos casos apresenta lesão localizada, papulonodular nas extremidades, e pode haver disseminação em imunossuprimidos | Crescimento lento (fotocromógena) | Para infecções limitadas, pode‐se usar monoterapia com claritromicina (500‐1000 mg/dia), doxiciclina (100 mg/dia), minociclina (100mg, 2×/dia) e sulfametoxazol 400 mg+trimetoprima 80mg, 2×/dia por, no mínimo, três meses. |
| Para infecções graves, pode‐se utilizar rifampicina (450‐600 mg/dia) e etambutol (15 mg/kg/dia) | ||
| Mycobacterium ulcerans | ||
| Não há confirmação de fontes persistentes de transmissão no Brasil. Lesões iniciais em pápulas ou nódulos, evolução para úlcera, relativamente indolor apesar da destruição tecidual evidente e visível | Crescimento lento (acromógena) | Combinação de rifampicina (450‐600 mg/dia) e outro antibiótico ativo como claritromicina (500‐1000 mg/dia), estreptomicina (15 mg/kg/dia) ou quinolonas por oito semanas (consultar indicações locais ou da Organização Mundial da Saúde vigentes) |
| Intervenção cirúrgica | ||
| Mycobacterium kansasii | ||
| Pacientes imunossuprimidos. Feridas operatórias, inclusive com acometimento de tecidos profundos e ósseos | Crescimento lento (fotocromógena) | Antibióticos tradicionais nas dosagens utilizadas contra a tuberculose mostraram efetividade. Rifampicina (450‐600 g/dia), isoniazida (300 mg/dia), etambutol (15 mg/kg/dia) |
| Mycobacterium haemophilum | ||
| Raramente acomete humanos. Ocorre após procedimentos cirúrgico e em pacientes imunossuprimidos | Crescimento lento (acromógena) | Poliquimioterapia contendo claritromicina (500‐1000 mg/dia), ciprofloxacina (500mg, 2×/dia) e rifabutina (150‐300 mg/dia) são sugeridos |
| Mycobacterium fortuitum, Mycobacterium abscessus, Mycobacterium chelonae | ||
| Pápula, nódulos, placas e abscessos. Infecções disseminadas podem ocorrer, principalmente em imunossuprimidos | Crescimento rápido | Para infecções localizadas, recomenda‐se poliquimioterapia com claritromicina (500‐1000 mg/dia), azitromicina (250‐500 mg/dia), ciprofloxacina (500mg, 2×/dia), levofloxacina (500 mg/dia), doxiciclina (100 mg/dia), minociclina (100mg, 2×/dia) ou sulfametoxazol 400 mg+trimetoprima 80mg, 2×/dia. Para infecções graves, pode ser necessário tratamento parenteral inicial seguido de tratamento oral por seis meses a um ano com poliquimioterapia |
A combinação de meios líquidos, que possibilitam crescimentos mais rápidos, e de meios sólidos, que propiciam o crescimento de micobactérias mais raras, deve ser utilizada para o diagnóstico das micobacterioses. A identificação precisa das micobactérias pode ser feita por estratégias de biologia molecular.
Os exames de biologia molecular revolucionaram o estudo e o diagnóstico das infecções micobacterianas. A PCR transforma quantidade escassa de DNA ou RNA em quantidade detectável. Diversas variações técnicas podem ser aplicadas para o diagnóstico.
Apesar da gama de exames complementares disponíveis, é importante salientar que a sensibilidade dessas estratégias não é de 100%. Por isso, a identificação direta do parasito nem sempre é possível, principalmente em locais que não disponham de exames de alta complexidade. A antibioticoterapia efetiva inviabiliza a detecção do RNA micobacteriano, mas não degrada totalmente o DNA. Frente a um exame clínico e histopatológico compatíveis e após exclusão de diagnósticos diferenciais, a decisão terapêutica empírica pode ser necessária (figs. 5 e 6).
Micobacteriose cutânea não tuberculosa. Reação em cadeia da polimerase foi positiva para Mycobacterium sp. e negativa para iniciadores específicos para Mycobacterium tuberculosis. O sequenciamento genético resultou inconclusivo. O quadro apresentou cura completa após esquema de tratamento para tuberculose pulmonar associado à claritromicina.
As medicações e recomendações gerais estão apresentadas na abordagem das diferentes micobacterioses (tabela 3).
VacinaçãoEstudos vêm sendo desenvolvidos para a criação de vacinas contra as micobacterioses. A prevenção da tuberculose é o alvo da quase totalidade dessas tentativas.31 Vacinas específicas e efetivas contra as MNT ainda não estão disponíveis.
A BCG é uma vacina de relativo baixo custo, recomendada em países onde a tuberculose é endêmica.33 Atualmente, a vacina também é utilizada em estratégias de saúde pública como profilaxia para prevenção do adoecimento de contatos domiciliares de casos índices de hanseníase, geralmente em pacientes que nunca receberam a BCG ou que receberam apenas uma dose dessa vacina. Seu efeito protetor contra outras micobactérias vem sendo motivo de discussão e permanece ainda incerto. No entanto, seu efeito em condições endêmicas como na infecção pelo M. ulcerans vem sendo considerado.31 A BCG é contraindicada para doentes imunossuprimidos por conter organismo vivo.
ConclusãoA crescente incidência das MNT justifica estudo mais aprofundado dessas condições não apenas em indivíduos adultos, mas também nas crianças. O dermatologista tem papel importante no reconhecimento e no tratamento dessas doenças, uma vez que a pele e seus anexos podem ser acometidos, inclusive após procedimentos cirúrgicos e estéticos.
Suporte financeiroNenhum.
Contribuição dos autoresLais Bastos Nogueira: Idealização, elaboração, edição e finalização
Carina Nogueira Garcia: Idealização, elaboração, edição e finalização
Marcela Santos Corrêa da Costa: Elaboração, edição e finalização
Monica Brauner de Moraes: Elaboração, edição e finalização
Patrícia Shu Kurizky: Idealização, elaboração, edição e finalização
Ciro Martins Gomes: Idealização, elaboração, edição, revisão, finalização, coordenação, supervisão
Conflito de interesseNenhum.
Como citar este artigo: Nogueira LB, Garcia CN, Costa MSC, Moraes MB, Kurizky PS, Gomes CM. Non‐tuberculous cutaneous mycobacterioses. An Bras Dermatol. 2021;96:527–38.
Trabalho realizado no Serviço de Dermatologia, Hospital Universitário de Brasília, Universidade de Brasília, Brasília, DF, Brasil.