A frequência de doenças autoimunes e câncer da tireoide tem aumentado em pacientes com rosácea. Entretanto, os estudos que investigam doenças da tireoide na rosácea são escassos, com resultados conflitantes.
ObjetivoInvestigar a relação entre doenças da tireoide e rosácea.
MétodosUm estudo caso‐controle foi conduzido com 2.091 pacientes com rosácea, pareados por idade e sexo com 9.572 controles. Os pacientes com rosácea foram identificados pelos códigos CID específicos para rosácea dos registros do hospital. Além disso, todos os participantes foram avaliados quanto à presença de hipotireoidismo e hipertireoidismo. A análise de regressão logística condicional foi utilizada para calcular o odds ratio (OR) dos casos e controles, com intervalos de confiança de 95%.
ResultadosForam incluídos 2.091 pacientes com rosácea (1.546 mulheres, 545 homens; média 48,73±14,53 anos) e 9.572 controles (7.009 mulheres, 2.563 homens; média 48,73±15,1 anos). Ainda que a taxa de hipotireoidismo tenha sido significantemente maior em pacientes com rosácea (OR=1,3; IC 95% de 1,13‐1,49; p <0,001), não houve diferença significante na taxa de hipertireoidismo entre os grupos (OR=1,12; IC 95% de 0,81‐1,53; p=0,497). A estratificação por gênero também revelou associação significante entre hipotireoidismo e rosácea em mulheres (OR=1,27; IC 95% de 1,1‐1,47; p=0,002) e em (OR=1,58; IC 95% de 1,04‐2,4; p=0,032). A frequência de hipotireoidismo em pacientes com rosácea aumentou na faixa etária de 40‐49 anos e depois diminuiu, paralelamente à frequência de hipotireoidismo da população do estudo.
Limitações do estudoNão foi possível distinguir os diferentes subtipos e gravidades da rosácea.
ConclusõesO hipotireoidismo pode ser uma comorbidade da rosácea, e a investigação de hipotireoidismo pode ser apropriada na avaliação de pacientes com rosácea.
A rosácea é uma doença cutânea inflamatória crônica caracterizada por episódios recorrentes de eritema, pápulas, pústulas, alterações fimatosas e sintomas oculares. A rosácea é mais frequente, particularmente, em populações de pele clara, com prevalência de 1 a 10%.1,2 Embora vários fatores, incluindo desregulação imunológica, hiperreatividade vascular, microrganismos, radiação ultravioleta (UV) e, mais raramente, genética tenham sido propostos em sua patogênese, ela ainda não foi totalmente compreendida.2,3 Além disso, constatou‐se que várias comorbidades, como doenças cardiovasculares, gastrintestinais, neurológicas e psiquiátricas, aumentam em pacientes com rosácea.4,5
Nos últimos anos, a relação entre a rosácea e doenças autoimunes envolvendo diabetes mellitus tipo 1, doença celíaca, artrite reumatoide e esclerose múltipla tem sido enfatizada.6,7 Entretanto, embora a frequência de câncer de tireoide também tenha aumentado em pacientes com rosácea, a autoimunidade da tireoide ainda não foi estudada em detalhes na rosácea.8 A relação da autoimunidade da tireoide com o câncer da tireoide é conhecida há muito tempo.9 Além disso, de modo semelhante às doenças da tireoide, a associação entre rosácea e doenças metabólicas foi relatada em detalhes nos últimos anos.10–13
A hipótese do presente estudo é que mecanismos patogênicos compartilhados podem fornecer uma ligação entre a rosácea e doenças da tireoide e, portanto, objetivamos investigar se há relação entre doenças da tireoide (hipo‐ e hipertireoidismo) e rosácea.
MétodosConduzimos um estudo caso‐controle em 2.091 pacientes com rosácea e 9.572 controles pareados por idade e sexo, atendidos no Ambulatório de Dermatologia do Mugla Sitki Kocman University Training and Research Hospital entre 1° de janeiro de 2015 e 31 de dezembro de 2019. Obteve-se aprovação do Comitê de Ética da Mugla Sitki Kocman University. Identificamos pacientes com rosácea com códigos CID (Classificação Internacional de Doenças) de rosácea (L71.8 e L71.9) nos prontuários do hospital. Os controles foram selecionados consecutivamente aos pacientes apresentando várias queixas dermatológicas, exceto rosácea. Cada paciente com rosácea foi pareado por idade e sexo (no tempo de calendário) com aproximadamente cinco controles. Também avaliamos todos os participantes quanto à presença de hipotireoidismo (códigos CID: E03.8 e E03.9) e hipertireoidismo (códigos CID: E05.9 e E05.2) utilizando códigos CID doença‐específicos. O critério de inclusão do estudo foi idade ≥ 18 anos para os pacientes e controles.
O programa estatístico SPSS para Windows v. 22.0 foi utilizado na análise estatística. As variáveis descritivas foram demonstradas como média, desvio‐padrão e frequência. A distribuição das variáveis foi verificada com o teste de Kolmogorov‐Smirnov. Como nem todas as variáveis numéricas apresentavam distribuição normal, o teste U de Mann‐Whitney foi utilizado para os dados quantitativos. O teste de Qui‐Quadrado foi utilizado para a análise dos dados qualitativos. A análise de regressão logística condicional foi usada para calcular o odds ratio (OR) de caso‐controle com intervalos de confiança (IC) de 95%; valores de p <0,05 foram considerados significantes.
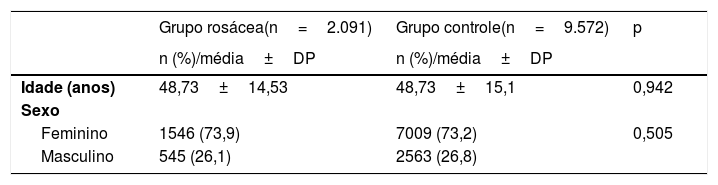
ResultadosForam incluídos 2.091 pacientes com rosácea (1.546 mulheres, 545 homens; faixa etária de 18 a 89 anos, média de idade de 48,73±14,53) e 9.572 controles (7.009 mulheres, 2.563 homens; faixa etária de 18 a 89 anos, média de 48,73±15,1) pareados por idade, sexo e tempo de calendário do estudo (tabela 1).
Características da população do estudo
| Grupo rosácea(n=2.091) | Grupo controle(n=9.572) | p | |
|---|---|---|---|
| n (%)/média±DP | n (%)/média±DP | ||
| Idade (anos) | 48,73±14,53 | 48,73±15,1 | 0,942 |
| Sexo | |||
| Feminino | 1546 (73,9) | 7009 (73,2) | 0,505 |
| Masculino | 545 (26,1) | 2563 (26,8) | |
Teste de Qui‐Quadrado, teste U de Mann Whitney. DP, desvio‐padrão.
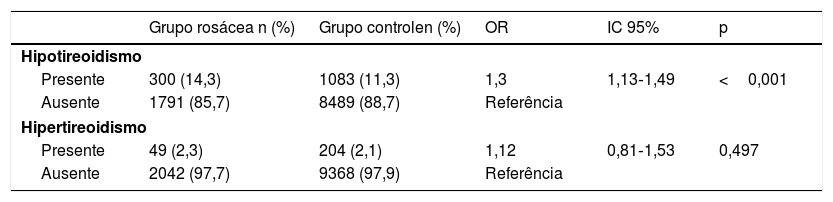
Enquanto a taxa de prevalência de hipotireoidismo foi significantemente maior em pacientes com rosácea (OR=1,3; IC 95% de 1,13‐1,49; p <0,001), não houve diferença significante na taxa de hipertireoidismo entre pacientes com rosácea e controles (OR=1,12; IC 95% de 0,81‐1,53; p=0,497 – tabela 2).
Valores de odds ratio associando a rosácea com a ocorrência de hipotireoidismo e hipertireoidismo
| Grupo rosácea n (%) | Grupo controlen (%) | OR | IC 95% | p | |
|---|---|---|---|---|---|
| Hipotireoidismo | |||||
| Presente | 300 (14,3) | 1083 (11,3) | 1,3 | 1,13‐1,49 | <0,001 |
| Ausente | 1791 (85,7) | 8489 (88,7) | Referência | ||
| Hipertireoidismo | |||||
| Presente | 49 (2,3) | 204 (2,1) | 1,12 | 0,81‐1,53 | 0,497 |
| Ausente | 2042 (97,7) | 9368 (97,9) | Referência | ||
Regressão logística condicional. OR, odds ratio; IC, intervalo de confiança.
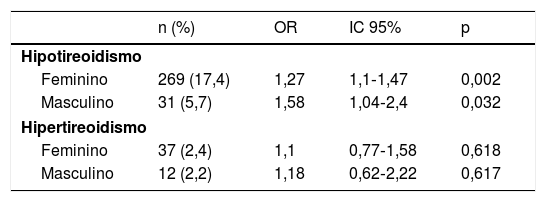
A estratificação por sexo também revelou uma associação significante entre hipotireoidismo e rosácea em mulheres (OR=1,27; IC 95% de 1,1‐1,47; p=0,002) e em homens (OR=1,58; IC 95% de 1,04‐2,4; p=0,032), respectivamente, enquanto não houve associação significante entre hipertireoidismo e rosácea em ambos os sexos (p >0,05; tabela 3).
Valores de odds ratios associando a rosácea com a ocorrência de hipotireoidismo e hipertireoidismo estratificado por sexo
| n (%) | OR | IC 95% | p | |
|---|---|---|---|---|
| Hipotireoidismo | ||||
| Feminino | 269 (17,4) | 1,27 | 1,1‐1,47 | 0,002 |
| Masculino | 31 (5,7) | 1,58 | 1,04‐2,4 | 0,032 |
| Hipertireoidismo | ||||
| Feminino | 37 (2,4) | 1,1 | 0,77‐1,58 | 0,618 |
| Masculino | 12 (2,2) | 1,18 | 0,62‐2,22 | 0,617 |
Regressão logística condicional. OR, odds ratio; IC, intervalo de confiança.
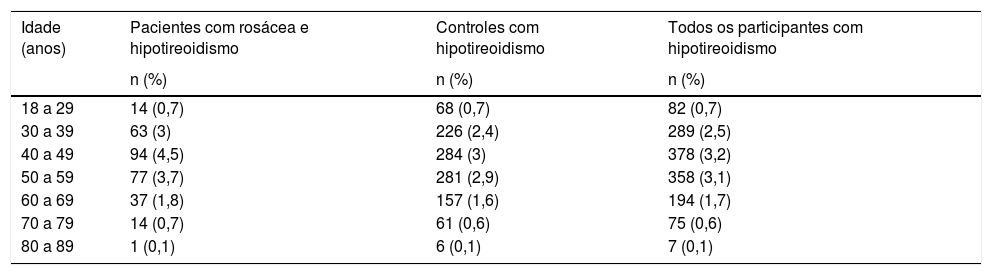
A frequência de hipotireoidismo em pacientes com rosácea aumentou na faixa etária de 40‐49 anos e depois diminuiu na faixa de 80‐89 anos, compatível com a frequência geral de hipotireoidismo da população do estudo (tabela 4).
Frequência de hipotireoidismo nos participantes por intervalos de aproximadamente 10 anos de idade
| Idade (anos) | Pacientes com rosácea e hipotireoidismo | Controles com hipotireoidismo | Todos os participantes com hipotireoidismo |
|---|---|---|---|
| n (%) | n (%) | n (%) | |
| 18 a 29 | 14 (0,7) | 68 (0,7) | 82 (0,7) |
| 30 a 39 | 63 (3) | 226 (2,4) | 289 (2,5) |
| 40 a 49 | 94 (4,5) | 284 (3) | 378 (3,2) |
| 50 a 59 | 77 (3,7) | 281 (2,9) | 358 (3,1) |
| 60 a 69 | 37 (1,8) | 157 (1,6) | 194 (1,7) |
| 70 a 79 | 14 (0,7) | 61 (0,6) | 75 (0,6) |
| 80 a 89 | 1 (0,1) | 6 (0,1) | 7 (0,1) |
A rosácea é uma doença crônica e inflamatória, cuja patogênese ainda está sendo investigada. Além disso, um número crescente de comorbidades está sendo relatado na rosácea, sugerindo que os médicos avaliem mais pormenorizadamente os pacientes com rosácea.4,5 Dentre os fatores que nos incentivaram a conduzir o presente estudo, em primeiro lugar está o fato de a rosácea ter sido associada a certas doenças autoimunes; em segundo lugar, o relatado aumento do câncer de tireoide em pacientes com rosácea; e, por último, o fato de que doenças da tireoide também estão associadas a processos inflamatórios, bem como a doenças cardiovasculares.6,8,10 No presente estudo, relatou‐se que a frequência de hipotireoidismo aumentou significantemente em pacientes com rosácea, e nenhuma associação foi observada entre hipertireoidismo e rosácea. Após estratificação por sexo, a associação entre hipotireoidismo e rosácea se manteve em ambos os sexos. A faixa etária em que o hipotireoidismo foi mais comum, entre 40 e 49 anos, em pacientes com rosácea é compatível com toda a população do estudo em termos de frequência de hipotireoidismo.
Nos últimos anos, vários estudos sugeriram autoimunidade na rosácea. Egeberg et al. relataram que a rosácea está associada ao diabetes mellitus tipo 1, esclerose múltipla, doença celíaca e artrite reumatoide, principalmente em mulheres.6 A infecção por Helicobacter pylori, cujo envolvimento com a patogênese da rosácea já foi relatado, pode ser enfatizada como outro achado sugestivo de autoimunidade na rosácea. De fato, diversas doenças autoimunes, como artrite reumatoide, tireoidite autoimune e púrpura de Henoch‐Schönlein, já foram associadas à infecção por H. pylori além da rosácea.14,15 Além disso, Wozniacka et al. relataram que 53,3% de 101 pacientes com rosácea tinham um título de ANA ≥ 1:160, e nenhum dos pacientes com títulos elevados de ANA desenvolveu doença autoimune conhecida durante o período de seguimento de dois anos.16 Entretanto, embora a maioria das doenças da tireoide seja autoimune, as mesmas não foram muito estudadas na rosácea.17
A relação da rosácea com doenças da tireoide foi investigada em alguns estudos, com resultados conflitantes. James et al. avaliaram o hipotireoidismo em pacientes com psoríase e rosácea e encontraram taxas de prevalência de 17,5% e 19,7%, respectivamente. Embora tenha sido observado que a taxa de hipotireoidismo era relativamente baixa (13,8%) em pacientes com outras doenças dermatológicas, eles não mencionaram essa diferença como significante.18 Em outro estudo, Berksoy Hayta et al. investigaram os níveis séricos de hormônios tireoidianos livres, autoanticorpos tireoidianos, prolactina, sulfato de de‐hidroepiandrosterona (DHEA‐S), cortisol basal, proteína C‐reativa e taxas de hemossedimentação em 72 pacientes com rosácea e 62 controles, e não relataram associação significante entre os grupos em relação à presença de doença da tireoide. No entanto, eles relataram que os níveis de PCR, anticorpo anti‐microssomal (anti‐M) e prolactina aumentaram em pacientes com rosácea.19 Artantaş et al. examinaram achados cutâneos de 220 pacientes com doença da tireoide e relataram a frequência de acne rosácea de 3,6% em geral.20 No presente estudo, uma taxa significantemente maior de hipotireoidismo foi observada no grupo rosácea (14,3%) em comparação ao grupo controle (11,3%), tanto no sexo masculino, quanto no feminino. Entretanto, como os autoanticorpos séricos da tireoide não foram avaliados nos participantes, não foi possível demonstrar os dados sobre quantos dos participantes tinham doenças autoimunes da tireoide.
Embora as comorbidades tenham sido investigadas na rosácea, a frequência do câncer de tireoide foi avaliada apenas em alguns estudos. Considerando que Li et al. relataram um risco aumentado de câncer de tireoide em pacientes com rosácea nos Estados Unidos, Egeberg et al. não observaram risco aumentado de câncer de tireoide em pacientes com rosácea em seu estudo de coorte na população dinamarquesa.8,21 A resposta inflamatória e a função imune desempenham um papel fundamental na patogênese do câncer de tireoide.22 De fato, a autoimunidade da tireoide e o câncer de tireoide, particularmente o carcinoma papilífero de tireoide, foram estudados e associados há várias décadas.9 A inflamação pode ser um elo potencial entre a rosácea e o câncer de tireoide. A associação relatada entre rosácea e câncer de tireoide pode dar suporte aos nossos resultados, considerando que o hipotireoidismo autoimune é a causa mais comum de hipotireoidismo, assim como a autoimunidade da tireoide e o câncer de tireoide estão altamente correlacionados.9,22
Rosácea e doenças da tireoide também são semelhantes em termos de condições metabólicas e vias inflamatórias que as acompanham. Os hormônios tireoidianos têm um papel fundamental no metabolismo de lipídios e glicose, na homeostase energética e também na pressão arterial. Portanto, um distúrbio do metabolismo glicose‐lipídeo, hipercolesterolemia e a formação de aterosclerose são mais frequentes em pacientes com hipotireoidismo.10 A rosácea também foi associada a doenças cardiovasculares em vários estudos com alterações metabólicas semelhantes ao hipotireoidismo.11–13 Além disso, o aumento da expressão de marcadores inflamatórios, incluindo metaloproteinases da matriz, particularmente MMP‐9, foi demonstrado na rosácea, bem como no hipotireoidismo.23–26
O presente estudo tem algumas limitações. Em primeiro lugar, ele foi baseado em banco de dados e, portanto, está sujeito a erros de codificação. Não foi possível distinguir os diferentes subtipos e gravidades da rosácea, e também as doenças da tireoide como autoimunes ou não autoimunes. Outra limitação do estudo foi o fato de incluir apenas indivíduos turcos, bem como sua realização em um centro único e, portanto, a incapacidade de generalização do estudo. Além disso, como o presente estudo é do tipo observacional, não é possível determinar a causalidade, se a rosácea leva ao hipotireoidismo ou vice‐versa.
ConclusãoDoenças da tireoide foram investigadas em pacientes com rosácea, considerando que ambas as doenças têm origens inflamatórias e autoimunes. Foi observado que a taxa de hipotireoidismo estava significantemente aumentada em pacientes com rosácea, em ambos os sexos. A frequência de hipotireoidismo foi maior na faixa etária de 40 a 49 anos em pacientes com rosácea, compatível com a população estudada. O hipotireoidismo pode ser uma comorbidade da rosácea e a investigação de um possível hipotireoidismo pode ser uma abordagem apropriada na avaliação de pacientes com rosácea. Estudos futuros são necessários para confirmar a associação entre rosácea e hipotireoidismo em outras populações, para explicar as vias comuns dessas doenças em detalhes e recomendar exames de rotina no seguimento de doenças da tireoide em pacientes com rosácea.
Suporte financeiroNenhum.
Contribuição dos autoresAsli Akin Belli: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Emine Tugba Alatas: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Asude Kara Polat: Aprovação da versão final do manuscrito; obtenção, análise e interpretação de dados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Gulhan Akbaba: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; revisão crítica do manuscrito; concepção e planejamento do estudo.
Conflito de interessesNenhum.
Como citar este artigo: Akin Belli A, Alatas ET, Kara Polat A, Akbaba G. Assessment of thyroid disorders in patients with rosacea: a large case‐control study. An Bras Dermatol. 2021;96:539–43.
Trabalho realizado no Departamento de Dermatologia, Mugla Sitki Kocman University Training and Research Hospital, Mugla, Turquia.