A melanoníquia longitudinal (ML) é uma pigmentação longitudinal da lâmina ungueal. Ocorre pela produção aumentada de melanina na matriz ungueal, seja por ativação ou proliferação dos melanócitos. É mais prevalente após a quinta década de vida e pouco comum na infância.1 Quando decorre da ativação de melanócitos, assume coloração acinzentada e tem como principais etiologias: pigmentação étnica, traumatismo, onicotilomania, medicamentos e síndromes genéticas, como Peutz‐Jagher e Lauzier‐Hunziker. Quando secundária à proliferação de melanócitos, apresenta coloração marrom a preta e decorre de nevo melanocítico (NM), lentigo simples, hiperplasia melanocítica atípica ou melanoma.2
Enquanto cerca de 5% das ML em adultos correspondem a melanoma, na infância é tipicamente benigna; o NM é uma das principais causas, porém compartilha características clínicas, dermatoscópicas e histopatológicas com o melanoma subungueal.3,4 A biópsia da matriz ungueal é o padrão ouro para o diagnóstico etiológico, porém trata‐se de procedimento invasivo, de execução complexa na criança, não raro complicada com distrofia ungueal e com recidiva, o que torna difícil a decisão entre acompanhamento clínico e indicação de biópsia.
Sinal de Hutchinson refere‐se à pigmentação periungueal (sinal clássico de risco para melanoma subungueal em adultos), e micro‐Hutchinson à pigmentação periungueal vista apenas por dermatoscopia; ambos são comumente encontrados na ML da infância. Denomina‐se pseudo‐Hutchinson a pigmentação da matriz ungueal visível através da cutícula, enão é sinal de alerta verdadeiro.2,5
Apresentamos uma série de quatro casos de ML em crianças que destacam peculiaridades dessa entidade na infância.
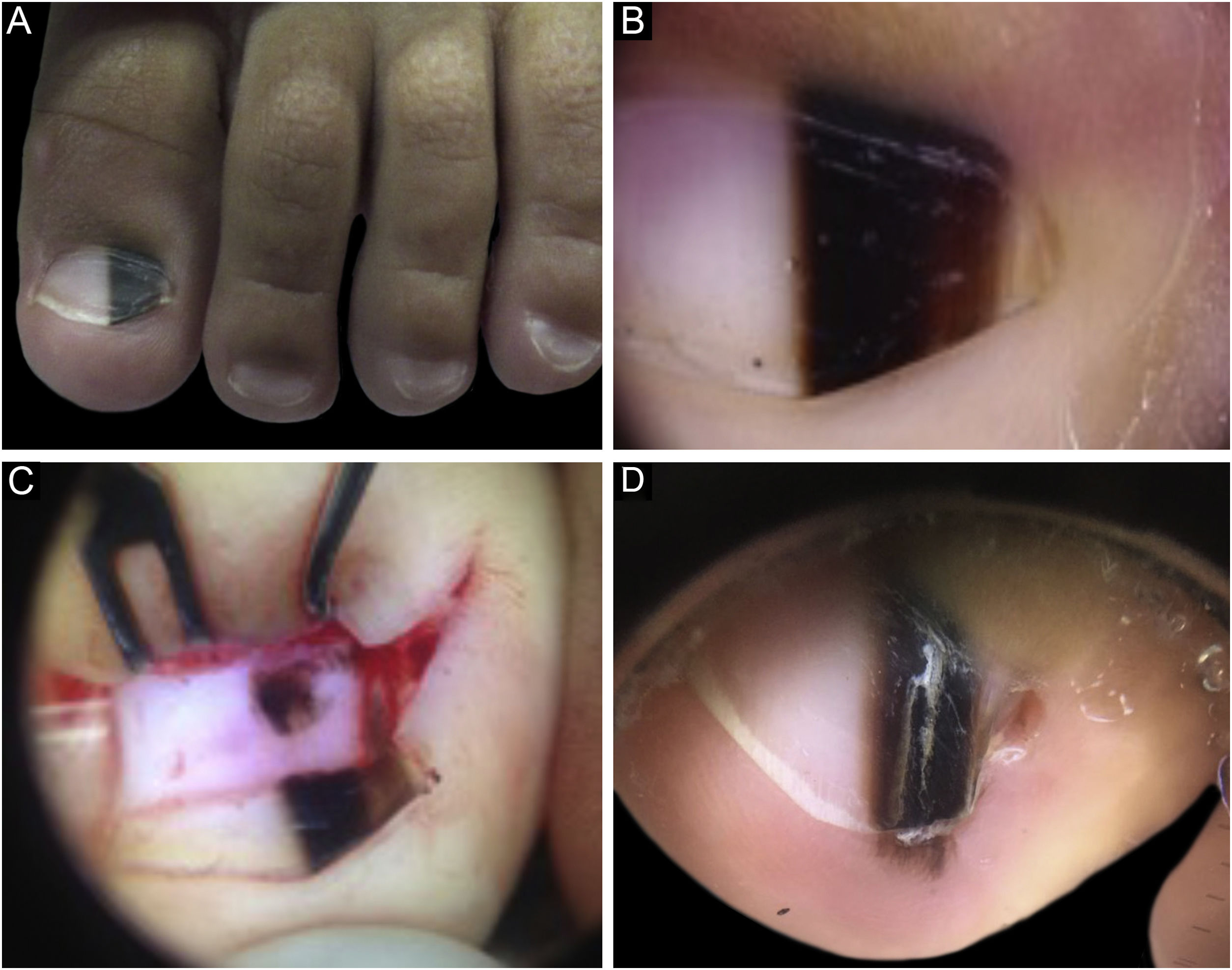
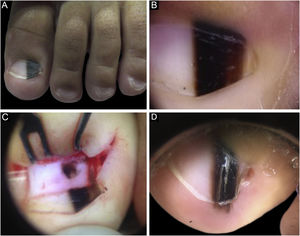
Caso 1Paciente do sexo masculino, 2 anos, com ML única no hálux esquerdo iniciada aos 6 meses de vida, com crescimento. Uma faixa marrom claro e escuro ocupava 40% da largura da lâmina ungueal, em formato triangular. À dermatoscopia, identificavam‐se linhas irregulares em cor, espessura e espaçamento, com bordas laterais apagadas. Dermatoscopia intraoperatória evidenciou padrão irregular. Realizada biópsia excisional, compatível com NM juncional e lentiginoso ungueal. O paciente evoluiu com distrofia ungueal pós‐biópsia e recidiva da melanoníquia dois anos após, com a presença do sinal de Hutchinson no hiponíquio. Optou‐se por acompanhamento, com estabilidade no seguimento de quatro anos (fig. 1)
A, Aspecto clínico da ML ocupando 50% da espessura total do hálux esquerdo. B, Dermatoscopia à primeira consulta. C, Dermatoscopia intraoperatória, evidenciando lesão pigmentada de padrão irregular e borrão excêntrico. D, Dermatoscopia dois anos após biópsia, sinal de Hutchinson no hiponíquio.
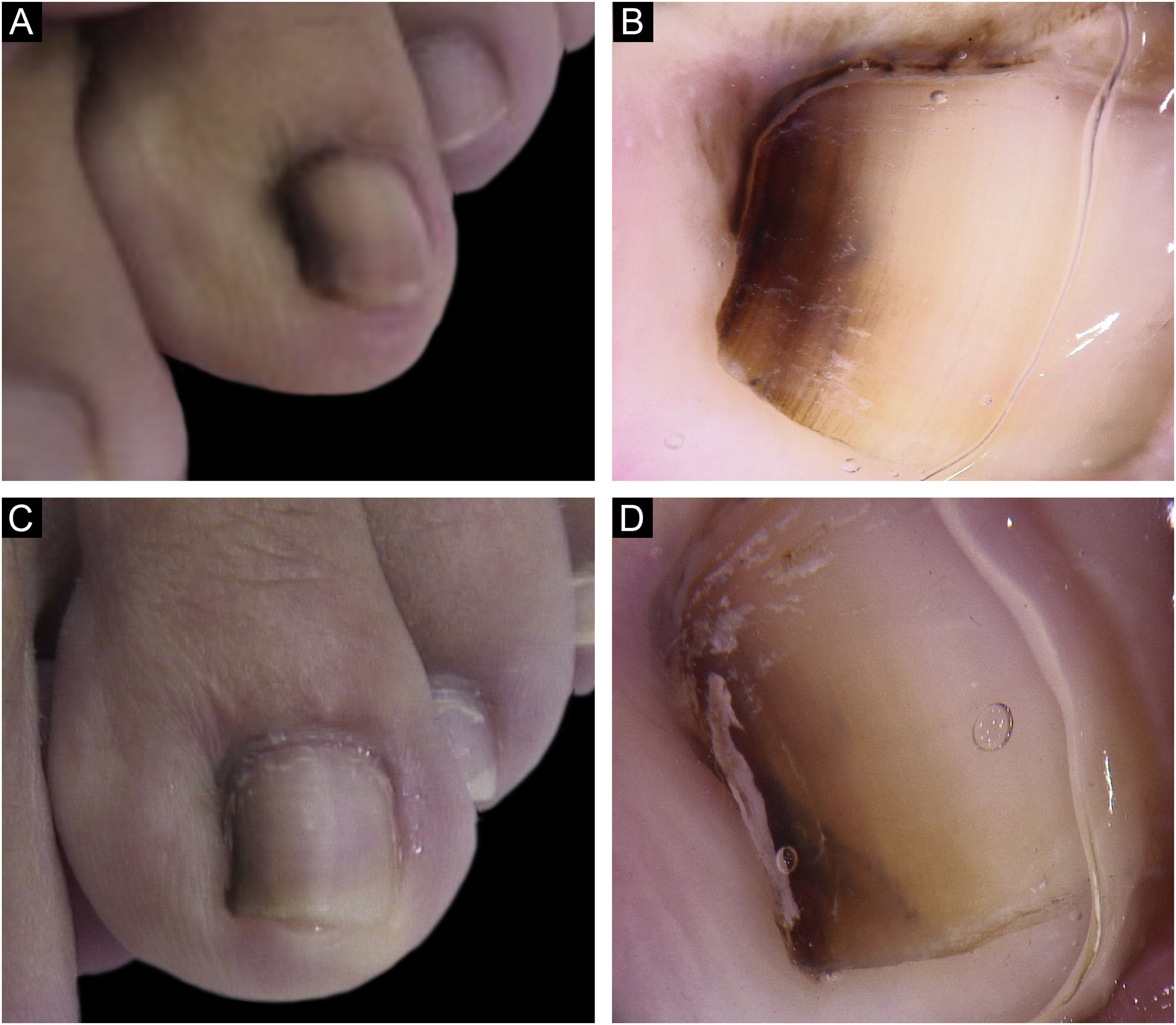
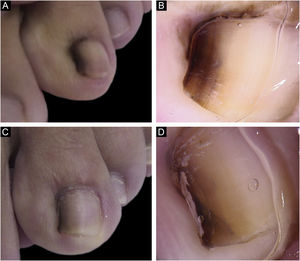
Paciente do sexo feminino, 13 anos, com ML única presente ao nascimento e com crescimento progressivo. Faixa marrom claro e escuro em segundo pododáctilo esquerdo, média 3mm, ocupava 20% da largura da unha, e havia sinal de Hutchinson nas dobras ungueais proximal e lateral. A dermatoscopia mostrou linhas irregulares em espessura e em cor, com perda de paralelismo e bordas apagadas. Foi realizada biópsia tangencial, compatível com NM juncional. Após biópsia, permaneceu com ML na borda lateral, sem distrofia, e mantém‐se estável em cinco anos de seguimento (fig. 2)
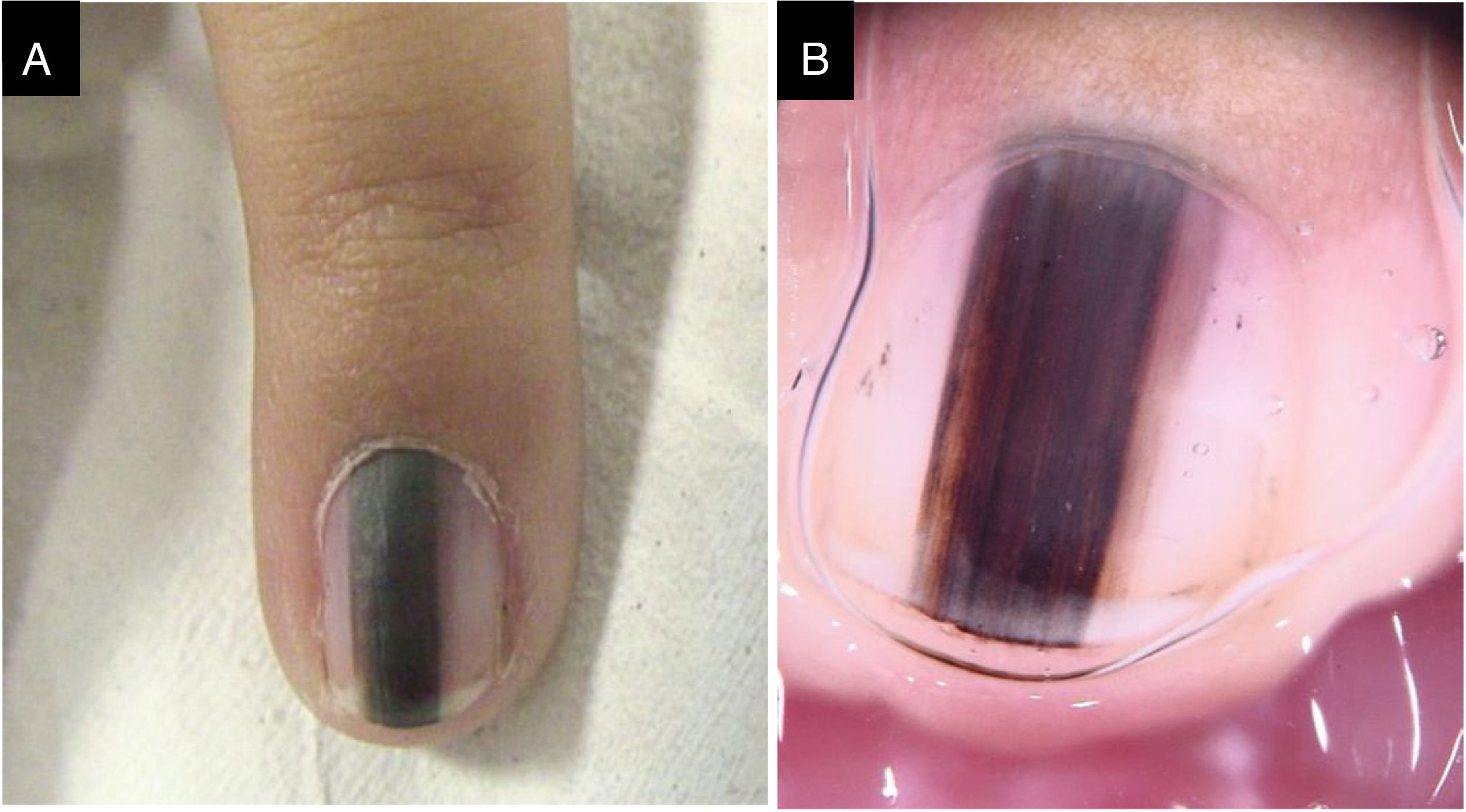
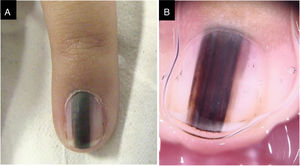
Caso 3Paciente do sexo feminino, 3 anos, com ML no quinto dedo da mão esquerda há dois anos, recidivada após biópsia prévia realizada há um ano, compatível com NM juncional, com crescimento desde então. Faixa preta a marrom escuro ocupava 50% da largura da unha, com pseudo‐Hutchinson. Dermatoscopicamente, havia linhas irregulares em cor e espessura, perda de paralelismo e bordas apagadas. Revisão do exame histopatológico não observou sinais de malignidade. Durante dois anos de seguimento, manteve‐se estável (fig. 3)
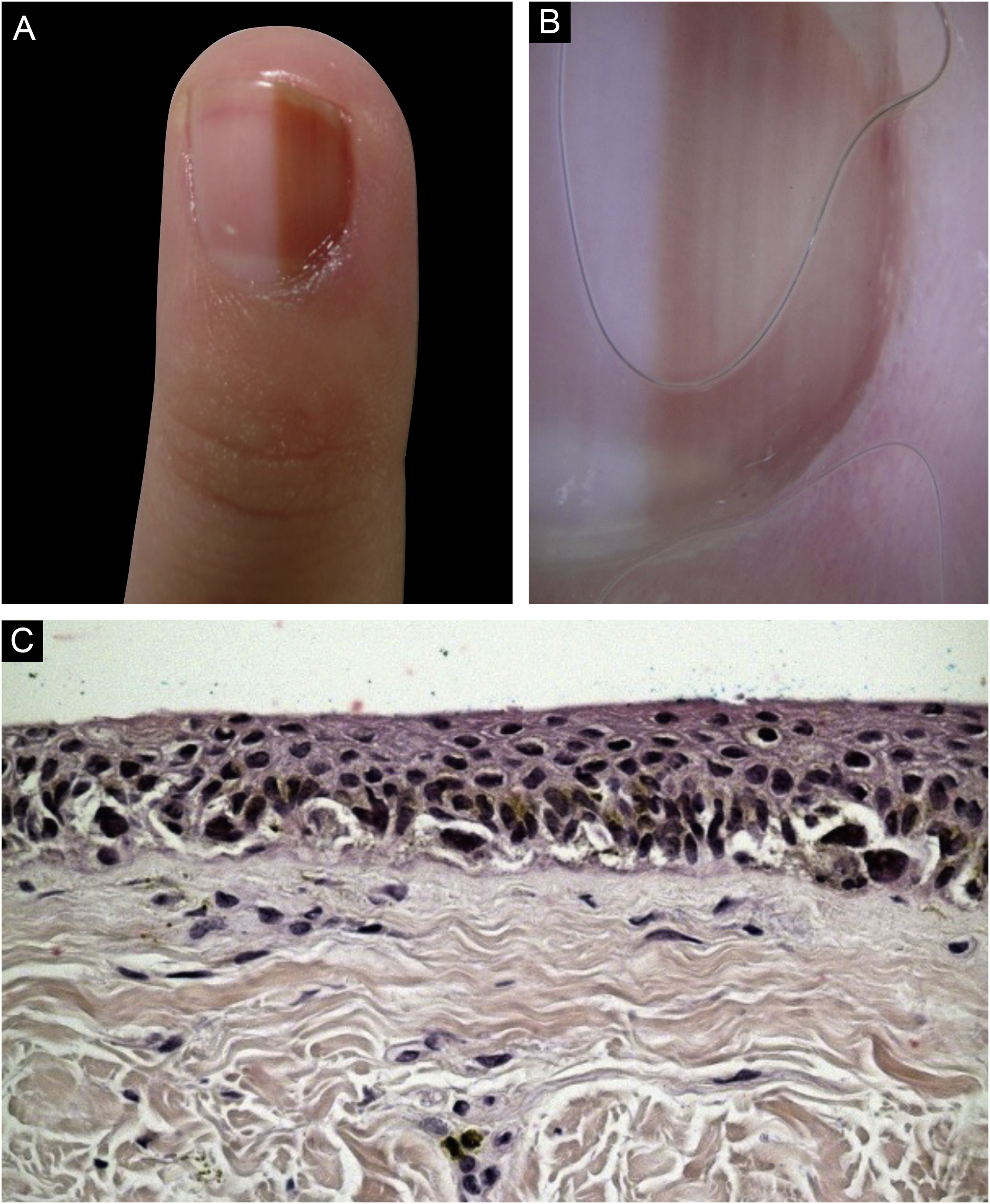
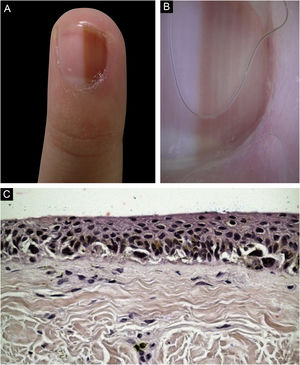
Caso 4Paciente do sexo feminino, 9 anos, com ML há seis anos no terceiro quirodáctilo esquerdo, com crescimento. Observada faixa marrom clara ocupando 40% da lâmina ungueal (4 mm), com pseudo‐Hutchinson. À dermatoscopia foram visualizadas linhas homogêneas, preservando paralelismo. Optou‐se por acompanhamento, porém houve perda do seguimento. A paciente retornou quatro anos após, com biópsia realizada em outro serviço compatível como melanoma in situ lentiginoso acral. A revisão do exame favoreceu a hipótese de NM lentiginoso, mas não foi possível excluir melanoma in situ. Realizada ampliação de margens de 5mm, com remoção do complexo ungueal até nível do periósteo e cicatrização por segunda intenção. Mantida em seguimento clínico rigoroso, sem sinais de recidiva ou de metástase durante oito anos de acompanhamento (fig. 4)
No adulto, são considerados sinais clínicos de alerta para melanoma subungueal o aparecimento recente de ML em única unha, coloração heterogênea, história de modificação de cor, espessura ou forma, largura> 2/3da unha ou> 3mm, largura proximal maior que a distal (formato triangular), sinal de Hutchinson e distrofia ungueal associada. Os achados dermatoscópicos de alerta incluem cor heterogênea marrom a preta, linhas irregulares (em cor, espaçamento, espessura e perda de paralelismo), apagamento das bordas e micro‐Hutchinson.2,6
Entretanto, tais achados são comuns na ML da infância, sem traduzir maior risco de malignidade. O NM, uma das principais causas de ML na criança, frequentemente apresenta crescimento rápido, bandas largas, pigmentação heterogênea, linhas irregulares, formato triangular e sinal de Hutchinson, como demonstrado em outros estudos.3,4,7–10 Sua recidiva após exérese é frequente, como nos Casos 1 e 3. O melanoma subungueal é extremamente raro em crianças, com poucos relatos na literatura, todos in situ. Curiosamente, o Caso 4, laudado como melanoma subungueal in situ, apresentou menor suspeita clínica e dermatoscópica durante avaliação inicial. A biópsia evidenciou proliferação melanocítica lentiginosa com raros ninhos, atipias citológicas focais e simetria preservada. O NM acral pode apresentar atipias citoarquiteturais sem significar malignidade, enquanto o melanoma subungueal pode ter poucas atipias em fase inicial, o que dificulta o diagnóstico diferencial entre essas duas entidades. Considerando a preservação da simetria histológica e o longo período de 10 anos de evolução sem evidência de progressão para melanoma invasivo, o Caso 4 representa mais provavelmente um NM do que um melanoma in situ.
Os casos apresentados ilustram o desafio no manuseio de crianças com ML. Embora o aspecto e comportamento da lesão possam ser desafiadores, simulando melanoma, há autores que discordam da indicação sistemática de biópsia.9 A conduta deve ser individualizada, priorizando o acompanhamento clínico e dermatoscópico, além de considerar o grau de ansiedade da família. Quando, no entanto, a opção for pela biópsia, é importante que seja guiada pela dermatoscopia intraoperatória e realizada tangencialmente quando possível, minimizando o risco de distrofia. Diante de padrão irregular à dermatoscopia intraoperatória, porém, pode ser optado por biópsia excisional visando menor risco de recidiva. Ademais, é imperativo a análise por patologista com expertise em lesões melanocíticas.
Suporte financeiroNenhum.
Contribuição dos autoresIsabela Boechat Morato: Concepção e desenho do estudo, aquisição de dados, redação do artigo, revisão crítica de conteúdo intelectual, aprovação final da versão a ser submetida.
Joao Renato Vianna Gontijo: Redação do artigo e revisão crítica do conteúdo intelectual relevante, aprovação final da versão a ser submetida.
Glaysson Tassara Tavares: Redação do artigo e revisão crítica do conteúdo intelectual relevante, aprovação final da versão a ser submetida.
Flávia Vasques Bittencourt: Redação do artigo e revisão crítica do conteúdo intelectual relevante, aprovação final da versão a ser submetida.
Conflito de interessesNenhum.
Como citar este artigo: Morato IB, Gontijo JRV, Tavares GT, Bittencourt FV. Longitudinal melanonychia in childhood: a great challenge. An Bras Dermatol. 2022;97:516–9.
Trabalho realizado no Serviço de Dermatologia, Hospital das Clínicas, Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.